Способ микробиологического синтеза молочной кислоты и рекомбинантный штамм дрожжей schizosaccharomyces pombe для его осуществления
Иллюстрации
Показать всеИзобретение относится к биотехнологической промышленности, в частности к способам получения молочной кислоты. Молочную кислоту получают путем культивирования рекомбинантного штамма дрожжей рода Schizosaccharomyces - продуцента молочной кислоты, содержащего, по крайней мере, один чужеродный ген лактатдегидрогеназы. Получен рекомбинантный штамм дрожжей Schizosaccharomyces pombe ВКПМ Y-3127, при создании которого в качестве реципиента использовали штамм Schizosaccharomyces pombe ВКПМ Y-285, а трансформацию штамма проводили плазмидной ДНК, несущей ген IdhA гриба Rhizopus oryzae. Данное изобретение позволяет осуществлять синтез молочной кислоты при низких значениях рН и повышенном ее содержании в среде, а заявляемый штамм обладает способностью продуцировать молочную кислоту при рН 4,0 и концентрации молочной кислоты в среде 80-100 г/л. 2 н.п. ф-лы, 5 ил, 2 табл.
Реферат
Изобретение относится к биотехнологической промышленности, в частности к способам получения молочной кислоты.
Молочная кислота (МК) широко используется в пищевой промышленности для консервирования, ароматизации и в производстве биодеградируемой пластмассы - полилактата (PLA). Мировое потребление молочной кислоты составляет более 100000 тонн в год, и ожидается значительное его увеличение, связанное со множеством перспектив в применении полилактата. Другая сфера использования молочной кислоты - получение биодеградируемого растворителя этиллактата, который применяется при производстве электротехники, лаков и красок, текстиля, смазок, клеев и т.д. Предполагается, что нетоксичные эфиры молочной кислоты потенциально могут заменить более 80% растворителей, используемых в мире в настоящее время. В связи с этим актуальной становится задача разработки эффективных способов производства молочной кислоты.
Традиционно для получения МК используют микробиологические способы получения, основанные на культивировании бактериальных штаммов. Однако, как правило, при использовании бактерий скорость образования молочной кислоты сильно зависит от рН среды, что приводит к необходимости добавления в ферментационную среду дополнительных рН-статирующих компонентов для поддержания нейтрального или слабокислого значения рН, что в свою очередь значительно усложняет и удорожает процесс очистки полученной молочной кислоты.
Одним из основных свойств дрожжей, делающих их перспективным объектом для производства молочной кислоты, является повышенная устойчивость некоторых из них к низким значениям рН. Свойство дрожжей расти и осуществлять брожение в условиях повышенной кислотности позволяет проводить ферментацию при более низких значениях рН, что дает возможность существенно снизить количество нейтрализирующего вещества, добавляемого в ходе ферментации, а следовательно, значительно облегчает процесс очистки продукта и, в конечном счете, удешевляет весь процесс.
Дрожжи в норме не продуцируют значимых для производства количеств молочной кислоты, однако рекомбинантные дрожжи, содержащие ген лактатдегидрогеназы (Idh), могут продуцировать молочную кислоту в количествах, сравнимых с производственным уровнем (US Patent 6485947; US Patent 6429006; US Patent 6268189). В качестве реципиента в указанных работах использованы такие дрожжи, как Saccharomyces cerevisiae, Kluyveromyces sp., Pichia sp. и Hansenula sp., а в качестве источника гена лактатдегидрогеназы использовали бактерии (Lactobacillus plantarum), грибы (Rhizopus oryzae) и млекопитающих (ген Idh из клеток мышечной ткани быка).
В качестве ближайшего аналога (прототипа) заявляемого способа выбран способ синтеза МК с использованием рекомбинантных дрожжей Saccharomyces cerevisiae, содержащих ген лактатдегидрогеназы из гриба Rhizopus oryzae (J. Ind. Microbiol. Biotechnol., 2003; 30; 22-27).
В качестве прототипа заявляемого штамма-продуцента МК выбран штамм Saccharomyces cerevisiae JnvSc1 (J. Ind. Microbiol. Biotechnol., 2003; 30; 22-27).
Отличительной особенностью способа-прототипа является то, что скорость образования МК остается неизменной в интервале рН 3,5-6,0, а основным недостатком - что процесс синтеза МК практически прекращается, как только ее концентрация в культуральной жидкости достигает 35-40 г/л, что отрицательно влияет на эффективность процесса получения МК. Кроме того, в настоящее время все большее распространение получают непрерывные способы проведение процесса синтеза МК, в которых, как правило, выделение МК осуществляется путем электродиализа культуральной жидкости, а эффективность процесса электродиализа значительно повышается при повышении концентрации молочной кислоты в культуральной жидкости.
Задача заявляемой группы изобретений - разработать способ синтеза МК с помощью рекомбинантных штаммов дрожжей, способных продуцировать МК при низких значениях рН и в условиях ее повышенного содержания в среде.
Задача решена
- разработкой способа синтеза МК путем культивирования рекомбинантных дрожжей рода Schizosaccharomyces, содержащих, по крайней мере, один чужеродный ген лактатдегидрогеназы;
- конструированием рекомбинантного штамма дрожжей Schizosaccharomyces pombe ВКПМ Y-3127 - продуцента МК.
Суть изобретения сводится к следующему.
Эффективность образования молочной кислоты зависит от эффективности протекания двух этапов метаболического пути - этапа гликолиза (серия биохимических превращений глюкозы в пируват) и этапа превращения пирувата в молочную кислоту, контролируемого ферментом лактатдегидрогеназой, причем именно 1-й этап - этап гликолиза - является чувствительным к низким значениям рН и повышенным концентрациям молочной кислоты.
Введение гена лактатдегидрогеназы в дрожжевую клетку не препятствует гликолизу, следовательно, дрожжевые культуры, способные в норме осуществлять гликолиз при низких значениях рН и высоких концентрациях молочной кислоты, будут сохранять эти свойства и после введения в них чужеродного гена.
С целью выявления дрожжей, способных осуществлять гликолиз при низких значениях рН и высоких концентрациях молочной кислоты, нами был проведен скрининг среди различных представителей кислотоустойчивых дрожжей (табл.1). Штаммы отбирали по скорости уменьшения уровня глюкозы в ферментационной среде при проведении процесса в анаэробных условиях при рН 4,0 и повышенном уровне молочной кислоты в ферментационной среде (50 г/л, 80 г/л и 100 г/л).
Методика проведения скрининга приведена в примере 1.
| Таблица 1 | |||||
| Род | Кол-во видов | Кол-во штаммов | Отобрано штаммов при рН 4,0 и 50 г/л МК | Отобрано штаммов при рН 4,0 и 80 г/л МК | Отобрано штаммов при рН 4,0 и 100 г/л МК |
| Debaryomyces | 8 | 86 | 0 | 0 | 0 |
| Brettanomyces | 3 | 10 | 0 | 0 | 0 |
| Metschnikowia | 4 | 35 | 0 | 0 | 0 |
| Deckera | 1 | 3 | 0 | 0 | 0 |
| Williopsis | 1 | 23 | 0 | 0 | 0 |
| Zygowilliopsis | 1 | 15 | 0 | 0 | 0 |
| Saccharomyces | 13 | 44 | 27 | 4 | 0 |
| Zygosaccharomyces | 3 | 6 | 0 | 0 | 0 |
| Hansenula | 10 | 41 | 0 | 0 | 0 |
| Kluyveromyces | 6 | 63 | 11 | 0 | 0 |
| Schizosaccharomyces | 3 | 22 | 22 | 22 | 11 |
Результаты скрининга (табл.1) показали, что дрожжи рода Schizosaccharomyces лучше других способны осуществлять гликолиз при концентрации МК в среде 50-100 г/л.
Так как введение гена лактатдегидрогеназы не влияет на способность дрожжей осуществлять гликолиз, а влияет только на эффективность этапа метаболизма, связанного с превращением пирувата в МК, то нами предложено использовать дрожжи рода Schizosaccharomyces в качестве перспективных реципиентов для получения рекомбинантных штаммов - продуцентов МК, используемых в заявляемом способе.
Для трансформации штамма реципиента может быть использован ген лактатдегидрогеназы из любого организма, кодирующий фермент с высоким сродством к пирувату.
Заявляемый способ осуществляют следующим образом.
Рекомбинантный штамм дрожжей рода Schizosaccharomyces, содержащий, по крайней мере, один чужеродный ген лактатдегидрогеназы, выращивают на полной дрожжевой среде предпочтительно в анаэробных условиях в течение 1-3 суток при температуре 25-30°С. Биомассу отделяют, ресуспендируют в минимальной дрожжевой среде, предпочтительно не содержащей источника азота, и инкубируют с образованием МК предпочтительно в анаэробных условиях. Концентрацию МК в культуральной жидкости определяют методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Для демонстрации осуществления заявляемого способа сконструирован заявляемый рекомбинантный штамм дрожжей Schizosaccharomyces pombe ВКПМ У-3127, при создании которого в качестве реципиента использовали один из штаммов, отобранных при скрининге, а именно штамм Schizosaccharomyces pombe ВКПМ У-285, а трансформацию штамма проводили геном IdhA из гриба Rhizopus oryzae.
Работу по созданию штамма условно можно разбить на 4 этапа.
1. Создание генетической конструкции для экспрессии гена IdhA из Rhizopus oryzae в клетках дрожжей Schizosaccharomyces pombe.
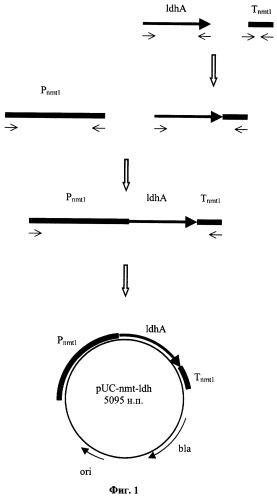
Методом ПЦР по праймерам с перекрывающимися последовательностями получен фрагмент ДНК, содержащий IdhA ген Rhizopus oryzae под контролем промотора и терминатора гена nmt1 Schizosaccharomyces pombe в составе плазмиды pUC-nmt-Idh (фиг.1).
2. Создание интегративной плазмиды pdURA-nmt-Idh для трансформации Schizosaccharomyces pombe и экспрессии гена IdhA.
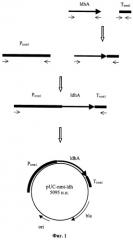
Методом ПЦР получен фрагмент ДНК, кодирующий часть аминокислотной последовательности гена URA4 Schizosaccharomyces pombe в составе плазмиды pUC-dURA4. Затем данный фрагмент ДНК перенесен на плазмиду pUC-nmt-Idh с образованием плазмиды pdURA-nmt-Idh (фиг.2).
3. Трансформация штамма Schizosaccharomyces pombe ВКПМ Y-285 плазмидой pdURA-nmt-Idh.
4. Гетерологичная экспрессия гена IdhA в штамме Schizosaccharomyces pombe ВКПМ Y-285 при проведении ферментации.
Сконструированный рекомбинантный штамм дрожжей Schizosaccharomyces pombe, содержащий гетерологичный ген IdhA из гриба Rhizopus oryzae и способный продуцировать молочную кислоту, отличается от штамма - ближайшего аналога способностью продолжать синтез МК при ее концентрации в среде 80-100 л.
Штамм депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) и имеет регистрационный номер ВКПМ Y-3127.
Заявляемый штамм Schizosaccharomyces pombe ВКПМ Y-3127 имеет следующие свойства.
Культурально-морфологические признаки.
Для описания культурально-морфологических признаков использовали среды "Malt extract", "Malt agar" и картофельно-кукурузный агар (The yeasts of toponomic study. Ed. N.J.W.Kreger-van Rij, Amsterdam, Elsevier Sci. Publ.B.V., 1984, p.421).
После трех дней культивирования на среде "Malt extract" культура образует клетки округлые, элипсоидальные и цилиндрические (3,0-5,0)×(5,0-15,0-24,0) мкм Осадок формируется.
На среде "Malt agar" на 5 сутки образует некрупные колонии белого или слегка кремоватого оттенка. Поверхность колоний гладкая, край ровный. Вегетативное размножение - деление клетки пополам.
Аски со спорами формируются на картофельно-кукурузном агаре. Конъюгация вегетативных клеток предшествует образованию асков, содержащих от 2-х до 4-х эллипсоидальных аскоспор. Свободные аскоспоры могут объединяться в небольшие группы.
Физиолого-биохимические признаки.
Культура способна сбраживать глюкозу, сахарозу, мальтозу и раффинозу. Не способна к брожению галактозы, лактозы и мелибиозы. Ассимилирует в качестве единственного источника углерода сахарозу, мальтозу, раффинозу. Не ассимилирует галактозу, целлобиозу, трегалозу, лактозу, ксилозу, арабинозу, рибозу, рамнозу, эритрит, рибитол, маннит, крахмал, янтарную, лимонную кислоты, инозит культура не ассимилирует нитраты, не способна расти на среде без витаминов.
Оптимальные условия для размножения штамма.
Температура 30°С, рН 6, полная дрожжевая среда (Захаров А. и др. Сборник методик по генетике дрожжей сахаромицетов. - Л., Наука, 1984, стр.144).
Штамм хранится в лиофилизированном виде или в парах жидкого азота.
Полученный штамм Schizosaccharomyces pombe ВКПМ Y-3127 сохраняет способность к образованию молочной кислоты после 18 последовательных пересевов на полноценной среде.
Изобретение иллюстрируется следующими фигурами графического изображения:
Фиг.1 Схема конструирования плазмиды pUC-nmt-ldh.
Фиг.2 Схема конструирования плазмиды pdURA-nmt-ldh.
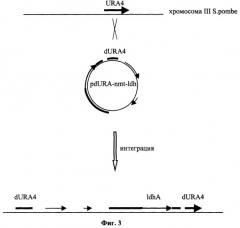
Фиг.3 Схема, отображающая механизм инактивации гена URA4 Schizosaccharomyces pombe при интеграции плазмиды pdURA-nmt-ldh в хромосому III Schizosaccharomyces pombe.
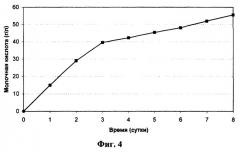
Фиг.4 Накопление МК в среде при культивировании штамма Schizosaccharomyces pombe ВКПМ Y-3127.
Фиг.5 Динамика накопления МК при разных начальных концентрациях ее в среде.
Изобретение подтверждено следующими примерами.
Пример 1. Определение скорости гликолиза у нерекомбинантных штаммов родов Saccharomyces и Schizosaccharomyces.
Исследуемые дрожжи двое суток выращивали на полной дрожжевой среде (мас.%): глюкоза 5,0, дрожжевой экстракт 0,5, пептон 1,0, вода остальное, при 30°С в колбах объемом 750 мл при перемешивании на качалке (250 об/мин). Объем культуральной жидкости 25 мл. В качестве посевного материала использовали односуточную биомассу дрожжей (2,5×106 клеток), выращенную на полной дрожжевой агаризованной среде.
Биомассу отделяли центрифугированием, отмывали дистиллированной водой и по 0,2 г сырой биомассы переносили в пробирки объемом 40 мл с минимальной средой следующего состава (мас.%): глюкоза 1, КН2PO4 0,085; K2HPO4 0,015; MgSO4 0,05; NaCl 0,01; CaCl2 0,01; биотин 2×10-5; пантотенат Са 2×10-4; фолиевая кислота 2×10-6; инозит 1×10-2; никотиновая кислота 4×10-4; парааминобензойная кислота 2×10-4; пиридоксин гидрохлорида 4×10-4; рибофлавин 2×10-4; борная кислота 2×10-6; CuSO4 5×10-6; KJ 1×10-5; FeCL3 2×10-5; MnSO4 4×10-5; Na2MoO4 2×10-5; ZnSO4 4×10-5, вода остальное.
Пробирки оснащены специальными сернокислотными затворами, обеспечивающими стерильность и анаэробные условия проведения опыта.
Каждый штамм культивировали в течение 3-х часов при температуре 30°С и рН 4,0. Скорость гликолиза определяли в среде без добавления МК, при начальной концентрации МК 50 г/л, 80 г/л и 100 г/л.
По окончании культивирования измеряли концентрацию глюкозы в культуральной жидкости и рассчитывали скорость гликолиза по формуле
Vгликолиза=(СT1глюк-СT0глюк)ΔТ,
где
Vгликолиза - скорость гликолиза, г/л×час;
СT0глюк - концентрация глюкозы в начальный момент времени, г/л;
СT1глюк - концентрация глюкозы по окончании культивирования, г/л;
ΔТ - время культивирования, час.
Концентрацию глюкозы определяли на спектрофотометре при длине волны 500 нм с использованием набора реактивов для определения содержания глюкозы в сыворотке и плазме крови ("Диаком Глюкоза ГО". Москва).
В табл.2 приведены результаты определения скорости гликолиза для 22 штаммов дрожжей рода Schizosaccharomyces, относящихся к 3-м известным в настоящее время видам данного рода.
Для сравнения в табл.2 приведена также скорость гликолиза для 4 штаммов дрожжей рода Saccharomyces, которые продемонстрировали способность осуществлять гликолиз при рН 4,0 и концентрации МК в среде 80 г/л.
Из приведенных результатов следует, что впервые обнаружена специфическая для дрожжей рода Schizosaccharomyces способность осуществлять гликолиз в кислой среде в условиях повышенного (50-100 г/л) содержания МК в среде.
Это послужило основанием для использования дрожжей этого рода в качестве реципиентов при конструировании рекомбинантных штаммов-продуцентов МК.
| Таблица 2 | ||||
| Вид, штамм | Скорость гликолиза (г/л/час) при рН 4,0 | |||
| Schizosaccharom yces pombe | Контроль (без МК) | Начальная концентрация МК | ||
| 50 г/л | 80 г/л | 100 г/л | ||
| Y-285 | 1,26 | 1,19 | 0,51 | 0,31 |
| Y-282 | 0,72 | 0,62 | 0,28 | - |
| Y-747 | 0,62 | 0,59 | 0,24 | 0,16 |
| Y-2586 | 0,49 | 0,46 | 0,27 | - |
| Y-2592 | 0,52 | 0,44 | 0,28 | - |
| Y-2596 | 0,60 | 0,56 | 0,28 | - |
| Y-2594 | 0,49 | 0,41 | 0,27 | - |
| Y-2590 | 0,69 | 0,62 | 0,29 | - |
| Y-2591 | 0,63 | 0,55 | 0,27 | 0,19 |
| Y-2588 | 0,56 | 0,49 | 0,25 | - |
| Y-2593 | 0,65 | 0,55 | 0,30 | 0,22 |
| Y-2587 | 0,48 | 0,45 | 0,20 | - |
| Y-2595 | 0,57 | 0,52 | 0,25 | 0,18 |
| Y-304 | 0,50 | 0,46 | 0,35 | 0,13 |
| Y-319 | 0.73 | 0,69 | 0,38 | 0,28 |
| Y-774 | 0,39 | 0,37 | 0,22 | - |
| Y-585 | 0,50 | 0,40 | 0,29 | 0,14 |
| Y-441 | 0,41 | 0,39 | 0,27 | - |
| Y-3106 | 0,66 | 0,60 | 0,32 | 0,20 |
| Y-3107 | 0,55 | 0,51 | 0,25 | - |
| Schizosaccharomyces japonicus | ||||
| Y-3131 | 0,59 | 0,58 | 0,36 | 0,18 |
| Schizosaccharomyces octosporus | ||||
| Y-3132 | 0,61 | 0,55 | 0,36 | 0,17 |
| Saccharomyces cerevisiae | ||||
| Y-1213 | 0,57 | 0,31 | 0,10 | - |
| Y-1218 | 0,49 | 0,26 | 0,08 | - |
| Saccharomyces exigans | ||||
| Y-2550 | 0,37 | 0,20 | 0,11 | - |
| Saccharomyces castellii | ||||
| Y-2538 | 0,43 | 0,25 | 0,13 | - |
Пример: 2 Конструирование штамма Schizosaccharomyces pombe ВКПМ Y-3127.
При конструировании заявляемого рекомбинантного штамма в качестве реципиента использовали штамм Schizosaccharomyces pombe ВКПМ Y-285, который при проведении скрининга показал наибольшую скорость гликолиза при культивировании в присутствии МК. Трансформацию штамма проводили плазмидной ДНК, несущей ген IdhA гриба Rhizopus oryzae с известной нуклеотидной последовательностью (Applied and Environmental Microbiology, June 2000, 2343-2348).
Этап 1. Создание генетической конструкции для экспрессии гена IdhA Rhizopus oryzae в Schizosaccharomyces pombe.
Для экспрессии гена IdhA R. oryzae в Schizosaccharomyces pombe получают конструкцию, содержащую этот ген под контролем промотора и терминатора гена nmtl Schizosaccharomyces pombe. Все приведенные ниже праймеры для ПЦР синтезированы фирмой Syntol (Москва), а их последовательности подобраны исходя из последовательностей ДНК, находящихся в открытом доступе (http://www.ncbi.nlm.nih.gov/Genbank/index.html).
Фрагмент ДНК размером 989 п.н., кодирующий аминокислотную последовательность гена IdhA R. oryzae, получают при помощи ПЦР с использованием Pfu-полимеразы (Fermentas Inc.) и праймеров: TCGCTTTGTTAAATCATGGTATTACACTCAAAGGTCG (G-ldhA-F) и GAGACATTCCTTTTAACAGCTACTTTTAGAAAAGGAAG (G-ldhA-R). В качестве матрицы для ПЦР используют тотальную геномную ДНК R. oryzae NRRL 395, полученную фенольным методом (Letters in Applied Microbiology 2000, 30, 53-56).
Фрагмент ДНК размером 1182 п.н., кодирующий последовательность промотора гена nmtl Schizosaccharomyces pombe, получают при помощи ПЦР с использованием Pfu-полимеразы (Fermentas Inc.) и праймеров: TTAGCGCTAAGACAGAATAAGTCATCAGCG (P-nmtl-F) и CTTTGAGTGTAATACCATGATTTAACAAAGCGACTATAA (P-nmtl-R). Матрицей для ПЦР служит тотальная геномная ДНК Schizosaccharomyces pombe ВКПМ Y-285, полученная фенольным методом.
Фрагмент ДНК размером 285 п.н., кодирующий последовательность терминатора гена nmtl Schizosaccharomyces pombe, получают при помощи ПЦР с использованием Pfu-полимеразы (Fermentas Inc.) и праймеров: TCTAAAAGTAGCTGTTAAAAGGAATGTCTCCCTTGC (T-nmtl-F) и AAAGCGCTGGGTTCATATTTTTGGGCCAC (T-nmtl-R). Матрицей для ПЦР служит тотальная геномная ДНК Schizosaccharomyces pombe ВКПМ Y-285.
Все три фрагмента амплифицированной ДНК очищают после электрофореза в 1% агарозном геле методом экстракции ДНК (Kit #K0513, Fermentas Inc.). Очищенные фрагменты ДНК размером 989 п.н. и 285 п.н. в количестве по 0,05 мкг используют в качестве матрицы для ПЦР по праймерам G-ldhA-F и T-nmtl-R, с использованием Pfu-полимеразы (Fermentas Inc.).
Полученный фрагмент ДНК размером 1261 п.н. очищают в агарозном геле аналогичным методом и используют вместе с фрагментом ДНК размером 1182 п.н. в качестве матрицы для ПЦР в количестве 0,05 мкг каждого по праймерам P-nmtl-F и Т-nmtl-R. 0,5 мкг фрагмента ДНК размером 2411 п.н., полученного после амплификации, электрофореза в агарозном геле и очистки, лигируют с 0,2 мкг ДНК вектора pUC19, обработанной эндонуклеазой рестрикции Hindi, и трансформируют в Е. coli XL1(Blue) методом электропорации (Molecular Cloning, J. Sambrook et al., Cold Spring Harbor Laboratory Press 1989, 1, 1.75). Клоны, содержащие необходимую вставку амплифицированной ДНК размером 2411 п.н., отбирают на чашках с агаризованной средой LB (мас.%): триптон 1, дрожжевой экстракт 0,5, NaCl 0,5, вода остальное, по устойчивости к ампициллину и стандартному тесту на отсутствие активности β-галактозидазы (Molecular Cloning, J. Sambrook et al., Cold Spring Harbor Laboratory Press 1989, 1, 1.85-1.86). Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом и секвенируют (праймеры M13/pUC 17-mer, M13/pUC reverse 17-mer, G-ldhA-F, G-ldhA-R и CTGATATATGAAAATAATACCCAC). Полученная плазмида размером 5095 н.п. названа pUC-nmt-Idh (фиг.1).
Этап 2. Создание интегративной плазмиды pdURA-nmt-Idh для трансформации Schizosaccharomyces pombe и экспрессии гена IdhA.
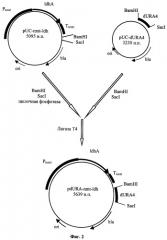
Для создания вектора, способного интегрироваться в хромосому Schizosaccharomyces pombe, получают фрагмент ДНК, кодирующий часть аминокислотной последовательности гена URA4 Schizosaccharomyces pombe, при помощи ПЦР с использованием Taq-полимеразы (Fermentas Inc.) и праймеров: AAGGATCCAGCTATTCAGCTAGAGCTGAG и AAGAGCTCTTTGAAGGTTAGGAAATCGAC. Матрицей для ПЦР служит тотальная геномная ДНК Schizosaccharomyces pombe ВКПМ Y-285. Для реакции амплификации используют по 100 наномолей каждого праймера. 0,5 мкг амплифицированной ДНК размером 569 п.н. расщепляют эндонуклеазами BamHI и Sad и лигируют с 0,2 мкг ДНК вектора pUC19, обработанной тем же способом. Полученную плазмиду трансформируют в Е.coli XL1(Blue). Клоны, содержащие необходимую вставку амплифицированной ДНК размером 559 п.н., отбирают по устойчивости к ампициллину и стандартному тесту на отсутствие активности 6-галактозидазы. Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом. Полученная плазмида размером 3230 н.п. названа pUC-dURA4. Она содержит фрагмент ДНК 559 п.н., гомологичный части открытой рамки считывания последовательности гена URA4 Schizosaccharomyces pombe. Такая плазмида может быть использована в качестве интегративного вектора, т.к. при рекомбинации по области гомологии на хромосоме Schizosaccharomyces pombe встраивается в нее с образованием двух делегированных копий гена URA4 (фиг.3).
1 мкг ДНК плазмиды pUC-dURA4 обрабатывают эндонуклеазами рестрикции BamHI и Sad. Меньший из полученных фрагментов размером 559 н.п., содержащий часть аминокислотной последовательности гена URA4 Schizosaccharomyces pombe, очищают методом экстракции после электрофореза в агарозном геле. Таким же способом разрезают и очищают плазмиду pUC-mnt-ldh. 0,2 мкг ДНК полученной линеаризованной плазмиды pUC-nmt-Idh обрабатывают щелочной фосфатазой (#EF0341, Fermentas Inc.), лигируют с 0,5 мкг фрагмента ДНК размером 559 н.п. и трансформируют в Е.coli XLl(Blue) методом электропорации. Трансформанты отбирают по устойчивости к ампициллину. Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом. Полученная плазмида размером 5639 н.п. названа pdURA-nmt-Idh (фиг.2).
Этап 3. Трансформация штамма Schizosaccharomyces pombe ВКПМ Y-285 плазмидой pdURA-nmt-Idh.
Штамм Schizosaccharomyces pombe ВКПМ Y-285 культивируют в YE среде (Experiments with Fission Yeast, C.Alfa et al., Cold Spring Harbor Laboratory Press 1992, 129) при 30°С и перемешивании на качалке (250 об/мин) до плотности клеток 108/мл. Отмывают дважды равным объемом ледяной дистиллированной воды и дважды ледяным 1М раствором сорбита. 107 клеток ресуспендируют в 50 мкл 1М раствора сорбита и добавляют 5 мкг ДНК, линеаризованной при помощи эндонуклеазы рестрикции StuI плазмиды pdURA-nmt-Idh. Суспензию помещают в кювету для электропорации с расстоянием между электродами 0,2 см и порируют при 1500В. Сразу после порации суспензию разбавляют 300 мкл 1М раствора сорбита. 5×106 клеток (1/10 часть суспензии) засевают в колбу объемом 750 мл и культивируют 48 ч в 30 мл YE среды с добавлением урацила (50 мг/л) и тиамина (0.1 мг/л) при 30°С и 250 об/мин. 108 клеток высевают на чашку с агаризованной EMM средой (Experiments with Fission Yeast, C. Alfa et al., Cold Spring Harbor Laboratory Press 1992, 128) с добавлением 5-фтороротовой кислоты (5-FOA) (1 г/л) и урацила (50 мг/л). Колонии, появившиеся на пятый день, проверяют на ауксотрофность по урацилу методом реплики на аналогичной среде (без 5-FOA) с добавлением урацила и без него. Ауксотрофные по урацилу клоны проверяют на наличие плазмиды, интегрировавшейся в хромосому в область гена URA4, по ПЦР (праймеры AGCTCGAGAAGCTTAGCTACAAATCC и GTAAAACGACGGCCAGT). Трансформанты, ауксотрофные по урацилу и содержащие плазмиду pdURA-nmt-Idh в интегрированном виде, используют для проведения ферментации.
Этап 4. Гетерологичная экспрессия гена IdhA в штамме Schizosaccharomyces pombe ВКПМ Y-285 при проведении ферментации.
Трансформанты, отобранные на этапе 3, культивируют в течение 48 часов при 30°С и перемешивании на качалке (250 об/мин) на YE среде с добавлением глюкозы 20 г/л, урацила (50 мг/л) и тиамина (0.1 мг/л). После отмывки 107 клеток ресуспендируют в 10 мл минимальной дрожжевой среды (пример 1) с добавлением глюкозы 100 г/л (рН 5.1) и инкубируют при 30°С в течение 72 ч. Клетки осаждают и культуральную жидкость анализируют на наличие молочной кислоты. Анализ показал, что все отобранные трансформанты способны продуцировать МК. Наличие молочной кислоты в культуральной жидкости трасформантов и отсутствие ее в культуральной жидкости реципиентного штамма Schizosaccharomyces pombe ВКПМ Y-285 указывает на то, что получен штамм дрожжей с клонированным гетерологичным и эффективно экспрессирующимся геном лактатдегидрогеназы из гриба Rhizopus oryzae.
Трансформант Schizosaccharomyces pombe, показавший наибольшую продуктивность по МК, заложен на хранение, депонирован в ВКПМ под номером ВКПМ Y-3127 и использован для дальнейших исследований.
Пример 3. Синтез МК с использованием рекомбинантного штамма ВКПМ Y-3127.
Посевной материал готовят, как описано в примере 1.
Процесс биосинтеза осуществляют в 3 стадии.
1. Дрожжи выращивают на жидкой полной дрожжевой среде следующего состава (мас.%): глюкоза 10, пептон 1, дрожжевой экстракт 1, вода остальное. Культивирование проводят в анаэробных условиях 3 суток при 30°С. Биомассу отделяют от культуральной жидкости центрифугированием и дважды промывают дистиллированной водой.
2. По 0,2 г сырой биомассы переносят в пробирки с минимальной средой следующего состава (мас.%): глюкоза 10, КН2PO4 0,085; К2HPO4 0,015; MgSO4 0,05; (NH4)2SO4 0,35; NaCl 0,01; CaCl2 0,01; биотин 2×10-5; пантотенат Са 2×10-4; фолиевая кислота 2×10-6; инозит 1×10-2; никотиновая кислота 4×10-4; парааминобензойная кислота 2×10-4; пиридоксин гидрохлорида 4×10-4; рибофлавин 2×10-4; борная кислота 2×10-6; CuSO4 5×10-6; KJ 1×10-5; FeCL3 2×10-5; MnSO4 4×10-5; Na2MoO4 2×10-5; ZnSO4 4×10-5, вода остальное, и инкубируют в течение 16 часов при 30°С в анаэробных условиях. Биомассу отделяют центрифугированием и промывают дистиллированной водой.
3. По 0,2 г сырой биомассы переносят в пробирки с минимальной средой, по примеру 1, но при концентрации глюкозы 10 мас.%. Ферментацию проводят в течение 8 суток при 30°С и рН 5,5 (рН-статирование осуществляют мелом).
Динамика накопления МК в культуральной жидкости приведена на фиг.4.
Полученные данные подтверждают, что заявляемый рекомбинантный штамм - продуцент МК - продолжает синтезировать МК в условиях, когда ее концентрация превышает 50 г/л.
Пример 4. Демонстрация способности штамма ВКПМ Y-3127 осуществлять биосинтез МК при разной начальной концентрации ее в культуральной жидкости.
Подготовку культуры осуществляют по схеме, описанной в примере 3.
По 2,0 г сырой биомассы, подготовленной на 2-й стадии, помещают в стеклянные ячейки объемом 40 мл и культивируют при 30°С, слабом перемешивании и рН 4,0. рН-статирование осуществляют 10% раствором NaOH. В часть ячеек перед началом культивирования добавляют молочную кислоту в концентрации 80 г/л и 100 г/л. Скорость накопления молочной кислоты рекомбинантным штаммом ВКПМ Y-3127 при высоких начальных концентрациях молочной кислоты приведена на фиг.5.
Приведенные данные подтверждают, что полученный штамм-продуцент может продуцировать МК при рН 4,0 и концентрациях молочной кислоты 80-100 г/л, что соответствует свойствам исходного штамма-реципиента, способного осуществлять гликолиз при высоком содержании МК в среде.
Таким образом, в результате скрининга, проведенного среди 11 родов дрожжей (изучено 348 штаммов, принадлежащих к 53 видам), обнаружены дрожжи рода Schizosaccharomyces (изучено 22 штамма, принадлежащие к 3 известным видам), способные осуществлять гликолиз (первую стадию синтеза МК) в условиях повышенной концентрации молочной кислоты в среде и низких значениях рН.
На примере конкретного штамма дрожжей Schizosaccharomyces pombe ВКПМ Y-3127, сконструированного на основе дрожжей рода Schizosaccharomyces, способных к осуществлению гликолиза в условиях повышенной концентрации МК, и гена лактатдегидрогеназы из гриба Rhizopus oryzae, придающего заявляемому штамму способность синтезировать МК, показана способность рекомбинантных штаммов рода Schizosaccharomyces, содержащих ген лактатдегидрогеназы, синтезировать МК в условиях ее повышенного содержания (80-100 г/л) в среде и низких значениях рН.
Заявляемый способ микробиологического синтеза молочной кислоты на основе рекомбинантных дрожжевых продуцентов из рода Schizosaccharomyces перспективен при использовании в производстве МК, т.к. устойчивость дрожжевых штаммов к низким рН позволяет проводить процесс без добавления рН-стабилизирующих реагентов, а способность рекомбинантных продуцентов продолжать синтез МК в условиях ее повышенной концентрации в среде приводит к увеличению эффективности процесса.
1. Способ микробиологического синтеза молочной кислоты путем культивирования рекомбинантного штамма дрожжей - продуцента молочной кислоты, содержащего, по крайней мере, один чужеродный ген лактатдегидрогеназы, отличающийся тем, что в качестве штамма - продуцента молочной кислоты - используют рекомбинантный штамм дрожжей рода Schizosaccharomyces.
2. Рекомбинантный штамм дрожжей Schizosaccharomyces pombe ВКПМ Y-3127 - продуцент молочной кислоты.