Применение fviia или антагониста тканевого фактора для регуляции генной экспрессии и клеточной миграции или хемотаксиса
Иллюстрации
Показать всеИзобретение относится к медицине, биологии и касается применения агониста тканевого фактора, которым является FVII или FVIIa для индукции или увеличения клеточной миграции, а также к применению антагониста тканевого фактора-модифицированного FVII для снижения или прекращения клеточной миграции при лечении патологических состояний, связанных с специфической регуляцией клеточной миграцией или хемотаксиса. Изобретение обеспечивает повышение эффективности лечения. 7 н. и 7 з.п. ф-лы, 10 ил.
Реферат
Область техники, к которой относится изобретение
Описана новая регулирующая клетки активность фактора коагуляции VII (FVII) или антагониста тканевого фактора, такого как, например, инактивированный фактор коагуляции VIIa (FVIIai) клеток, экспрессирующих тканевой фактор (TF). Настоящее изобретение относится к способу регуляции клеточной миграции или хемотаксиса с помощью контактирования клетки с FVIIa или с другим агонистом TF, или с FVIIai или с другим антагонистом TF и определения миграции указанной клетки. Изобретение также относится к применению FVIIa или другого агониста TF, или FVIIai, или другого антагониста TF для получения лекарства для регуляции клеточной миграции у больного. Более того, настоящее изобретение относится к способу лечения и к способу определения активности соединений, в частности предполагаемых лекарств, которые связаны с клеточной миграцией.
Известный уровень техники
Внешний путь свертывания крови инициируется при связывании циркулирующего в крови FVIIa с интегральным белком мембран, тканевым фактором (TF). Роль TF в свертывании крови интенсивно изучается. Считается, что вовлечение FVIIa в качестве протеолитического фермента в каскад свертывания крови ограничивается внеклеточной частью клеток, экспрессирующих TF. Внутриклеточная активность FVIIa впервые была предположена, когда была выявлена гомология последовательности TF и суперсемейства цитокиновых/интерфероновых или гемопоэтических рецепторов. Подкласс I семейства гемопоэтических рецепторов включает рецепторы гормона роста, пролактина, интерлейкинов с 1 по 7, факторов, стимулирующих колонии гранулоцитов и макрофагов, эритропоэтина и тромбопоэтина. Подкласс II включает TF и рецепторы интерферона а и b.
Сходство TF с данным классом рецепторов дополнительно подтвердилось с выявлением кристаллической структуры. Характеристикой данного класса рецепторов цитокинов, который включает рецепторы интерферона b и g, а также ИЛ-10, является то, что их активация ведет к быстрому фосфорилированию по тирозину самих рецепторов, а также группы внутриклеточных белков. В течение минут после первоначального фосфорилирования по тирозину активируется набор митоген-активируемых (Ser/Thr) киназ (МАРК). Данные киназы связаны с несколькими параллельными сигнальными путями. При исследовании предполагаемой внутриклеточной сигнальной активности FVIIa показано, что он индуцирует мобилизацию свободного внутриклеточного кальция (Ca2+) в клеточной линии J82 карциномы мочевого пузыря человека, которая конститутивно экспрессирует TF, и в клетках эндотелия пупочной вены, которые были предварительно обработаны интерлейкином-1 для экспрессии TF, но не способен вызывать какую-либо активацию внутриклеточных тирозинкиназ подобно цитокинам. В заключение предполагается, что FVIIa зависимым от TF способом индуцирует мобилизацию внутриклеточного Ca+2 путем активации фосфолипазы С. Механизм, с помощью которого FVIIa активирует фосфолипазу С не известен, но активация тирозинкиназы определенно исключена.
Последние данные ряда лабораторий указывают на те, что TF может влиять на спектр важных биологических функций, отличных от коагуляции, таких как ангиогенез, васкуляризация эмбрионов и метастазирование опухолей. В настоящее время, однако, неясно каким образом TF вносит вклад в данные биологические процессы. Внеклеточный домен TF состоит из двух модулей, подобных фибронектину типа III, что типично для внеклеточного домена рецепторов цитокинов класса II, это дает возможность предположить, что TF может играть роль в передаче сигнала, главной функции рецептора цитокинов. Однако TF имеет очень короткий цитоплазматический домен (длиной только из 21 аминокислотного остатка) и лишен прилегающих к мембране мотивов, которые опосредуют связывание нерецепторных киназ Януса (Jaks), существенных для передачи сигнала рецепторов цитокинов. Несмотря на это, некоторые биохимические данные предполагают наличие у TF функции трансдукции сигнала. Анализ последовательности белка TF человека выявил предполагаемый сайт фосфорилирования в цитоплазматическом домене, который консервативен для TF мыши, крысы и кролика. Специфические остатки серина в цитоплазматическом хвосте TF фосфорилируются в клетках после стимуляции с помощью активатора протеинкиназы С. Цитоплазматический хвост TF человека фосфорилируется in vitro по множеству сайтов при инкубации с лизатами клеток U87-MG. На потенциальную роль цитоплазматического домена TF в передаче сигнала указывается также в исследованиях, которые показали, что прометастатическое действие TF принципиально зависит от цитоплазматического домена TF. Кроме того, обнаружено, что цитоплазматический домен TF взаимодействует с актинсвязывающим белком 280 (АВР-280) и поддерживает клеточную адгезию и миграцию путем привлечения АВР-280 к опосредуемым TF адгезионным контактам.
Однако показано также, что TF участвует в определенных типах клеточной сигнализации, действуя в качестве кофактора для своего физиологического лиганда FVIIa во внеклеточной сигнализации посредством протеолитического механизма. Например, показано, что связывание FVIIa с TF клеточной поверхности индуцирует осцилляции внутриклеточного Са2+ в ряде клеток, экспрессирующих TF, временное фосфорилирование тирозина в моноцитах, активацию MAP киназы, изменение экспрессии генов в фибробластах и повышенную экспрессию рецептора урокиназы в опухолевых клетках. Каталитически неактивный FVIIa (FVIIai) не способен индуцировать многие из указанных сигнальных ответов, начиная с осцилляции Са2+ до активации MAP киназы и снижения активности генов, и, похоже, что каталитическая активность FVIIa может требоваться для, по меньшей мере, некоторых путей проведения сигнала, опосредуемого TF-FVIIa. В настоящее время мало известно о пути(ях) проведения сигнала, которые индуцируются протеолитически активным FVIIa, и о том, как возникающие под действием FVIIa сигналы могли бы участвовать в ангиогенезе и в метастазировании опухоли.
Для изучения временной программы транскрипции, которая лежит в основе индуцированного FVIIa ответа, в настоящей работе заявители исследовали ответ фибробластов человека на действие FVIIa с помощью микрочипов (микроматриц) для кДНК. Результаты показали, что клеточная экспрессия некоторых генов значительно изменяется в фибробластах после экспозиции с FVIIa. Одним из таких генов является Суr61, индуцируемый ростовым фактором промежуточный ранний ген, продукт которого, как показано, способствует клеточной адгезии, повышает индуцированный ростовым фактором синтез ДНК и стимулирует клеточную миграцию фибробластов и эндотелиальных клеток.
Краткое изложение существа изобретения
Настоящее изобретение относится к применению FVII и/или FVIIa, и/или другого агониста TF, и/или FVIIai, и/или другого антагониста TF в терапевтическом лечении патологических состояний, которые могут иметь отношение к миграции клеток или которые лечатся с помощью специфической регуляции клеточной миграции или хемотаксиса.
В другом варианте изобретение относится к применению FVII и/или FVII, и/или другого агониста TF, и/или FVIIai, и/или другого антагониста TF в терапевтическом лечении патологических состояний, которые могут иметь отношение к регуляции экспрессии, по меньшей мере, одного гена в клетке, например гена Суr61.
В другом варианте изобретение относится к способу индукции или усиления клеточной миграции, включающему стадию контактирования указанной клетки с агонистом тканевого фактора.
В одном осуществлении агонистом тканевого фактора является FVII или FVIIa.
В другом варианте изобретение относится к способу снижения или торможения клеточной миграции, включающему стадию контактирования клетки с антагонистом тканевого фактора.
В одном осуществлении антагонистом тканевого фактора является модифицированный FVII.
В одном осуществлении клетка представляет собой клетку человека, экспрессирующую тканевой фактор, включая фибробласты, гладкомышечные клетки, опухолевые клетки, гематопоэтические клетки и эпителиальные клетки.
В одном осуществлении модифицированный фактор FVII выбран из фактора VII, модифицированного с помощью Dansyl-Phe-Pro-Arg хлорметилкетона, Dansyl-Glu-Gly-Arg хлорметилкетона, Dansyl-Phe-Phe-Arg хлорметилкетона, Phe-Phe-Arg хлорметилкетона, Dansyl-D-Phe-Pro-Arg хлорметилкетона, Dansyl-D-Glu-Gly-Arg хлорметилкетона, Dansyl-D-Phe-Phe-Arg хлорметилкетона и D-Phe-Phe-Arg хлорметилкетона.
В другом варианте изобретение относится к способу индукции или усиления заживления ран у больного, включающему введение указанному больному эффективного количества фармацевтической композиции, включающей фактор VIIa или фактор VII, или другой агонист тканевого фактора, или их сочетание.
В другом варианте изобретение относится к способу торможения или снижения клеточной миграции, инвазии, индуцированной миграцией клеточной пролиферации или ангиогенеза у больного, страдающего заболеванием или состоянием, связанным с нежелательной клеточной миграцией, инвазией, индуцированной миграцией клеточной пролиферацией или ангиогенезом, включающему введение указанному больному эффективного количества фармацевтической композиции, включающей антагонист тканевого фактора.
В одном осуществлении заболевание или состояние представляет собой первичный опухолевый рост, опухолевую инвазию или метастаз.
В другом варианте изобретение относится к применению агониста тканевого фактора для производства лекарства для индукции или усиления клеточной миграции.
В другом варианте изобретение относится к применению антагониста тканевого фактора для производства лекарства для снижения или торможения клеточной миграции.
В другом варианте изобретение относится к способу регуляции экспрессии, по меньшей мере, одного гена в клетке, включающему стадию либо контактирования указанной клетки с агонистом тканевого фактора, либо контактирования указанной клетки с антагонистом тканевого фактора.
В одном осуществлении ген представляет собой ген, принадлежащий к семейству генов CCN.
В другом осуществлении ген выбран из группы, состоящей из Cyr61, CTFG, рецептора D2 дофамина, EST Incyte PD 395116 или рецептора P2U нуклеотидов.
В одном осуществлении ген представляет собой ген Cyr61.
В одном осуществлении регуляция представляет собой индукцию или усиление экспрессии. В другом осуществлении регуляция представляет собой снижение или торможение экспрессии.
В одном осуществлении FVII или FVIIa или другой агонист тканевого фактора индуцирует или усиливает экспрессию генов, а модифицированный FVII или другой антагонист тканевого фактора снижает или тормозит экспрессию генов, например, когда ген представляет собой ген, принадлежащий к семейству генов CCN или ген, выбранный из группы, состоящей из Cyr61, CTFG, рецептора D2 дофамина, EST Incyte PD 395116 или рецептора P2U нуклеотида.
В другом осуществлении FVII или FVIIa или другой агонист тканевого фактора снижает или тормозит экспрессию генов, а модифицированный FVII или другой антагонист тканевого фактора индуцирует или усиливает экспрессию генов, например, когда ген представляет собой EST PD674714.
Патологические состояния, которые можно лечить, представляют собой такие патологические состояния, как, например, атеросклероз, закрепление опухоли, опухолевый рост, опухолевая инвазия, метастаз или ангиогенез. Другие состояния, которые можно лечить, представляют собой, например, заживление ран, включая регенерацию стенок сосудов и лечение ожогов, или воспаление, или регуляцию клеточной миграции in vitro, как, например, при росте ткани.
Перечень фигур
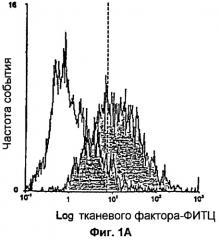
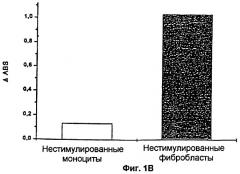
Фиг.1А и 1В: Анализ с помощью проточной цитометрии экспрессии TF в фибробластах (1А). Клетки красили либо с помощью мышиного моноклонального антитела против IgG, конъюгированного с флуоресцеинизотиоцианатом (ФИТЦ) (незакрашенная область), что использовалось в качестве негативного контроля, либо с помощью моноклонального антитела против тканевого фактора (TF), конъюгированного с ФИТЦ (закрашенная область). На фиг.1В показана прокоагулянтная активность фибробластов. В фибробластах с экспрессией TF вызывалось 10-кратное увеличение РСА по сравнению с моноцитами, не экспрессирующими TF.
Фиг.2А: Действие FVIIa и FFR-FVIIa на индуцированный PDGF-BB хемотаксис фибробластов человека. ▪ показывает хемотаксический ответ фибробластов на различные концентрации PDGF-BB.
Фибробласты, инкубированные с 100 нМ FVIIa (•) или 100 нМ FFR-VIIa (о), мигрировали в направлении различных концентраций PDGF-BB. Результаты представляют собой среднее и SEM (стандартная ошибка средней) из трех отдельных экспериментов. Величины Р менее 0,05, * считались статистически достоверными (t-критерий Стьюдента).
Фиг.3 А-D: Влияние различных концентраций FVIIa или FFR-FVIIa на индуцированный PDGF-BB хемотаксис фибробластов. ▪ показывает миграцию фибробластов по направлению к различным концентрациям PDGF-BB. Клетки инкубировали с 12,5 (А), 25 (В), 50(С) и 100 (D) нМ FVIIa (•) или FFR-FVIIa (о) и анализировали в камере Boyden по отношению к различным концентрациям PDGF-BB. Результаты представляют собой среднее и SEM из трех отдельных экспериментов. *=р<0,05, **=р<0,01 и ***=р<0,001 по t-критерию Стьюдента.
Фиг.4А: смесь трех моноклональных антител против TF блокирует действие FVIIa и FFR-FVIIa на индуцированный PDGF-BB хемотаксис фибробластов. ▪ показывает миграцию фибробластов по направлению к PDGF-BB в отсутствие антител против TF, • фибробласты, преинкубированные с антителами против TF и 100 нМ FVIIa, и о фибробласты, преинкубированные с антителами против TF и 100 нМ FFR-FVIIa. Результаты представляют собой среднее и SEM из трех отдельных экспериментов.
Фиг.5А и 5В: Влияние FXa на хемотаксический ответ на PDGF-BB, индуцированный FVIIa. Фибробласты проинкубировали с 200 нМ ТАР (фиг.5А) (▪) или с 0,2-2 мкМ ТАР (фиг.5В) (▪) и затем с 100 нМ FVIIa (•). ТАР присутствовал во всех экспериментах. Хемотаксис индуцировали различными концентрациями PDGF-BB (5А) или 0,1 нг/мл PDGF-BB (5В). Результаты представляют собой среднее и SD (стандартное отклонение) двух отдельных экспериментов.
Фиг.6А: влияние тромбина на хемотаксический ответ на PDGF-BB, индуцированный FVIIa. Фибробласты проинкубировали с 5 Ед/мл (конечная концентрация) гирудина и затем с 100 нМ FVIIa. Гирудин присутствовал во всех экспериментах. Хемотаксис индуцировали различными концентрациями PDGF-B. ▪ показывает клетки, инкубированные с одним гирудином, а • - клетки с гирудином и FVIIa. Результаты представляют собой среднее и SD двух отдельных экспериментов.
Фиг.7А: влияние ингибирования Р13'-киназы на хемотаксис фибробластов, инкубированных с FVIIa. Клетки проинкубировали с различными концентрациями LY294002 в течение 30 мин при 37°С, а затем 100 нМ FVIIa (•) или без FVIIa (▪). Ингибитор присутствовал во время анализа хемотаксиса. Хемотаксис индуцировали 0,1 нг/мл PDGF-BB. Результаты представляют собой среднее и SD двух отдельных экспериментов.
Фиг.8А и 8В: влияние ингибирования PLC на хемотаксис фибробластов, инкубированных с FVIIa. Клетки инкубировали с различными концентрациями U73122 (активным ингибитором PLC) (8A) или U73343 (неактивным контролем) (8В) в течение 30 мин при 37°С, перед инкубацией в присутствии или в отсутствие 100 нМ FVIIa, и затем анализировали в камере Boyden по отношению к градиенту концентрации 0,1 нг/мл PDGF-BB. Агенты присутствовали во время всего эксперимента. ▪ показывает клетки с одним U73122 или U73343, • - клетки с U73122 или U73343 и FVIIa. Результаты представляют собой среднее и SD двух отдельных экспериментов.
Фиг.9: выделение инозитолтрифосфата (IP3) из фибробластов, стимулированных только FVIIa, FFR-FVIIa или в сочетании PDGF-BB. Клетки метили в течение ночи с помощью мио [3H] инозитола, инкубировали в присутствии или в отсутствие 100 нМ FVIIa или FFR-FVIIa в отсутствие или в присутствии 10 нг/мл или 100 нг/мл PDGF-BB. После этого клетки анализировали на предмет выделения 1Рз. Незакрашенные столбики показывают клетки без FVIIa или FFR-FVIIa (контроль), заштрихованные столбики показывают клетки с FFR-FVIIa, а черные столбики показывают клетки, инкубированные с FVIIa.
Фиг.10: фосфорилирование по тирозину PLC-γ1 в ответ на один PDGF-BB (контроль), FVIIa или FFR-FVIIa в сочетании с PDGF-BB. Клетки инкубировали с 100 нМ FVIIa или FFR-FVIIa в течение одного часа, а затем в присутствии или в отсутствие PDGF-BB в указанных концентрациях. Клетки лизировали, и фосфорилирование по тирозину PLC-γ1 определяли, как описано в методах.
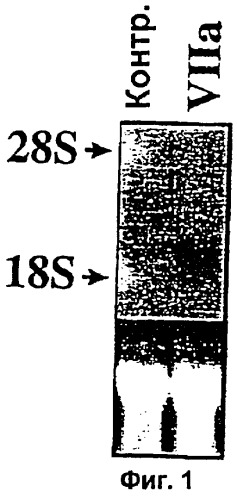
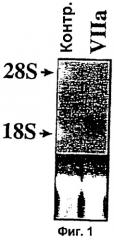
Фиг.1. Нозерн-блот анализ, подтверждающий данные, полученные с помощью теста с применением микрочипов для кДНК. Десять г суммарной РНК (из тех же образцов РНК, которые применяли для выделения поли(А)РНК для получения зондов для гибридизации кДНК в микрочипах) были применены для Нозерн-блот анализа с применением в качестве зонда 32Р-меченным Суr61 (кДНК неполной длины, полученная от Genomic Systems). Вставка В. Сигналы гибридизации, количественно оцененные с помощью Phosphorimager (Molecular Dynamics).
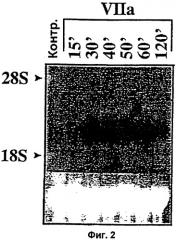
Фиг.2 и 2В. Зависимая от времени индуцированная фактором VIIa экспрессия Суr61. Находящиеся в покое монослои клеток WI-38 обрабатывали фактором VIIa (5 г/мл) (2А) или PDGF-BB (10 нг/мл) (2В) в течение различных периодов времени. Суммарную РНК (10 г) подвергали Нозерн-блот анализу с применением в качестве зонда радиоактивно-меченного Суr61. Окрашенная бромистым этидием 28S рибосомальная РНК соответствующего блота показана на нижней вставке в качестве контроля внесения РНК.
Фиг.3. Дозозависимая индуцированная фактором VIIa экспрессия Суr61. Находящиеся в покое монослои клеток WI-38 обрабатывали различными дозами фактора VIIa, 0, 0,1, 0,5, 2,0 и 5,0 г/мл в течение 45 мин. Суммарную РНК (10 г) подвергали Нозерн-блот анализу с применением в качестве зонда радиоактивно-меченного Суr61. Окрашенная бромистым этидием 28S рибосомальная РНК соответствующего блота показана на нижней вставке в качестве контроля внесения РНК.
Фиг.4. Каталитическая активность фактора VIIa необходима для индуцированной экспрессии Суr61. Находящиеся в покое монослои клеток WI-38 обрабатывали контрольной бессывороточной средой или бессывороточной средой, содержащей фактор VIIa (5 г/мл) или инактивированным по активному сайту фактором VIIa (VIIai, 5 г/мл) в течение 45 мин. Суммарную РНК (10 г) подвергали Нозерн-блот анализу с применением в качестве зонда радиоактивно-меченного Суr61. Окрашенная бромистым этидием 28S рибосомальная РНК соответствующего блота показана на нижней вставке в качестве контроля внесения РНК.
Фиг.5. Индуцированная фактором VIIa экспрессия Суг61 не снимается специфическими ингибиторами фактора Ха и тромбина. Находящиеся в покое монослои клеток WI-38 обрабатывали контрольной средой и средой, содержащей фактор VIIa (5 г/мл; 100 нМ) в течение 45 мин. Клетки проинкубировали с 200 нМ рекомбинантного ТАР (дорожка 3) или гирудином (дорожка 4) в течение 30 мин перед экспозицией с фактором VIIa в течение 45 мин. Суммарную РНК (10 г) подвергали Нозерн-блот анализу с применением в качестве зонда радиоактивно-меченного Суr61. Окрашенная бромистым этидием 28S рибосомальная РНК соответствующего блота показана на нижней вставке в качестве контроля внесения РНК.
Фиг.6. Действие актиномицина D и циклогексимида на индуцированный фактором VIIa стационарный уровень мРНК Суr61. Находящиеся в покое монослои клеток WI-38 проинкубировали с контрольным растворителем, актиномицином D (10 г/мл) или циклогек-симидом (10 г/мл) в течение 30 мин перед тем как клетки экспонировали с фактором VIIa (5 г/мл) в течение 45 мин. Суммарную РНК (10 г) подвергали Нозерн-блот анализу с применением в качестве зонда радиоактивно-меченного Суr61. Окрашенная бромистым этидием 28S рибосомальная РНК соответствующего блота показана на нижней вставке в качестве контроля внесения РНК.
Фиг.7. Фактор VIIa индуцирует экспрессию CTGF.
Находящиеся в покое монослои клеток WI-38 обрабатывали фактором VIIa (5 г/мл) в течение различных периодов времени. Суммарную РНК (10 г) подвергали Нозерн-блот анализу с применением в качестве зонда радиоактивно-меченного CTGF. Окрашенная бромистым этидием 28S рибосомальная РНК соответствующего блота показана в качестве контроля внесения РНК.
Подробное описание изобретения
Настоящее изобретение относится к применению FVII или FVIIa или другого агониста TF для производства фармацевтической композиции для индукции или усиления клеточной миграции.
В другом варианте настоящее изобретение относится к применению FVII, FVIIa или другого агониста TF для производства фармацевтической композиции для индукции или усиления заживления ран или ангиогенеза.
В еще одном варианте настоящее изобретение относится к применению FVIIai или другого антагониста TF для производства фармацевтической композиции для ингибирования или предотвращения клеточной миграции.
В одном осуществлении предметом является клеточная миграция.
В другом варианте настоящее изобретение относится к применению FVIIai или другого антагониста TF для производства фармацевтической композиции для ингибирования или предотвращения ангиогенеза, метастазирования, опухолевого роста или опухолевой инвазии.
В другом варианте настоящее изобретение касается способа индукции или усиления клеточной миграции у больного, включающего введение указанному больному эффективного количества FVII или FVIIa или другого агониста TF.
В еще одном варианте настоящее изобретение касается способа торможения или предотвращения клеточной миграции у больного, включающего введение указанному больному эффективного количества FVIIai или другого антагониста TF.
В отдельном осуществлении эффективное количество представляет собой дневную дозу от приблизительно 5 мкг/кг/день до приблизительно 500 мкг/кг/день.
В другом осуществлении антагонист TF включает модифицированный FVIIa, например FFR-FVIIa.
В настоящем изобретении представляется механизм осуществления активности FVII и/или FVIIa, который касается стимуляции клеточной миграции. Такой механизм создает основу для выявления участия FVII и/или FVIIa в патологических состояниях, в которых принимают участие экспрессирующие TF клетки, подобные эндотелиальным клеткам, эпителиальным клеткам, фибробластам, гладкомышечным клеткам и моноцитам/макрофагам. Более того, в изобретении предлагается основа для идентификации конкретных фармакологических мишеней, которые уместны для терапевтического вмешательства.
Таким образом, настоящее изобретение относится к применению FVII и/или FVIIa и/или FVIIai для терапевтического лечения патологических состояний, которые могут быть связаны с клеточной миграцией или которые могут быть подвергнуты лечению с помощью специфической регуляции клеточной миграции.
В другом варианте настоящее изобретение относится к способу выявления потенциальных лекарств, которые регулируют клеточную миграцию, при этом данный способ включает
a) культивирование экспрессирующей TF клетки;
b) измерение миграции клетки;
c) инкубацию клетки с потенциальным лекарством и
d) измерение миграции инкубированной клетки и определение какого-либо изменения уровня миграции по сравнению с миграцией, измеренной на стадии b, причем такое изменение является показателем биологической активности потенциального лекарства в указанной клетке.
В целом компоненты крови, участвующие в том, что было обозначено как коагуляторный "каскад", представляют собой проферменты или зимогены, ферментативно неактивные белки, которые превращаются в протеолитические ферменты под действием активатора, который сам является активированным фактором свертывания. Факторы коагуляции, которые уже подверглись такому превращению, и обычно обозначаемые как "активные факторы" обозначаются добавлением буквы "а" к наименованию коагуляторного фактора (например, фактор VIIa).
Термин "цинковый хелатор" предназначен для включения соединения, которое связывает фактор VIIa и индуцирует замещение ионов кальция на ионы цинка в факторе VIIa, тем самым ингибируя активность фактора VIIa или комплекса тканевой фактор-фактор VIIa (TF-FVIIa).
Подходящим антагонистом TF согласно изобретению может быть хелатирующее цинк соединение, например, дигидроксамат или дигидразид с группами гидроксамата или гидразида, расположенными друг относительно друга таким образом, что они способны хелатировать ион цинка. Хелатирующее цинк соединение действует в сочетании с FVIIa. Ионы Zn2+ проявляют свое тормозное действие за счет конкуренции со стимулирующим действием ионов Са2+. Предполагается, что ионы Zn2+ вытесняют ионы Са2+ из одного или более сайта(сайтов) связывания кальция в FVIIa. Хелатирующие цинк соединения, например, гидроксаматы и гидразиды, способны действовать как сильные агенты, способствующие связыванию ионов цинка при конкуренции с ионами кальция. Тем самым, специфические соединения потенцируют ингибирование цинком активности комплекса фактор VIIa/тканевой фактор. Активность фактора VIIa в комплексе с тканевым фактором может быть ингибирована с помощью механизма, в котором хелатор цинка связывается с фактором VIIa и облегчает замещение Са2+ на Zn2+. За счет данного действия хелатор оказывает модулирующее влияние на TF при нормальной концентрации свободных ионов Са2+ и Zn2+ в крови.
Термин "FVII" или "фактор VII" обозначает "одноцепочечный" (зимогенный) коагуляторный фактор VII. Термин "фактор VIIa" или "FVIIa" обозначает "двухцепочечный" активированный коагуляторный фактор VII, расщепленный за счет специфического расщепления по пептидной связи Arg152-Ile153. FVII и FVIIa могут быть выделены из крови или получены рекомбинантными способами. Очевидно, что применение способов, описанных здесь, не зависит от происхождения очищенного фактора VIIa и, следовательно, настоящее изобретение рассматривается как охватывающее применение любых препаратов фактора VII или FVIIa, пригодных для указанного здесь применения. Предпочтительным является FVIIa человека. FVII или FVIIa также предназначены для включения вариантов FVII, в которых один или более аминокислотных остатков был(были) заменен(ы).
Термин "модифицированный фактор VII", "инактивированный FVII" или "FVIIai" предназначен для обозначения FVIIa, содержащего, по меньшей мере, одну модификацию в каталитическом центре, которая существенно снижает способность модифицированного FVIIa активировать FX и FIX. Термины можно применять взаимозаменяемо. Такая модификация включает аминокислотное замещение (или замену) одного или более остатков из каталитической триады Ser344, Asp142 и His193, а также включает модификацию остатков каталитической триады ингибиторами сериновой протеазы, такими как фосфорорганические соединения, сульфанилфторид, пептид галометилкетон или азапептид. FFR-FVIIa служит одним из примеров производного FVIIai, полученного с помощью блокады активного центра FVIIa необратимым ингибитором, D-фенилаланин-L-фенилаланин-L-аргининхлорметилкетон (FFR cmk). Другими подходящими производными FVIlai являются инактивированный FVIIa, полученный или который может быть получен путем блокирования активного центра с помощью L-фенилаланин-L-фенилаланин-L-аргининхлорметилкетона, дансил-L-фенилаланин-L-фенилаланин-L-аргининхлорметилкетона или дансил-D-фенилаланин-L-фенилаланин-L-аргининхлорметилкетона. Предпочтительным является FFR-FVIIa (FVIIa, инактивированный с помощью FFR cmk).
Термин "протеинкиназа" предназначен для обозначения фермента, способного фосфорилировать серии и/или треонин, и/или тирозин в пептидах и/или белках.
Термин "потенциальное лекарство" предназначен для обозначения любого образца, имеющего биологическую функцию или оказывающего биологическое действие в клеточной системе. Образец может быть образцом биологического материала, таким как микробиологический или растительный экстракт, или он может быть образцом, содержащим соединение или смесь соединений, полученных с помощью органического синтеза или генетическими методами.
Термин "агонист TF" включает соединения, индуцирующие
a) передачу сигнала путем прямого связывания с TF (например, FVIIa),
b) стимуляцию каскада МАРК,
c) блокирование ингибирования МАРК (например, ингибиторы РТР-азы),
в которых агонисты являются потенциальными лекарствами, как определено выше.
Термин "антагонист FT" включает
a) агенты, которые конкурируют с FVIIa за связывание с TF без проведения сигнала, например FVIIai,
b) агенты, которые связываются с FVIIa и предотвращают связывание с TF, например Zn-гидроксамат,
с) агенты, которые тормозят проведение сигнала, препятствуя членам каскада МАРК,
d) агенты, которые связываются с FVIIa/TF и предотвращают проведение сигнала,
e) агенты, которые связываются с FVIIa/TF/FX и предотвращают проведение сигнала,
f) агенты, которые блокируют активацию фактора Х человека, катализируемую комплексом тканевой фактор/фактор VIIa человека,
причем данные антагонисты являются потенциальными лекарствами, как определено выше.
Термин "фармакологические мишени" предназначен для обозначения белка, который может менять миграцию экспрессирующих TF клеток.
Термин "репортерный ген" предназначен для обозначения конструкции ДНК, которая после транскрипции дает белок, который может быть выявлен.
Термин "промоторный элемент SRE" обозначает последовательность ДНК, которая связывает транскрипционные факторы, индуцируемые компонентами, присутствующими в сыворотке.
Термин "экспрессирующая TF клетка" обозначает любую клетку млекопитающего, которая экспрессирует TF.
Термин "фосфорилирование белка" предназначен для обозначения фосфорилирования серина и/или треонина, и/или тирозина в пептидах и/или белках.
Модуляция или регуляция клеточной миграции определяется как способность FVIIa или другого агониста TF, или FVIIai или другого антагониста TF 1) повышать или снижать характер, нормальный или ненормальный, протекающей клеточной миграции, 2) инициировать нормальную клеточную миграцию и 3) инициировать ненормальную клеточную миграцию.
В данном контексте термин "лечение" включает как предотвращение неблагоприятного состояния, так и регуляцию уже существующего состояния с целью торможения или сведения к минимуму этого состояния. Таким образом, профилактическое введение FVIIa или другого агониста TF, или FVIIai или другого антагониста TF включается в термин "лечение".
В данном контексте термин "одна единица" определяется как количество фактора VII, присутствующее в 1 мл нормальной плазмы, соответствующее приблизительно 0,5 мкг белка. После активации 50 единиц соответствуют приблизительно 1 мкг белка.
В данном контексте термин "больной" определяется как любое животное, в частности млекопитающее, такое как человек. Термин "субъект" применяют взаимозаменяемо с термином "больной".
Сокращения
| TF | тканевой фактор |
| FVII | фактор VII в одноцепочечной, неактивной форме |
| FVIIa | фактор VII в активированной форме |
| RFVIIa | рекомбинантный фактор VII в активированной форме |
| FVIIai | модифицированный (инактивированный) фактор VII |
| FFR-FVIIai | фактор VII, инактивированный с помощью реакции с D-Phe-L-Phe-L-Arg-хлорметилкетоном |
Тканевой фактор (TF) является клеточным рецептором фактора VIIa (FVIIa), и комплекс служит главным инициатором свертывания крови. Заявители изучали влияние связывания FVIIa с TF на клеточную миграцию и проведение сигнала фибробластов человека, которые экспрессируют TF на высоком уровне. Фибробласты, инкубированные с FVIIa, мигрировали в направлении концентрационного градиента PDGF-BB при концентрации приблизительно в сто раз меньшей, чем в случае фибробластов, не связанных с FVIIa. Антитела против TF ингибировали повышение хемотаксиса, вызванное FVIIa/TF. Более того, при ингибированном по активному сайту FVIIa (FFR-FVIIa) наблюдалось выраженное подавление хемотаксиса, индуцированного PDGF-BB. Была исключена возможность того, что гиперхемотаксис индуцируется предполагаемым образованием FXa и активностью тромбина.
FVIIa индуцировал образование инозитол-1,4,5-трифосфата в той же степени, что и PDGF-BB; эффекты FVIIa и PDGF-BB были аддитивными. FFR-FVIIa не вызывал какого-либо выделения инозитол-1,4,5-трифосфата. Ответ на PDGF-BB и FVIIa в виде клеточной миграции полностью блокировался ингибитором PLC, что позволяет предположить, что для ответа важна активация PLC. Таким образом, связывание FVIIa с TF может быть независимым от свертывания, может модулировать клеточные ответы, такие как хемотаксис и для этого необходима каталитическая активность FVIIa.
Полагают, что TF играет роль в метастазировании опухолевой клетки, но механизм пока не известен. Однако, совсем недавно Ott et al. идентифицировали связывающийся с актином белок 280 (АВР-280) в качестве лиганда цитоплазматического домена TF, что служит молекулярным путем, посредством которого TF может поддерживать метастазирование опухолевой клетки. Молекулярные сигналы и биологические функции, трансдуцируемые FVIIa/TF, являются, однако, еще малопонятными.
В фибробластах человека имеет место конститутивная экспрессия TF. Данные клетки экспрессируют также рецепторы фактора роста тромбоцитов (PDGF). PDGF индуцирует в своих клетках-мишенях митогенность, реорганизацию актина и направленную клеточную миграцию (хемотаксис). Ранее заявители показали, что PDGF-BB является эффективным хемотаксическим фактором для фибробластов человека и что хемотаксический ответ опосредуется рецептором β-класса. Таким образом, данные клетки были выбраны для изучения предполагаемой трансдукции сигнала и клеточной миграции, индуцированной связыванием FVIIa с TF.
Ниже заявители впервые показывают четкую связь между передачей сигнала, индуцированного связыванием FVIIa с TF, и клеточным ответом на ростовой фактор. Заявители представляют результаты, свидетельствующие о том, что в фибробластах человека комплекс FVIIa/TF ведет к гиперхемотаксическому ответу на PDGF-BB. Более того, ингибированный по активному сайту FVIIa (FFR-FVIIa) дозозависимо подавлял направленную миграцию к PDGF-BB. С помощью применения специфических ингибиторов PLC и фосфатидили-нозитол-3'-киназы (PI3'-киназы) заявители также показывают, что гиперхемотаксический ответ по направлению к PDGF-BB, индуцированный сигналом FVIIa/TF, зависит от активности фосфолипазы С (PLC), но не зависит от PI3'-киназы. FVIIa и PDGF-BB аддитивным образом индуцировали образование инозитол-1,4,5-трифосфата (IP3), одного из вторичных посредников, выделяющихся после активации PLC.
TF конститутивно экспрессируется на плазматической мембране многих экстраваскулярных клеток, таких как фибробласты стромы в сосудистой адвентициальной оболочке и в фиброзных капсулах печени, селезенки и почек. Таким образом, экспрессия TF обнаруживается в местах, физически отделенных от циркулирующей крови и обеспечивающих гемостатическую оболочку. После травмы данный барьер, как полагают, защищает организм от потери крови. TF может, однако, индуцироваться в моноцитах/макрофагах, гладкомышечных клетках сосудов, эндотелиальных клетках и ряде опухолевых клеток под действием множества агентов, включая цитокины и ростовые факторы. Индукция на транскрипционном уровне происходит вскоре после стимуляции, что указывает на TF как относящийся к росту немедленно-ранний ген.
В данной работе заявители исследовали роль TF в качестве рецептора с сигнальной функцией. Заявители показывают, что фибробласты человека с конститутивной экспрессией TF после связывания лиганда FVIIa мигрируют по направлению к крайне низким концентрациям PDGF-BB. Один TF/FVIIa не индуцировал повышенную спонтанную миграцию, т.е. случайную миграцию. Таким образом, сочетание внутриклеточного проведения сигнала FVIIa/TF и ростового фактора PDGF-BB было необходимо для достижения ответа в виде подвижности. Обязательным было не только связывание с TF, но и каталитическая активность TF/FVIIa, поскольку ингибированный по активному сайту FVIIa не вызывал повышенного миграционного ответа. Более того, ингибирующие моноклональные антитела предотвращали увеличение хемотаксического ответа под действием FVIIa. Заявители также исключили возможность того, что происходит непрямая передача сигнала за счет FXa или тромбина, поскольку ТАР и гирудин не оказывали влияния на индуцированный FVIIa/TF хемотаксис. Вместо этого заявители обнаружили, что возрастающие концентрации FFR-FVIIa активно ингибируют индуцированный PDGF-BB хемотаксис. Фибробласты, инкубированные с FFR-FVIIa, проявляли совершенно нормальную случайную миграцию. Ингибирующее действие FFR-FVIIa на индуцированный PDGF-BB хемотаксис не наблюдалось в присутствии сочетания антител против TF, что тем самым исключает возможность того, что FFR-FVIIa является токсичным. Результаты скорее позволяют предположить, что в клетках, э