Способ предупреждения функциональной диспепсии и физиологического иммунодефицита у телят
Иллюстрации
Показать всеИзобретение относится к ветеринарному акушерству. Способ включает подкожное введение телятам биоглобина (планцеты денатурированной суспендированной - ПДС) в дозе 20 мг/гол/сут не более 10 сут перед родами. Способ позволяет повысить качество профилактики возникновения функциональной диспепсии у новорожденных телят и уровень общей резистентности организма. 20 ил., 2 табл.
Реферат
Изобретение относится к области животноводства, в частности к ветеринарии, и может быть применено при профилактике острых желудочно-кишечных заболеваний у новорожденных животных.
Известен способ профилактики возникновения диспепсии путем применения глюкокортикостероидов в первые сутки жизни телят, который предупреждает возникновение заболевания в 20,57% случаев (Александров И.Д. Глюкокортикостероиды для профилактики и лечения телят при диспепсии //ж. Вегеринария. - 1985. - №1. - с.61-62).
Применение данного способа без предварительного исследования гормонального статуса у животных может привести к негативным последствиям (Машковский М.Д. Лекарственные средства /Гормоны коры надпочечников. - 1993. - 1 ч. - 666 с.). Кроме того, эти препараты не обладают антибактериальной активностью в отношении патогенной микрофлоры, часто переводящей диспепсию из простой формы в токсическую. Повышение же уровня эндогенных глюкокортикоидов после инъекций вышеуказанных препаратов, только на короткий срок задерживает время развития клинических признаков диспепсии и не влияет на концентрацию катаболических гормонов щитовидной железы.
Известен также способ повышения резистентности у новорожденных телят (SU 1801003 5, А 61 К 31/00, 1993), по которому животным вводят неспецифический иммуноглобулин в комплексе с 2-триметиламонийэтилкарбонатом. Данный способ не обеспечивает соотношение уровней глюкокортикоидов и тиреоидов в крови новорожденных.
Задача изобретения - повышение качества профилактики возникновения функциональной диспепсии у новорожденных телят.
Это достигается тем, что в качестве профилактического средства применяют иммуномодулятор (RU 2036651 5, А 61 К 31/00, 1995) биоглобин (плацента денатурированная суспендированная - ПДС). Биоглобин - средство, нормализующее метаболические процессы в организме, оказывающее иммуномодулирующее и адаптогенное влияние за счет наличия в его составе полипептидов, аминокислот и нуклеиновых кислот.
В связи с тем, что у новорожденных телят в первые дни постнатального периода есть дефицит иммуноглобулинов и эндогенных кортикостероидов, который возрастает при диспепсии, то введение биоглобина обеспечивает повышение эндогенного продуцирования корой надпочечников коровы-роженицы и возможно плода - кортизола, при одновременном снижении уровня тироксина (Гришина Т.Д. Динамика тиреоидных гормонов при неонатальной диареи телят //Р.ж. Ветеринария - 1983. - №12, - с.25). Кортизол, в свою очередь, усиливает продуцирование иммуноглобулинов и очевидно иммуноглобулина G, который, проходя через плацентарный барьер, также поднимает уровень естественной резистентности.
Такое комплексное действие в целом способствует восстановлению иммунного статуса организма, функции желудочно-кишечного тракта и препятствует развитию патогенной микрофлоры.
Пример. Биоглобин вводили коровам в дозе 20 мл/гол/сут подкожно в течение 10 сут перед родами.
Роды у коров проходили без осложнений в физиологические сроки.
Были подобраны четыре группы новорожденных телят (n=4) с функциональной (простой) формой диспепсии: 1-я группа - телята без диспепсии, от коров, обработанных биоглобином; 2-я - телята с диспепсией, от коров, обработанных биоглобином; 3-я - телята без диспепсии, от интактных коров (контроль 1); 4-я - телята с диспепсией от интактных коров (контроль 2). Дифференциальным диагнозом исключены инфекционные заболевания.
1) Кровь на определение кортизола и тироксина иммуноферментным методом и показателей естественной резистентности: альбумина; глобулинов альфа, бета, гамма и иммуноглобулинов брали у телят из яремной вены на 2-е и 10-е сут после рождения. Гистологические исследования иммунокомпетентных органов у телят проводили на 7-е сут (посмертно) после рождения.
В результате отмечено (табл.1), что на 2-е сут после рождения концентрация кортизола была наибольшей в группах телят без диспепсии: в 1-й группе - 78,3; во 2-й - 50,75 нмоль/л.
У телят с диспепсией уровень кортизола был значительно меньше: во 2-й группе - 27,15; в 4-й - 15,65 нмоль/л. Снижение количества кортизола на 65,3% во 2-й группе по отношению к 1-й и на 69,2% в 4-й, по отношению к 3-й группе, свидетельствует об активизации стероидогенеза после обработки биоглобином.
Тенденция повышения уровня кортизола у телят без диспепсии в 1-й и 3-й группах сохранилась и на 10-е сут.
Уровень тироксина в группах телят на 2-е сут после рождения имел разные показатели.
Наличие высокой концентрации свободного тироксина в крови телят с диспепсией 4-й группы свидетельствует о наличии гипертиреоза. У телят 3-й группы (без диспепсии) количество тироксина на 36,5% меньше. И значительно меньшее количество гормона отмечено у телят 1-й и 2-й групп, где коровам вводили биоглобин. Концентрация тироксина в 1-й группе была в 2,3 раза меньше по отношению к показателям 3-й группы, а во 2-й соответственно в 16,1 раза по отношению к данным 4-й группы.
Динамика снижения гормона в 1-й группе после обработки биоглобином (на 7,9%) соответствует таковой в 3-й (на 25,5%; р<0,01), что указывает на бионормализующее влияние биоглобина в течение времени протекания диспепсии.
Значительное повышение тироксина у телят 2-й группы, равно как и снижение кортизола к 10-м сут, возможно отражает наличие более глубоких морфофункциональных нарушений в организме новорожденных или коров-матерей.
| Таблица 1Содержание гормонов в крови новорожденных телят | |||||||
| № п/п | Группы n=4 | Кортизол, нмоль/л | Тироксин, нмоль/л | ||||
| 2-е сут | 10-е сут | Р | 2-е сут | 10-е сут | Р | ||
| 1. | Телята без диспепсии от коров, обработанных биоглобином | 78,30±6,05 | 86,25±3,19 | >0,2 | 62,00±12,30 | 57,13±6,42 | >0,5 |
| 2. | Телята с диспепсией от коров, обработанных биоглобином | 27,15±4,00 | 25,55±2,48 | >0,5 | 14,25±17,90 | 157,63±18,97 | >0,5 |
| 3. | Телята без диспепсии от интактных коров (контроль 1) | 50,75±4,80 | 55,12±2,38 | >0,5 | 146,25±6,25 | 109,00±6,01 | <0,01 |
| 4. | Телята с диспепсией от интактных коров (контроль 2) | 15,65±0,88 | 16,42±0,75 | >0,5 | 230,00±23,80 | 205,25±12,32 | >0,2 |
2) Одновременно проведенные биохимические исследования гуморальных показателей естественной резистентности у данных телят показали (табл. 2), что синдром диареи новорожденных телят сопровождается выраженным повышением уровня сывороточного альбумина и альфа-глобулинов и снижением содержания бета-глобулинов и гамма-глобулинов.
Так, превышение количества альбуминов у телят с диспепсией по сравнению с телятами без нее на 2-е сут составило: 2-я группа - на 27,2% больше значения в 1-й группе; 4-я группа - на 20,1% больше показателя в 3-й группе. На 10-е сут эта зависимость сохранилась и превышение соответственно было равно: 2-я группа - на 19,8%, 4-я группа - на 21,0%.
Превышение уровня альфа-глобулинов в эти сроки у телят с диспепсией (2-я и 4-я группы) над показателями, полученными в 1-й группе, соответственно было: 6,7 и 10,0%. Даже у телят без диспепсии от интактных коров имелось превышение количества альфа-глобулинов на 3,6% по сравнению с данными по животным 1-й группы. На 10-е сут концентрация в крови альфа-глобулинов в 1-й группе еще снизилась на 29,7% и была ниже аналогичных показателей 2-й, 3-й и 4-й групп на: 25,6; 44,8 и 24,7%.
Содержание бета-глобулинов на 2-е сут от рождения было наименьшим у телят 4-й (телята с диспепсией от интактных коров) группы. Снижение этого показателя по сравнению с данными 1-й, 2-й и 3-й групп было на: 10,4; 24,4 и 27,7%. Некоторое увеличение (на 14,1%) на 10-е сут мало изменило ситуацию и уровень бета-глобулинов оставался сниженным на 21,4% по сравнению со значением в 3-й группе (телята без диспепсии от интактных коров). Такая же закономерность отмечена и по количеству гамма-глобулинов. Наибольшее их количество на 2-е сут в 1-й группе значительно превышает аналогичные значения во 2-й, 3-й и 4-й группах на: 55,0; 43,5 и 56,4% соответственно. На 10-е сут это соотношение еще более увеличилось по отношению к 4-й группе и аналогично составило: 40,2; 50,2 и 70,0%.
| Таблица 2Биохимические показатели крови новорожденных телят | ||||||||||
| Группы (п-4) | Иммуноглобулины, ед. | Альбумины | Глобулины | |||||||
| α | 3 | 1 | ||||||||
| 2-е сут | 10-е сут | 2-е сут | 10-е сут | 2-е сут | 10-е сут | 2-е сут | 10-е сут | 2-е сут | 10-е сут | |
| 1. Телята от коров, обработанных биоглобином без диспепсии | 13,65±0,92 | 17,42±1,51 | 35,14±1,45 | 34,08±1,00 | 18,45±0,31 | 16,40±1,10 | 16,50±1,01 | 16,87±0,95 | 29,90±2,51 | 32,95±1,50 |
| 2. Телята от коров, обработанных биоглобином с диспепсией | 5,96±0,24 | 5,87±0,40 | 41,46±0,63 | 39,02±0,40р<0,02 | 16,69±0,49 | 18,50±0,94 | 19,57±0,57 | 19,00±0,29 | 19,28+1,20 | 23,49±1,36 |
| 3. Телята от коров без обработки, без диспепсии | 7,47±0,41 | 8,39±0,38 | 39,49±0,76 | 37,84±0,35 | 19,23±0,51 | 18,74±0,72 | 20,45±0,30 | 21,49±0,52 | 20,80±1,48 | 21,93±0,50 |
| 4. Телята от коров без обработки с диспепсией | 1,37±0,26 | 1,32±0,19 | 45,83±1,05 | 44,50±0,77 | 20,30±2,40 | 19,20±1,20 | 14,80±0,85 | 16,90±0,78 | 19,11±1,04 | 19,38±0,96 |
Отношение А/Г также имело значения, которые соответствуют данному физиологическому состоянию животных. Так во 2-й и 4-й группах соотношение А/Г было наибольшим, соответственно: на 2-е сут - 0,7 и 1,03; на 10-е сут - 0,63 и 0,80. В 1-й и 3-й группах, где телята были без диспепсии, соотношение соответственно составило: на 2-е сут - 0,54 и 0,65; на 10-е сут - 0,51 и 0,60.
Наилучший показатель на 2-е сут в 1-й группе, на 20,3% меньше показателя 3-й группы, а также на 29,6% меньше от показателя телят 2-й группы и на 90,7% меньше значения А/Г в 4-й группе. На 10-е сут общее соотношение белкового коэффициента по группам имело ту же направленность и снизилось незначительно, в основном за счет небольшого роста количества глобулинов.
Таким образом, биохимические показатели крови свидетельствуют о выраженном бионормализующем влиянии биоглобина, направленном на снижение физиологического иммунодефицита у новорожденных телят.
3) Гистологические исследования проводили на трех группах новорожденных телят (n=3). 1-я группа - телята без диспепсии от коров-матерей, обработанных биоглобином в дозе 20 мл/гол/сут, в течение 10 сут перед родами. 2-я группа - телята без диспепсии от интактных коров-матерей; 3-я группа - телята с диспепсией от интактных коров-матерей. Патологический материал (брыжеечные лимфоузлы, селезенку, тимус) для проведения гистологических исследований согласно общепринятым методикам, отбирали посмертно на 10-е сут после рождения.
В результате была установлена следующая картина гистоморфологических изменений в иммунокомпетентных органах.
Селезенка
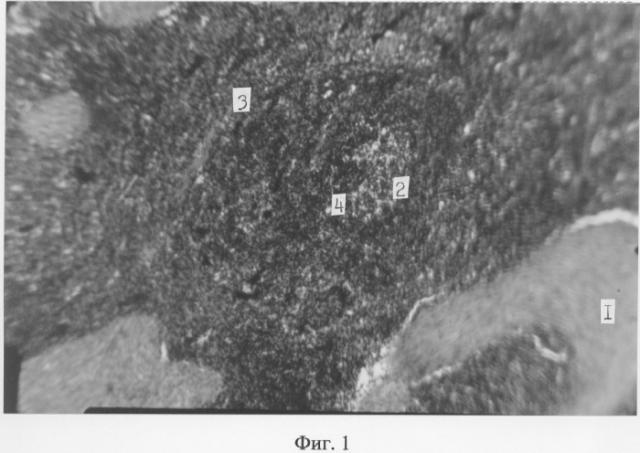
1-я группа. Количественно лимфоидная ткань селезенки телят развита примерно так же, как у телят 2-й группы. Однако клеточный состав белой пульпы имеет значительные особенности. Большинство селезеночных телец (Фиг.1 (2)) имеют реактивные центры (Фиг.1, (4)), среди клеток которых (Фиг.1 (1)) встречаются макрофагальные и митотически активные элементы, по-видимому пролиферирующие В-лимфобласты. Краевая зона селезеночных телец, на границе между белой и красной пульпой (Фиг.1 (3)), умеренно заполнена малыми лимфоцитами и содержит единичные макрофаги. Вокруг пульпарных сосудов наблюдаются равномерные скопления малых лимфоцитов, образуя периартериальные лимфатические влагалища.
Вышеизложенное дает основание говорить о преимущественной активизации В-зависимых зон белой пульпы селезенки у телят 1-й группы.
В красной пульпе, по сравнению с телятами 2-й группы лучше заметны пульпарные тяжи, часто с бластными элементами и макрофагами. Синусы красной пульпы умеренно заполнены кровью.
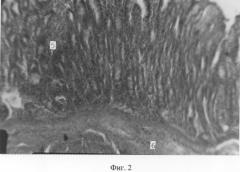
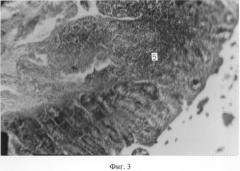
О стимулирующем действии биоглобина на элементы иммунной защиты свидетельствуют обширные диффузные скопления лимфоидной ткани в слизистой оболочке 12-перстной кишки и сычуга телят (Фиг.2 (5); 3(1)). Местами эти скопления носят нодулярный характер. Причем в некоторых узелках формируются реактивные центры (Фиг.2 (6)).
2-я группа. Микроскопическая характеристика органа свидетельствует о типичном его строении. Лимфоидная ткань в составе белой пульпы занимает около 20% паренхимы. Красная пульпа умеренно заполнена кровью. Белая пульпа представлена формирующимися селезеночными тельцами и периваскулярными лимфоидными муфтами (Фиг.4 (7)). И тельца и муфты состоят из плотно упакованных лимфоцитов, без зонального их расположения. Между лимфоцитами не были обнаружены макрофагальные элементы и бластные формы клеток (Фиг.5).
Реактивные центры в умеренно развитых фолликулах не выявлялись.
Указанные особенности белой пульпы свидетельствуют о несколько большем развитии Т-зависимых зон и незначительной функциональной активности В-зависимых зон органа.
Между слабо кровенаполненными синусами селезенки выявляются пульпарные тяжи органа, бедные как бластными элементами, так и макрофагами.
3-я группа. У телят этой группы по гистологическому строению в селезенке отмечена анаплазия лимфоидной ткани, рыхлость и отсутствие зональности в селезеночных тельцах, а также кровенаполнение синусоидов красной пульпы (Фиг.6 (8)). В ретикулярной строме часто обнаруживаются макрофагальные элементы.
В селезенке лишь изредка встречаются сформированные лимфоидные тельца и периваскулярные муфты. В центре некоторых телец иногда можно заметить незначительное разрыхление, напоминающее морфологически реактивные центры (Фиг.6). В основном же бедная лимфоидная ткань располагается диффузно на фоне умеренно кровенаполненных синусоидов красной пульпы.
Для селезенки телят этой группы на фоне общего иммунодефицитного состояния наиболее заметна ущербность В-зависимых зон белой пульпы.
Тимус
1-я группа. Для тимуса телят этой группы характерны достаточно выраженные инволютивные процессы. Однако в дольках хорошо контурируют корковое и мозговое вещество. В корковом веществе густо расположенные лимфоциты маскируют клетки стромы. Часто встречаются фигуры митоза бластных лимфоидных элементов. Редко встречаются дырчатые образования и деструктивно измененные лимфоциты. Вместе с тем сравнительно часто обнаруживаются активные макрофаги.
В мозговом веществе находится относительно много тимусных телец разной генерации. Тельца, как правило, плотные, сочные, с малым количеством деструктивных изменений.
В целом для органа характерно иммунодефицитное состояние на уровне I, II степени, согласно существующей классификации.
2-я группа. Тимус телят этой группы имеет характерное для данного вида и возраста животного строение (Фиг.7). От соединительнотканной капсулы отходят тонкие прослойки, разделяющие орган на дольки. В прослойках хорошо контурируют кровеносные сосуды, наблюдаются редкие макрофаги и эозинофильные лейкоциты, а также клетки плазмоцитарного ряда.
В каждой дольке хорошо различается корковое (Фиг.7(9)) и мозговое вещество (Фиг.7 (10)). Корковое вещество содержит большое количество относительно плотно расположенных малых лимфоцитов. Между ними заметны элементы сетевидного эпителиального остова, а также, особенно в подкапсулярной зоне, более крупные лимфобласты. Корковое вещество занимает почти 2/3 площади среза каждой дольки. Ближе к границе с мозговым веществом встречаются деструктивно измененные лимфоциты с явлениями кариорексиса.
Мозговое вещество более светлое, в связи с меньшим содержанием лимфоцитов в петлях цитоплазмы эпителиоретикулоцитов. Последние местами как бы изолируются, их цитоплазма становится более оксифильной, а ядро более светлым, пузырьчатым. Это уже одноклеточная стадия будущего слоистого эпителиального тимусного тельца. Именно такие тельца обнаруживаются ближе к центральной части мозгового вещества долек тимуса. Вблизи тимусных телец встречаются отдельные макрофаги и ацидофилоциты. В некоторых тельцах наблюдаются деструктивные изменения.
3-я группа. Для тимуса телят этой группы были характерными крайне выраженные инволютивные процессы и иммунодефицитное состояние. В органе отсутствовали признаки деления долек на корковое и мозговое вещество. Наблюдалось разрыхление паренхимы и стромы долек. По всей площади среза встречались тимусные тельца одноклеточной стадии (Фиг.8 (11)). Редко обнаруживались многоклеточные эпителиальные тельца без четких очертаний. В них, как правило, отмечались резко выраженные деструктивные изменения и некротические очаги. Вместе с тем макрофагальная реакция в органе была умеренной (Фиг.8, 9 (12), 10(12), 11(12)).
Лимфоузлы
Группа 1. В корковом веществе органа по всей площади пирамидальной области обнаруживаются фолликулы разных размеров (Фиг.12(13)). Наиболее четкими являются фолликулы меньших размеров, округлые по форме, с хорошо выраженными центрами размножения. Ближе к подкапсулярному синусу встречаются более крупные скопления малых лимфоцитов, но с менее выраженными центрами размножения (Фиг.13(14)).
Наблюдается относительно хорошо развитая паракортикальная зона органа, насыщенная малыми лимфоцитами (Фиг.13(15)). От этой зоны в глубину органа располагаются хорошо контурирующие мозговые тяжи (Фиг.14(16)) с большим количеством лимфоцитов, среди которых встречаются иммунобласты (Фиг.14(17); 15(17)). Широкие мозговые синусы заполнены свободными клеточными элементами (Фиг.16(18)), особенно макрофагами, а также четко контурирующими ретикулярными клетками с гиперхромными ядрами (Фиг.16(19)).
Группа 2. У телят этой группы брыжеечный лимфатический узел имеет типичное строение (Фиг.17). В корковом веществе можно выделить пирамидальные области с фолликулами разной величины (Фиг.17(13)) и умеренно выраженными центрами размножения. На периферии фолликулов лимфоциты располагаются более плотно, образуя концентрическую зону. В центрах размножения можно различать иммунобласты и дендритные ретикулярные клетки. Паракортикальная зона относительно богата диффузно расположенными малыми лимфоцитами. Мозговое вещество узла представлено хорошо развитыми тяжами, богатыми малыми лимфоцитами. Изредка встречаются бластные элементы.
Мозговые синусы содержат мелкие, тонкоотросчатые ретикулярные клетки, малое количество лимфоцитов и единичные в поле зрения макрофаги (Фиг.18).
Группа 3. В лимфоузлах пирамидальные области коркового вещества не выражены. Лимфоидная ткань содержит очень малое количество лимфоцитов (Фиг.19(14)) в петлях дендритных ретикулярных клеток. Отсутствуют сформированные фолликулы. Незначительные уплотненные участки лимфоидной ткани не содержат центров размножения (Фиг.19). Учитывая то, что последние являются местом расположения лимфоцитов, трансформирующихся в плазмоциты, можно говорить о значительном ослаблении гуморального иммунитета организма.
Паракортикальная зона органа также бедна лимфоцитами. Она является основной тимус-зависимой зоной лимфоузлов. Ее слабое развитие свидетельствует о снижении клеточной иммунологической защиты.
Внутренняя зона коркового вещества лимфоузла переходит в слабо контурирующие тяжи мозгового вещества, с малым содержанием лимфоцитов и иммунобластов, что также является признаком иммунодепрессивного состояния. В относительно узких синусах мозгового вещества обнаруживается мало свободных клеточных элементов - лимфоцитов и макрофагов (Фиг.20).
Таким образом, обработка биоглобином коров-матерей за 10 сут перед родами способствует активизации иммунологического статуса у новорожденных и снижению физиологического иммунодифецита телят за счет активизации стероидогенеза, иммуноглобулинов, а также положительных морфофункциональных изменений в иммунокомпетентных органах животных.
Применение биоглобина в дозе 20 мл/гол/сут, в течение 10 сут коровам-матерям способствует предупреждению возникновения физиологической диспепсии в 90% случаев. Эффективность составляет 1 рубль затрат на 63 рубля прибыли.
Источники информации
1. Александров И.Д. Глюкокортикостероиды для профилактики и лечения телят при диспепсии //Ветеринария. - 1985. - №1. - с.61-62.
2. Гришина Т.Д., Динамика тиреоидных гормонов при неонатальной диарее телят //Р. ж. Ветеринария. - 1983. - № 12. - с. 25.
3. Машковский М.Д. Лекарственные средства /Гормоны коры надпочечников. - 1993. - 1 ч. - 666 с.
4. RU 2036651 5, A 61 K 31/00, 1995.
5. SU 1801003 5, A 61 K 31/00, 1993.
Способ предупреждения функциональной диспепсии и физиологического иммунодефицита у телят, заключающийся в том, что перед родами коровам вводят иммуномодулятор биоглобин (плацента денатурированная суспендированная - ПДС) подкожно в дозе 20 мг/гол/сут не более 10 суток.