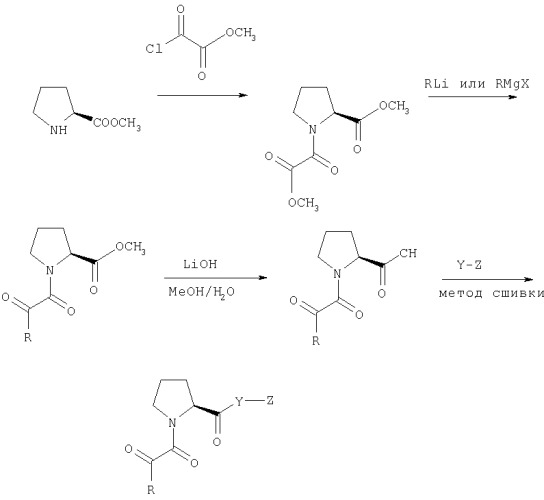
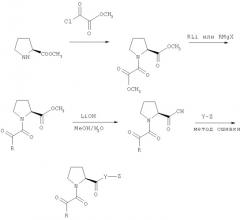
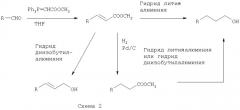
Ингибиторы ферментативной активности ротамазы, являющиеся малыми молекулами
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы:
где R1 означает - С1-С9алкил с прямой или разветвленной цепью, возможно замещенный С3-С8циклоалкилом, - С6циклоалкил, 2-фурил, 3-фурил, 2-тиазолил, 2-тиенил, 3-тиенил, фенил; Х означает кислород; Y означает кислород, NR2, где R2 означает Н, C1-С6алкил; Z означает Н;
при условии, что когда Х является кислородом и Y является кислородом тогда R1 не является метилом, этилом, изопропилом, изобутилом или фенилом; и когда Х является кислородом, а Y представляет собой NR2, где R2 является водородом, метилом, изопропилом или трет-бутилом, тогда R1 не является метилом. Соединения I используют в качестве промежуточных для синтеза биологически активных соединений. 3 н. и 5 з.п. ф-лы, 3 табл., 26 ил.
Реферат
УРОВЕНЬ ТЕХНИКИ
1. Область изобретения
Настоящее изобретение касается нейротрофных соединений, обладающих сродством к иммунофилинам FKBP-типа, их получения, а также применения в качестве ингибиторов ферментативной активности, ассоциированной с иммунофилиновыми белками, в частности в качестве ингибиторов ферментативной активности пептидил-пролил-изомеразы или ротамазы.
2. Описание предшествующих достижений в данной области
Термин "иммунофилин" относится к ряду белков, служащих рецепторами основных иммунодепрессорных лекарственных средств, таких как циклоспорин A (CsA), FK506 и рапамицин. Известными классами иммунофилинов являются циклофилины и FK506-связывающие белки, такие как FKBP. В то время как циклоспорин А связывается с циклофилином, FK506 и рапамицин связываются с FKBP. Указанные комплексы, образованные иммунофилином и лекарственным средством, задействованы в целом ряде внутриклеточных систем сигнальной трансдукции, в особенности в иммуной и нервной системах.
Известно, что иммунофилины обладают пептидил-пролил-изомеразной (PPI) или ротамазной ферментативной активностью. Показано, что ротамазная активность задействована в катализе взаимного превращения цис- и транс-изомеров иммунофилиновых белков.
Иммунофилины были впервые открыты и изучены в иммунной ткани. Исходно специалисты предполагали, что ингибирование ротамазной активности иммунофилинов приводит к подавлению пролиферации Т-клеток, что в свою очередь вызывает иммунодепрессорный эффект, свойственный иммунодепрессорным лекарственным препаратам, таким как циклоспорин A, FKBP и рапамицин. Как показали дальнейшие исследования, само по себе ингибирование ротамазной активности недостаточно для осуществления иммунодепрессорной активности (Schreiber et al., Science, 1990, vol.250, pp.556-559). Было продемонстрировано, что способ действия вышеупомянутых комлексов иммунофилина и лекарственного средства обусловлен их взаимодействием с тройными белками-мишенями (Schreiber et al., Cell, 1991, vol.66, pp.807-815). Комплексы, образованные лекарственным средством и иммунофилином (такие как FKBP-FK506 и FKBP-CsA), связываются с ферментом кальцинейрином, ингибируя передачу сигнала рецепторов Т-клеток, что приводит к пролиферации Т-клеток. Комплекс, образованный рапамицином и FKBP, взаимодействует аналогичным образом с белком RAFT1/FRAP и подавляет передачу сигнала от рецептора IL-2.
Обнаружено, что иммунофилины присутствуют в высоких концентрациях в центральной нервной системе, где их количество в 10-50 раз больше, нежели в иммунной системе. Как оказалось, в нервных тканях иммунофилины оказывают влияние на процесс роста нейрона, синтез оксида азота, а также выделение нейротрансмиттеров.
Пикомолярные концентрации иммунодепрессантов, таких как FK506 и рапамицин, стимулируют внешний рост аксонов у клеток РС12 и сенсорного нерва, в частности у клеток спинномозговых узлов (DRGs) (Lyons et al., Proc. of Natl. Acad. Sci., 1994, vol.91, pp.3191-3195). В экспериментах, проводимых на целых животных, было установлено, что FK506 стимулирует регенерацию нервов после лицевой нервной хирургии и вызывает функциональное восстановление у животных с повреждениями седалищного нерва.
Удивительным оказался тот факт, что лекарственные препараты, обладающие высоким сродством к FKBP, являются мощными ингибиторами ротамазы, обладающими нейротрофным действием (Lyons et al.). На основании этих открытий было предложено использовать иммунодепрессанты при лечении различных периферических невропатий, а также для усиления процесса восстановления нервов в центральной нервной системе (CNS). Как показали проведенные исследования, причиной нейродегенеративных расстройств, таких как болезнь Альцгеймера (Alzheimer's), болезнь Паркинсона (Parkinson's) и боковой амиотрофический склероз (ALS) может служить потеря или снижение доступности нейротрофного вещества, специфичного для конкретной популяции нейронов, пораженных указанным заболеванием.
Выявлено несколько нейротрофных факторов, воздействующих на определенные популяции нейронов в центральной нервной системе. В частности, было высказано предположение, что болезнь Альцгеймера возникает в результате уменьшения содержания или исчезновения нервного ростового фактора (NGF). В связи с этим было высказано предположение, что болезнь Альцгеймера можно лечить экзогенным нервным ростовым фактором или другими нейротрофными белками, такими как мозговой нервный фактор (BDNF), глиальный нервный фактор, цилиарный нейротрофный фактор, а также нейротропин-3, в результате чего будет наблюдаться повышение выживаемости дегенерирующей популяции нейронов.
Клиническое применение указанных белков для лечения различных неврологических заболеваний затруднено сложностями введения и биологической доступности крупных белков по отношению к мишеням нервной системы. Напротив, иммунодепрессорным лекарственным средствам, обладающим нейротрофной активностью, свойственны относительно небольшие размеры, а также великолепные биологическая доступность и специфичность. Вместе с тем, при хроническом применении иммунодепрессантов наблюдается ряд потенциально серьезных побочных эффектов, в том числе нейротоксичность (например, нарушение клубочковой фильтрации и необратимый интерстициальный фиброз (Корр et al., 1991, J. Am. Soc. Nephrol. 1:162); неврологические дефициты (например непроизвольные треморы) или неспецифическая церебральная стенокардия (например, нелокализуемые головные боли (De Groen et al., 1987, Engl. J. Med. 317:861)); а также сосудистая гипертензия с протекающими от нее осложнениями (Kahan et al., 1989, N. Engl. J. Med. 321:1725).
Для того чтобы избежать указанных побочных эффектов, ассоциированных с применением иммунодепрессорнык соединений, настоящее изобретение предусматривает использование соединений, которые не являются иммунодепрессантами и содержат ингибиторы ротамазы FKBP в виде небольших молекул, служащие для стимуляции роста и регенерации нейронов при различных невропатологических состояниях, когда может быть облегчено восстановление нервов, в частности при повреждении периферических нервов в результате физической травмы или болезненного состояния, таких как диабет, физическое повреждение центральной нервной системы (спинного или головного мозга), повреждение мозга при сотрясении, а также для лечения неврологических заболеваний, сопровождающихся нейродегенерацией, в том числе болезни Паркинсона, болезни Альцгеймера и бокового амиотрофического склероза.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается нового класса нейротрофных соединений, обладающих сродством к иммунофилинам FKBP-типа. Связанные с указанными белками рассматриваемые нейротрофные соединения являются мощными ингибиторами ферментативной активности, ассоциированной с иммунофилиновыми белками, конкретно - ферментативной активности ротамазы, в результате чего происходит стимуляция регенерации и удлинения нейронов. Ключевой отличительной особенностью соединений, предусмотренных настоящим изобретением, является отсутствие у них сколь бы то ни было существенной иммуносупрессорной активности в дополнение к их нейротрофной активности.
Предпочтительным вариантом воплощения настоящего изобретения является нейротрофное соединение, соответствующее формуле:
в которой R1 представляет собой группу, выбранную из числа линейных или разветвленных С1-С9алкильных или алкенильных групп, возможно замещенных С3-С8циклоалкилом, С3 или С5циклоалкилом, С5-С7циклоалкенилом или радикалом Ar1, где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть при желании замещены С1-С4алкилом, С1-С4алкенилом или гидроксилом, а Ar1 представляет собой радикал, выбранный из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3- тиенила, 2-, 3- или 4-пиридила, а также фенила, несущих от одного до трех заместителей, которые независимо выбраны из числа следующих: водород, галоген, гидроксил, нитрогруппа, трифторметил, линейный или разветвленный C1-С6алкил или алкенил, С1-С4алкоксил или C1-C4алкенилоксил, фенокси-группа, бензилокси-группа, а также аминогруппа;
Х соответствует группе, выбранной из числа следующих: кислород, сера, метилен (СН2) или H2;
Y обозначает группу, представляющую собой кислород или NR2, где R2 является водородом либо линейным или разветвленным С1-С6алкилом; а
Z обозначает остаток, соответствующий линейному или разветвленному C1-C6алкилу или алкенилу;
причем указанная алкильная цепь замещена по одному или нескольким положениям Ar1, определенным выше; С3-С8циклоалкилом; циклоалкилом, присоединенным посредством линейной или разветвленной C1-С6алкильной или алкенильной цепи; либо Ar2, который представляет собой группу, выбранную из числа следующих: 2-индолил, 3-индолил, 2-фурил, 3-фурил, 2-тиазолил, 2-тиенил, 3-тиенил, 2-, 3- или 4-пиридил, а также фенил, несущий от одного до трех заместителей, которые независимо выбраны из числа следующих: водород, галоген, гидроксил, нитрогруппа, трифторметил, линейный или разветвленный С1-С6алкил или алкенил, С1-С4алкоксил или C1-C4алкенилоксил, фенокси-группа, бензилокси-группа, а также аминогруппа; а
Z может быть также представлен фрагментом
где R3 выбран из группы, состоящей из линейного или разветвленного алкила С1-8, возможно замещенного С3-C8циклоалкилом или вышеописанным Ar1, либо незамещенным Ar1;
Х2 является кислородом или NR5, где R5 выбран из группы, состоящей из водорода, C1-C6 прямого или разветвленного алкила или алкенила; а
R4 выбран из группы, состоящей из фенила, бензила, линейного или разветвленного С1-С5алкила или алкенила, а также линейного или разветвленного С1-С5алкила или алкенила, замещенного фенилом; а также его фармацевтически приемлемые соли или гидраты.
Еще одним предпочтительным вариантом воплощения настоящего изобретения является нейротрофное соединение, соответствующее формуле
в которой
R1 представляет собой С1-9линейную или разветвленную алкильную или алкенильную группу, возможно замещенную С3-С8циклоалкилом, С3- или С5циклоалкилом, С5-С7циклоалкенилом или Ar1, где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть возможно замещены C1-4алкилом, С1-С4алкенилом или гидроксилом, а Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила или фенила, несущих от одного до трех заместителей, которые независимо выбраны из числа следующих: водород, галоген, гидроксил, нитрогруппа, трифторметил, линейный или разветвленный С1-С6алкил или алкенил, С1-C4алкоксил или С1-С4алкенилоксил, фенокси-группа, бензилокси-группа, а также аминогруппа; а
Z обозначает С2-6 линейный или разветвленный алкил или алкенил; причем указанная алкильная цепь замещена по одному или большему числу положений определенным выше Ar1; С3-С8циклоалкилом; циклоалкилом, присоединенным посредством линейной или разветвленной С1-С6алкильной или алкенильной цепи; либо Ar2, причем Ar2 выбран из группы, состоящей из
2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила, или фенила, несущего от одного до трех заместителей, которые независимо выбраны из числа следующих: водород, галоген, гидроксил, нитрогруппа, трифторметил, линейный или разветвленный C1-С6алкил или алкенил, С1-С4алкоксил или С1-С4алкенилоксил, феноксигруппа, бензилоксигруппа, а также аминогруппа; либо его фармацевтически приемлемые соли или гидраты.
Еще одним предпочтительным вариантом воплощения настоящего изобретения является нейротрофное соединение, обладающее сродством к иммунофилинам типа FKBP, которые ингибируют ротамазную активность указанного иммунофилина.
Еще одним предпочтительным вариантом воплощения настоящего изобретения является способ лечения неврологического заболевания у животного, предусматривающий использование терапевтически эффективного количества соединения, обладающего сродством к иммунофилинам типа FKBP, которое ингибирует ротамазную активность указанного иммунофилина.
Еще одним предпочтительным вариантом воплощения настоящего изобретения является способ активации регенерации и роста нейронов у млекопитающих, предусматривающий воздействие на млекопитающего эффективным количеством нейротрофного соединения, обладающего сродством к иммунофилинам типа FKBP, которое ингибирует ротамазную активность указанного иммунофилина.
Еще одним предпочтительным вариантом воплощения настоящего изобретения является способ предотвращения деградации нервов у животных, предусматривающий воздействие на животного эффективным количеством нейротрофного соединения, обладающего сродством к иммунофилинам типа FKBP, которое ингибирует ротамазную активность указанного иммунофилина.
Еще одним предпочтительным вариантом воплощения настоящего изобретения является нейротрофное соединение, являющееся N-глиоксил-пролиловым эфиром формулы:
в которой
R1 представляет собой линейную или разветвленную С1-С5алкильную или алкенильную группу, возможно замещенную С3-С6циклоалкилом, или Ar1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила или фенила;
Х выбран из группы, состоящей из кислорода или серы;
Y является кислородом; а
Z является алкилом или алкенилом с линейной или разветвленной цепью, причем указанная алкильная цепь замещена по одному или большему числу положений Ar1, описанным выше, С3-С6циклоалкилом или Ar2, который выбран из группы, сотоящей из 2-, 3- или 4-пиридила, либо фенила, несущего от одного до трех заместителей, независимо выбранных из числа водорода или С1-С4-алкоксила.
Наиболее предпочтительными нейротрофными соединеними, представляющими собой N-глиоксил-пролиловые эфиры, отвечающие приведенной выше формуле, являются следующие:
3-(2,5-диметоксифенил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
2-(3,4,5-триметоксифенил)-1-этил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(2-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(4-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-циклогексил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-N-([2-тиенил]глиоксил)-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксобутил)-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-циклогексилглиоксил-2-пирролидинкарбоксилат, а также
3,3-дифенил-1-пропил(2S)-N-([2-тиенил]глиоксил)-пирролидинкарбоксилат.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАЦИЙ
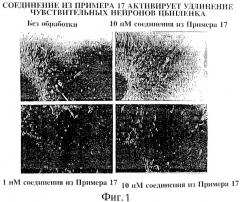
На фиг.1, приведена микрофотография спинномозгового узла цыпленка, обработанного различными концентрациями соединения, описанного в примере 17. Как следует из Фиг.1, соединение, соответствующее примеру 17 настоящего изобретения, оказывает мощное активирующее действие на удлинение аксонов в культурах сенсорных нейронов. Культуры эксплантов, выделенных на 9-10 день эмбрионального развития цыпленка из спинномозгового узла, обрабатывали различными концентрациями соединения из примера 17. Через 48 часов подсчитывали количество аксонов, длина которых превышала соответствующий показатель для исходного экспланта DRG. Из указанной величины вычитали количество аналогичных аксонов в эксплантах, не обработанных соединением из примера 17, в результате чего получали показатель, характеризующий стимуляцию удлинения аксонов под действием соединения из примера 17. Представлены микрофотографии DRG's, обработанных соединением из примера 17, а также количественное дозо-зависимое удлинение аксонов, элисированное соединением из примера 17.
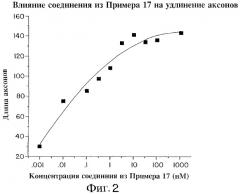
На фиг.2 графически представлены количественные показатели удлинения аксонов в спинномозговых узлах цыпленка, обработанных различными концентрациями соединения из примера 17. Как следует из фиг.2, соединение, соответствующее примеру 17 настоящего изобретения, оказывает мощное активирующее действие на удлинение аксонов в культурах чувствительных нейронов. Культуры эксплантов, выделенных на 9-10 день эмбрионального развития цыпленка из спинномозговых узлов, обрабатывали различными концентрациями соединения из примера 17. Через 48 часов подсчитывали количество аксонов, длина которых превышала соответствующий показатель для исходного экспланта DRG. Из указанной величины вычитали количество аналогичных аксонов в эксплантах, не обработанных соединением из примера 17, в результате чего получали показатель, характеризующий стимуляцию удлинения аксонов под действием соединения из примера 17. Представлены количественные зависимости "доза-эффект" удлинения аксонов под действием соединения из примера 17.
Фиг.3 представляет собой микрофотографию срезов седалищного нерва крысы. Как следует из фиг.3, соединение, описанное в примере 1 настоящего изобретения, активирует регенерацию нейронов после повреждения седалищного нерва. У самцов крыс линии Sprague-Dawley, весящих 150 г, сдавливали седалищные нервы на уровне бедер. В течение последующего 21-го дня указанным крысам ежедневно проводили однократное подкожное введение соединения из примера 1 (30 мг/кг), неактивного соединения (30 мг/кг), либо липидного носителя. Затем животных умервщляли, выделяли седалищные нервы, получали срезы нервов на участке 2 мм дистальнее повреждения и окрашивали их с помощью серебряного красителя Хольмса (Holmes) (для подсчета количества аксонов), а также Luxol быстрым синим (для выявления ремиелинизации). На данной микрофотографии (увеличение 630х) представлены срезы седалищного нерва у только что прооперированных крыс, а также животных, обработанных носителем, соединением из примера 1, либо неактивным соединением; по 4 животных на группу.
На фиг.4 графически представлено [3H]-CFT связывание на мкг стриарного мембранного белка. Как видно из фиг.4, нейроиммунофилиновые лиганды, предусмотренные настоящим изобретением, активируют восстановление дофаминовых нейронов мыши после обработки МРТР. Мышам линии CD1, весящим 25 г, ежедневно в течение 5 дней внутрибрюшинно вводили 30 мг/кг МРТР. Кроме того, указанным животным ежедневно в течение всего срока применения МРТР, а также последующих 5 дней проводили подкожное введение липидного носителя, соединения из примера 1 (100 мг/кг), либо соединения из примера 17 (40, 20 или 10 мг/кг). Через еще 18 дней мышей умерщвляли, полосатые тела, выделенные из 5 животных каждой группы, объединяли, а затем использовали их для получения препаратов отмытых мембран. Для того чтобы определить количество транспортеров дофамина на живых нервных окончаниях, оценивали интенсивность связывания [3H]-CFT с препаратами стриарных мембран, полученными из различных групп животных. Интенсивность связывания в присутствии 10 мкМ немеченного CFT служила показателем неспецифического связывания; данную величину вычитали из показателя общей интенсивности связывания, в результате чего получали характеристику специфического [3H]-CFT связывания. Интенсивность связывания служила показателем количества соответствующего белка в стриарных мембранах каждой из экспериментальных групп. Для того чтобы получить данные о количестве тирозин-гидролазы (ТН) в полосатом теле, в пучках аксонов средней части переднего мозга, а также о нигральном уровне фермента (что является характеристикой функциональных дофаминэргических нейронов), венечные и саггитальные срезы головного мозга животных, обработанных либо МРТР, либо лекарственным препаратом, окрашивали анти-тирозингидролазным lg.
На фиг.5 приведена гистограмма для [3H]-CFT, построенная для 200 мкг мембранного белка. Как видно из фиг.5, нейроиммунофилиновые лиганды, предусмотренные настоящим изобретением, активируют восстановление дофаминовых нейронов после обработки мышей МРТР в соответствии с методикой, описанной для фиг.4.
Фиг.6 представляет собой микрофотографию (увеличение 630х) венечных и саггитальных срезов головного мозга. На фиг.6 показаны срезы головного мозга, окрашенные анти-тирозин-гидроксилазным lg; при этом подопытные животные были обработаны либо МРТР либо лекарственным средством; указанная обработка позволяет оценить количество ТН в полосатом теле, что является характеристикой функциональных дофаминэргических нейронов.
Фиг.7 представляет собой микрофотографию (увеличение 50х) венечных и саггитальных срезов головного мозга. На фиг.7 показаны срезы головного мозга, окрашенные анти-тирозин-гидроксилазным lg; при этом подопытные животные были обработаны либо МРТР либо лекарственным средством; указанная обработка позволяет оценить нигральные уровни ТН, что является характеристикой функциональных дофаминэргических нейронов.
Фиг.8 представляет собой микрофотографию (увеличение 400х) венечных и саггитальных срезов головного мозга. На фиг.8 показаны срезы головного мозга, окрашенные анти-тирозин-гидроксилазным lg; при этом подопытные животные были обработаны либо МРТР либо лекарственным средством; указанная обработка позволяет оценить количество ТН в пучках аксонов средней части переднего мозга, что является характеристикой функциональных дофаминэргических нейронов.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Новые нейротрофные соединения, предусмотренные настоящим изобретением, характеризуются относительно небольшим размером молекул по сравнению с другими известными соединениями, такими как рапамицин, FK506 и циклоспорин, способными связываться с иммунофилинами типа FKBP.
Предусмотренные настоящим изобретением нейротрофные соединения обладают сродством к белкам, связывающим FK-506, таким как FKBP-12. Неожиданно оказалось, что при своем связывании с FKBP предусмотренные настоящим изобретением нейротрофные соединения ингибируют пролил-пептидил цис-транс изомеразную или ротамазную активности связывающего белка и стимулируют рост аксонов при отсутствии иммуносупрессорного эффекта.
Конкретнее настоящее изобретение касается нового класса нейротрофных соединений, соответствующих формуле
в которой R1 представляет собой линейную или разветвленную С1-С9алкильную или алкенильную группу, возможно замещенную С3-С8циклоалкилом, С3 или С5циклоалкилом, С5-С7циклоалкенилом или радикалом Ar1, где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть при желании замещены С1-С4алкилом, С1-С4алкенилом или гидроксилом, а Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила, а также фенила, несущих от одного до трех заместителей, которые независимо выбраны из числа следующих: водород, галоген, гидроксил, нитрогруппа, трифторметил, линейный или разветвленный C1-С6алкил или алкенил, С1-С4алкоксил или С1-С4алкенилоксил, феноксигруппа, бензилоксигруппа, а также аминогруппа;
Х является кислородом, серой, метиленом (СН2) или Н2;
Y является кислородом или NR2, где R2 является водородом либо C1-С6алкилом; а
Z является линейным или разветвленным С2-С6алкилом или алкенилом; причем алкильная цепь замещена по одному или большему числу положений радикалом Ar1, определенным выше; С3-С8циклоалкилом; циклоалкилом, соединенным посредством линейной или неразветвленной С1-С6алкильной или алкенильной цепи; либо радикалом Ar1, который выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3- фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила, а также фенила, несущих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, линейного или разветвленного С1-С6алкила или алкенила, С1-С4алкоксила или С1-C4алкенилоксила, феноксигруппы, бензилоксигруппы, а также аминогруппы; а
Z может быть также представлен фрагментом
где R3 выбран из группы, состоящей из линейного или разветвленного C1-С8алкила, возможно замещенного С3-С8циклоалкилом или вышеописанным радикалом Ar1, либо незамещенным Ar1;
Х2 является кислородом или NR5, где R5 выбран из группы, состоящей из водорода, линейного или разветвленного C1-С6алкила или алкенила; а
R4 выбран из группы, состоящей из фенила, бензила, линейного или разветвленного С1-С5алкила или алкенила, а также линейного или разветвленного С1-C5алкила или алкенила, замещенного фенилом;
а также фармацевтически приемлемых солей указанных соединений и их гидратов.
Предпочтительными являются соединения, отвечающие формуле:
в которой R1 представляет собой C1-С9алкильную или алкенильную группу с линейной или разветвленной цепью, возможно замещенную С3-С8циклоалкилом, С3 или С5циклоалкилом, С5-С7циклоалкенилом или радикалом Ar1, где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть при желании замещены С1-С4алкилом, С1-C4алкенилом или гидроксилом, а Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила, а также фенила, несущих от одного до трех заместителей, которые независимо выбраны из водорода, галогена, гидроксила, нитрогруппы, трифторметила, линейного или разветвленного С1-С6алкила или алкенила, C1-С4алкоксила или С1-С4алкенилоксила, феноксигруппы, бензилоксигруппы, а также аминогруппы; а
Z обозначает линейный или разветвленный С2-С6алкил или алкенил; причем указанная алкильная цепь замещена по одному или большему числу положений описанным выше радикалом Ar1; С3-С8циклоалкил; циклоалкил, соединенной посредством линейной или неразветвленной C1-С6алкильной или алкенильной цепи; либо радикалом Ar2, который выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила, а также
фенила, несущих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, линейного или разветвленного С1-С6алкила или алкенила, С1-С4алкоксила или С1-С4-алкенилоксила, феноксигруппы, бензилоксигруппы, а также аминогруппы;
либо фармацевтически приемлемые соли указанных соединений и их гидраты.
Предпочтительные нейротрофные соединения, представляющие собой пролиловый эфир N-глиоксила, отвечают формуле:
в которой R1 представляет собой линейную или разветвленную С1-С5-алкильную или алкенильную группу, возможно замещенную С3-С6циклоалкилом или радикалом Ar1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила или фенила;
Х выбран из группы, состоящей из кислорода или серы;
Y является кислородом; а
Z является линейным или разветвленным алкилом или алкенилом; причем указанная алкильная цепь замещена по одному или большему числу положений описанным выше радикалом Ar1, С3-С6циклоалкилом или радикалом Ar2, который выбран из группы, состоящей из 2-, 3- или 4-пиридила, либо фенила, несущих от одного до трех заместителей, независимо выбранных из группы, состоящей из водорода или С1-С4алкоксила.
Предусмотренные настоящим изобретением соединения существуют в форме стереоизомеров либо энантиомеров либо диастереоизомеров. Стереохимия в положении 1 (см. формулу 1) является R или S, однако S-конфигурация является предпочтительной. Область настоящего изобретения охватывает энантиомеры, рацемическую форму, а также смеси диастереоизомеров. Разделение энантиомеров и диастереоизомеров можно проводить с помощью методов, хорошо известных специалистам.
Известно, что иммунофилины, такие как FKBP, предпочтительно распознают пептидные субстраты, содержащие мотивы Хаа-Рго-Yaa, где Хаа и Yaa обозначают липофильные аминокислотные остатки (Schreiber et al., 1990, J. Org. Chem. 55, 4984-4986; Harrison and Stein, 1990, Biochemistry, 29, 3813-3816). Модифицированные таким образом соединения, являющиеся пролил-содержащими псевдосимметричными пептидами, несущими липофильные заместители, должны с высокой эффективностью связываться с гидрофобным остовом активного сайта FKBP и ингибировать его ротамазную активность.
В структуру предпочтительных соединений, предусмотренных настоящим изобретением, входят группы R1, не являющиеся стереохимически объемными по сравнению с известными формой и размером гидрофобного остова в активном сайте молекулы FKBP. В соответствии с этим, очень крупные и/или высокозамещенные группы R1 должны связываться с активным сайтом FKBP с меньшей эффективностью.
К числу предпочтительных соединений, предусмотренных настоящим изобретением, относятся:
3-фенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-фенил-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3,4,5-триметоксифенил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3,4,5-триметоксифенил)-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(4,5-метилендиоксифенил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(4,5-метилендиоксифенил)-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-циклогексил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-циклогексил-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
(1R)-1,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(1,2-диоксо-2-[2-фуранил])этил-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(1,2-диоксо-2-[2-тиенил])этил-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(1,2-диоксо-2-[2-тиазолил])этил-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(1,2-диоксо-2-фенил)этил-2-пирролидинкарбоксилат,
3-(2,5-диметоксифенил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3,4,5-триметоксифенил)-1-этил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(2-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(4-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-циклогексил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-циклогексил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-N-([2-тиенил]глиоксил)-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксобутил)-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-циклогексилглиоксил-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(2-тиенил)глиоксил-2-пирролидинкарбоксилат.
Наиболее предпочтительные нейротрофные соединения, представляющие собой N-глиоксил-пролиловые эфиры, принадлежат к числу следующих:
3-(2,5-диметоксифенил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
2-(3,4,5-триметоксифенил)-1-этил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(2-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(4-пиридил)-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-фенил-1-пропил(2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-1-(2-циклогексил-1,2-диоксоэтил)-2-пирролидинкарбоксилат,
3-(3-пиридил)-1-пропил(2S)-N-([2-тиенил]глиоксил)-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-(3,3-диметил-1,2-диоксобутил)-2-пирролидинкарбоксилат,
3,3-дифенил-1-пропил(2S)-1-циклогексилгпиоксил-2-пирролидинкарбоксилат, а также
3,3-дифенил-1-пропил(2S)-N-([2-тиенил]глиоксил)-пирролидинкарбоксилат.
Предусмотренные настоящим изобретением соединения могут быть использованы в форме солей, образованных неорганическими или органическими кислотами и основаниями. К числу указанных солей, образованных кислотами, принадлежат следующие: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафтилсульфонат, никотинат, оксалат, памоат, пектинат, пропионат, сукцинат, тартрат, тиоционат, тозилат, а также ундеканоат. К числу солей, образованных основаниями, относятся: соли аммония, соли щелочных металлов (такие как натриевые и калиевые соли), соли щелочно-земельных металлов (такие как кальцевые и магниевые соли), соли, образованные органическими основаниями (такие как соли дициклогексиламина и N-метил-D-глюкамина), а также соли, образованые аминокислотами (такими как аргинин, лизин и т.п.). Кроме того, основные азот-содержащие группы могут быть кватернизованы с помощью таких агентов, как галогениды низших алкилов (например, метил-, этил-, пропил- и пентил- хлориды, бромиды или иодиды), диалкилсульфаты (например, диметил-, диэтил-, дибутил- и диамилсульфаты), галогениды длинноцепочечных углеводородов (например, децил-, лаурил-, миристил- и стеарилхлориды, бромиды или иодиды), аралкил-галогениды (например, бензил- и фенилэтилбромиды), а также другие соединения. При этом получают продукты, растворимые либо диспергируемые в воде или масле.
Предусмотренными настоящим изобретением нейротрофными соединениями можно периодически воздействовать на пациента, проходящему лечение неврологических расстройств, либо в других целях, когда желательно стимулир