Диагностические тесты на основе соединений тетразолия
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к реагентной полоске для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин, такой как цельная кровь. Реагент содержит флавин-зависимый фермент, который проявляет специфичность в отношении анализируемого вещества, флавиновый кофактор, если только флавин не связан с ферментом, предшественник тетразольного красителя, агент, осуществляющий перенос электронов, и нитритную соль. Реагент вызывает образование красителя, который является мерой концентрации анализируемого вещества. Нитритная соль устраняет помехи образованию красителя, неферментативно производимые гемоглобином. Предпочтительно реагент применяется в сухой полоске для измерения глюкозы в цельной крови. Изобретение позволяет устранить интерференцию гемоглобина при измерении концентрации анализируемого вещества. 6 н. и 7 з.п. ф-лы, 3 табл., 6 ил.
Реферат
Данная заявка отчасти является продолжением не прошедшей экспертизу заявки на патент США №09/282 083, поданной 30 марта, 1999, которая является продолжением заявки на патент США №09/161 876, поданной 28 сентября 1998, в настоящее время патент США №5 902 731.
Это изобретение относится к диагностическим композициям, которые позволяют измерять концентрации анализируемых веществ в биологических жидкостях, содержащих гемоглобин. Композиции основаны на предшественниках тетразольного красителя и подавляют восстановление предшественника, вызываемое гемоглобином.
Жировая ткань является одной из наиболее изобилующих форм накопления энергии в организме. Она высвобождает в кровеносную систему аккумулированные жирные кислоты, которые сначала метаболизируются в печени. В процессе жизнедеятельности расходуется жир, и энергия высвобождается и обеспечивает организм. Обычно потребляется немного жира, жирные кислоты метаболизируются полностью до двуокиси углерода и воды, а превращение не нарушает хрупкого баланса рН в организме. Однако если в организме имеется недостаточное количество углеводов, например, вследствие диеты, потребление жира и образование жирных кислот может увеличиться, возможно, до опасных уровней. Кроме диеты, инсулинозависимые пациенты становятся уязвимыми вследствие нарушенного у них метаболизма углеводов. Когда избыточное количество жирных кислот потребляется для снабжения организма требуемой энергией, образуется большое количество ацетоацетата, ацетона и бета-гидроксибутирата. Эти промежуточные соединения упоминаются как кетоновые тела, а состояние известно как кетоацидоз.
Обычно кетоновые тела могут преобразовываться организмом в другие формы, если только организм не поражен. Поэтому здоровый индивидуум аккумулирует незначительное количество этих анализируемых веществ. Когда большое количество жиров метаболизируется за относительно короткий период или когда большая часть энергии получается из жиров, образуются большие количества кетоновых тел. Избыточная продукция этих метаболитов жиров может вызывать определенные неврологические нарушения, если проблема быстро не корректируется.
Кетоновые тела присутствуют в крови и, если превышен порог, выделяются с мочой. Они легко определяются с помощью современного клинического анализатора. В среднем проценты бета-гидроксибутирата, ацетоацетата и ацетона составляют 78%, 20% и 2%, соответственно. Ацетон определяется редко вследствие его относительно низкой концентрации и высокой летучести. Вместо этого количественно определяется ацетоацетат с помощью нитропруссидной реакции, и бета-гидроксибутират количественно определяется энзиматическим способом. Уже в течение десятилетий имеются ацетоацетатные тест-полоски. Они основаны на реакции связывания нитропруссидного иона с альдегидами и кетонами. Образец щелочной мочи или образец крови оставляется для реакции с нитропруссидом в течение нескольких минут, и развивается пурпурный цвет. Интенсивность окраски указывает на концентрацию ацетоацетата. Однако ацетон мешает определению, приводя в результате к более высоким показателям. К тому же, когда пациент излечивается от состояния кетоацидоза, уровень ацетоацетата в моче и крови увеличивается, создавая таким образом трудности для диагностики.
Для контроля за концентрациями кетоновых тел чаще используется определение бета-гидроксибутирата. Этот способ основан на окислении бета-гидроксибутирата соответствующей дегидрогеназой в присутствии никотинамидадениндинуклеотида (NAD) как кофактора (строго говоря, только D-бета-гидроксибутират встречается в природе и окисляется, но в данном случае для краткости «D» исключено на протяжении всего описания и в прилагаемой формуле изобретения). При окислении образуется NADH, и его концентрация измеряется непосредственно по поглощению в УФ на спектрофотометре. Следовательно, соответствующее сигнальное изменение в спектре пропорционально концентрации анализируемого вещества. К сожалению, возбуждение NADH происходит в УФ области; таким образом, этот способ определения оказывается подходящим только для лабораторных приборов. Другой способ измерения бета-гидроксибутирата заключается в окислении NADH соединением тетразолия.
Соединения тетразолия обычно очень чувствительны к сильным основаниям и свету. Так, следует проявлять особую осторожность, чтобы обеспечить целостность этих соединений. Тем не менее тетразолий выполняет важную роль в исследованиях тканевого метаболизма. Например, этот класс соединений используется при исследовании анаэробных реакций окисления и восстановления в клетках. Кроме того, обычно они применяются в клинических диагностических тестах. Обычно соединения представляют собой светлоокрашенные или бесцветные соединения, которые подвергаются реакции восстановления в присутствии восстанавливающего агента, чтобы получить интенсивно окрашенный формазан. Восстанавливающие агенты, такие как аскорбаты, сульфгидрилы или варианты NADH, NADPH, PQQH2 (восстановленный PQQ - пирролохинолинхинон), FMNH2 (восстановленный FMH - флавинмононуклеотид), и FADH2 (восстановленный FAD - флавинадениндинуклеотид) способны образовывать краситель.
Обнаружено, что в клинических диагностических тестах эти красители неоценимы для контроля за образованием NAD(Р)Н из их исходных соединений, NAD(Р)+, в анаэробных реакциях. См., например, патент США 5 360 595 от 1 ноября 1994, D. Bell et al.). Окислительно-восстановительная реакция является очень быстрой и не чувствительна к кислороду. Цвет полученного красителя очень интенсивен, и краситель характеризуется низкой растворимостью в воде.
В принципе предшественники тетразольных красителей используются для определения кетоновых тел и глюкозы в цельной крови. Однако тетразолий может быть восстановлен неферментативно гемоглобином (Fe(II)) с образованием окрашенного формазана, если гемоглобин не содержится в красных клетках крови. Таким образом, свободный гемоглобин является причиной серьезных помех при измерениях. В действительности вследствие гемолиза и получающегося в результате большого количества свободного гемоглобина относительно анализируемого вещества при типичном определении кетоновых тел интерферирующий сигнал гемоглобина может превышать предполагаемый сигнал. При определении глюкозы, в частности при нормальной концентрации или выше, неблагоприятные воздействия не проявляются. Когда реакция проводится в образцах с высоким гематокритным числом или при более высокой температуре, когда реакция окисления гемоглобина происходит быстрее, помехи определению глюкозы также оказываются значительными. Так как невозможно легко избежать гемолиза красных клеток крови, который является причиной появления свободного гемоглобина, красные клетки крови следует удалять из образцов до тестирования, если для определения используется тетразолий.
Красные клетки крови можно удалять из образцов фильтрованием через мембраны и фильтры, улавливанием химическими реагентами или сочетанием обоих способов. Способы фильтрования для отделения красных клеток из цельной крови являются дорогими и требуют достаточно больших объемов образцов. Примером теста на кетон (бета-гидроксибутират) крови, в котором для удаления красных клеток из образца цельной крови используется фильтрование, является тест-KetoSite®, доступный от CDS Diagnostics, Elkhart, IN. (См. Tietz Textbook of Clinical Chemistry, 2nd Ed., by С.Burtis et al., W.В.Saunders Со., Philadelphia, РА, 1994, р.974). Используется «Тест-карта» ("Test-Card"), в которой тест содержит два слоя фильтров, что делает тест-карту довольно дорогой и требует большого (25 мкл) образца крови. К тому же кровь не должна быть гемолизирована.
Сочетание фильтрования и химического улавливания используется при определении глюкозы крови с помощью узкой полоски в глюкометре Ames® Glucometer EncoreТМ, доступном у Miles. Так, в полоске применяют слой фильтрующего вещества и агглютинирующую добавку (картофельный лектин) для исключения интерференции от красных клеток (см. Chu et al., European Pat. Appl. 0 638 805 А2, опубликовано 15 февраля, 1995).
Включение окисляющего агента в систему для окисления гемоглобина до метгемоглобина представляет собой другой способ снижения гемоглобиновой интерференции. Хотя известно, что ферррицианиды превращают гемоглобин до метгемоглобина, они также разрушают требуемый продукт NADH.
Palmer et al. в ЕРО 0 330 517 В2, опубликованном 30 августа 1989, описывает способ определения анализируемого биохимического вещества, который включает в себя взаимодействие анализируемого вещества с оксидазным ферментом, проявляющим электрон-трансферазную активность в отношении анализируемого вещества с образованием восстановленного фермента. Для определения концентрации анализируемого вещества фермент исследуется колориметрически. Энзиматическая реакция не зависит от кислорода.
Freitag et al. в Международной заявке WO 94/01544, опубликованной 20 января 1994, описывают стабильный реагент для измерения анализируемого вещества. Реагент включает в себя фермент, производное феназина, соль тетразолия и соль двухвалентного металла для стабилизирования реагента.
Storhoff et al. в Международной заявке WO 94/01578, опубликованной 20 января 1994, также представлен стабильный реагент для анализа анализируемого вещества. Реагент включает в себя фермент, медиатор, соль тетразолия и окисляющий агент, который стабилизирует реагент.
Данное изобретение обеспечивает реагент для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин. Реагент содержит:
а) флавин-зависимый фермент, который содержит связанный с ним флавин и специфичен в отношении анализируемого вещества,
b) предшественник тетразольного красителя,
с) агент, осуществляющий перенос электронов, и
d) нитритную соль.
В альтернативном аспекте изобретения реагент содержит
а) флавин-зависимый фермент, который специфичен в отношении анализируемого вещества и не содержит связанный с ним флавин,
b) флавинмононуклеотид (FMN) или флавинадениндинуклеотид (FAD),
с) предшественник тетразольного красителя,
d) агент, осуществляющий электронный перенос, и
е) нитритную соль.
Реагент особенно пригоден для покрытия одного или более субстратов, чтобы сформировать сухую узкую реагентную полоску для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин. Особо предпочтительная полоска содержит
а) слой подложки,
b) на слое подложки мягкую тест-прокладку, имеющую покрытие, которое содержит
i) флавин-зависимый фермент, содержащий связанный с ним флавин и специфичный в отношении анализируемого вещества,
ii) предшественник тетразольного красителя и
iii) вещество, осуществляющее перенос электронов, и
с) на мягкой тест-прокладке впитывающий влагу верхний слой, который покрыт нитритной солью.
Другая полоска согласно изобретению содержит а) слой подложки,
b) на слое подложки мягкую тест-прокладку, имеющую покрытие, которое содержит
i) флавин-зависимый фермент, который специфичен в отношении анализируемого вещества и не содержит связанного с ним флавина,
ii) FMN или FAD,
iii) предшественник тетразольного красителя
iv) агент, осуществляющий перенос электронов, и
с) на тест-прокладке впитывающий влагу верхний слой, который покрыт нитритной солью.
Краткое описание чертежей
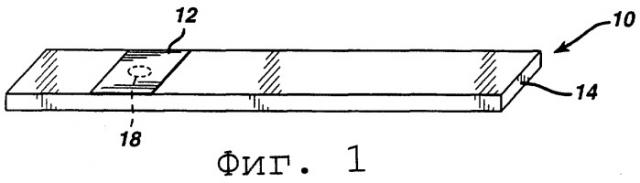
На Фиг.1 представлен перспективный вид тест-полоски согласно изобретению.
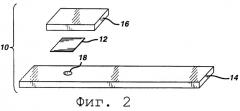
На Фиг.2 представлен разобранный вид другой тест-полоски согласно изобретению.
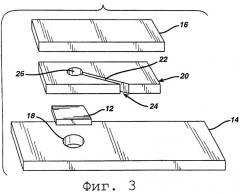
На Фиг.3 изображен разобранный вид еще одной тест-полоски согласно изобретению.
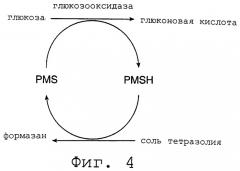
Фиг.4 является графическим изображением химии глюкозного анализа согласно изобретению.
На Фиг.5 представлен график, который демонстрирует действие нитрита как супрессора гемоглобина при исследовании двухслойным способом.
На Фиг.6 представлен график, который демонстрирует действие нитрита как супрессора гемоглобина при анализе глюкозы однослойным способом.
Данное изобретение предусматривает реагент для измерения концентрации анализируемого вещества в биологических жидкостях, содержащих гемоглобин (таких как цельная кровь), посредством создания концентрации восстановленной формы кофактора, такого как NADH, NAD(Р)Н, PQQH2, FMNH2 или FADH2, которая является мерой концентрации анализируемого вещества. Включение нитрита в реагент устраняет интерференцию гемоглобина при измерении концентрации восстановленого кофактора. В частности, его используют для определения кетоновых тел и глюкозы, но не ограничиваются этим.
На фиг.1 изображена типичная тест-полоска 10 согласно изобретению, которая состоит из мягкой тест-прокладки 12, прикрепленной к подложке 14. Подложка может быть пластиковой, например, полистирольной, нейлоновой или полиэфирной, или металлической пластинкой или любым другим материалом, известным в данной области. Мягкая тест-прокладка покрывается реагентом, который взаимодействует с анализируемым веществом, что вызывает изменение цвета. Предпочтительно тест-прокладка содержит впитывающий влагу материал, такой как фильтровальная бумага или полимерная мембрана. Однако поскольку для реакции не требуется кислород, тест-прокладка может быть не впитывающим влагу материалом, таким как пластиковая пленка. Реагент включает в себя фермент, который специфичен в отношении анализируемого вещества, агент, осуществляющий» гидридный перенос, предшественник тетразольного красителя, приемлемый кофактор фермента и супрессор гемоглобина. Буфер и стабилизатор необязательно могут включаться для большей стабильности.
Как показано на фиг. 2, тест-полоска может быть многослойной конструкцией с верхним слоем 16, расположенном на мягкой тест-прокладке 12. В такой конструкции реагент может быть разделен между двумя слоями. Например, гемоглобиновый супрессор может покрывать необязательный верхний слой 16, а оставшаяся часть реагента может покрывать тест-прокладку 12. Предпочтительно, чтобы верхний слой 16 являлся впитывающим влагу и служил в качестве распределяющего слоя и в качестве абсорбирующего слоя для поглощения избытка образца. Образец наносится на верхний слой 16, и он проходит через мягкую тест-прокладку 12. Концентрация анализируемого вещества измеряется по изменению цвета через слой подложки 14 или, если слой 14 оказывается непрозрачным, там, где он прилегает к реакционной области через возможное окно или отверстие 18.
Как показано на фиг.3, в альтернативном варианте промежуточная пластинка 20 разделяет верхний слой 16 и тест-прокладку 12. Промежуточная пластинка 20 предпочтительно представляет собой не впитывающую влагу пластиковую пленку, имеющую адгезивное покрытие (не показано) на обеих поверхностях. Канал 22 в промежуточной пластинке 20 обеспечивает капиллярный путь для образца для протекания от отверстия 24 к измерительной зоне 26. Поток зависит от удаления воздуха между поверхностью мягкой тест-прокладки 12 и прилегающим слоем или, альтернативно, через возможное выходное отверстие 18. Изменение цвета в области измерения 26 регистрируется через возможное выходное отверстие/окно 18. Весь реагент может находиться на тест-прокладке 12 или, альтернативно, может быть разделен между тест-прокладкой и одним или двумя не впитывающими влагу слоями 14 и 16. Таким образом, первая часть реагента может находиться на мягкой тест-прокладке, а вторая часть реагента может находиться на одном или двух не впитывающих влагу слоях. Когда упоминается реагент как "покрытие" или "на" слое, то предполагают возможность того, что реагент абсорбируется слоем, особенно если последний оказывается впитывающим влагу.
Все флавин-зависимые ферменты подходят для способа данного изобретения. Подходящие оксидазные ферменты и их соответствующие анализируемые вещества включают в себя алкогольоксидазу для спирта, глюкозооксидазу для глюкозы, галактозооксидазу для галактозы, холестеролоксидазу для холестерина, L-лактатоксидазу для L-лактата, уратоксидазу для мочевой кислоты, билирубиноксидазу для билирубина и холиноксидазу для холина. Подходящие дегидрогеназные ферменты и соответствующие анализируемые вещества включают в себя пируватдегидрогеназу для пирувата, D-лактатдегидрогеназу для D-лактата и сукцинатдегидрогеназу для сукцината.
В случае, когда кофактор не связан с ферментом, кофактор следует добавлять к активированному ферменту. Кофакторы, которые следует добавлять к флавин-зависимому ферменту, включают в себя флавинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD). В присутствии фермента анализируемое вещество восстанавливает кофактор.
Следующая стадия способа, образующего краситель, заключается в извлечении гидрида из восстановленного кофактора с помощью агента, осуществляющего перенос электронов. Подходящие агенты, осуществляющие перенос электронов, включают в себя диафоразу, такую как липоевая дегидрогеназа, ферредоксин-NADP-редуктаза и липоамиддегидрогеназа. Когда используется флавиновый кофактор, более предпочтительными оказываются агенты, осуществляющие неферментативный перенос электронов, такие как метосульфат феназина (PMS), этосульфат феназина (PES), метосульфат 1-метоксифеназина, или мельдольная синь (Meldola Blue). Кинетические параметры реакций и стабильность являются главными критериями при выборе агента, осуществляющего перенос электронов, или «отделителя гидрида». Например, PMS является универсальным агентом, отщепляющим гидрид, так как он характеризуется относительно быстрой скоростью реакции с большинством из перечисленных ниже соединений тетразолия. По этой причине предпочтительным кофактором является PQQ. Однако PMS оказывается более чувствительным к свету, чем связанные с ферментом агенты, отделяющие гидрид. Диафораза более стабильна, и по этой причине она предпочтительна, если кофактором является NAD.
Захваченный гидрид переносится на соединение тетразолия (предшественник красителя) с образованием окрашенного формазана. Соединения тетразолия, которые наиболее пригодны для этого способа, представляют собой 2-(2'-бензотиазолил)-5-стирил-3-(4'-фтальгидразидил) тетразолий (BSPT), 2-бензо-тиазолил-(2)-3,5-дифенилтетразолий (BTDP), 2,3-ди-(4-нитрофенил)тетразолий (DNP), 2,5-дифенил-3-(4-стирилфенил) тетразолий (DPSD), дистирил-нитросиний тетразолий (DS-NBT), 3,3'-[3,3'-диметокси-(1,1' -бифенил)-4,4'-диил]-бис[2-(4-нитрофенил)-5-фенил(2Н)]тетразолий (NBT), 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н тетразолий (МТТ), 2-фенил-3-(4-карбоксифенил) -5-метилтетразолий (РСРМ), тетразолий синий (ТВ), тиокарбамилнитросиний тетразолий (TCNBT), тетранитросиний тетразолий (TNBT), тетразолий фиолетовый (TV), 2-бензотиазотиазолил-3-(4-карбокси-2-метоксифенил)-5-[4-(2-сульфоэтилкарбамоил)фенил]-2Н-тетразолий (WST-4), и 2,2'-дибензотиазолил-5,5'-бис[4-ди(2-сульфоэтил) карбамоилфенил] -3,3'-(3,3'-диметокси-4,4'-бифенилен)дитетразолий, динатриевая соль (WST-5). Предпочтительно используются водорастворимые предшественники красителя, более предпочтительно WST-5, так как являются совместимыми с биологическими образцами. Кроме того, когда используется WST-5, полученное соединение формазана проявляет сильное спектральное поглощение в пурпурно синей области, таким образом снижая необходимость коррекции фонового сигнала от гемоглобина.
Наконец, супрессор гемоглобина присутствует в реагенте для того, чтобы уменьшить нежелательную образующую краситель реакцию между гемоглобином и соединением тетразолия. Роль супрессора гемоглобина заключается в окислении гемоглобина до метгемоглобина, который не реагирует с тетразолием или формазаном. Неожиданно нитритные соли, такие как нитрит натрия, нитрит калия и их производные, очень эффективны в супрессии гемоглобина, но не разрушают восстановленный кофактор (такой как NADH, PQQH2, FMNH2 или FADH2). Нитриты эффективны также при повышенной температуре и в отношении образцов с высоким гематокритным числом. Предпочтителен нитрит натрия потому, что он характеризуется высокой растворимостью в воде, не токсичен и является относительно недорогим.
Необязательно, реагент также включает в себя стабилизатор, такой как соль двухвалентного металла.
Хотя реагент согласно изобретению можно использовать во влажной химической форме, такой как кювета, в предпочтительных аспектах изобретение предусматривает сухие полоски для определения бета-гидроксибутирата или глюкозы в цельной крови. Полоски могут быть однослойными или двухслойными. Двухслойная полоска состоит из мембранной мягкой тест-прокладки, предпочтительно из найлона, которая размещается между подложкой и верхним слоем. Предпочтительно подложка представляет собой полиэфирную пластинку. Верхний слой может быть ячеистым или любым впитывающим влагу материалом, известным в данной области. Предпочтительным материалом является пористый полиэтилен, обработанный метилолеоилтауратом натрия, доступный в Porex Corp. of Fairburn, GA. Это вещество упоминается как "Порекс" ("Porex"). Предпочтительно тест-прокладка имеет положительно заряженную поверхность. Более предпочтительно тест-прокладка представляет собой полиамид. Тест-прокладка содержит реагент, содержащий глюкозооксидазу (включающую в себя флавиновый кофактор), PMS (или один из его аналогов) и WST-5 (Таблица 1). Верхний слой Порекса содержит нитритный реагент (Таблица 2).
В однослойную полоску не включен слой Порекса, на тест-прокладку наносится полный реагент, включающий в себя нитриты (Таблица 3). Отмечают, что как в двухслойной, так и в однослойной полоске можно использовать или флавин-зависимый фермент, который содержит связанный с ним флавин, или флавин-зависимый фермент, который не содержит связанный с ним флавин. В последнем случае добавляется флавиновый кофактор (например, FMN или FAD).
На практике потребитель наносит каплю цельной крови на верхнюю поверхность порексового верхнего слоя. Когда цельная кровь или лизированная кровь контактирует с Порексом, нитрит натрия восстанавливается и взаимодействует с доступным свободным гемоглобином, снимая таким образом вызываемые гемоглобином помехи при определении. Получающийся в результате образец, по существу без гемоглобина, переносится ниже на тест-прокладку за счет капиллярной или гравитационной силы. На тест-прокладке образец инициирует каскадную реакцию, чтобы получить окрашенный краситель, концентрация которого пропорциональна концентрации анализируемого вещества в образце и может быть определена непосредственно на фотометре. На фиг. 4 изображена реакция для глюкозы с применением глюкозооксидазы и PMS.
На фиг.5 представлено, в зависимости от времени, изменение оптической плотности образцов крови, все из которых имеют 60% гематокрит и содержат 0 и 100 мг/дл глюкозы как в присутствии нитрита, так и без него. Верхняя часть графика показывает результаты при 35°С. Нижняя часть графика демонстрирует результаты, полученные при комнатной температуре (RT). В каждом случае концентрация нитрита была 5 г/дл. В отсутствие нитрита гемоглобин восстанавливает тетразолий с образованием непрерывно увеличивающейся концентрации красителя с соответствующим увеличением в оптической плотности. Удаляя гемоглобин (посредством окисления), нитрит ограничивает образование окраски до той, которая обусловлена исключительно глюкозой в образце. Приготовление двухслойной полоски, которая использовалась для получения результатов, представленных в графиках, описывается в Примере 1, ниже.
На фиг.6 продемонстрировано влияние нитрита реакцию, образующую окраску, в системе глюкоза/глюкозооксидаза на однослойной полоске. Образцы крови, все имеющие 60% гематокрит, содержали 0 или 200 мг/дл глюкозы и 0 или 20 мг/мл нитрита. Образцы пропускались при комнатной температуре. На графике показано, что данная система эффективна при комнатной температуре и гематокрите вплоть до 60%. Приготовление использованной однослойной полоски описывается в Примере 2, ниже.
Следующие примеры демонстрируют предпочтительные аспекты данного изобретения. В Примере 1 использовали двухслойную полоску, анализируемым веществом была глюкоза, а ферментом глюкозооксидаза. В Примере 2 использовали однослойную полоску. Как прежде, анализируемым веществом была глюкоза, а ферментом глюкозооксидаза. Композиции можно легко модифицировать для применения в других сочетаниях анализируемое вещество/фермент, перечисленных ранее (см., например, Tietz Textbook of Clinical Chemistry, 2nd Ed., ed. By С. Burtis et al., W.В. Saunders Со., Philadelphia, РА, 1994, рр.976-978 and 1174-1175). Примеры не предназначены для ограничения в каком-либо отношении сферы применения изобретения.
Пример 1
0,8 мкм нейлоновой мембраны, полученной от Pall Corporation (East Hills, NY), погружали в реагент Таблицы 1 до насыщения. Избыток реагента мягко соскабливали стеклянным стержнем. Полученную мембрану вывешивали для высушивания в печь при 56°С в течение 10 минут. Порекс (толщиной 0,6 мм) пропитывали раствором нитрита (Таблица 2), а затем вывешивали для высушивания в печь при 100°С в течение десяти часов. Наконец, мембрану наслаивали между полиэфирной основой (0,4 мм полиэфира Меленекс® от ICI America, Wilmington, DE) и порексом, пропитанным нитритом.
Пример 2
Повторяли процедуры Примера 1, за исключением того, что первой пропиткой был реагент из Таблицы 3, и не проводили вторую пропитку, так как не требовался порекс.
| Таблица 1. Реагент для глюкозной тест-прокладки | |
| Компоненты | Количество |
| Вода | 100 мл |
| Натриевая соль (2-[-морфолино]этансульфоновой кислоты MES (мол. масса 217,2 Sigma, St. Louis, МО, USA) Приведение рН к 5-7 добавлением 6М HCl | 2,2 г |
| Тетоник 1307 (BASF Corporation, Moun Olive, New Jersey, USA) | 1-3 г |
| PSSA, натриевая соль полистиролсульфоновой кислоты (мол. масса 70000, Polysciences, Inc, Warrington, РА, USA) | 2-4 г |
| Кротеин (Croda Inc., Parsippany, NJ, USA) | 2-4 г |
| Маннит (мол. масса 182, Sigma, St. Louis, МО, USA) | 1-10 г |
| Метосульфат феназина (PMS, мол. масса 306,34, Sigma, St. Louis, МО, USA | 30-300 мг |
| WST-5 (мол. масса 1331,37, Dojindo) | 0,8-4 г |
| Глюкозооксидаза (GO, TOYOBO) | 100-1000 KU |
| Таблица 2. Нитритный реагент | |
| Компоненты | Количество |
| 10 мМ забуференный фосфатом физиологический раствор, рН 7,4 (Р-3813, Sigma, St. Louis, МО, USA) | 70 мл |
| Этанол | 30 мл |
| Нитрит натрия (мол. масса 69, Aldrich Chemical, Milwaukee, WI, USA) | 5 г |
| Поливинилпирродин (мол. масса 40000, Sigma, St, Louis, МО, USA) | 200 мг |
| Таблица 3. Реагент для глюкоэной тест-прокладки | |
| Компоненты | Количество |
| Вода | 100 мл |
| Натриевая соль (2-[морфолино]этансульфоновой кислоты) MES (мол. масса 217,2, Sigma, St. Louis, МО, USA) | 2,2 г |
| Гантрез (Gantrez*) 6% | 20 мл |
| Приведение рН к 5,5-7 добавлением 50% NaOH | |
| Тритон Х-305 (BASF Corporation, Moun Olive, New Jersey, USA) | 0,5-2 г |
| Маннит (мол. масса 182, Sigma, St. Louis, МО, USA) | 1-10 г |
| Нитрит натрия (мол. масса 69, Aldrich Chemicals, Milwaukee, MI, USA | 1-5 г |
| WST-5 (мол. масса 1331, 37, Dojindo) | 0,8-4 г |
| Хлорид магния (мол. масса 203, Sigma, St. Louis, МО, USA) | 3-5 г |
| Этосульфат феназина (PES, мол. масса 334,4, Sigma, St. Louis, МО, USA) | 10-1000 мг |
| Глюкозооксидаза (GO, TOYOBO) | 10-1000 KU |
| * Gantrez AN-139 (Полиметилвинилэфир-альт-малеиновый ангидрид, мол. масса 1080000, каталожный номер 41632-0, Aldrich Chemicals, Milwaukee, WI, USA). Готовят 6% гантрез в воде, нагревают до 95°С в течение периода менее 45 минут, чтобы получить 6% гантрез, который готов к употреблению. |
1. Сухая реагентная полоска для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин, заключающая в себе слой подложки, на котором находится тест-прокладка, имеющая покрытие из реагента, содержащего
а) флавинзависимый фермент, который содержит связанный с ним флавин и обладает специфичностью в отношении анализируемого вещества,
b) предшественник тетразольного красителя,
с) агент, осуществляющий перенос электронов, и
d) нитритную соль.
2. Полоска по п.1, отличающаяся тем, что тест-прокладка имеет положительно заряженную поверхность.
3. Полоска по п.1, отличающаяся тем, что тест-прокладка содержит полиамид.
4. Полоска по п.1, отличающаяся тем, что дополнительно содержит впитывающий влагу верхний слой, покрывающий тест-прокладку.
5. Сухая реагентная полоска для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин, заключающая в себе слой подложки, на котором находится тест-прокладка, имеющая покрытие из реагента, содержащего
а) флавинзависимый фермент, который содержит связанный с ним флавин и обладает специфичностью в отношении анализируемого вещества,
b) флавинмононуклеотид (FMN) или флавинадениндинуклеотид (FAD),
с) предшественник тетразольного красителя,
d) агент, осуществляющий перенос электронов, и
е) нитритную соль.
6. Сухая реагентная полоска для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин, заключающая в себе слой подложки, на котором находится тест-прокладка, и верхний слой, покрывающий тест-прокладку, где тест-прокладка покрыта реагентом, содержащим
а) флавинзависимый фермент, который содержит связанный с ним флавин и обладает специфичностью в отношении анализируемого вещества,
b) предшественник тетразольного красителя и
с) агент, осуществляющий перенос электронов;
и слой подложки и/или верхний слой, покрытый нитритной солью.
7. Полоска по п.6, отличающаяся тем, что верхний слой является впитывающим влагу.
8. Полоска по п.6, отличающаяся тем, что дополнительно содержит промежуточную пластинку и канал между верхним слоем и тест-прокладкой, чтобы обеспечить капиллярный путь между верхним слоем и прокладкой.
9. Полоска по п.6, отличающаяся тем, что анализируемое вещество является глюкозой, а фермент является глюкозооксидазой.
10. Полоска по п.6, отличающаяся тем, что предшественник тетразольного красителя представляет собой динатриевую соль 2,2'-дибензотиазолил-5,5'-бис[4-ди(2-сульфоэтил)-карбамоилфенил]-3,3'-(3,3'-диметокси-4,4'-бифенилен)дитетразолия (WST-5).
11. Сухая реагентная полоска для измерения концентрации анализируемого вещества в биологической жидкости, содержащей гемоглобин, заключающая в себе слой подложки, на котором находится тест-прокладка, и верхний слой, покрывающий тест-прокладку, где тест-прокладка покрыта реагентом, содержащим
а) флавинзависимый фермент, который содержит связанный с ним флавин и обладает специфичностью в отношении анализируемого вещества,
b) флавинмононуклеотид (FMN) или флавинадениндинуклеотид (FAD),
с) предшественник тетразольного красителя и
d) агент, осуществляющий перенос электронов,
и слой подложки и/или верхний слой, покрытый нитритной солью.
12. Сухая реагентная тест-полоска для измерения концентрации глюкозы в биологической жидкости, содержащей гемоглобин, которая включает в себя
а) слой подложки,
b) на слое подложки тест-прокладку, имеющую покрытие, которое включает в себя
i) глюкозооксидазу, которая содержит связанный с ней флавин,
ii) предшественник тетразольного красителя и
iii) метосульфат фенозина (PMS) или его аналог, и
с) на тест-прокладке впитывающий влагу верхний слой, который покрыт нитритной солью.
13. Сухая реагентная тест-полоска для измерения концентрации глюкозы в биологической жидкости, содержащей гемоглобин, которая включает в себя
а) слой подложки,
b) на слое подложки тест-прокладку, имеющую покрытие, которое включает в себя
i) флавинзависимый фермент, который не содержит связанный с ним флавин,
ii) флавинмононуклеотид (FMN) или флавинадениндинуклеотид (FAD),
iii) предшественник тетразольного красителя и
iv) метосульфат фенозина (PMS) или его аналог, и
с) на тест-прокладке впитывающий влагу верхний слой, который покрыт нитритной солью.