Увеличение эффективности ингаляционной терапии с помощью диоксида углерода
Иллюстрации
Показать всеИзобретение относится к медицине, к фармакологии, пульмонологии и может быть использовано для увеличения эффективности ингаляционной терапии с помощью диоксида углерода. В дыхательные пути человека или животного вводят лекарственное средство в виде аэрозоля в воздушной смеси, содержащей приблизительно от 2,5% до приблизительно 10% газообразного диоксида углерода. Данное изобретение способствует доставке лекарственного средства непосредственно к зоне повреждения, что, в свою очередь, способствует увеличению его концентрации в этой зоне и обеспечению лечебного эффекта минимальными дозами препарата. 23 з.п. ф-лы, 13 ил., 3 табл.
Реферат
Область изобретения
Настоящее изобретение относится в основном к областям фармакологии и доставки лекарственных средств. Более конкретно, настоящее изобретение относится к способу применения газообразного диоксида углерода для увеличения осаждения в легких вводимого в виде аэрозоля лекарственного средства в процессе ингаляционной терапии.
Описание предыдущего уровня техники
Обработка аэрозолем, содержащим липосомы малого размера, состоит в том, что жирорастворимые или водорастворимые противораковые лекарственные средства включают в липосомы, которые вводят из водной дисперсии с помощью струйного распылителя (см. патент США №5049388). Полученные при распылении аэрозоли, частицы которых имеют среднемассовый аэродинамический диаметр 1-3 мкм, обеспечивают целевую доставку на поверхность дыхательных путей. Впоследствии осажденные липосомы локально высвобождают лекарственное средство в легких, или в кровоток с доставкой к ткани, находящейся вне легких.
Если лекарственное средство является жирорастворимым, оно будет связано с липидной молекулой способом, специфичным для использующегося липида, применяемого противоракового средства, и, возможно, оно может быть дополнительно модифицировано с помощью различных растворимых компонентов, которые могут быть включены в суспендирующую водную среду. Такие растворимые компоненты могут включать забуферивающие соли и, возможно, инозитол для увеличения синтеза и секреции поверхностно-активного фосфолипида в легочной ткани, а также для минимизации дыхательной недостаточности, которая уже существует, или которая может возникнуть при лечении аэрозолем.
Если лекарственное средство является водорастворимым, оно может быть включено с помощью соответствующих методов в водные полости, которые существуют в концентрических пространствах между липидными бислоями (ламеллами) многослойной липосомы. Могут быть получены однослойные липосомы; однако они имеют более низкую способность удерживать жирорастворимые или водорастворимые лекарственные средства, так как удерживание ограничено одной центральной полостью. Водные капельки аэрозоля могут содержать одну или несколько липосом, включающих лекарственное средство. Кроме того, в обработку аэрозолем, содержащем липосомы, можно также включить более чем одно лекарственное средство, либо путем смешивания различных, содержащих лекарство липосом, либо путем применения липосом, в которых лекарственные средства объединены и включены вместе в липосомы.
В процессе распыления липосомы разбиваются до размеров, обеспечивающих легкое испускание из сопла распылителя. Липосомы размером до нескольких микрон в диаметре обычно разбиваются с получением частиц диаметром менее 500 нм, причем они могут быть и значительно меньше, что зависит от эксплуатационных характеристик распыляющего устройства и других переменных. Перераспределение водорастворимых лекарств, содержащихся в липосомах, приводит к высвобождению существенных количеств водорастворимого соединения, возможно 50 процентов. Это не является противопоказанием к их применению, но означает, что вводят две формы лекарственного препарата, и эффект включает терапевтический эффект от обеих форм, получаемый при введении каждой формы отдельно. Много других деталей лечения липосомными аэрозолями описано в патенте США №5049388.
Как правило, основной целью ингаляционной терапии является местная доставка аэрозольных частиц фармацевтических препаратов в центральные дыхательные пути и к периферическим участкам респираторного тракта. Однако осаждаемая фракция вдыхаемых частиц, даже при оптимальном диапазоне размеров, составляющих 1-2 мкм для среднемассового аэродинамического диаметра, составляет только приблизительно 20%. Осаждение в легких вдыхаемых аэрозолей в значительной степени зависит от размера частиц, гигроскопических свойств и геометрии дыхательных путей (1, 2). Характер дыхания также является важным параметром, который определяет способ осаждения вдыхаемых частиц (1, 2).
В частности, задержка дыхания заметным образом увеличивает осаждение в легких вследствие увеличения времени пребывания частиц в легком. Она обеспечивает увеличение периода гравитационного осаждения, происходящего в особенности в малых периферических дыхательных путях, и гарантирующего, что водные частицы могут полностью уравновешиваться в условиях почти 100% влажности и достигать своего максимального размера, что в дальнейшем увеличивает их осаждение (1, 2). С помощью компьютерного моделирования показано, что тридцатисекундная процедура задержки дыхания у людей может увеличить осажденную фракцию в 3,2 раза. Физиологической причиной данного эффекта является увеличение поглощения частиц при глубоком вдыхании, при котором вдыхаемый объем может быть в 8 раз выше объема, вдыхаемого при основном дыхании. Увеличение дыхательного объема приводит к проникновению частиц в самые дальние уголки легких, где диаметры дыхательных путей являются наименьшими, и, следовательно, осаждение благодаря силе тяжести и максимальному размеру частиц происходит с максимальной эффективностью.
Исходя из данного физиологического свойства, можно заключить, что непосредственное использование факторов, которые могут увеличивать объем вдыхаемого воздуха (содержащего аэрозольные частицы), будет впоследствии значительно увеличивать фракцию, осаждавшуюся в центральных дыхательных путях, и, даже в большей степени, в периферических участках легких. Диоксид углерода (СО2) является наиболее важным природным регулятором дыхания. Диоксид углерода свободно диффундирует из тканей в кровь в соответствии с существующим градиентом давления. При повышении уровней диоксида углерода в крови он легко диффундирует в спинно-мозговую жидкость, где превращается в НСО3 - и Н+. Хеморецепторы центральной нервной системы на вентральной поверхности спинного мозга отвечают на повышение концентрации Н+ в CSF и вызывают компенсаторное увеличение газообмена (частоты дыхания и дыхательного объема).
Исследователи используют ингаляцию диоксидом углерода для регулирования дыхания у тестируемых животных и людей. Вдыхание 5% диоксида углерода вызывает увеличение дыхательного объема до 192% (3). Данное увеличение происходит быстро и достигает устойчивого плато на протяжении всего воздействия (4). Когда воздействие диоксида углерода прекращается, изменения дыхания возвращаются к исходному уровню в течение нескольких минут (4). Подобным образом, вдыхание людьми 5% диоксида углерода приводит к 3-кратному увеличению минутного объема (5). Вдыхание 5% или 7,5% диоксида углерода нормальными людьми в течение двух минут приводит к увеличению частоты дыхания на 6,7% и 19% соответственно, а также увеличению дыхательного объема на 31% и 52% соответственно, так, что минутный объем увеличивается на 34% и 75% соответственно (6). Более длительные воздействия указанных концентраций продуцируют еще более сильные ответы (5).
Аналоги камптотецина и таксаны представляют собой химические агенты, которые в настоящее время разрабатываются в качестве химиотерапевтических агентов (21, 26). Противораковые лекарственные средства, паклитаксел (РТХ) и различные производные камптотецина (СРТ), являются клинически активными при лечении ряда человеческих опухолей, включая рак легких. Клинические испытания данных лекарственных средств демонстрируют благоприятные результаты при использовании их в виде отдельных агентов, или в сочетании друг с другом (21). Данные лекарства принимают системно посредством перорального или внутривенного способов введения; для паклитаксела наиболее эффективным способом является длительная внутривенная инфузия (22, 24), тогда как доказано, что для липофильных родственных соединений камптотецина наиболее эффективным является пероральное введение.
Развитие токсических побочных эффектов часто является основным ограничением таких терапевтических режимов. Некоторые подкожные ксенотрансплантанты рака человека у голых мышей (23) и в экспериментальных легочных метастазах мышей (6) успешно лечили липосомальными композициями камптотецина и 9-нитрокамптотецина (9NC), вводимыми аэрозольным способом, что является альтернативным методом лечения. Исследования фармакокинетики камптотецина на мышах показали, что вдыхание липосомального камптотецина обеспечивает значительные уровни лекарственного средства в легких и других органах, которые быстро снижаются после прекращения аэрозольной доставки (17). Несмотря на достижение указанных уровней, системы аэрозольной доставки являются эффективными только на 15-20% в отношении осаждения в легких (29, 30); таким образом, повышение осаждения в легких может быть полезным.
При использовании указанных системных способов доставки лекарственных средств некоторое количество лекарства выходит из кровотока и локализуется в тканях органов дыхания, однако легкие не являются основными органами для осаждения лекарства. Применение обычных липосом в качестве носителей для указанных лекарственных средств не улучшает осаждения в легких лекарств, вводимых с помощью традиционных системных способов (11, 27). Распыление является очень эффективным способом целевой доставки лекарственного средства, например камптотецина, к дыхательным путям (17). Собак со спонтанно растущими первичными и метастатическими опухолями легких успешно лечили с помощью новых препаративных форм доксорубицина и РТХ, доставляемых посредством аэрозолизации (16). Однако в данных случаях аэрозоли получают, используя обычный воздух.
Доставку генов к различным тканям осуществляют с использованием как вирусных, так и невирусных векторов. Хотя применение невирусных векторов позволяет избежать иммуногенного ответа, связанного с вирусными векторами, невирусные векторы, такие как катионные липиды и поликатионные полимеры, как правило, не были связаны с высокими уровнями экспрессии генов, характерной для вирусных векторов. Однако полиэтиленимин (PEI), катионный полимер, является эффективным как в культуре ткани, так и in vivo (36). Способность к протонированию каждого третьего азота придает полиэтиленимину высокую буферную емкость. Полиэтиленимин может эффективно транспортировать ДНК к ядрам (37) и защищать ДНК от расщепления ДНКазами (36). Было показано, что как линейные, так и разветвленные формы полиэтиленимина обеспечивают высокие уровни экспрессии трансгена в различных тканях, таких как легкие, мозг и почки (39-41). Полиэтиленимин также используют для эффективной доставки ДНК к опухолям in vivo (42).
Аэрозольная доставка является неинвазивным способом доставки нужных генов к легким и потенциально может использоваться для лечения заболеваний, таких как рак легкого и кистозный фиброз. Однако уровни экспрессии трансгена не являются очень высокими из-за того, что в некоторых случаях в процессе распыления утрачивается жизнеспособность ДНК (43). PEI может защищать ДНК в процессе распыления (44) и может обеспечивать в легких более высокие уровни трансфекции, чем большинство других катионных липидов, подвергавшихся испытаниям (44, 45). Кроме того, PEI-опосредованная трансфекция является устойчивой к ингибированию легочными поверхностно-активными веществами (46).
Повышения эффективности осаждения лекарственного средства в дыхательных путях посредством ингаляционного способа введения достигают несколькими способами: 1) путем изменения концентрации лекарственного средства в препаративной форме, используемой для введения посредством аэрозоля (31); 2) путем применения более эффективных типов распылителей (32); 3) путем увеличения продолжительности лечения; или 4) путем изменения моделей дыхания (4). Как ранее установлено, диоксид углерода является природным модулятором дыхания. Вдыхание воздуха, содержащего низкие концентрации СО2 (приблизительно от 3-7%), вызывает подобные изменения моделей дыхания и хорошо переносится (13, 6). Различия в моделях дыхания при вдыхании 5% СО2 в воздухе и выполнении человеком умеренных физических упражнений не наблюдаются (32). Такое воздействие 5% СО2 в воздухе на человека может быть получено при использовании аэрозольного лечения. Так, применение для распылителя воздуха, обогащенного СО2, как модулятора ингаляционной терапии, может приводить к более эффективной легочной доставке химиотерапевтических агентов.
В предыдущем уровне техники существует дефицит средств, увеличивающих осаждения в легких лекарственного средства, вводимого в виде аэрозоля в процессе ингаляционной терапии. Настоящее изобретение удовлетворяет данную многолетнюю потребность, существующую в данной области.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способ увеличения осаждения в дыхательных путях человека или животного лекарственного средства, вводимого в виде аэрозоля, включающий стадию введения упомянутого лекарственного средства в виде аэрозоля в воздушной смеси, содержащей приблизительно до 10% газообразного диоксида углерода. В данном описании используются концентрации диоксида углерода 2,5%, 5% и 7,5%. Аэрозоль может быть введен в течение от 1 до 30 минут, или даже в течение более длительного времени. Вводимое лекарственное средство может представлять собой растворимое лекарственное средство, нерастворимое лекарственное средство или терапевтическую композицию, например олигонуклеотид, ген, пептид или белок, который можно растворить в растворе и непосредственно вводить в виде аэрозоля с помощью струйного распылителя, или перед введением в виде аэрозоля его можно включить в носитель, такой как липосомы, полимеры с замедленным высвобождением или поликатионные полимеры.
Другие аспекты, признаки и преимущества настоящего изобретения станут понятными из следующего описания представленных предпочтительных воплощений данного изобретения, приведенного с целью раскрытия.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для того, чтобы материал, в котором приведенные выше признаки, преимущества и цели изобретения, а также другие аспекты, стали бы понятными, достижимыми и могли бы быть понятны в деталях, более конкретное описание изобретения, кратко изложенное выше, может быть приведено со ссылкой на определенные его воплощения, которые иллюстрируются в прилагаемых чертежах. Данные чертежи составляют часть описания. Следует отметить, однако, что прилагающиеся чертежи иллюстрируют предпочтительные воплощения данного изобретения и, следовательно, не могут рассматриваться как ограничивающие их объем.
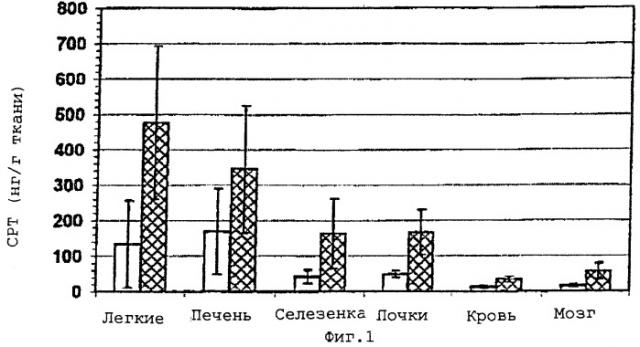
На фигуре 1 показано тканевое распределение камптотецина после 30 мин воздействия липосомального аэрозоля, полученного с использованием нормального воздуха (сплошные), или с использованием воздуха, содержащего 5% СО2 (заштрихованные). В конце обработки (30 мин) производят резекцию органов у трех мышей из каждой группы и определяют содержание лекарственного средства методом ВЭЖХ. Рассчитывают средние значения со стандартным отклонением (SD). Значения Р для воздуха, содержащего 5% СО2, по сравнению с нормальным воздухом составляют 0,02, 0,13, 0,04, 0,04, 0,03 и 0,01 для легких, печени, селезенки, почек, крови и мозга соответственно (двухсторонний критерий Стьюдента).
На фигуре 2 показана кривая зависимости концентрация-время, полученная на легких для СРТ-липосом, вводимых в течение 30 мин в виде аэрозоля, полученного с использованием нормального воздуха (о), или воздуха, содержащего 5% СО2 (•). Для каждой временной точки производят резекцию легких от трех мышей и определяют содержание лекарственного средства методом ВЭЖХ. Рассчитывают средние значения с SD.
На фигуре 3 показана кривая зависимости концентрация-время, полученная на легких для РТХ-липосом, вводимых в течение 30 мин в виде аэрозоля, полученного с использованием нормального воздуха (о), или воздуха, содержащего 5% СО2 (•). Для каждой временной точки легкие от трех мышей объединяют и определяют содержание лекарства методом ВЭЖХ. Каждый эксперимент повторяют три раза и рассчитывают средние значения с SD.
На фигуре 4 демонстрируется сравнение тканевых уровней паклитаксела в легких мышей, подвергавшихся воздействию аэрозолей, содержащих различные липосомальные композиции. Эквивалентные уровни обработки паклитакселем достигаются при использовании аэрозоля, полученного с применением 5% СО2 в воздухе, содержащего стерически стабилизированные паклитаксел-содержащие липосомы, полученные из димиристилфосфоэтаноламинполи(этиленгликоля) 2000, а также при применении DLPC.
На фигуре 5 демонстрируется сравнение экспрессии CAT в легких под действием PEI-ДНК аэрозоля, полученного с использованием воздуха, или воздуха, содержащего 5% СО2. Один миллиграмм CAT плазмиды подвергают комплексованию с PEI при соотношении N:P, составляющем 10:1, и полученный комплекс вводят мышам в виде аэрозоля в течение 30 мин. Спустя 24 часа легкие собирают и проводят CAT анализ по описанной методике. Данные приводят в виде средних значений ± SD (n=6 мышей на группу, Р=0,001).
На фигуре 6 демонстрируется влияние процентного содержания СО2 на эффективность переноса PEI-ДНК к легким посредством аэрозоля. Используют различные процентные концентрации СО2 в воздухе при фиксированном количестве CAT плазмиды. Комплексы вводят в виде аэрозолей, используя 0%, 2,5%, 5%, 10% диоксида углерода и контроль. Мышей умерщвляют, собирают легкие и проводят CAT анализ. Данные выражают в виде средних значений ± SD.
На фигуре 7 демонстрируется, что экспрессия гена в легких, индуцированная PEI-ДНК аэрозолем, является дозозависимой. Увеличивающиеся дозы CAT плазмиды вводят в виде аэрозоля с использованием 5% CO2 в воздухе, при фиксированном соотношении N:P, равном 10:1. Наблюдается увеличение как общего количества доставляемой ДНК, так и концентрации доставляемого PEI-ДНК. Мышей умерщвляют через 24 ч, легкие собирают и анализируют Cat белок. Данные приводят как средние значения ± SD (n=5 мышей на группу).
На фигуре 8 демонстрируется влияние соотношения N:Р на эффективность переноса PEI-ДНК к легким в виде аэрозоля. Различные соотношения PEI-ДНК (N:P) используют с фиксированным количеством CAT плазмиды (2 мг). Комплекс вводят в виде аэрозоля, полученного с использованием 5% СО2 в воздухе. Через 24 часа мышей умерщвляют, собирают легкие и проводят CAT анализ. Данные представляют как средние значения ± SD (n=5 мышей на группу).
На фигуре 9 демонстрируется влияние соотношения N:P на экспрессию гена люциферазы в легких. Фиксированное количество люциферазкой плазмиды (2 мг) доставляют при различных соотношениях N:P. Комплексы вводят в виде аэрозоля, полученного с использованием 5% СО2 в воздухе. Через 24 часа после доставки аэрозоля мышей умерщвляют, собирают легкие и определяют люциферазную активность. Данные представляют как средние значения ± SD (n=5 мышей на группу).
На фигуре 10 показана экспрессия трансгена во времени после однократной обработки PEI-ДНК аэрозолем. На фигуре 10А мышей обрабатывают аэрозолем, содержащим 2 мг CAT плазмиды при соотношении N:P, равном 15:1, полученным с использованием 5% СО2 в воздухе. Мышей умерщвляют в разные временные точки, легкие собирают и сразу замораживают. CAT анализ проводят после последней временной точки. Данные приводят как средние значения ± SD (n=5 мышей на временную точку). На фигуре 10В показана устойчивая экспрессия CAT, полученная с использованием двух разных соотношений N:P. Обеим группам мышей (n=5 мышей на каждую временную точку на группу) вводят 2 мг CAT плазмиды при соотношении NPP 15:1 или 10:1, с использованием 5% СО2 в воздухе. Временные точки для соотношения 10:1 составляли 1, 2, 3 и 6 дней после воздействия аэрозоля, и для соотношения 15:1 составляли 1, 3, 7 и 10 дней после воздействия аэрозоля.
На фигуре 11 показано тканевое распределение трансгена после однократной обработки PEI-ДНК аэрозолем. Используют такие же группы мышей, как для фигуры 9 (из группы 10:1). Разные ткани собирают и немедленно замораживают. CAT белок анализируют после последней временной точки. Данные приводят как средние значения ± SD (n=5 мышей на временную точку). Уровни CAT в тканях, не относящихся к легким, в группе, обработанной аэрозолем, не отличаются от уровней, полученных для контрольных тканей (Р>0,1).
На фигуре 12 демонстрируется гистологический анализ легких, обработанных PEI-ДНК аэрозолем. Получают комплекс двух миллиграммов CAT плазмиды и PEI при соотношении N:P, составляющем 15:1, и комплекс вводят пяти мышам в течение 30 мин в виде аэрозоля, полученного с использованием 5% СО2 в воздухе. Спустя 24 часа мышей умерщвляют, легкие собирают и фиксируют в формалине. Тонкие срезы окрашивают гематоксилином и эозином (Н&Е). Фигура 12А: бронхиол (контроль); Фигура 12В: бронхиол (обработанные). Увеличение 100×.
На фигуре 13 демонстрируется ингибирование метастаз в легких B16-F10 под действием обработки аэрозолем PEI-р53. Фигура 13А: Опухолевый индекс рассчитывают по формуле: опухолевый индекс = массы легких × средний размер для группы. Данные представляют как средние значения ± SD (n=10 мышей на группу). Фигура 13В: Представлены образцы легких от контрольных мышей, мышей, обработанных PEI-Lucand и PEI-р53 (n=10 мышей на группу). Легкие от группы, обработанной PEI (не показано), по форме, размеру и числу опухолевых очагов сходны с легкими, показанными для контрольной группы и группы, обработанной PEI-Luc. Данные получены от двух отдельных экспериментов. Фигура 13С: Массы легких мышей из разных групп. Данные представлены как средние значения ± SD (n=10 мышей на группу).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способ увеличения осаждения в дыхательных путях человека или животного лекарственного средства, вводимого в виде аэрозоля, который включает стадию введения указанного лекарственного средства в виде аэрозоля в воздушной смеси, содержащей приблизительно до 10% газообразного диоксида углерода. Предпочтительные концентрации газообразного диоксида углерода включают 2,5%, 5% и 7,5%. Аэрозоль может быть введен в течение от 1 до 30 минут, или даже в течение более длительного времени.
Настоящее изобретение направлено на аэрозольную доставку водорастворимого лекарственного средства. Такое лекарственное средство может быть непосредственно получено в виде водного или буферного раствора, который непосредственно используют для получения аэрозоля. Примеры водорастворимых лекарственных средств включают антибиотики, такие как тобрамицин и пентамидин; муколитики, такие как ацетилцистеин; бронхолитические средства, такие как альбутерол; парасимпатические агенты, такие как ипратропиум бромид; ферменты, такие как ДНКазы; а также антивирусные агенты, такие как рибавирин.
Альтернативно настоящее изобретение может использоваться для доставки нерастворимого лекарственного средства, которое перед аэрозольной доставкой присоединяют к носителю. Возможные носители включают липосомы, полимеры, обеспечивающие замедленное высвобождение, и поликатионные полимеры. Липосомы представляют собой особенно пригодный носитель для липофильных лекарственных средств, таких как амфотерицин В; нистатин; глюкокортикоиды; иммунодепрессанты, такие как CsA, FK506, рапамицин или микофенолат; и противораковые средства, такие как камптотецин, производные камптотецина и паклитаксел. Липосомы могут быть образованы из таких липидов, как фосфолипид дилауроилфосфатидилхолин (DLPC), или они могут представлять собой стерически стабилизированные липосомы, в состав которых входят модифицированные фосфолипиды, такие как димиристилфосфоэтаноламин-поли(этиленгликоль) 2000. Могут применяться полимеры, обеспечивающие замедленное высвобождение, такие как сополимер (молочной кислоты и гликолевой кислоты) (PLGA), или поликатионные полимеры, такие как полиэтиленимин (PEI).
Настоящее изобретение также может применяться для доставки терапевтических белков, терапевтических пептидов, ДНК генов, смысловых олигонуклеотидов, антисмысловых олигонуклеотидов и вирусных векторов. Характерными примерами ДНК генов являются ген хлорамфениколацетилтрансферазы (CAT) или ген р53. Предпочтительно данные гены доставляются посредством носителя из поликатионного полимера, такого как полиэтиленимин. В качестве носителей могут также применяться катионные липосомы. Полиэтиленимин может иметь соотношение азот:фосфат, составляющее приблизительно от 10:1 до 20:1. В предпочтительном воплощении соотношение азот: фосфат в PEI составляет приблизительно 10:1.
Предоставляются нижеследующие определения. Термины, которые конкретно не определены, следует интерпретировать, как принято в данной области.
В данном описании термин "аэрозоли" относится к дисперсиям в воздухе твердых или жидких частиц, имеющих достаточно маленький размер и, как следствие, достаточно низкие скорости оседания для того, чтобы образовывать относительно стабильную взвесь в воздухе (8).
В данном описании термин "липосомные аэрозоли" относится к водным капелькам, в которых диспергированы одна или несколько липосомных частиц или липосом, содержащих один или несколько лекарственных препаратов, предназначенных для доставки к дыхательным путям человека или животных (9).
В данном описании размер аэрозольных капелек, определенный для данной заявки, соответствует описанному в патенте США 5049338, а именно среднемассовый аэродинамический диаметр (MMAD) составляет 1-3 мкм при геометрическом стандартном отклонении, составляющем приблизительно 1,8-2,2. Однако при низких концентрациях 9-NC и, возможно, других производных камптотецина среднемассовый аэродинамический диаметр может быть менее 1 мкм, например 0,8 мкм. Исследования, раскрытые в настоящем изобретении, показали, что липосомы могут занимать по существу весь объем капельки, если она уравновешена с влажностью окружающей среды.
В данном описании "модель легких Вейбела (Weibel)" относится к классификации структуры человеческих легких, которая распознает 23 последовательных ответвления дыхательных путей человека. Трахею обозначают 0, бронхи и бронхиолы простираются до ветви 16. Данные фрагменты дыхательных путей содержат реснитчатый эпителий и слизистые железы. Вместе они составляют покрытие из реснитчатого эпителия. Ветви 17-23 составляют альвеолярный фрагмент легкого и не имеют реснитчатого эпителия. Таким образом, осевшие частицы не выносятся вверх по дыхательным путям для проглатывания.
В данном описании постулируется, что при контролируемых экспериментальных состояниях гиперкапнии осаждение вдыхаемых частиц лекарственного средства значительно превышает уровни, наблюдаемые при базальных состояниях дыхания. Применение смесей газообразный диоксид углерода/воздух для обеспечения непрерывного потока струйного распылителя может сильно увеличить эффективность доставки дозы лекарственного средства к периферическим участкам легких (образования Вейбела 17-23). По аналогии данная система может эффективно применяться для увеличения биологической эффективности вдыхаемых лекарственных средств. Данный принцип теоретически может применяться с любым лекарственным средством, геном, олигонуклеотидом или белок/пептидной композицией (растворимой, липосомальной, кристаллической или содержащей носитель на основе полимера, такой как полиэтиленимин), и любым струйным распылителем, действующим с использованием газа или воздуха.
Настоящее изобретение в первую очередь направлено на применение газообразного диоксида углерода для увеличения глубины и частоты дыхания в процессе ингаляционной терапии лекарственным средством, вводимым в виде аэрозоля, что приводит к увеличению минутных объемов. Увеличение дыхательного объема легких приводит к повышению осаждения в легких вдыхаемых частиц лекарственного средства, особенно в периферических участках легких, которые могут не вентилироваться полностью при низких уровнях дыхания. Увеличение минутного объема происходит в результате повышения частоты и глубины дыхания, оба данных фактора вносят вклад в увеличение минутного объема.
Введение лекарственного средства в виде аэрозоля в воздушной смеси, содержащей приблизительно до 10% газообразного диоксида углерода, приводит к увеличению осаждения лекарственного средства в дыхательной системе, значительно улучшая эффективность и терапевтическое действие аэрозольной доставки лекарственного препарата. Предпочтительные концентрации газообразного диоксида углерода включают 2,5%, 5% и 7,5%. Аэрозоль может быть введен в течение от 1 до 30 минут, или даже в течение более длительного времени. Усиливающий эффект диоксида углерода становится очевидным в пределах 30 секунд. Влияние диоксида углерода на дыхание является временным и может применяться многократно.
Нижеследующие примеры приведены с целью иллюстрации различных воплощений данного изобретения и не должны пониматься как ограничивающие каким-либо образом настоящее изобретение.
Пример 1
Материалы
РТХ получают от Xechem (New Brunswick, NJ). CPT получают от Sigma (St.Louis, МО), a 9NC от ChemWerth (Woodbridge, CN). Дилауроилфосфатидилхолин (DLPC) получают от Avanti Polar Lipids (Alabaster, AL). DMSO получают от Sigma (St. Louis, МО), а другие органические растворители, имеющие степень чистоты "чистый для ВЭЖХ" получают от Fisher Scientific. Стерильную воду для промывания получают от Baxter Healthcare Corporation (Deerfield, IL).
Мышей ICR (возрастом 7-8 недель) получают от Harlan-Sprague Dawley (Indianapolis, IN) и помещают в стандартные клетки со свободным доступом к пище и воде. Самок мышей C57BL/6 (возрастом 8-9 недель) и самок мышей Balb/C (возрастом 5-7 недель) получают от Harlan-Sprague Dawley (Houston, TX). Уход за всеми животными осуществляют в соответствии с Baylor College of Medicine Institutional Animal Care и Use Committee.
Ген бактериальной хлорамфениколацетилтрансферазы (CAT, p4119, ссылка 15), главным образом, используют в качестве репортерного гена для измерения экспрессии трансгена. Ген CAT находится под контролем элемента раннего промотора/энхансера человеческого цитомегаловируса (CMV). Люциферазная плазмида (pGL3, Promega, Madison, WI), модифицированная путем вставки промотор/энхансерного элемента CMV и последовательности полиаденилирования человеческого гормона роста, предоставлена Dr.Michael Barry (Center for Cell and Gene Therapy, Baylor). Все плазмиды очищены на колонках Qiagen (Qiagen, Valencia, CA) и не содержат эндотоксина. Количественное определение плазмид осуществляют по УФ-поглощению при 260 нм. Анализ на агарозном геле показал, что плазмиды представляют собой смесь главным образом суперспиральной плазмиды с небольшим количеством плазмиды с одноцепочечным разрывом.
Плазмиду, содержащую ген р53, получают от Dr.Y.K.Fung (Children's Hospital, Los Angeles, CA). Ген р53 находится под контролем промотор/энхансерного элемента человеческого цитомегаловируса (CMV). В качестве контроля используют плазмиду, содержащую ген светящейся люциферазы (Luc), полученную от Dr.Michael Barry (Baylor College of medicine). Плазмиды, очищенные в промышленных масштабах Bayou Biolabs (Harahan, LA), не содержат эндотоксина, и количественное определение данных плазмид осуществляют по УФ-поглощению. Анализ на агарозном геле показал, что плазмиды главным образом находятся в суперспиральной форме при небольшом количестве плазмиды с одноцепочечным разрывом.
Клеточную линию меланомы B16-F10 получают от Division of Cancer treatment и Diagnosis Center (DCTDC, NCE, Frederick, MD) и культивируют в DMEM, дополненной 10% фетальной телячьей сывороткой. Показано, что данная клеточная линия образует опухоли в легком (15). Мышам C57BL/6 вводят в хвостовую вену двадцать пять тысяч клеток B16-F10 в 200 мкл среды на одну мышь. Метастазы в легких визуально детектируют в течение двух недель после инокуляции клеток. Клетки используют от 3-12 пассажа.
Пример 2
Статистика
После однофакторного дисперсионного анализа (ANOVA) для сравнения средних значений проводят двусторонний непарный t-тест Стьюдента. Различие считают значимым, если Р≤0,05.
Пример 3
Получение липосом
Базовые растворы DLPC, РТХ и камптотецина готовят в т-бутаноле с концентрацией 100, 10 и 1 мг/мл соответственно, используя ранее описанные методы (17). Аликвоты паклитаксела и DLPC смешивают при массовом соотношении 1:10. Массовое соотношение камптотецина к DLPC составляет 1:50. Затем смесь лекарственное средство - фосфолипид замораживают в жидком азоте и лиофилизируют в течение ночи до получения сухого порошка. Готовые формы хранят в герметично закрытом состоянии при -20°С. Перед применением смесь разбавляют стерильной водой для смачивания и энергично перемешивают до получения гомогенной суспензии многослойных липосом. Исходные концентрации камптотецина и паклитаксела в суспензии перед распылением составляют 0,5 мг/мл и 10 мг/мл соответственно. Размер липосом до и после распыления определяют, используя Nicomp Submicron Particle Sizer Model 370 9NICOMP, Santa Barbara, CA.
Пример 4
Характеристики размеров аэрозольных частиц
Характеристики аэрозольных частиц, содержащих лекарственные средства, заключенные в липосомах, оценивают, используя дозатор размеров для неживых рассеянных частиц Andersen/AFCM (Andersen Instruments, Atlanta, GA) no описанной методике (31). Концентрацию лекарственного средства в аэрозолях, полученных с использованием воздушных или газовых смесей, истекающих со скоростью 10 л/мин из распылителя AERO-MIST, также измеряют путем сбора образцов в течение 3 минут через 1 минуту после начала аэрозолизации. Среднемассовый аэродинамический диаметр (MNAD) и геометрическое стандартное отклонение (GSD) рассчитывают, как описано ранее (30, 31), используя программное обеспечение KaleidaGraph 2.0 (synergy Softwear, Reading, PA).
Пример 5
Аэрозольная доставка паклитаксела и камптотецина
Обработку мышей аэрозолем проводят, как описано ранее (16-18). Вкратце, для получения аэрозольных частиц применяют струйный распылитель AERO-MIST (CIS-USA, Beadford, MA) при скорости воздушного потока 10 л/мин. Мышей помещают в герметично закрытую пластиковую клетку (23×18×13 см) и подвергают действию аэрозоля в течение 30 минут. Аэрозоль получают с использованием нормального воздуха или воздуха, содержащего 5% СО2, который получают путем смешивания нормального воздуха и СО2 с помощью смесителя (Bird 3m, Palm Springs, CA), и концентрации СО2 проверяют с помощью Fluid Fyrite (Bacharach Inc., Pittsburg, PA). Для каждой временной точки 3 мышей удаляют из клетки, умерщвляют, подвергая воздействию изофлурана, USP (Abbott Laboratories, Chicago, IL), и обескровливают. Органы удаляют, взвешивают и держат замороженными при -70°С до экстракции.
Пример 6
Экстракция лекарственного средства из тканей
Перед экстракцией образцы оттаивают и сразу разрезают ножницами на маленькие кусочки. Для того, чтобы экстрагировать паклитаксел из тканей, к каждому образцу добавляют 3 мл этилацетата и гомогенизируют в разрушающем клетки гомогенизаторе mini-beadbeater (Wig-L-Bug, Model 3110В, Crescent Dental MFR, Co., Lyons, IL) в течение 2 минут. Гомогенаты переносят в конические стеклянные центрифужные пробирки объемом 10 мл и центрифугируют 10 мин при 1000×g. Супернатантную фракцию отделяют и органический растворитель упаривают под током воздуха. Остаток разбавляют 0,2 мл смеси метанол: ацетонитрил (2:1, об/об), обрабатывают ультразвуком в ультразвуковом устройстве с водяной баней и центрифугируют 10 мин при 1000×g. Супернатантные фракции нагревают 30 мин при 37°С и анализируют методом ВЭЖХ.
Процедуру экстракции для камптотецина и 9NC проводят по описанному ранее способу (17). Вкратце, для определения эффективности экстракции после оттаивания ткани к органам добавляют 20 мкг 9NC в 20 мкл в качестве внутреннего стандарта. Образцы разрезают на маленькие кусочки и к каждому образцу добавляют 1 мл 1% водного раствора уксусной кислоты, рН 3,2. После гомогенизации в mini-beadbeater гомогенаты центрифугируют при 1000×g в течение 5 мин. Супернатантные фракции повторно экстрагируют 8 мл метиленхлорида. Органическую фракцию отделяют и сушат на воздухе при комнатной температуре. Высушенные образцы разбавляют 0,2 мл ацетонитрила.
Пример 7
Анализ ВЭЖХ
Паклитаксел количественно определяют методом ВЭЖХ с обращенной фазой с детекцией на детекторе УФ-поглощения Waters 486 при 227 нм (Waters, Milford, MA). Все измерения производят при комнатной температуре на колонке Waters Nova-Pak C18 (3,9×150 см). Мобильная фаза состоит из 49% ацетонитрила и 51% воды. Скорость потока составляет 1,5 мл/мин. Вводят аликвоту каждого образца объемом 25 мкл и данные анализируют с помощью Waters millennium Software. Для определения эффективности экстракции РТХ проводят п