Комплексное анти-вич соединение
Иллюстрации
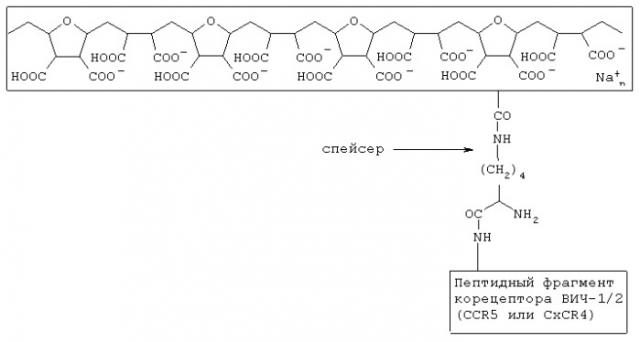
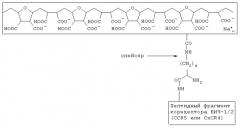
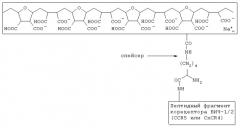
Показать всеИзобретение относится к биологии и медицине и может быть использовано для лечения и профилактики ВИЧ-инфекции и СПИД(а), а также в исследовательской работе для изучения лиганд-рецепторных взаимодействий (типа поверхностные вирусные белки - клеточные рецепторы). Комплексное анти-ВИЧ соединение включает полианионную матрицу и химически с ней связанный псевдолиганд для gp120 ВИЧ-1/2, который содержит пептидный фрагмент корецептора ВИЧ-1/2 CCR5 или CXCR4. Полианионная матрица и связанный с ней пептидный фрагмент корецептора ВИЧ-1/2 CCR5 или CXCR4 имеют следующую общую формулу:
полианионная матрица
Изобретение обеспечивает адресную доставку противовирусного препарата к очагу поражения (ткани) ВИЧ-1/2, при этом соединение подавляет специфическую вирусную инфекцию на начальных ее этапах развития, помимо этого соединение также обладает пониженной токсичностью. 1 н. и 2 з.п. ф-лы, 1 ил., 2 табл.
Реферат
Изобретение относится к биологии и медицине и может быть использовано для лечения и профилактики ВИЧ-инфекции и СПИД(а), а также в исследовательской работе для изучения лиганд-рецепторных взаимодействий (типа поверхностные вирусные белки - клеточные рецепторы).
Известно комплексное анти-ВИЧ соединение, включающее в свой состав полимерную матрицу, выполненную в виде наночастиц, на поверхности которых нанесены путем пассивной адсорбции пептиды, представляющие собой моноклональные анти-CD4-антитела (Международная заявка (WO) 94/24168, МПК С 07 К 17/08, опубл. 27.10.1994) [1]. Указанное комплексное соединение может быть использовано для производства лекарственного средства для профилактики или лечения патологических состояний, связанных с ВИЧ-инфекцией.
Однако данный анти-ВИЧ комплекс является высокомолекулярным соединением, которое плохо утилизируется из организма, что может вызвать тяжелые токсические последствия при его применении.
Известны комплексные анти-ВИЧ соединения, включающие в свой состав полианионную матрицу и синтетический фармакофор модификатор Норборнен [2, 3, 4].
Наиболее близким техническим решением (прототипом) является другое комплексное анти-ВИЧ соединение, включающее полианионную матрицу и химически с ней связанный псевдолиганд для gp120 ВИЧ-1/2. Псевдолиганд для gp120 ВИЧ-1/2 представляет собой синтетический фармакофор модификатор, например Адамантан [5, прототип].
Недостатком вышеуказанных соединений-аналогов, в том числе и прототипа, является относительно узкий спектр потенциальных мишеней в многоэтапном процессе взаимодействия ВИЧ-1/2 - чувствительная клетка. Взаимодействие препарата может происходить помимо целевых агентов с биологически важными соединениями и структурами, не задействованными в развитии ВИЧ-инфекции и СПИДа. Кроме того, эти соединения за счет неспецифического связывания фармакофора с биологически активными веществами могут приводить к их инактивации и развитию за счет этого токсических проявлений. Таким образом, данные химические соединения не могут полноценно блокировать начальные этапы инфицирования клеток вирусом иммунодефицита человека.
Техническим результатом изобретения является создание менее токсичных комплексных химических соединений, обеспечивающих адресную доставку противовирусного препарата к очагу поражения (ткани) ВИЧ-1/2 и подавление специфической вирусной инфекции на начальных ее этапах развития.
Указанный технический результат достигается тем, что в комплексном анти-ВИЧ соединении, включающем полианионную матрицу и химически с ней связанный псевдолиганд для gp120 ВИЧ-1/2, согласно изобретению псевдолиганд для gp120 ВИЧ-1/2 содержит пептидный фрагмент корецептора ВИЧ-1/2 CCR5 или CXCR4, а полианионная матрица и связанный с ней пептидный фрагмент корецептора ВИЧ-1/2 CCR5 или CXCR4 имеют следующую общую формулу:
полианионная матрица
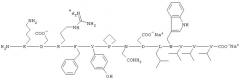
Пептидный фрагмент корецептора ВИЧ-1/2 CCR5 (структура пептидного фрагмента из N-конца (K-D2-E18) хемокинового рецептора CCR5) имеет следующую формулу:
Пептидный фрагмент корецептора ВИЧ-1/2 CXCR4 (структура пептидного фрагмента из области внеклеточной второй петли (EXL2) хемокинового рецептора CxCR4 (K-D187-V198) имеет следующую формулу:
Таким образом для получения заявляемого комплексного продукта выбирают и синтезируют адресные анти-ВИЧ соединения на основе пептидных фрагментов корецепторов ВИЧ-1/2 CCR5 или CXCR4, которые химически связаны с полианионной матрицей в комплексный препарат, обеспечивающий высокий уровень защиты ВИЧ-инфицированных клеток.
Пептидные фрагменты клеточных корецепторов ВИЧ-1 CCR5 и CxCR4 играют ключевую роль при связывании белков с лигандом gp120.
Существенными отличительными признаками изобретения являются:
- дизайн и синтез фрагментов оригинальных фрагментов пептидов корецепторов ВИЧ-1/2;
- использование в препарате полианионной матрицы молекулярной массой 20КД с целью повышения заряда и гидрофильности комплексного соединения;
- объединение в единый макромолекулярный комплекс адресных пептидных фрагментов корецепторов ВИЧ-1/2 - CCR5 или CXCR4 и полианионной матрицы.
Данный комплекс химической и пространственной структуры макромолекулярного соединения неизвестен из доступных источников информации.
На чертеже приведены графики сравнительной анти-ВИЧ эффективности (по защите клеток от гибели) комплексного препарата As643 (матрица с пришитым пептидом ПЗ), смеси матрицы с пептидом П3 и одного пептида П3 (имитатора корецептора ВИЧ CxCR4).
Пример 1. Синтез пептидных фрагментов
Синтез пептидных фрагментов-имитаторов функционально значимых участков корецепторов CCR5 и CXCR4 осуществляют твердофазным методом на колонке с хлортритильным полимером с использованием щелочелабильной 2-(4-нитрофенилсульфонил) этоксикарбонильной (Nsc) группы для временной защиты N-конца [6]. Твердофазный синтез широко применяется для получения биологически активных пептидов, используемых в медицине, ветеринарии, биотехнологии и научных исследованиях. Сущность твердофазного синтеза пептидов состоит в ступенчатом наращивании пептидной цепи посредством повторяющихся циклов химических реакций начиная с С-концевой аминокислоты, закрепленной на нерастворимом носителе. При этом целевые продукты всех реакций в процессе синтеза остаются связанными с носителем, а избыточные реагенты и побочные продукты удаляются фильтрованием и промыванием носителя.
Для проведения твердофазного синтеза пептида С-концевую аминокислоту целевой аминокислотной последовательности, защищенную по α-аминогруппе, через α-карбоксильную группу ковалентно связывают с нерастворимым полимерным носителем путем образования амидной или эфирной связи. Затем с полученного Nα-защищенного аминоацил-полимера отщепляют Nα-защитную группу и получают аминоацил-полимер со свободной α-аминогруппой. Далее этот полимер ацилируют следующей аминокислотой, защищенной по α -аминогруппе и получают Nα-защищенный дипептидил-полимер. Синтетические циклы, состоящие из стадий отщепления Nα-защитной группы и ацилирования свободной аминогруппы пептидил-полимера последующей аминокислотой, защищенной по α-аминогруппе, повторяют до тех пор, пока не будет собрана полная аминокислотная последовательность целевого пептида.
Так как в процессе твердофазного синтеза применяются большие молярные избытки ацилирующих реагентов (2-10-кратные по отношению к свободным аминогруппам), все реакционноспособные группы в боковых радикалах аминокислот, в частности амино-, карбокси-, гидрокси-, меркапто-, гуанидино- группы, должны быть блокированы защитными группами. Защитные группы для этой цели подбирают таким образом, чтобы, с одной стороны, обеспечить полную и постоянную защиту боковых радикалов аминокислот в условиях реакций ацилирования пептидил-полимера и отщепления временной N-αзащитной группы и, с другой стороны, иметь возможность количественно и без повреждения структуры синтезированного пептида отщепить эти защитные группы в одну или две стадии.
Очистку синтезированных пептидов осуществляют препаративной ВЭЖХ (Altex, USA) на колонке 10×250 мм с фазой SynChropak RPP 100, 10 мкм (Eichrom Ind., USA) при скорости потока 4 мл/мин в линейном градиенте элюэнтов от А до В за 2 ч (элюэнт А - 0.1% ТФУ в воде; элюэнт В - 0.1% ТФУ в 60% растворе ацетонитрила). На выходе получали пептиды с 90-98% чистоты по данным аналитической ВЭЖХ. С N-концевого фрагмента пептида вводят аминокислоту лизин, имеющую стерически доступную для химической модификации аминогруппу с целью осуществления последующего химического связывания пептидов с поликарбоксилатной матрицей.
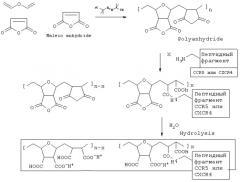
Пример 2. Получение полимерной матрицы
Ниже приведена схема трехстадийного синтеза поликарбоксилатной матрицы из малеинового ангидрида (более подробное описание синтеза в [5]), а также схема ковалентного присоединения пептидного фрагмента:
Пример 3. Получение комплексного анти-ВИЧ соединения
Берут поликарбоксилатную матрицу следующей формулы
сокращенная формула
Для модификации матрицы используют ее ангидридную форму, реакционно активную в отношении синтетических пептидов. Суммарную степень модификации матрицы ограничивали пределом не более 20% для сохранения необходимого количества немодифицированных карбоксильных групп матрицы, ответственных за обеспечение отрицательного заряда и ее специфических адъювантных свойств. Указанные карбоксильные группы получали после предварительных стадий модификации пептидными фармакофорами (схема приведена в примере 2) путем исчерпывающего гидролиза оставшихся немодифицированными ангидридных циклов матрицы. Продукты гидролиза очищали от остатков органических растворителей и непрореагировавших реагентов методом ультрафильтрации водных растворов с применением мембраны проницаемостью 3KD. Конечные продукты в форме натриевой полусоли выделяли лиофильной сушкой.
Пример 4. Исследование анти-ВИЧ активности заявляемого комплексного соединения
Препараты. Для исследований были использованы препараты, синтезированные методами органического и полимерного синтеза в Исследовательском центре биомодуляторов и лекарственных соединений НИФ Здоровья. При подготовке к биологическим испытаниям препараты подвергали тщательной очистке от возможных низкомолекулярных примесей методом селективной ультрафильтрации: четырьмя циклами десятикратной промывки-концентрирования на ультрафильтрационных мембранах фирмы Sigma (США) проницаемостью до 1 или 3 KD (NMLW; 1,000 и 3,000 соответственно). Очищенные полимер-ассоциированные субстанции выделяли лиофильной сушкой в форме белых высокопористых порошков, растворимых в воде, диметилсульфоксиде и спирте.
Вирус. Для оценки эффективности анти-ВИЧ соединений в работе использовали макрофаготропный штамм ВИЧ-1EVK (ГКВ 4005), макрофаго-Т-лимфоцитотропный синцитий, образующий штамм ВИЧ-1Z, СХСR4-тропный вариант ВИЧ-1 (Х4-вирус) - штамм LAV.04; ССR5-тропный вариант ВИЧ-1 (R5-вирус) - штамм SF162, предоставленные Национальным Институтом Здоровья (США).
Клеточные линии. Высокочувствительная к инфекции ВИЧ-1/2 перевиваемая культура лимфобластоидных клеток человека МТ-4. МТ-4 клетки культивировали в полной ростовой питательной среде RPMI-1640, содержащей 0,06% L-глутамина, 10% сыворотки эмбрионов коров, линкомицина (60 ед/мл) и гентамицина (100 мкг/мл) при температуре 37°С, 5% CO2 в течение 4 суток. Посевная концентрация клеток составляла 0,5×106 кл/мл. На 4 сутки культивирования учитывали количество клеток, разводили ростовой средой до посевной концентрации и культивировали вновь.
ФГА-стимулированные мононуклеарные клетки периферической крови (МКПК) человека. МКПК выделяли из венозной крови здорового донора по методике, описанной Fotino с соавт. [2]. Культивирование первичных лимфоцитов осуществляли в среде RPMI-1640 с добавлением 10% сыворотки эмбрионов коров, 4 мкг/мл ФГА, 5 ед/мл ИЛ-2, 60 ед/мл линкомицина и 100 мкг/мл гентамицина в 50 мм3 пластиковых матрасах при 37°С с 5% CO2 в атмосфере. После 4 дней инкубации культуры в данных условиях производили замену питательной среды новой, аналогичной по составу, но уже не содержащей ФГА. Для этого клетки осаждали центрифугированием при 200 g и разводили до посевной концентрации свежей средой.
Анализ токсичности изучаемых соединений проводили на перевиваемой лимфобластоидной линии клеток человека МТ-4. О токсичности препаратов судили по жизнеспособности клеток в присутствии тестируемых соединений в широком диапазоне концентраций, индексу пролиферации и по морфологии роста культуры. Схема эксперимента аналогична той, что приведена ниже для оценки анти-ВИЧ активности соединений, но без инфицирования клеток вирусом.
Исследование анти-ВИЧ активности препаратов проводили по следующей схеме: раствор препарата в концентрациях от 0,1 до 500 мкг/мл (по три лунки на каждую концентрацию) вносили в клеточную культуру (МТ-4, МКПК), одновременно вносили вирус и инкубировали в течение 4-х суток. Множественность заражения составляла 0.2-1 инфекционных единицы на клетку. Культуры клеток инкубировали в течение 4 суток при температуре 37°С во влажной атмосфере 5% СО2. В качестве контролей служили ВИЧ-инфицированные клетки без добавления противовирусных препаратов и неинфицированные клетки.
Анти-ВИЧ активность оценивали после окончании инкубации по снижению жизнеспособности культуры и по подавлению продукции вирусспецифического белка р24 ВИЧ-1. Долю жизнеспособных клеток учитывали методом исключения трипановым синим (Sigma, USA) или методом, основанным на редукции красителя МТТ (ICN, USA) с накоплением формазана в живых клетках. Количество вирусспецифического белка р24 в культуральной среде оценивали с помощью иммуноферментного анализа (тест-система "Векто ВИЧ-1 р24-антиген", чувствительность 20×10-12 г/мл, производства ЗАО "Вектор-Бест", Россия). На основе экспериментальных данных строили дозозависимые кривые и вычисляли концентрации препаратов, на 50% (ЕС50) и на 90% (ЕС90) защищающие инфицированные клетки от гибели; а также определяли концентрации препарата, на 50% (IC50) и на 90% (IC90) снижающие накопление вирусспецифического белка р24.
Для поиска ЕС50, ЕС90, IC50, IC90 строились графики зависимости доза-эффект и по их линейным участкам вычислялись соответствующие концентрации и погрешности по формулам обратной регрессии [Н. Дрейпер, Г.Смит, "Прикладной регрессионный анализ", М.: Финансы и статистика, 1986]. Для каждого значения концентрации было проведено одновременно три различных измерения, нормальность распределения проверялась по критерию R/s, равенство дисперсий по критерию Кочрена. Сопоставление эффективности препаратов проводилось путем сравнения эффектов при фиксированной концентрации (10 мкг/мл) методом однофакторного дисперсионного анализа. При этом учитывалась ошибка воспроизводимости, оцененная по трем независимым повторам измерений.
Экспериментальные данные по анти-ВИЧ активности монокомпонентов комплексных мембранотропных препаратов на клетках линии МТ4 со штаммом ВИЧ-1Z показали, что как пептидные фрагменты корецепторов ВИЧ-1/2 П1, П3, так же как и полианионная матрица не оказывали существенного защитного действия на инфицированные ВИЧ-1 клетки. По полученным данным, смесь пептидов П1 с матрицей (соединение As470) в любом соотношении П/М (1:1, 1:5, 1:10) не дают видимого изменения противовирусной активности последней. Однако при комбинации пептидов П3 с поликарбоксилатной матрицей в соотношении П/М 1:10 эффективность подавления репродукции вируса соединением As470 заметно возрастает. На чертеже видно, что препарат As643, в котором пептид П3 ковалентно связан с матрицей, демонстрирует наибольшую анти-ВИЧ активность среди сравниваемых соединений (полианионная матрица и смесь матрицы с пептидом) во всем исследованном диапазоне концентраций.
В таблицах 1 и 2 представлены результаты изучения противовирусной активности эффективность комплексных соединений с пептидными фрагментами и полианионной матрицей.
| Таблица 1Сравнительная анти-ВИЧ эффективность комплексных мембранотропных препаратов и базовых соединений (клетки МТ-4, штамм ВИЧ-1z). | |||||
| Препарат | Структура | ЕС50, мкг/мл | ЕС90, мкг/мл | IC50, мкг/мл | IC90, мкг/мл |
| As470 | M | 41,6-74,7 | >70 | 23,9-68,2 | ≥100,0 |
| As337 | M-Ad | 2,9-9,7 | 2:8,1 | 1,5-2,3 | 5,9-9,5 |
| As639 | М-Р1Р2 | 2,0-45,0 | 2:68,4 | ^1,0 | ≥30,0 |
| As641 | М-P5(Plns) | 0,8-9,0 | 2:21,5 | 6,0-9,7 | ≥100,0 |
| As643 | М-РЗ | 0,4-0,6 | 7,1-39,2 | 0,6-1,0 | 3,6-11,7 |
| As645 | М-Р4 | 6,3-13,7 | 2:6,5 | 0,3-8,9 | ≥5,7 |
| Примечание: М - полимерная матрица; M-Ad - комплексный препарат матрица-адамантан (прототип); М-Р1 (или Р2 или Р3 или Р4 или Р5) -заявляемый комплексный препарат с разными пептидными фрагментами. | |||||
| Таблица 2Сравнительная анти-ВИЧ эффективность комплексных мембранотропных препаратов и базовых соединений (клетки МТ-4, штамм ВИЧ-levk) | |||||
| Препарат | Состав препарата | ЕС50, мкг/мл | ЕС90, мкг/мл | IC50, мкг/мл | IC90, мкг/мл |
| As470 | М | 14,0-28,0 | ≥70 | 15,0-70,0 | >100 |
| As337 | M-Ad | 1,3-2,9 | 3,5 | 1,6-2,3 | 5,0-8,5 |
| As639 | М-Р1Р2 | 4,4-5,6 | 26,0-47,0 | 10,0-12,0 | ≥30-≥100 |
| As641 | М-Р5 (Plns) | 0,1-1,2 | 0,26-10,5 | 2,0-3,7 | 7,8-14,0 |
| As643 | М-Р3 | 1,3-1,8 | 6,1-7,8 | 0,9-1,0 | 12,0-20,0 |
| As645 | М-Р4 | 2,0-3,4 | 12,0-18,0 | 1,2-1,5 | 9,3-20,0 |
| Примечание: М - полимерная матрица; M-Ad - комплексный препарат матрица-адамантан (прототип); М-Р1 (или Р2 или Р3 или Р4 или Р5) -заявляемый комплексный препарат с разными пептидными фрагментами. |
Анализ анти-ВИЧ активности комплексных препаратов, проведенный на лимфоидных клетках человека МТ4 и штамме ВИЧ-1Z, показал их явное преимущество перед использованием монокомпонентных составов: пептид-имитатор или полианионная матрица. Наличие синергического анти-ВИЧ эффекта при одновременном применении матрицы и пептидов-имитаторов корецепторов ВИЧ-1 и усиление анти-ВИЧ эффективности комплексных препаратов с включением ковалентно связанных пептидов в отношении исследованных штаммов ВИЧ-1 позволяет сделать следующий вывод: компоненты, представляющие собой псевдолиганды для белка gp120 ВИЧ-1, обеспечивают конкурентное ингибирование взаимодействия gp120 с клеточными корецепторами при вирусной адсорбции-фузии и включение их в состав, обеспечивает эффективность разрабатываемых противовирусных препаратов.
Преимущества предлагаемого способа по сравнению с известным заключаются в том, что комплексные соединения обеспечивают адресную доставку противовирусного препарата к очагу поражения ВИЧ-1/2 и подавление специфической вирусной инфекции за счет включения в структуру пептидных фрагментов и в сравнении с прототипами воздействуют на более широкий круг мишеней на ранних этапах взаимодействия вирус - клетка.
Источники информации
1. Международная заявка (WO) 94/24168, МПК С 07 К 17/08, опубл. 27.10.1994.
2. Kolocouris N., Foscolos G.B., Kolocouris A. et al. - Synthesis and antiviral activity evaluation of some new aminoadamantane derivatives. J Med Chem 1994; 37: 2896-2902.
3. Сербин А.В., Стоцкая Л.Л., Кренцель Б.А. и др. Сополимеры на основе фурана и малеинового ангидрида и перспективы их использования в медицине. Сб. Полимеры медицинского назначения. М.: ИНХС 1988; 127-152.
4. Тимофеев Д.И., Перминова Н.Г., Сербин А.В. и др. Мембранотропные соединения и препараты, воздействующие на ранние стадии ВИЧ-инфекции. Антибиотики и химиотерапия 2003; 48: 2: 29-41.
5. Патент США №5880154, А. МПК C 08 F 22/06, опубл. 09.03.1999.
6. Патент РФ №2079491, МПК С 07 С 317/48, опубл. 20.05.1997.
1. Комплексное анти-ВИЧ соединение, включающее полианионную матрицу и химически с ней связанный псевдолиганд для gp120 БИЧ-1/2, отличающееся тем, что псевдолиганд для gpl20 ВИЧ-1/2 содержит пептидный фрагмент корецептора ВИЧ-1/2 CCR5 или CXCR4, а полианионная матрица и связанный с ней пептидный фрагмент корецептора ВИЧ-1/2 CCR5 или CXCR4 имеет следующую общую формулу:
полианионная матрица
2. Комплексное анти-ВИЧ соединение по п.1, отличающееся тем, что пептидный фрагмент корецептора ВИЧ-1/2 CCR5 имеет следующую формулу:
3. Комплексное анти-ВИЧ соединение по п.1, отличающееся тем, что пептидный фрагмент корецептора ВИЧ-1/2 CXCR4 имеет следующую формулу: