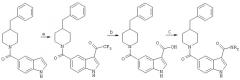
Гетероциклическое соединение
Иллюстрации
Показать всеИзобретение относится к новым ортозамещенным и N-замещенным индолам формулы (α) или (β)
или их фармацевтически приемлемым солям, где Z1-CR4 или N, R4-H, C1-С6алкил, необязательно включающий атом 0 или N, возможно замещенный галогеном, кето, 5-6-членным циклоалифатическим радикалом, возможно содержащим 1-2 атома 0 или N, Z2-CH или CR, где R-C1-С6-алкил, R1-
где X1-CO, или его изостер, m=0, 1, Y - алкил, возможно замещенный, или два Y вместе образуют С2-С3-алкилен, n=0, 1 или 2, Z3-CH или N, Х2-СН, СН2 или их изостер, Ar - одна или две фенильные группы, связанные с X2, где фенил может быть замещен, R2-H, C1-С6алкил, или арил, где каждый арил возможно включает атом 0 или N и может быть замещен. Соединения являются селективными ингибиторами р 38α-киназы. 1 н. и 33 з.п. ф-лы, 5 табл.
Реферат
Данное изобретение относится к соединениям, которые полезны для лечения воспаления и которые содержат пиперазиновые или пиперидиновые группы, связанные с положением 5 или 6 индола, бензимидазола или бензотриазола. Более конкретно, данное изобретение относится к новым ортозамещенным индолам и N-замещенным индолам, а также к способам лечения сердечных и почечных нарушений с использованием этих соединений и их производных.
Уровень техники
Было установлено, что большое число хронических и острых состояний связано с нарушением нормального хода (пертурбацией) воспалительной реакции. В этой реакции участвует большое количество цитокинов, в том числе IL-1, IL-6, IL-8 и TNF. По-видимому, активность этих цитокинов в регулировании воспаления основывается по меньшей мере частично на активации фермента в пути передачи клеточных сигналов, члена семейства МАР-киназ, обычно известного как р38 и альтернативно известного как CSBP и RK. Эта киназа активируется двойным фосфорилированием после стимуляции физико-химическим стрессом, обработкой липополисахаридами или провоспалительными цитокинами, такими как IL-1 и TNF. Таким образом, ингибиторы киназной активности р38 являются полезными противовоспалительными агентами.
В заявках РСТ WO98/28292, WO98/06715, WO98/07425 и WO96/40143, которые включены сюда в качестве ссылок, описана взаимосвязь ингибиторов киназы р38 с различными патологическими состояниями. Как упоминается в этих заявках, ингибиторы киназы р38 полезны для лечения различных заболеваний, связанных с хроническим воспалением. Эти заявки перечисляют ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие относящиеся к артриту состояния, сепсис, септический шок, эндотоксиновый бактериально-токсический шок, сепсис, вызываемый грамотрицательными бактериями, синдром токсического шока, астму, респираторный дистресс-синдром взрослых, удар (сердечную и мозговую недостаточность), реперфузионное повреждение, повреждения ЦНС, такие как невральная травма и ишемия, псориаз, рестеноз, церебральную малярию, хроническое воспалительное заболевание легких, силикоз, легочный саркоз (патологическое разрастание мягких тканей легких), заболевания с резорбций (рассасыванием) костей, такие как остеопороз, реакцию "трансплантат против хозяина", болезнь Крона, язвенный колит, в том числе воспалительное заболевание пищеварительного тракта (IBD) и pyresis*.
В вышеуказанных заявках РСТ описаны соединения, которые являются ингибиторами киназы р38, которые, как указывается, полезны для лечения этих патологических состояний. Эти соединения являются либо имидазолами, либо индолами, замещенными в положении 3 или 4 пиперазиновым или пиперидиновым кольцом, связанным через карбоксамидную связь. Дополнительные соединения, которые являются конъюгатами пиперазинов с индолами, описаны в качестве инсектицидов в WO97/26252, также включенной сюда в качестве ссылки.
Описание изобретения
Данное изобретение относится к соединениям, полезным для лечения воспаления в общем, в том числе специфических состояний, таких как состояния, описанные в разделе "Уровень техники" выше. Было обнаружено, что некоторые новые соединения ингибируют киназу р38, в частности киназу р38 α, и, следовательно, полезны для лечения заболеваний, опосредованных этим ферментом. Соединения данного изобретения являются соединениями формулы:
предпочтительно соединениями формул:
и их фармацевтически приемлемыми солями,
где каждый из Z1 и Z2 обозначает независимо CR4 или N;
каждый R4 обозначает независимо Н или C1-С6алкил или арил, причем каждый указанный алкил и арил необязательно включает один или несколько гетероатомов, выбранных из О, S и N, и необязательно замещен одним или несколькими заместителями, выбранными из галогена, OR, SR, NR2, RCO, COOR, CONR2, OOCR или NROCR, где R обозначает Н или C1-С6алкил, или одним или несколькими CN или =O, или одним или несколькими алифатическими или ароматическими 5- или 6-членными кольцами, необязательно содержащими 1-2 гетероатома;
R1 обозначает
где X1 обозначает СО или его изостер;
m равно 0 или 1;
Y обозначает необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил или два Y, взятые вместе, могут образовывать С2-С3алкиленовый мостик;
n равно 0, 1 или 2;
Z3 обозначает СН или N;
X2 обозначает СН, СН2 или их изостер и
Ar состоит из одной или двух фенильных групп, связанных непосредственно с X2, необязательно замещенных галогеном, нитро, C1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом, CN или CF3 или RCO, COOR, CONR2, NR2, OR, SR, OOCR или NROCR, где R обозначает Н или C1-С6алкил,
или фенилом, который необязательно замещен вышеуказанными заместителями;
R2 обозначает Н или обозначает C1-С6алкил или арил, причем каждый указанный алкил или арил необязательно включает один или несколько гетероатомов, которые представляют собой О, S или N, и необязательно замещен одним или несколькими заместителями, выбранными из галогена, OR, SR, NR2, RCO, COOR, CONR2, OOCR или NROCR, где R обозначает Н или C1-С6алкил, или одним или несколькими CN или =O, или одним или несколькими алифатическими или ароматическими 5- или 6-членными кольцами, необязательно содержащими 1-2 гетероатома;
R3 обозначает Н, галоген, NO2, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, CN, OR, SR, NR2, RCO, COOR, CONR2, OOCR или NROCR, где R обозначает Н или C1-С6алкил.
Таким образом, в одном аспекте, данное изобретение относится к соединениям формул, представленных выше. В других аспектах, данное изобретение относится к способам получения этих соединений, к содержащим их фармацевтическим композициям и к способам лечения воспаления с использованием этих соединений. Данное изобретение относится также к лечению состояний, связанных с сердечной недостаточностью, с использованием соединений данного изобретения и других описанных здесь соединений.
Способы осуществления данного изобретения
Соединения формул 1-4 полезны в различных физиологических применениях, дополнительно описанных ниже. Предпочтительные варианты соединений включают соединения, в которых оба Z1 и Z2 представляют собой СН или в которых Z1 представляет собой CR4, а Z2 представляет собой СН; таким образом, предпочтительные соединения данного изобретения включают производные индола. Особенно предпочтительными заместителями в положении 3 являются заместители, связанные через карбоксамидные связи. Таким образом, некоторыми предпочтительными вариантами R4 является формула RNHCO-, где R представляет собой алкил или замещенный алкил.
Обычно, заместители на азотсодержащей части индольно-го, бензимидазольного или бензотриазольного колец предназначены для повышения растворимости. Таким образом, в типичном случае, заместители R2 и R4 являются полярными или содержат полярные группы.
В других предпочтительных вариантах, заместители соединений данного изобретения, являются заместителями, приведенными ниже.
Для R1:
X1 обозначает СО или его изостер. Таким образом, кроме СО, X1 может являться СН2, SO, SO2 или СНОН. Предпочтительным является СО.
Z3 обозначает СН или N; Z3=СН является предпочтительным.
Обычно m равно 1; однако, в некоторых соединениях данного изобретения m может быть равно 0; таким образом, этот заместитель является пятичленным кольцом.
X2 обозначает СН2, если Ar состоит из одной фенильной группы, или СН, если Ar состоит из двух фенильных групп, или может быть их изостером. Таким образом, для подходящих вариантов Ar, X2 может быть любой из альтернатив, описанных выше для X1.
Фенильные группы, представленные Ar, могут быть необязательно замещены заместителями, включающими C1-С6алкил, галоген, RCO, COOR, CONR2, OR, SR, NR2, OOCR, NROCR, NO2, CN или CF3, где R обозначает Н или С1-С6алкил. Фенильные группы могут быть также замещены дополнительным фенильным остатком, предпочтительно в положении 4. Дополнительный фенильный остаток может быть замещен заместителями, указанными выше. Дополнительный фенил может быть замещен во всех пяти положениях, но предпочтительно менее, предпочтительно в 1-2 положениях, или вообще является незамещенным. Предпочтительные заместители включают С1-С6алкил, OR, NR2 и галоген, в частности, галоген и ОСН3. Заместители могут занимать все пять положений фенильного заместителя, предпочтительно 1-2 положения, или этот фенил может быть незамещенным.
n может быть равно 0, 1 или 2 и предпочтительно равно 0. Однако, когда n равно 1, Y присутствует и может быть алкилом, арилалкилом или арилом, которые могут быть необязательно замещены заместителями, представленными выше для Ar. Когда n равно 2, обе группы Y вместе могут составлять алкиленовый мостик. Предпочтительным является этиленовый мостик. Предпочтительные значения Y, когда n равно 1, включают незамещенный алкил и незамещенный арилалкил.
Для R2:
R2 обозначает предпочтительно Н, но может быть также подходящим заместителем. Такие заместители представляют собой в типичном случае и предпочтительно алкил или замещенный алкил. Алкил или замещенный алкил могут необязательно включать один или несколько гетероатомов, которыми могут быть О, N или S, предпочтительно N или О. Возможные заместители алкильной группы приведены выше; предпочтительные заместители включают OR, где R обозначает Н или C1-С6алкил и =O. Предпочтительными заместителями алкильной группы являются также циклические группы, такие как пиперазин, пиридин, пиперидин, фенил и т.п. Предпочтительно, алкильные группы R2 содержат 0, 1 или 2 заместителя. Предпочтительными значениями R2 являются -(CO)O-Y', где Y' обозначает, например, -(CH2)nNR2, где n является целым числом от 0 до 6, а R имеет указанные выше значения; или Y' обозначает, например, алифатическую или ароматическую циклическую систему, такую как
Дополнительные иллюстративные значения R2 включают в себя никотиноил и его изомеры, акрилоил и заместители общей формулы Y'(CH2)nNH(CH2)nCHOH(CH2)n-, где Y' обозначает характерный для данного типа радикалов заместитель, такой как необязательно замещенный алкил, пиперазинил, пиперидинил, циклогексил, фенил или метокси, и подобные и, где каждое n независимо является целым числом от 1 до 3. Y' является очень вариабельным и может в общем включать любую невлияющую часть молекулы. Дополнительные значения включают Y'NH(CH2)n-CO, где Y' и n имеют указанные выше значения; а также Y'(CH2)nNH(CH2)nCO, где Y' и n имеют указанные выше значения; и Y'(СН2)nСО и Y'(CH2)nNHCO, где Y' и n имеют указанные выше значения; и R2N(CH2)n-, где R представляет собой C1-С6алкил и n является целым числом 1-3.
Для R3:
Хотя R3 может быть Н, включены и другие значения, и они могут быть предпочтительными. Они включают галоген, OR, NR2 и C1-С6алкил, как особенно желательные.
В вариантах, где Z1 или Z2, предпочтительно Z1, представляет собой CR4, где R4 является отличным от Н, предпочтительные значения R4 включают R2N(СН2)n-, где каждый R независимо обозначает C1-С6алкил или Н и n является целым числом 1-6; или Y'(-CH2)n-, где Y' имеет указанные выше значения и n является целым числом 1-6; или Y'NHCO; или R2NCO, где заместители R2, взятые вместе, образуют кольцо, которое может быть замещено, предпочтительно алкилом, арилалкилом и подобными. Когда R4 обозначает Y'(СН2)n-, например, Y' может быть
Дополнительные иллюстративные значения R4 включают 2-, 3- и 4-пиридил, 2-, 3- и 4-пиперидил.
Соединения формул (1)-(4) могут быть получены в форме их фармацевтически приемлемых кислотно-аддитивных солей, включая соли неорганических кислот, таких как хлористоводородная, серная, бромистоводородная или фосфорная кислота, или соли органических кислот, таких как уксусная, винная, янтарная, бензойная, салициловая кислота и подобные. Если присутствует карбоксильная часть, эти соединения могут быть получены в виде соли с фармацевтически приемлемым основанием, в том числе с неорганическими основаниями, такими как гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид аммония и т.п., или соли с органическим основанием, таким как кофеин.
Особенно предпочтительными соединениями данного изобретения являются соединения формул (5) и (6):
В этих соединениях R1 имеет приведенную формулу, где каждый X3 независимо обозначает галоген, C1-С6алкил, OR или NR2, где R обозначает Н или C1-С6алкил, а р является целым числом 0-3. R2, R3 и R4 имеют указанные выше значения.
Предпочтительными являются также подобные соединения, где положения заместителей R3 и показанного заместителя R1 являются обращенными; т.е. R3 находится в положении 5, а R1 находится в положении 6.
Синтез соединений данного изобретения
Соединения данного изобретения могут быть синтезированы различными способами, большинство которых известны в данной области per se. Индольная, бензимидазольная или бензотриазольная части могут быть полезны per se, а заместитель R1 может быть присоединен к ним. R1 может быть полезен как таковой или его синтез может быть завершен, когда пиперазильный или пиперидильный остаток уже связан с индольной, бензимидазольной или бензотриазольной частью. Альтернативно, в частности, в вариантах, в которых R3 обозначает заместитель, отличный от водорода, подходящим образом замещенное производное п-аминобензойной кислоты может быть циклизовано и затем замещено пиперазином или пиперидином.
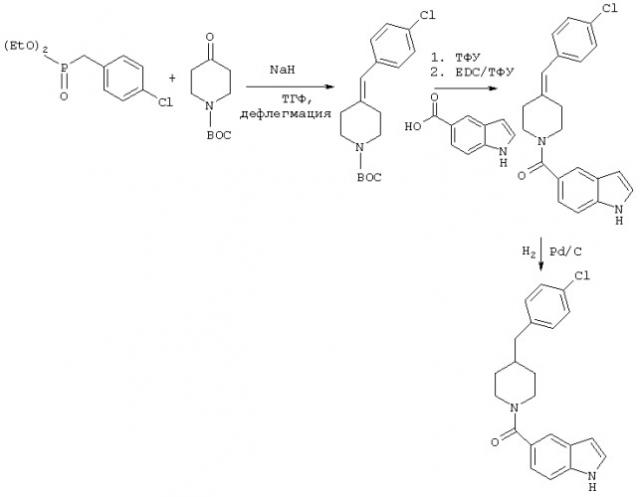
Так, например, как показано на схеме реакций 1, пиперазин, защищенный трет-бутоксикарбонилом (ВОС), связывают с 5-карбоксибензимидазолом (или 5-карбоксииндолом или 5-карбоксибензотриазолом) в реакционной смеси, содержащей связующий агент, такой как EDAC, в инертном апротонном растворителе с получением связанного карбоксамида, который затем освобождают от защитных групп и обрабатывают замещенными или незамещенными бензилгалогенидами или бензоилгалогенидами.
Схема 1
R4 представляет собой, например, 2,6-дифторфенил; 3,4-дифторфенил, 2,3-дифторфенил; 3,5-дифторфенил; 3-хлорфенил; 4-хлорфенил; 4-карбоксиметилфенил; 4-метоксифенил; 4-трифторметилоксифенил; 4-метилфенил; 6-хлорпиперонил; трет-бутилкарбоксифенил; 3-трифторфенил; 2,4-дихлорфенил; 3,4-дихлорфенил; фенил; метоксифенил или п-толуил.
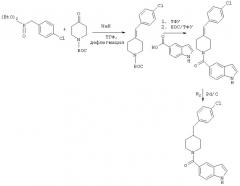
Альтернативно, как показано на схеме реакций 2, 2,5-карбоксилированный бензимидазол (или индол или бензотриазол) взаимодействует с пиперазиновой или пиперидиновой частью, уже замещенной Х2-Ar. В этой реакции пиперазил- или пиперидилпроизводное непосредственно взаимодействует с карбоксилированным бициклом, содержащим гетероатом в присутствии связующего агента, такого как EDAC, в присутствии инертного растворителя, как описано выше.
Схема 2
Для получения замещенного пиперазина, требующегося для схемы 1, пиперазин сначала превращают в ВОС-производное и затем он взаимодействует с ArCHO в присутствии боргидрида при кислых условиях с образованием замещенного пиперазина, как показано на схеме реакций 3.
Схема 3
Альтернатива связывания производного пиперазина или пиперидина с индолом, бензимидазолом или бензотриазолом показана на схеме реакций 4. В этой реакции получают производное пиперазинового или пиперидинового кольца с подходящей уходящей группой, как показано, и затем обрабатывают основанием, таким как NaH, в инертном растворителе с получением целевого конъюгата.
Схема 4
Другая альтернатива показана на схеме реакций 5. По этой методике защищенный пиперидон взаимодействует в присутствии основания, такого как NaH, с подходящим фосфонатным эфиром с образованием защищенного бензиленпиперидина. Затем этот продукт освобождают от защитных групп и подвергают реакции с карбоксилатом индола, бензимидазола или бензотриазола с использованием соответствующего дегидратирующего агента. Затем продукт восстанавливают с получением целевого арилалкилированного производного пиперидина.
Схема 5
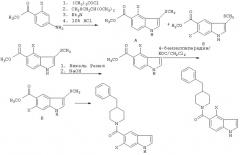
Схема реакций 6 иллюстрирует способ получения соединений данного изобретения, в котором индол замещен в 6-членном кольце. В схеме реакций 6, подходящим образом замещенный анилин взаимодействует с 1-метилмеркаптил-2,2-диалкоксиэтаном в присутствии трет-бутирилхлорида и основания с получением целевого индола. В зависимости от характера замещения исходного анилина, может образоваться более чем один изомер, как показано. Метилмеркаптильную группу, остающуюся на 5-членном кольце, восстанавливают никелем Ренея и обязательную метильную группу, включенную в исходную анилиновую часть, гидролизуют с получением соответствующей карбоновой кислоты. Затем полученная кислота взаимодействует с желаемым производным пиперидина или пиперазина в присутствии связующего агента, такого как EDC.
Схема 6
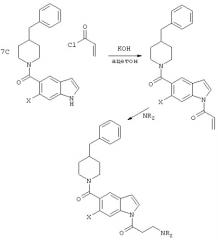
Алкилирование атомов азота на индольном, бензимидазольном или бензотриазольном кольце в соединениях per se проводят общепринятыми способами реакцией галогена заместителя, который должен быть присоединен, в присутствии основания и ацетона, как показано на иллюстративной альтернативной схеме 7.
Схема 7
или
где Х=Н, ОМе, Cl;
каждый R представляет собой Н или алкил;
n является целым числом; или
где Х=Н, ОНС3, Cl, СН3 и т.д.;
каждый R представляет собой Н, алкил, арил
или вместе оба R образуют
Заместители в положении 3 индола могут быть модифицированы с использованием методик, показанных на схеме 8:
Схема 8
где Х=ОМе, Cl, СН3;
каждый R обозначает Н, алкил, арил или вместе группы R обозначают пиперазинил, 4-бензилпиперазинил и подобные.
Для синтеза соединений, в которых n равно 1 --, т.е. в которых пиперидиновое кольцо содержит один дополнительный заместитель, иной, чем заместители, которые являются обязательными в соединениях данного изобретения, 4-замещенный пиперидин сначала защищают при помощи ВОС2О в ТГФ или другом апротонном растворителе и затем подвергают взаимодействию, например, с алкилиодидом, в присутствии смеси S-бутил-литий/TMEDA с использованием, например, эфира в качестве растворителя с получением алкилированного пиперидина. Затем алкилированный пиперидин превращают в соединение данного изобретения удалением защитных групп с последующим образованием карбоксамидной связи с индоильным остатком. Это проиллюстрировано примером ниже.
Для соединений данного изобретения, которые являются индолами, замещенными в положении 3, может быть успешно использована схема реакций, показанная в примере 23. Обычно, карбоксамидный исходный материал обрабатывают трифторуксусным ангидридом с получением трифторацетилсодержащего промежуточного продукта, который также является соединением данного изобретения. При обработке основанием, образуется 3-карбоновая кислота, которая может затем взаимодействовать с подходящим амином с образованием дополнительных соединений данного изобретения.
Введение и применение
Соединения данного изобретения полезны для лечении состояний, связанных с воспалением. Таким образом, соединения формул (1)-(4) или их фармацевтически приемлемые соли используют для приготовления лекарственного средства для профилактики или терапии млекопитающих, в том числе человека, по поводу состояний, характеризующихся избыточным продуцированием цитокинов и/или неприемлемой или нерегулируемой активностью цитокинов на таких клетках, как кардиомиоциты, кардиофибробласты и макрофаги.
Соединения данного изобретения ингибируют продуцирование цитокинов, таких как TNF, IL-1, IL-6 и IL-8, которые являются важными провоспалительными составляющими во многих различных патологических состояниях и синдромах. Таким образом, ингибирование этих цитокинов является выгодным в регулировании и облегчении многих заболеваний. Показано, что соединения данного изобретения ингибируют член семейства МАР-киназ, называемый р38 МАРК (или р38), CSBP или SAPK-2. Показано, что активация этого белка регулирует продуцирование простаноидов, таких как PGE2, и металлопротеиназ матрикса (межклеточного вещества тканей), таких как коллагеназа-3, и сопровождает обострение заболеваний в ответ на стресс, вызванный, например, обработкой липополисахаридами или цитокинами, такими как TNF и IL-1. Следовательно, ингибирование активности р38 позволяет предсказать способность лекарственного средства обеспечивать полезное действие при лечении заболеваний, таких как болезнь коронарных артерий, застойная сердечная недостаточность, кардиомиопатия, миокардит, васкулит, рестеноз, которые встречаются после пластической операции на сосудах сердца, атеросклероз, ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния, рассеянный склероз, острый респираторный дистресс-синдром у взрослых (ARDS), астма, хроническая обструктивная болезнь легких (ХОБЛ), силикоз, легочный саркоз (патологическое разрастание тканей легких), сепсис, септический шок, эндотоксиновый бактериально-токсический шок, синдром токсического шока, сердечная и мозговая недостаточности (удар), которые характеризуются ишемией, и реперфузионное повреждение, в хирургических процедурах, таких как процедуры при трансплантации и отторжениях трансплантата, искусственном (экстракорпоральном) кровообращении, обходном шунтировании кардиолегочной артерии, обходном шунтировании коронарных артерий, повреждениях ЦНС, в том числе открытой и закрытой травме головы, в лечении воспалительных глазных состояний, таких как конъюнктивит и увеит, острой почечной недостаточности, гломерулонефрита, воспалительных заболеваний пищеварительного тракта, таких как болезнь Крона или язвенный колит, реакции "трансплантат против хозяина", заболеваний с резорбцией костей, таких как остеопороз, диабета типа II, pyresis*, псориаза, кахексии, вирусных заболеваний, таких как вызываемые ВИЧ, CMV, вирусом герпеса, и церебральной малярии, опухолевых метастазов и острой боли, такой как боль, сопровождающая зубную хирургию, дисменорею и постортопедическую хирургию.
В последние несколько лет было показано, что р38 содержит группу МАР-киназ, обозначенных р38α, р38β, р38γ и р38δ. Jiang, Y. et al. J. Biol. Chem (1996) 271:17920-17926 первые описали характеристику р38β как белка из 372 аминокислот, близкородственного р38α. Kumar, S. et al. Biochem. Biophys. Res. Comm.(1997) 235:533-538 и Stein, В. et al. J. Biol. Chem. (1997) 272:19509-19517 сообщили о второй изоформе р38β, р38β2, содержащей 364 аминокислоты с 73% идентичностью к р38α. Все эти сообщения дают доказательства того, что р38β активируется провоспалительными цитокинами и стрессовыми условиями окружающей среды, хотя вторая описанная изоформа р38β, р38β2, по-видимому, является преимущественно экспрессированной в ЦНС, сердечную и скелетную мышцы в сравнении с более распространенной экспрессией в ткани р38α. Кроме того, наблюдали, что активированный фактор транскрипции 2 (ATF-2) является лучшим субстратом для р38β2, чем для р38α, что предполагает, что с этими формами могут быть связаны разные механизмы действия. Физиологическая роль p38β1 была поставлена под вопрос последними в двух последних сообщениях, так как киназа р38β1 не могла быть обнаружена в ткани человека и не проявляла поддающейся определению киназной активности с субстратами р38α.
Об идентификации р38γ было сообщено в Li, Z. et al. Biochem. Biophys. Res. Comm. (1996) 228:334-340 и об идентификации р38δ было сообщено в Wang, X., et ai., J. Biol. Chem. (1997) 272:23668-23674 и Kumar, S. et al. Biochem. Biophys. Res. Comm. (1997) 235:533-538. Эти данные предполагают, что эти две изоформы р38 (γ и δ) представляют уникальную субпопуляцию семейства МАРК на основе распределений их экспрессии в тканях, утилизации субстрата, ответной реакции на прямые и опосредованные стимулы и чувствительности к ингибиторам киназ.
Различные результаты в отношении ответной реакции на лекарственные средства, нацеленные на семейство р38, как среди р38α, так и для предполагаемых p38β1 или р38β2 или для обоих, были опубликованы в Jiang, Kumar and Stein, указанных выше, а также в Eyers, P.A. et al. Chem. and Biol. (1995) 5:321-328. В еще одной статье Wang, Y. et al. J. Biol. Chem. (1998) 273:2161-2168 высказывается предположение о значении таких дифференциальных эффектов. Как указывается в Wang, ряд стимулов, таких как инфаркт миокарда, гипертензия, клапанные заболевания, вирусный миокардит и кардиомиопатия с дилатацией сердца, приводят к увеличению рабочей нагрузки сердца и повышенному механическому стрессу в отношении кардиомиоцитов. Говорится, что это приводит к адаптивной гипертрофической реакции, которая, если ее не регулировать, имеет несомненно негативные последствия. Wang цитирует прежние исследования, которые показали, что в подвергнутых реперфузии ишемических сердцах активности р38 МАРК повышаются в связи с гипертрофией и запрограммированным некрозом клеток. В указанной статье Wang показывает, что активация активности р38β ведет к гипертрофии, тогда как активация активности р38α ведет к апоптозу миоцитов. Таким образом, избирательное ингибирование активности p38α в сравнении с активностью p38β будет выгодным для лечения состояний, связанных с сердечной недостаточностью. Эти состояния включают застойную сердечную недостаточность, кардиомиопатию, миокардит, васкулит, рестеноз сосудов, клапанное заболевание, состояния, связанные с искусственным (экстракорпоральным) кровообращением, шунтированием коронарных артерий, трансплантатами и васкулярными трансплантатами.
Кроме того, с учетом того, что α-изоформа является токсичной в других типах мышечных клеток, α-селективные ингибиторы были бы полезными для состояний, связанных с кахексией, приписываемой TNF, или других состояний, таких как рак, инфекция или аутоиммунное заболевание.
Соединения, описанные здесь, которые селективно ингибируют активность изоформы p38α, полезны для лечения состояний, связанных с активацией р38α, в частности, состояний, связанных с гипертрофией сердца, ишемией или другим стрессом окружающей среды, таким как окислительное повреждение, гиперосмолярность или другие агенты или факторы, которые активируют киназу р38α, или сердечной недостаточности, например застойной сердечной недостаточности, кардиомиопатии и миокардита.
Соединения, которые проявляют эту активность, являются соединениями формулы
где R1, R2, R3, Z1 и Z2 имеют указанные в п.1 значения. Способ введения и формулирования описанных здесь соединений будет зависеть от природы состояния, тяжести состояния, конкретного проходящего лечение субъекта и оценки лечащего врача; формулирование будет зависеть от способа введения. Так как эти соединения являются небольшими молекулами, их удобно вводить пероральным путем, формулируя их с подходящими фармацевтическими наполнителями, пригодными для получения таблеток, капсул, сиропов и т.п. Подходящие препаративные формы для перорального введения могут также включать незначительное количество компонентов, таких как буферы, улучшающие вкус и запах агенты и т.п. Обычно количество активного ингредиента в этих препаративных формах находится в диапазоне 5-95% от количества всей композиции, но допускается широкое варьирование в зависимости от носителя. Подходящие носители включают сахарозу, пектин, стеарат магния, лактозу, арахисовое масло, оливковое масло, воду и т.п.
Соединения, применимые в данном изобретении, могут также вводиться в качестве суппозиториев или других трансмукозных носителей. В типичном случае, такие препаративные формы будут включать наполнители, которые облегчают прохождение соединения через слизистую оболочку, такие как фармацевтически приемлемые детергенты.
Эти соединения могут также вводиться местно, для локальных состояний, таких как псориаз, или в виде препаративных форм, предназначенных для проникновения через кожу. Такие композиции включают лосьоны, кремы, мази и т.п., которые могут быть приготовлены известными способами.
Эти соединения могут также вводиться инъекцией, в том числе внутривенной, внутримышечной, подкожной или внутрибрюшинной инъекции. Типичными препаративными формами для такого применения являются жидкие композиции в изотонических носителях, таких как раствор Хенка или раствор Рингера.
Альтернативные препаративные формы включают назальные спреи, липосомные композиции, композиции замедленного высвобождения и т.п., которые известны в данной области.
Может быть использована любая подходящая препаративная форма. Обзор известных в данной области композиций можно найти в Remington's Pharmaceutical Sciences, latest edition. Mack Publishing Company, Easton, PA. Ссылка на этот справочник является обычной в данной области.
Дозы соединений данного изобретения будут зависеть от ряда факторов, которые будут меняться от пациента к пациенту. Однако считается, что обычная суточная пероральная доза будет составлять 0,001-100 мг/кг от общего веса тела, предпочтительно от 0,01 до 50 мг/кг и более предпочтительно около 0,01 мг/кг-10 мг/кг. Схема приема лекарственного средства будет, однако, варьироваться в зависимости от состояний, которые должны быть подвергнуты лечению, и оценки практикующего врача.
Как упоминалось выше, хотя соединения данного изобретения могут быть использованы для человека, они также пригодны для применения в ветеринарии для лечения животных.
Следующие ниже примеры предназначены для иллюстрации, но не для ограничения данного изобретения.
Примеры 1-3 иллюстрируют схему реакции 1:
Пример 1
Получение 4-ВОС-пиперазинилбензимидазол-5-карбоксамида
Вензимидазол-5-карбоновую кислоту (3,25 г, 20 ммоль) подвергали взаимодействию с 2,52 г (20 ммоль) диизопропил-карбодиимида в сухом ДМФ при комнатной температуре в течение 15 минут. К этой реакционной смеси добавляли 3,75 г (20 ммоль) трет-бутил-1-пиперазинкарбоксилата и смесь перемешивали в течение 18 часов. Смесь выливали в воду и экстрагировали метиленхлоридом (3×100 мл). Органические экстракты промывали опять водой, солевым раствором и сушили над MgSO4. После удаления растворителя в вакууме остаток хроматографировали на колонке силикагеля с элюированием смесью CHCl3-метанол (градиент, метанол 0-5%) с получением 5,69 г (86%) продукта. 1Н-ЯМР (ДМСО-d6): с 8,3 (1Н), м 7,7-7,6 (2Н), м 7,2-7,3 (1Н), м 3,6-3,3 (8Н), с 1,4 (9Н); MS (ESI) m/e 330 (М+).
Пример 2
Получение пиперазинилбензимидазол-5-карбоксамида
N-ВОС-пиперазинилбензимидазол-5-карбоксамид (5,6 г) перемешивали в 20 мл смеси 4 М HCl-диоксан в течение 1 часа. Диоксан удаляли при пониженном давлении с получением гидрохлоридной соли с количественным выходом. Ее использовали для алкилирований без какой-либо дополнительной очистки.
Пример 3
Получение 4-(2,6-дифторбензил)-пиперазинилбензимидазол-5-карбоксамида
А. Пиперазинилбензимидазол-5-карбоксамид (0,186 г, 0,5 ммоль) помещали в 5 мл ДМФ и добавляли 0,101 г (1 ммоль) триэтиламина и перемешивали в течение 15 минут при комнатной температуре. К этой реакционной смеси добавляли 0,104 г 2,6-дифторбензилбромида и смесь перемешивали в течение 20 часов. Смесь выливали в воду и экстрагировали метиленхлоридом (3×50 мл). Объединенный экстракт дополнительно промывали солевым раствором, водой и сушили над MgSO4. Растворитель удаляли в вакууме и остаток хроматографировали на колонке силикагеля с элюированием смесью хлороформ-метанол (0-5% метанол, градиент). Упаривание целевой фракции давало 48,9 мг целевого продукта; MS(ESI) m/e 356 (М+).
В. С использованием методики, описанной в части А, получали следующие соединения:
| Получение | Заменой 2,6-дифторбензилбромида |
| 4-(2,3-дифторбензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 356 (М+) | 2,3-дифторбензилбромидом |
| 4-(3,5-дифторбензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 356 (М+) | 3,5-дифторбензилбромидом |
| 4-(3-хлорбензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 354 (М+) | 3-хлорбензилбромидом |
| 4-(4-карбоксиметилбензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 378 (М+) | метил-4-(бромметил)бензоатом |
| 4-(4-метоксибензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 350 (M+) | 4-метоксибензилхлоридом |
| 4-(4-трифторметоксибензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 404 (М+) | 4-(4-трифторметокси)-бензилбромидом |
| 4-(4-метилбензил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 334 (М+) | 4-метилбензилбромидом |
| 4-(2,4-дихлорбензоил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 403 (M+) | 2,4-дихлорбензоилхлоридом |
| 4-(3,4-дихлорбензоил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 403 (M+) | 3,4-дихлорбензоилхлоридом |
| 4-[транс-3-(трифторметил)циннамоил]пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 428 (М+) | транс-3-(трифторметил)циннамоил-хлоридом |
| 4-(4-хлорбензоил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 369 (М+) | 4-хлорбензоилхлоридом |
| 4-бензоилпиперазинбензимидазол-5-карбоксамидаMS(ESI) m/e 334 (М+) | бензоилхлоридом |
| 4-(2-трифторметилбензоил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 402 (М+) | 2-(трифторметил)бензоил хлоридом |
| 4-(4-метоксибензоил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 364 (M+) | 4-метоксибензоилхлоридом |
Пример 4 иллюстрирует схему реакций 2:
Пример 4
Получение 4-(3,4-дихлорфенил)пиперазинилбензимидазол5-карбоксамида
А. Бензимидазол-5-карбоновую кислоту (1 ммоль, 162 мг) растворяли в 5 мл сухого ДМФ и подвергали взаимодействию с гидрохлоридом 1-этил-3-(3-диметиламинопропил)карбодиимида в течение 15 минут. Добавляли 1-(3,4-дихлорфенил)пиперазин, 1 ммоль (231 мг) с последующим добавлением 10 мг DMAP. Эту смесь перемешивали в течение 20 часов при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали метиленхлоридом (3×50 мл). Экстракты объединяли, промывали солевым раствором, водой и сушили над MgSO4. После выпаривания растворителя остаток хроматографировали на колонке силикагеля со смесью хлороформ-метанол (0-5% метанол, градиент) в качестве элюента. Упаривание желательных фракций давало 150 мг (40%) указанного в заголовке соединения; MS(ESI) m/e 375 (M+).
В. С использованием методики части А получали следующие соединения:
| Получение | Заменой 1-(3,4-дихлорфенил)пиперазина: |
| 4-(4-хлорбензгидрил)пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 431 (М+) | 1-(4-хлорбензгидрил)пиперазином |
| 4-транс-1-циннамилпиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 346 (М+) | транс-1-циннамилпиперазином |
| 4-[бис(4-фторфенил)метил]пиперазинилбензимидазол-5-карбоксамидаMS(ESI) m/e 432 (М+) | 1-бис(4-фторфенил)метилпиперазином |
| 4-(4-хлорбе |