Штамм бактерий b. subtilis - продуцент сурфактина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения биогенного поверхностно-активного вещества сурфактина, обладающего множественной биологической активностью. Штамм Bacillus subtilis 0017 выделен из образца типичного чернозема Республики Башкортостан и поддерживается в коллекции микроорганизмов Института биологии Уфимского научного центра РАН. Регистрационный номер в коллекции - 0017. Штамм превосходит по уровню накопления сурфактина известные природные штаммы. 1 табл., 4 ил.
Реферат
Изобретение относится к области биотехнологии и может быть использовано для получения биогенного поверхностно-активного вещества сурфактина, обладающего множественной биологической активностью. Его практическое применение возможно в нефтедобывающей промышленности для увеличения извлечения нефти из нефтеносных пластов [1], при очистке емкостей от остатков нефти, очистки загрязненной углеводородами почвы, для стабилизации и дестабилизации эмульсий [2, 3], а также в качестве биологически активного компонента фармпрепаратов.
Это вещество, согласно описанию Kakinuma et al. [4, 5], представляет собой смесь циклических гексапептидов, замкнутых в кольцо через β-гидрокси жирную кислоту с углеродной цепью из 13-15 атомов:
Сурфактин обладает множественной биологической активностью. Он способен лизировать эритроциты [6] и протопласты бактерий [7]. Кроме того, сурфактин ингибирует реакцию фибриноген-тромбин, замедляя образование фибрина [8]. Это свойство определяет его как возможный компонент при создании противокоагулирующих средств для профилактики тромбозов и для предотвращения болезней типа инфаркта миокарда, легочной эмболии и т.д.
Сурфактин проявляет антихолестеразную активность, снижая уровень холестерина в плазме и печени [9], обладает противоопухолевой [10], фунгицидной и антибиотической активностями [11]. Данный липопетид проявляет бактериостатические свойства даже при концентрациях 5-10 ppm.
Сурфактин является сильным поверхностно-активным соединением, при концентрации 0,05% поверхностное натяжение воды снижается с 72 мН/м до 27 мН/м [8].
Множественность полезных физико-химических, биологических и физиологических свойств этого вещества свидетельствует о том, что оно может широко использоваться в фармацевтике, технических и природоохранных областях.
Arima, К et al. [8] описал метод получения сурфактина, основанный на использовании природных штаммов бактерий B.subtilis ATCC 21331 или АТСС 21332. Однако эти штаммы обеспечивали выход не более 0.05-0.1 г/л сырого продукта и 0.04-0.05 г/л очищенного вещества, что экономически оказалось невыгодно.
Для повышения выхода сурфактина в процессах ферментации были предложены решения, основанные на подборе состава питательных сред, изменении технологических схем или на получении мутантных штаммов уже известного продуцента B.subtilis ATCC 21332.
Путем добавления в базовую питательную среду гидролизата торфа Sheppard J. and Mulligan С. [12] добились выхода 0,16 г/л сурфактина, используя известный продуцент.
Cooper D.G. et al., [13] предложили технологию получения сурфактина с помощью известного штамма B.subtilis ATCC 21332, основанную на непрерывном отборе пены из ферментера. Реализация данного решения позволила достичь выхода сурфактина 0,7-0,8 г/л.
Mulligan et al. [14] путем ультрафиолетового облучения известного продуцента B.subtilis ATCC 21332 получили мутант B.subtilis ATCC 53813, в 3,4 раза превосходящий исходный по продуктивности.
Carrera et al. [15, 16], используя в качестве мутагена N-метил-N'-нитро-N-нитрозогуанидин, получили из известного B.subtilis ATCC 21332 новый мутант B.subtilis ATCC 55033, обеспечивающий выход от 1,2 до 2,0 г/л сурфактина с чистотой 99%.
Ohno et al. [17] с помощью рекомбинантной плазмиды рС112 получили штамм Bacillus subtilis MI 113, превосходящий по продуктивности дикий штамм в 1,5 раза. Однако накопление сурфактина при глубинном культивировании не превышало 0,4 г/л, но при твердофазной ферментации этого рекомбинантного штамма на среде с коагулятом сои "Okara" в качестве субстрата продуктивность возросла до 2,0 г/кг сырого веса среды [18].
Основным недостатком известных рекомбинантных штаммов является недостаточная стабильность плазмид, несущих ген, регулирующий биосинтез сурфактина. К другим недостаткам следует отнести законодательные ограничения на применение генетически модифицированных микроорганизмов в природных условиях и фармацевтике, существующие в большинстве развитых стран.
В научных публикациях имеются данные о природных ("диких") штаммах B.subtilis S 499 (продуктивность 110 мг/л) [19] и B.subtilis RB 14 (продуктивность 250 мг/л) [17], однако, их недостатком является сопродукция антибиотика итурина, который крайне сложно отделить от целевого продукта.
Цель настоящего изобретения - получение природного, генетически неизмененного штамма почвенных бактерий, превосходящего по уровню накопления сурфактина известные природные ("дикие") штаммы.
Поставленная цель достигается предлагаемым штаммом Bacillus subtilis ИБ-17, выделенным из образца почвы типичного чернозема, отобранного на территории республики Башкортостан (Российская Федерация). Штамм поддерживается в Коллекции микроорганизмов лаборатории прикладной микробиологии Института биологии Уфимского научного центра РАН. Номер штамма в коллекции 0017 (ИБ-17).
Культурально-морфологические признаки. Спорообразующие, грамотрицательные, палочковидные подвижные клетки размером 0,9-1,7 на 5,6-9,9 мкм. Спорангий не раздувают, расположены субцентрально. На среде с мясопептонным агаром на 1 сутки образует колонии: овальные, диаметром 1,0-1,5 мм, плоские, непрозрачные, блестящие, кремового цвета. На седьмые сутки роста около 80% колоний разрастаются в размерах до 4-8 мм и приобретают неправильную форму за счет вторичного веерообразного разрастания исходной колонии. У колонии края приобретают ярко выраженный лопастной вид с незначительным бортиком по краям, где сохраняется исходный цвет и непрозрачность. Тогда как сама колония становится полупрозрачной, структура ее не однородная, в центре крупнозернистая с включением не прозрачных глыбок.
Физиологические признаки. Отношение к кислороду - строгий аэроб. Светонезависим. Хорошо растет в интервале температур от 30 до 45°С. Минимальная температура 10°С, максимальная 50°С. Растет в интервале рН от 4,5 до 9,0, оптимально - при рН 7,5. Галотолерантность характеризуется ростом при 7% NaCl. При сбраживании сахаров газа не образует. Гидролизует крахмал. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) положительная. Индол не образует. Дезаминирование фенилаланина не происходит. Разлагает тирозин и использует цитрат. Проявляет гемолитическую активность - β гемолиз, кислород независимый.
По совокупности физиолого-биохимических признаков штамм принадлежит к семейству Bacillaceae и относится к роду Bacillus, виду subtilis [20].
Состав среды для культивирования, мас.%: крахмал - 1; пептон - 0,5; дрожжевой экстракт - 0,3; кукурузный экстракт - 0,3; К2HPO4 - 0,2; (NH4)2SO4 - 0,2; вода водопроводная - до 100. Штамм хранится на косяках картофельного агара или в лиофильно высушенном состоянии.
Образование заявляемым штаммом поверхностно-активного вещества - сурфактина характеризуется следующими примерами.
Пример 1. Поверхностно-активные свойства. Предлагаемый штамм Bacillus subtilis ИБ-17 выращивают в колбах объемом 250 мл со 100 мл питательной среды на качалке УВМТ-12 при 37°С и n=160 мин-1 в жидкой питательной среде следующего состава, г/л дистиллированной воды:
| Картофельный крахмал | 10,0 |
| Кукурузный экстракт | 1,5 |
| (NH4)2HPO4 | 2,0 |
| К2HPO4 | 2,0 |
| (NH4)2SO4 | 2,0 |
| СаСО3 | 5,0 |
| начальное рН | 8,2 |
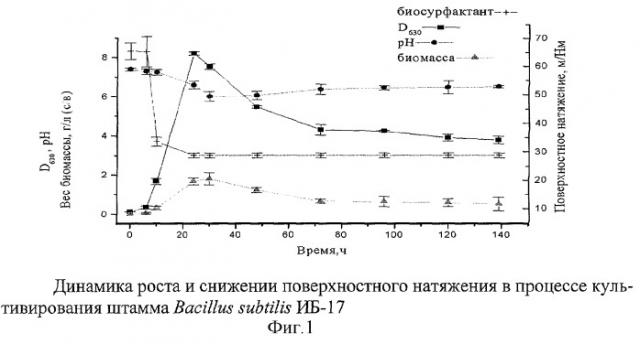
Через 8, 10, 24, 30, 48, 72, 96, 120 часов от начала культивирования отбирают пробы для определения биомассы (г/л), оптической плотности (D630), рН. Поверхностное натяжение определяют методом отрыва кольца после отделения биомассы центрифугированием при n=4000 мин-1. Результаты, свидетельствующие о динамике роста и снижении поверхностного натяжения в процессе культивирования штамма Bacillus subtilis ИБ-17, представлены на рисунке 1. Снижение поверхностного натяжения с 72 мН/м до 27 мН/м характерно для сурфактинов.
Пример 2. Биологическая активность. Предлагаемый штамм Bacillus subtilis ИБ-17 выращивают как в примере 1 в течение 72 ч. Биомассу отделяют центрифугированием при n=4000 мин-1. Супернатант закисляют 2N HCl до рН 2,0 и оставляют на ночь при +4°С для формирования осадка. Осадок отделяют центрифугированием при n=4000 мин-1. Осадок трижды экстрагируют 10 мл метанола при комнатной температуре в течение 1,5 ч. Экстракты объединяют, добавляют 1 г активированного угля, встряхивают 15 мин на ротационном шейкере. Осветленный центрифугированием экстракт выпаривают в тигле при 60°С досуха и перерастворяют в 10 мл дистиллированной воды. Полученный раствор вносят в лунки чашек Петри агара с эритроцитами и сусло-агара, предварительно инокулированного пекарскими дрожжами Saccharomyces cervisiae. Чашки с эритроцитами выдерживают в течение 12 ч при температуре 10°С, затем 6 ч при комнатной температуре и определяют зоны гемолиза. Чашки с пекарскими дрожжами инкубируют в термостате при 28°С в течение 48 ч и измеряют зоны ингибирования роста дрожжей вокруг лунок. Результаты представляют в таблице:
| Концентрация вещества, мкг/мл | Диаметр зоны гемолиза, мм | Диаметр зоны ингибирования роста дрожжей, мм |
| 200 | 7,6±0,2 | 0,0 |
| 400 | 9,0±0,2 | 0,0 |
| 1000 | 11,2±0,3 | 0,0 |
Из литературных источников известно, что гемолиз эритроцитов одно из основных свойств сурфактинов, в то же время сурфактин не ингибирует рост дрожжевых клеток. Отсутствие ингибирования роста Saccharomyces cervisiae в данном случае свидетельствует об отсутствии сопродукции итурина [21].
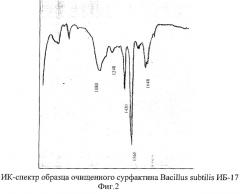
Пример 3. ИК-спектроскопия. Культуру выращивают и выделяют сурфактин как в примере 2. Раствор сурфактина в дистиллированной воде высушивают лиофильно и полученный порошок диспергируют в вазелиновом масле и подвергают анализу на инфракрасном спектрофотометре Specord (Carl Zeiss Jena, ГДР) М-80. Данные спектра поглощения (фиг.2) свидетельствуют о наличии следующих полос: пептидных связей (1648 см-1); аминогрупп (1568 см-1), а также карбоксильных групп (1420 см-1) и сложноэфирных связей (1248 см-1, 1080 см-1), что характерно для молекул липопептидов.
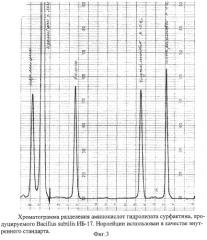
Пример 4. Аминокислотный анализ. Культуру выращивают и выделяют вещество как в примере 2 и высушивают как в примере 3. Навеску сухого вещества (около 10 мг) помещают в стеклянную ампулу, добавляют 10 мл 6N HCl, запаивают и выдерживают в течение 24 часов при 110°С для гидролиза. Гидролизат анализируют с помощью Автоматического анализатора аминокислот ААА 339 М (Mikrotechna, Чехия). Данные аминокислотного анализа (фиг.3) свидетельствуют о наличии четырех доминирующих аминокислот: Аспарагиновой кислоты, Глутаминовой кислоты, Валина и Лейцина в соотношении 1:1:1:4, что свойственно сурфактину.
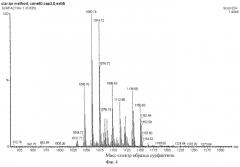
Пример 5. Хромато-масс-спектрометрия. Культуру Bacillus subtilis ИБ-17 выращивают как в примере 1. Биомассу отделяют центрифугированием при n=4000 мин-1. Супернатант закисляют 2N HCl до рН 2,0 и оставляют на ночь при +4°С для формирования осадка. Осадок отделяют центрифугированием при n=4000 мин-1. Осадок трижды экстрагируют 10 мл метанола при комнатной температуре в течение 1,5 ч. Экстракты объединяют, добавляют 1 г активированного угля, встряхивают 15 мин на ротационном шейкере. Осветленный центрифугированием экстракт выпаривают в тигле при 60°С досуха. Навеску полученного вещества перерастворяют в метаноле до концентрации 3,0 мг/мл и анализируют на масс-спектрометре, используя масс-детектор "Waters Micromass ZQ 2000" с электроспрей ионизацией (ESI). Условия детектирования положительно заряженных ионов следующие:
напряжение на капилляре - 3,0 кВ;
напряжение на конусе - 60 В,
напряжение на экстракторе - 5 В;
температура испарения - 150°С;
температура источника - 70°С;
расход азота при испарении - 150 л/ч;
расход азота на конусе - 50 л/ч.
В результате анализа вещества получают спектр заряженных частиц, характеризующийся кластером интенсивных пиков в интервале 1032-1150 m/z, характерным для изоформ сурфактина (фиг.4).
Пример 6. Продуктивность штамма. Предлагаемый штамм Bacillus subtilis ИБ-17 выращивают как в примере 1 в течение 72 ч и отделяют биомассу центрифугированием. Супернатант закисляют 2N HCl до рН 2,0 и оставляют на ночь при +4°С для формирования осадка. Осадок отделяют центрифугированием при n=4000 мин-1. Осадок трижды экстрагируют 10 мл метанола при комнатной температуре в течение 1,5 ч. Экстракты объединяют, добавляют 1 г активированного угля, встряхивают 15 мин на ротационном шейкере, фильтруют через капроновый мембранный фильтр с диаметром пор 0,2 мкм. Фильтрат анализируют методом высокоэффективной жидкостной хроматографии на приборе ГПЦ (Чехия) с ультрафиолетовым детектором при 205 нм. Условия разделения: подвижная фаза - ацетонитрил: 1%-ный раствор уксусной кислоты - 4:1; скорость потока 1,5 мл/мин; колонка Zorbax ODS (4,6 мм×25 см).
Содержание сурфактина в культуральной жидкости рассчитывают исходя из калибровочной кривой, построенной на основе растворов коммерческого препарата сурфактина (Sigma-Aldrich Co) чистотой 98,0%.
Выход сурфактина при данных условиях культивирования Bacillus subtilis ИБ-17 составляет 1798±87 мг/л.
Источники, принятые во внимание
1. Schaller К. D., Bala G. A. Characterization of Surfactin from Bacillus subtilis for Application as an Agent for Enhanced Oil Recovery // 25-th Symposium on Biotechnology for Fuels and Chemicals. Breckenridge, Colorado, May 4-7 2003. PP.5-17. http://www.nrel.gov/biotech_symposium/docs/abst5-17.doc.
2. Gitnik D., Pinas W. Perspectives of microbiol surfactants. // Biochem. Soc. Transakt. - 1987. - V.15, №6. - P.19S-35S.
3. Елисеев С.А, Вильданова-Марцишина Р.И., Шульга А.П., Шабо З.В., Туровский А.А. Нефтеотмывающий биоэмульгатор, образуемый Bacillus species. // Микробиологический журнал. - 1991. - Т.53, №6. - С.61-66.
4. Kakinuma A., Hori M., Isono M., Tamura G., Arima К. Determination of amino acid sequence in surfactin, a crystalline peptidolipid surfactant produced by Bacillus subtilis. // Agric. Biol. Chem., - 1969. - V.33, - P.971-972.
5. Kakinuma A., Sugino H., Isono M., Tamura G., Arima K. Determination of fatty acid in surfactin and elucidation of the total structure of surfactin. // Agric. Biol. Chem., - 1969. - V.33, - P.973-976.
6. Bernheimer A.W., Avigad L.S. Nature and properties of a cytolytic agent produced by Bacillus subtilis // J.Gen. Microbiol. - 1970. V 61, - P.361-369.
7. Hosono K, Suzuki H. Acylpeptides, the inhibitors of cyclic adenosine 3',5'-monophosphate phosphodiesterase. III. Inhibition of cyclic AMP phosphodiesterase. //J Antibiot (Tokyo). - 1983. V.36, - P.679-683.
8. Arima K., Kakinuma A., Tamura G. Surfactin, a crystalline peptidolipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. // Biochem. Biophys. Res. Commun. - 1968. V.31, - p.488-494.
9. Imai Y., Sugino H., Takeshi, Takinuma A. Hypocholesterolemic effect of surfactin, a novel bacterial peptide lipid. //Takeda Kenkyusho Ho - 1971. - V.30, - P.728-734.
10. Kameda Y., Matsui К., Hisato К., Yamada Т., Sagai H. Antitumor activity of Bacillus natto. III. Isolation and characterization of a cytilytic substance on Ehrlich ascites carcinoma cells in the culture medium of Bacillus natto KMD 1126. //Chem. Pharm. Bull. - 1972. - V.20, - P.1551-1553.
11. Tsukagoshi N., Tamura G., Arima K. A novel protoplast-bursting factor (surfactin) obtaned from Bacilus subtilis IAM 1213. I. The effects of surfactin on Bacillus megaterium KM. // Biochim. Biophys. Acta. - 1970. - V.196, - P.204-210.
12. Sheppard J.D., Mulligan C.C.N., The production of surfactin by Bacillus subtilis grown on peat hydrolysate // Appl. Microbiol. Biotechnol., - 1987. - V.27 - Р.110-116.
13. Cooper D.G., MacDonald C.R., Duff S.F.B., Kosaric N. Enhanced production of surfactin from Bacillus subtilis by continuous product removal and metal cation additions. // Appl. Environ. Microbiol. - 1981. V.42 - P.408-412.
14. Pat. 5037758 USA, C12N 001/20 Enhanced production of biosurfactant through the use of a mutated В subtilis strain. /Mulligan C.N., Chow T.Y./ Publ. August 6, 1991.
15. Pat. 5227294 USA, C12P 021/02; C12P 001/125 Method of producing surfactin with the use of mutant of Bacillus subtilis. / Carrera P., Cosmina P., Grandi G./ Publ. July 13, 1993.
16. Pat. 5264363 USA, C12R 001/125; C12P 021/04 Mutant of Bacillus subtilis. / Carrera P., Cosmina P., Grandi G./ Publ. November 23, 1993.
17. Ohno A., Takashi A., Shoda M. Production of a lipopeptide antibiotic surfactin with recombinant Bacillus subtilis. // Biotechnol. Lett. - 1992. V.14, - P.1165-1168.
18. Ohno A., Ano Т., Shoda M. Production of a lipopeptide antibiotic surfactin with recombinant Bacillus subtilis in solid state fermentation. // Biotechnol. Bioeng. - 1995. V.47, - P.209-214.
19. Sandrin С, Peypoux F, Michel G. Coproduction of surfactin and iturin A, lipopeptides with surfactant and antifungal properties, by Bacillus subtilis.// Biotechnol Appl Biochem. - 1990. V.12, No4, - P.370-375.
20. Bergey's manual of systematic bacteriology/ - Baltimore: Willliams & Wilkins Co., 1986, - V.2, - P.1104-1141.
21. Feignier С., Besson F., Geoges M. Studies on lipopeptide biosynthesis by Bacillus subtilis: Isolation and characterization of iturin-, surfactin+ mutants //FEMS Microbiol. Letters, 1995, V.127, - P.11-15.
Штамм бактерий Bacillus subtilis №0017 (Коллекция микроорганизмов Института биологии УНЦ РАН) - продуцент сурфактина.