Способ регенерации одноразовых нуклеотидных биочипов, используемых в анализах с флуоресцентными метками
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в медицине. Отработанный одноразовый нуклеотидный биочип, используемый в анализах с флуоресцентными метками, обрабатывают раствором, содержащим денатурирующий агент, и промывают водой. Контроль восстановленного биочипа осуществляют с помощью ридера при экспозиции, превышающей рабочую, причем регенерацию биочипа считают завершенной, если в его рабочих ячейках отсутствует сигнал метки, а реперные (контрольные) маркеры остаются без изменений. Применение изобретения позволяет повысить экономичность анализов, предусматривающих использование одноразовых нуклеотидных биочипов. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области молекулярной биологии, биотехнологии, а также медицинской и санитарной микробиологии и вирусологии и представляет собой способ восстановления отработанных биочипов (микрочипов, несущих биологическую информацию), позволяющий привести их к исходному состоянию для повторного (многократного) использования в скрининг-методах.
Изобретение может быть широко использовано в медицинской практике для диагностики заболеваний, вызванных различными инфекционньми агентами, для осуществления контроля за ходом лечебного процесса, а также для проведения санитарно-экологического мониторинга окружающей природной среды и типирования объектов микробиологического, вирусологического и другого происхождения.
Биочип представляет собой подобие микросетки (матрицы), в узлах которой расположены не связанные друг с другом ячейки, располагающиеся на одинаковом расстоянии друг от друга, каждая из которых несет химически прикрепленный (иммобилизованный) одноцепочечный олиго(поли)нуклеотид; последний может быть иммобилизован на полиакриламидной матрице (трехмерная ячейка) или стекле или иной полимерной поверхности (двумерная ячейка). Таким образом, каждая ячейка трехмерной матрицы - это, в конечном счете, 5%-ный полиакриламидный гель, приготовленный путем фотополимеризации, с иммобилизованным на в нем (в объеме геля) олиго(поли)нуклеотидом. В каждой ячейке содержится только один олиго(поли)нуклеотид определенного строения, нуклеотидная последовательность которого соответствует некоторой нуклеотидной последовательности природного инфекционного агента или последовательности его мутантного аналога (обычно с одной точечной мутацией) [1].
В основу работы биочипа положен метод гибридизации одноцепочечных иммобилизованных на матрице (двумерной или трехмерной) олиго(поли)нуклеотидов с комплементарными одноцепочечными олиго(поли)нуклеотидами - зондами, полученными в результате полимеразной цепной реакции (ПЦР) на исследуемом фрагменте генома инфекционного агента или иным способом. Зонды содержат маркер, как правило, флуоресцентную метку. В процессе гибридизации иммобилизованные олиго(поли)нуклеотиды и зонды образуют двуцепочечные участки или дуплексы, которые могут быть полными или неполными и различаться по своей прочности. Интерпретация полученных результатов проводится путем сравнения интенсивности флуоресценции сигналов, полученных при полной и неполной гибридизации образующихся двуцепочечных структур.
Таким образом, процедура использования биочипов для проведения современных скрининг-методов довольно проста. Развитие биочиповой технологии несмотря на внедрение ее конечной продукции - биочипов (микроматриц) в медицинскую практику (контроль качества донорской крови и медицинских препаратов, диагностика инфекционных заболеваний, контроль пищевой и сельскохозяйственной продукции), находится на начальной стадии своего развития и имеет нерешенные проблемы как связанные с собственно отдельными техническими операциями при производстве биочипов, так и с молекулярно-биологическими при использовании биочипа. Из-за нерешенности этих проблем производители не могут перейти к крупномасштабному производству биочипов и как следствие к широкому использованию их в научно-исследовательской практике и затем повсеместно в медицинской практике. Для большинства медицинских учреждений, таких как муниципальные поликлиники и больницы, эта продукция остается дорогой: в настоящее время стоимость одного биочипа на российском рынке находится в зависимости от размера матрицы (количества ячеек) от 3 до 10 долларов (биочипы для исследовательских целей, приготовленные комбинированным методом фотолитографии и комбинаторной химии, доходят по стоимости до 200 долларов). Кроме того, добавляется дорогостоящее оборудование, необходимое для их производства и использования: синтезаторы олигонуклеотидов, роботы для нанесения растворов, содержащих отдельные олигонуклеотиды, при формировании матрицы биочипа, амплификаторы, микроцентрифуги, термостаты, ридеры - устройства для чтения информации, полученной на биочипе, и, наконец, компьютеры, которые управляют отдельными процессами. И тем не менее, несмотря на имеющиеся трудности, производители ориентированы на одноразовое использование биочипов.
Технической задачей изобретения является разработка способа регенерации (восстановления) нуклеотидного биочипа для повторного (многоразового) использования.
В настоящее время в научно-технической литературе не имеется сведений об использовании биочипов многократно (или хотя бы двукратно) и не описаны способы их регенерации.
Поставленная задача решается путем использования денатурирующего агента, приводящего к разрушению двуцепочечных структур нуклеотидной природы, образовавшихся в ходе проведения гибридизации на биочипе или введенных иным способом на его поверхность, с последующим удалением незакрепленных химическим способом одноцепочечных цепей с матрицы биочипа в регенерирующий раствор и проверкой восстановленного биочипа при более высокой экспозиции (превышающей рабочую в 10-100 раз) с использованием читающего устройства (ридера), на котором проводится обработка информации с впервые использованного биочипа.
Как указывалось выше, в основу работы биочипа положен процесс гибридизации одноцепочечных иммобилизованных на матрице олигонуклеотидов с комплементарными им одноцепочечными олигонуклеотидами - зондами. Известно, что процесс, обратный гибридизации, называется денатурация. Он широко используется для разделения на одиночные цепи двуцепочечной ДНК разной длины при постановке секвенирования на плазмидах по Сэнгеру (тепловая или щелочная денатурация) [2, 3]. Разделение на одиночные цепи чаще всего проводится с помощью электрофореза в денатурирующих условиях [4]. Классически процесс денатурации подразумевает разрушение двуцепочечной нуклеиновой кислоты (двуцепочечной ДНК или двуцепочечных участков одноцепочечной РНК, или двуцепочечной РНК, или дуплексов - ДНК-ДНК, ДНК-РНК), стабилизация которой связана с силами, обеспечивающими стэкинг-взаимодействие, и специфические водородные связи между парами гетероциклических оснований, каждое из которых принадлежит одной из цепей, с образованием одноцепочечных цепей или участков. В последнем случае говорят о частичной денатурации. Расхождение цепей достигают повышением температуры или рН, или с помощью химических денатурирующих агентов.
В качестве химических денатурирующих агентов для нуклеиновых кислот (ДНК и РНК) в молекулярной биологии используются неорганические соли (NaCl, KCl и др.), щелочи (NaOH, КОН, LiOH и др.), мочевина, формамид, формальдегид, гидроксид метилртути, глиоксаль и др., а также их комбинации [4]. Формальдегид, гидроксид метилртути и глиоксаль образуют с гетероциклическими основаниями, входящими в нуклеиновые кислоты, производные, которые можно восстановить и таким образом иммобилизованный нуклеотидный материал привести к исходному состоянию в первых двух случаях; напротив, в присутствии глиоксаля образуются такие промежуточные соединения, которые восстановить невозможно.
Известно, что полиакриламидный гель каждой ячейки биочипа в ходе фотокаталитической полимеризации химически связывается с поверхностью модифицированного стекла посредством взаимодействия гидроксильных групп, находящихся на поверхности стекла, с одним из ряда кремнийорганических соединений [5].
Известно, что за счет проведенной модификации поверхности стекла кремнийорганическими соединениями работы по использованию биочипов могут проводиться как в широком диапазоне рН (рН 2-12), так и в широком температурном диапазоне (-10-100°С) [5].
Известно, что произведенные биочипы на конечной стадии процесса их изготовления отмываются от непрореагировавших реагентов органическими растворителями и на завершающей отмывке операции - водой, после чего высушиваются и готовы к использованию [1].
Поскольку при проведении гибридизации синтезируют с помощью ПЦР зонды такой длины, чтобы они беспрепятственно могли проникать через поры 5%-ного полиакриламидного геля [1], то они также легко будут удаляться в случае их обработки денатурирующими агентами, поскольку в ходе проведения работ с биочипом пористость геля не изменяется.
В ходе проведенных экспериментов в рамках данной работы было показано, что использование даже насыщенных водных растворов неорганических солей при комнатной температуре (20-25°С) не приводит к желаемому результату; при температурах растворов этих солей, более высоких или близких к температуре кипения, достигается желаемый эффект, но при этом некоторая доля биочипов механически повреждается, что выражается в отслаивании отдельных ячеек полиакриламидного геля от поверхности стекла. Это хорошо заметно при просмотре биочипов под обычным световым микроскопом. Кроме того, при использовании раствора хлорида натрия (NaCl) было обнаружено, что эта соль по причине незначительного увеличения растворимости с ростом температуры плохо вымывается из геля и выкристаллизовывается в отдельных случаях прямо в объеме гелевой ячейки, что приводит к образованию солевых пятен, хорошо просматриваемым на биочипе с помощью ридера. Несмотря на значительно лучшую растворимость хлорида калия (KCl) в воде по сравнению с хлоридом натрия, на отдельных регенерированных биочипах также наблюдаются солевые пятна.
Следует заметить, что щелочная денатурация накладывает ограничения на работу с биочипами: она не может быть использована для регенерации биочипа, при изготовлении которых для связывания стеклянной поверхности с полиакриламидной основой геля, необходимой для иммобилизации олиго(поли)нуклеотидов в случае трехмерных ячеек, или той же самой поверхности через промежуточный (якорный) реагент для иммобилизации олиго(поли)нуклеотидов в случае двумерных ячеек применяются кремнийорганические соединения. При длительной обработке щелочью такого рода биочипов даже при комнатной температуре происходит разрушение связи -O-Si- (кислород - кремний), что приводит к полному отслаиванию полиакриламидного геля от стекла (очищение стеклянной поверхности) либо другой поверхности, где для связи с ней была использована химическая связь этой природы. Также не может быть использована щелочь для восстановления биочипов, которые в качестве иммобилизованной нуклеотидной структуры несут рибонуклеотидные последовательности; но зато легко процесс денатурации будет проходить в случае использования меченых зондов рибонуклеотидной природы, которые расщепляются щелочью до монорибонуклеотидов. На биочипы, имеющие трехмерные и двумерные ячейки с другим типом химического связывания - нещелочелабильными составляющими олиго(поли)нуклеотидов со стеклянной или иной поверхностью - воздействие щелочью не скажется, даже, напротив, может оказаться наилучшим регенерирующим агентом. Наилучшие результаты были получены при использовании формамида, формамида с добавлением мочевины, формальдегида и водного раствора едкого натра (0,1 М NaOH).
Изобретение ориентирует научное сообщество на многократное использование биочипа, рассматривая биочип как своего рода инструмент для проведения анализа и замену его по мере износа, что может быть определено с помощью программы для обработки информации, содержащейся на биочипе до и после регенерации, при использовании ридера.
Сущность изобретения заключается в том, что отработанный биочип погружают в регенерирующий раствор, состоящий из чистого формамида или его водного раствора, мочевины в формамиде, разбавленного (3%-ного водного) раствора формальдегида или водного раствора щелочи (для биочипов с нещелочелабильными соединениями), выдерживают при температуре выше температуры плавления формамида (для формамида и формамидного раствора мочевины) или выше температуры замерзания разбавленного раствора формальдегида как минимум 10-60 мин, ополаскивают дистиллированной водой для удаления со стекла капель формамида или раствора формальдегида или иного денатурирующего агента, отмывают водой при температуре 20-60°С один-два раза в течение не менее 5-15 мин, контролируя ход регенерации биочипа в ячейках, при просмотре его в ридере при экспозиции, превышающей рабочую как минимум в 10 раз, что составляет 1000-10000 мс, и проводят оценку качества восстановления биочипа. Исчезновение флуоресцентного сигнала в рабочих ячейках позволяет сделать заключение о завершении регенерации биочипа. Реперные (контрольные) флуоресцентные сигналы остаются на регенерированном биочипе без изменений. Восстановленный биочип переносят в 5-10%-ный водный раствор глицерина на 30-60 мин (эта операция может быть пропущена, если не требуется длительное хранение биочипов), после чего его окончательно быстро ополаскивают струей дистиллированной воды комнатной температуры и подсушивают.
Изобретение иллюстрируется следующими графическими материалами.
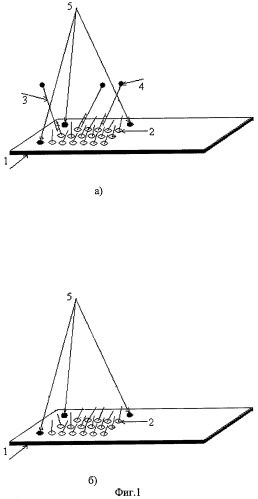
Фиг.1. Схематическое изображение строения биочипа с трехмерной матрицей и хода регенерации: а) вид биочипа до начала регенерации, б) вид биочипа по окончании регенерации. 1 - предметное стекло или стеклянная пластина, 2 - одиночная ячейка из 5%-ного полиакриламидного геля с включенным в этот гель олиго(поли)нуклеотидом, 3-флуоресцентно меченый одноцепочечный фрагмент или флуоресцентно меченый олигонуклеотид, 4-флуоресцентный краситель (метка), 5-иммобилизованный в ячейке геля (таких ячеек три) флуоресцентно меченый олигонуклеотид как реперная ячейка для настройки сетки программы ридера.
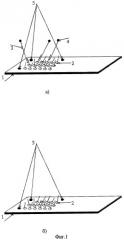
Фиг.2. Флуоресцентная картина использованного биочипа до проведения процесса регенерации (экспозиция 150 мс). На ней четко зафиксированы светящиеся ячейки с различной интенсивностью, за исключением трех угловых, являющихся реперными точками (две сверху и одна слева снизу) и светящимися как до, так и после регенерации.
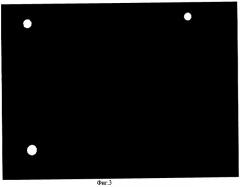
Фиг.3. Флуоресцентная картина биочипа по окончании регенерации при использовании формамида с добавлением 6 М мочевины в качестве денатурирующего агента: видны только реперные светящиеся точки (экспозиция 5000 мс).
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения. В эксперименте использованы биочипы для определения устойчивости микобактерий вида Mycobacterium tuberculosis к одному (рифампицину) или двум лекарственным препаратам (рифампицину и изониазиду); производство Института молекулярной биологии (Москва, Россия).
Пример 1. Денатурирующий агент - формамид без мочевины или с мочевиной Свежеотработанный (или хранившийся в течение определенного времени) биочип погружают в чистый формамид или формамид, содержащий мочевину в концентрации 6 М. Выдерживают при комнатной температуре в течение 1 ч. Затем ополаскивают дистиллированной водой, погружая биочип в емкость, наполненную водой, для удаления остатков регенерирующего раствора. (Не рекомендуется проводить ополаскивание биочипа, используя направленную на биочип (в случае трехмерной матрицы) струю воды во избежание механических поврежденений.) Биочип переносят в следующую емкость, содержащую воду, подогретую в термостате до температуры 37°С, и оставляют для отмывания на 10 мин. За это время происходит вымывание растворенных в регенерирующем растворе флуоресцентно меченных зондов, перешедших в регенерирующий раствор в ходе проведения денатурации и удерживаемых в ячейках геля, в дистиллированную воду за счет диффузии. Биочип просматривают в ридере с помощью компьютера при экспозиции, превышающей рабочую как минимум в 10 раз, что составляет 1000-10000 мс, и проводят оценку качества: биочип должен содержать только флуоресцирующие реперные (контрольные) ячейки. В случае неудовлетворительного качества отмывку повторяют еще раз. Для обеспечения сохранности регенерированного биочипа в течение длительного времени последний погружают в емкость, содержащую 10%-ный водный раствор глицерина, подогретый до температуры 37°С (в термостате), и выдерживают в течение 30 мин при этой температуре. Затем быстро (в течение 5-10 с) ополаскивают предметное стекло (стеклянную пластинку) от остатков промывочного глицеринового раствора погружением его в емкость с дистиллированной водой и подсушивают на воздухе или в термостате в течение 15 мин для удаления остатков воды. Глицерин, концентрируясь, придает гелю эластичность и предохраняет его от возможного растрескивания. Регенерированный биочип сохраняют до использования.
Пример 2. Денатурирующий агент - формальдегид. Свежеотработанный (или хранившийся в течение определенного времени) биочип погружают в 3%-ный водный раствор формальдегида. Выдерживают при комнатной температуре в течение 1 ч. Затем ополаскивают дистиллированной водой, погружая биочип в емкость, наполненную водой, для удаления остатков регенерирующего раствора. (Не рекомендуется проводить ополаскивание биочипа, используя направленную на биочип (в случае трехмерной матрицы) струю воды во избежание механических поврежденений). Биочип переносят в следующую емкость, содержащую воду, подогретую в термостате до температуры 37°С, и оставляют для отмывания на 10 мин [4]. За это время происходит одновременно вымывание растворенных в регенерирующем растворе флуоресцентно меченных зондов, перешедших в регенерирующий раствор в ходе проведения денатурации и удерживаемых в ячейках геля, в дистиллированную воду за счет диффузии. Биочип переносят еще раз в емкость, содержащую дистиллированную воду с температурой 60°С, на 10 мин. За это время происходит восстановление метилольных производных гетероциклических оснований, содержащих аминогруппы (цитозин, аденин, гуанин), иммобилизованных олиго(поли)нуклеотидов к исходному состоянию [4]. Биочип просматривают в ридере с помощью компьютера при экспозиции, превышающей рабочую как минимум в 10 раз, что составляет 1000-10000 мс, и проводят оценку качества: биочип должен содержать только флуоресцирующие реперные (контрольные) ячейки. Для обеспечения сохранности восстановленного биочипа в течение длительного времени последний погружают в емкость, содержащую 10%-ный водный раствор глицерина, подогретый до температуры 37°С (в термостате), и выдерживают в течение 30 мин при этой температуре. Затем быстро (в течение 5-10 с) ополаскивают предметное стекло (стеклянную пластинку) от остатков промывочного глицеринового раствора погружением его в емкость с дистиллированной водой и подсушивают на воздухе или в термостате в течение 15 мин для удаления остатков воды. Глицерин, концентрируясь, придает гелю эластичность и предохраняет его от возможного растрескивания. Регенерированный биочип сохраняют до использования.
Пример 3. Денатурирующий агент - 0,1 М водный раствор едкого натра (0,1 М NaOH)
Свежеотработанный (или хранившийся в течение определенного времени) биочип, содержащий нещелочелабильные соединения, погружают в 0,1 М водный раствор едкого натра. Выдерживают час при комнатной температуре. Затем ополаскивают дистиллированной водой, погружая биочип в емкость, наполненную водой, для удаления остатков регенерирующего раствора. (Не рекомендуется проводить ополаскивание биочипа, используя направленную на биочип (в случае трехмерной матрицы) струю воды во избежание механических поврежденений.) Биочип переносят в следующую емкость, содержащую дистиллированную воду также комнатной температуры, и оставляют для отмывания на 5 мин. За это время происходит вымывание растворенных в регенерирующем растворе флуоресцентно меченных зондов, перешедших в регенерирующий раствор в ходе проведения денатурации и удерживаемых в ячейках геля, в дистиллированную воду за счет диффузии. Переносят в новую емкость с дистиллированной водой еще 2 раза (для полного удаления щелочи) на то же время. В случае использования биочипов, матрица которых образована трехмерными или двумерными ячейками, каждая из которых присоединена к стеклянной или иной поверхности с помощью кремнийорганических соединений, присутствие щелочи не допустимо, так как ее присутствие приведет к удалению иммобилизованных олиго(поли)нуклеотидов с поверхности стекла или иной поверхности в общем случае или к отслаиванию полиакриламидного геля от поверхности стеклянной пластины в случае трехмерных ячеек и удалению иммобилизованных олиго(поли)нуклеотидов вместе с якорным (промежуточным) компонентом в случае двумерных ячеек в частности. Биочип просматривают в ридере с помощью компьютера при экспозиции, превышающей рабочую как минимум в 10 раз, что составляет 1000-10000 мс, и проводят оценку качества: биочип должен содержать только флуоресцирующие реперные (контрольные) ячейки. Для обеспечения сохранности регенерированного биочипа в течение длительного времени последний погружают в емкость, содержащую 10%-ный водный раствор глицерина, подогретый до температуры 37°С (в термостате), и выдерживают в течение 30 мин при этой температуре. Затем быстро (в течение 5-10 с) ополаскивают предметное стекло (стеклянную пластинку) от остатков промывочного глицеринового раствора погружением его в емкость с дистиллированной водой и подсушивают на воздухе или в термостате в течение 15 мин для удаления остатков воды. Глицерин, концентрируясь, придает гелю эластичность и предохраняет его от возможного растрескивания. Регенерированный биочип сохраняют до использования.
Пример 4. Сравнение качества нового и регенерированного биочипа
В эксперименте используют биочипы для определения устойчивости микобактерий вида Mycobacterium tuberculosis к двум лекарственньм препаратам - рифампицину и изониазиду производства Института молекулярной биологии (Москва, Россия). Из полученного после 2-го раунда полимеразной цепной реакции (ПЦР) амплификата (25 мкл), содержащего флуоресцентно меченный зонд, отбирают в каждую их двух пробирок или лунок иммунологического планшета по 10 мкл, смешивают с 20 мкл гибридизационного буфера следующего состава: 1,5 М гуанидинтиоцианат, 75 mM HEPES, pH 7,5, 7,5 mM EDTA, рН 8,0. Полученный раствор вносят в гибридизационную камеру нового биочипа, второй раствор наносят на область матрицы регенерированного биочипа и сверху накрывают покровной резиновой мембраной. Оба биочипа инкубируют в воздушном термостате при 37°С в течение ночи или 16 ч. По окончании инкубации вскрывают гибридизационную камеру в случае нового биочипа, отрывая пластмассовую крышку, или снимают покровную резиновую мембрану в случае регенерированного биочипа, промывают один раз дистиллированной водой, нагретой до температуры 37°С, погружением биочипа на 1 мин в дистиллированную воду, затем один раз в дистиллированную воду комнатной температуры. Полученные при рабочей экспозиции (150 мс) флуоресцентные картины идентичны.
Повторные эксперименты показывают диапазон кратности использования биочипа 3-10, которая не сказывается на качестве получения очередной флуоресцентной картины.
Таким образом, впервые разработана технология регенерации нуклеотидных биочипов для повторного (многократного) использования, что позволит форсировать проведение работ, которые могут быть связаны с использованием биочипов в различных областях науки и медицины, а также резко снизит затраты на проведение исследований на этапе внедрения.
ЛИТЕРАТУРА
1. Патент РФ №2175015, кл. С 12 Q 1/68. опубл.2001 г.
2. Rouer E. // 1994. Nucleic Acids Res. V.22. 4844. Direct neutralization of alkaline-denatured plasmid DNA in sequencing protocol by the sequencing reagent itself.
3. Stahl S., Hultman T., Olsson A., Moks T., Uhlen M. 1988 Nucleic Acids Res., 16(7):3025-38. Solid phase DNA sequencing using the biotin-avidin system.
4. Остерман Л.А. Методы исследования белков и нуклеиновых кислот: электрофорез и ультрацентрифугирование (практическое пособие), M.: Наука, 1981 г., с.288.
5. Патент РФ №2206575, кл. С 07 К 17/08, опубл. 2003 г.
1. Способ регенерации одноразовых нуклеотидных биочипов, используемых в анализах с флуоресцентными метками, включающий химическую денатурацию двухцепочечных структур нуклеотидной природы, образовавшихся в рабочих ячейках на поверхности отработанного биочипа, в течение 10-60 мин в растворе, содержащем в качестве денатурирующего агента либо формамид, либо раствор мочевины в формамиде, либо 3%-ный водный раствор формальдегида, либо (для нещелочелабильных нуклеотидных биочипов) водный раствор щелочи, удаление меченых одноцепочечных фрагментов с помощью отмывок водой при температуре 20 - 60°С и контроль восстановленного биочипа с помощью ридера при экспозиции, превышающей рабочую как минимум в 10 раз, причем регенерацию биочипа считают завершенной, если в его рабочих ячейках отсутствует сигнал метки, а реперные (контрольные) маркеры остаются без изменений.
2. Способ по п.1, отличающийся тем, что для обеспечения длительной сохранности регенерированного биочипа последний дополнительно обрабатывают водным раствором глицерина, ополаскивают водой и подсушивают.