Способ оценки внутрипредсердного и межпредсердного проведения возбуждения
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к кардиологии, в частности к аритмологии, функциональной диагностике. Электрокардиограмму регистрируют в пищеводе. Электрод устанавливают в месте, где регистрируется максимальная амплитуда сигнала. Сигнал усиливают не менее чем в 5 раз, фильтруют в диапазоне 0,5-40 Гц, регистрируют со скоростью не менее 100 мм/с. Время внутрипредсердного проведения измеряют от начала восходящего колена первой положительной волны пре-Р-зубца до вершины второго спайка Р-зубца, а время межпредсердного проведения измеряют от точки пересечения нисходящего колена первой положительной волны с началом косовосходящего пре-Р-интервала до пересечения этого интервала с точкой крутого подъема первой фазы зубца Р. Способ расширяет арсенал средств неинвазивной оценки внутрисердечного и межпредсердного проведения возбуждения. 3 ил.
Реферат
Изобретение относится к кардиологии, в частности к аритмологии, функциональной диагностике.
В настоящее время установлено, что нарушение внутри- и межпредсердного проведения играет основную, а в ряде случаев и ведущую роль в генезе инициации и поддержания тахиаритмий [16]. Так, при изучении экспериментальных моделей фибрилляции предсердий (ФП) было показано, что электрофизиологическим механизмом этой аритмии являются множественные хаотические волны microre-entry, обусловленные однонаправленной задержкой предсердного проведения [19, 14, 17]. Таким образом, ФП поддерживается деполяризующей волной, которая непрерывно циркулирует в возбудимой ткани, что подтверждается медленным внутрипредсердным проведением и коротким периодом рефрактерности предсердий. По мнению большинства исследователей [13], факторы, ответственные за возникновение ФП, включают ФП в отсутствие других вспомогательных факторов. В качестве субстрата рассматривается нарушение внутри- и межпредсердного проведения [15].
Известен способ оценки предсердного проведения возбуждения при помощи стандартной поверхностной электрокардиограммы (ЭКГ) в общепринятых 12 отведениях (6 от конечностей и 6 грудных) [10]. При данном методе представление о предсердном проведении складывается на основании анализа формы, амплитуды и длительности зубца Р, однако точность при определении внутри- и межпредсердного проведения возбуждения достаточно низкая, так как мы оцениваем только общую длительность зубца и корректно выделить право- и левопредсердную составляющие зубца Р не в состоянии. При ряде патологий регистрируется низкоамплитудный, сглаженный зубец Р, оценка которого крайне затруднена [4, 10, 11].
Известен способ определения предсердного проведения возбуждения у больных ишемической болезнью сердца, выбранный нами в качестве прототипа [А.В.Шабров, А.И.Олесин, Я.В.Голуб, В.И.Голуб. Клиническая оценка использования неинвазивного метода определения внутри- и межпредсердной проводимости у больных ишемической болезнью сердца. - Терапевтический архив, 1999, №1, с.34-39]. На людях он осуществляется следующим образом. Одновременно регистрируют ЭКГ во II стандартном отведении и эхокардиограмму в В- и М-режимах. Время проведения возбуждения по правому и левому предсердиям определяют от начала электрического возбуждения предсердий (волны Р ЭКГ) до начала механического сокращения левого предсердия, определяемого в разных точках левого предсердия.
Метод определения предсердного проведения возбуждения, выполненный авторами на собаках, требует вскрытия грудной клетки, что является сложной и жизненноопасной процедурой.
Недостатками этого способа являются низкая точность определения времени предсердного проведения возбуждения. Это связано с тем, что очень сложно провести визуализацию левого предсердия при поворотах сердца, связанных с различной конституцией пациентов, избыточной массой тела, а также при эмфиземе легких, возникающей при различных хронических заболеваниях легких [20]. Все это затрудняет или делает невозможным визуализацию контрольных точек на левом предсердии.
Задачей нашего изобретения является повышение точности измерения времени предсердного проведения возбуждения.
Это достигается тем, что электрод для регистрирации ЭКГ. через носовой ход устанавливают в определенном месте пищевода, сигнал усиливают до 50 мм/мВ и фильтруют в диапазоне 0,5-40 Гц. Регистрация полученного сигнала производится на скорости не менее 100 мм/с. При измерении на зарегистрированной ЭКГ длительности сегментов, интервалов и спайков выделенного пре-Р-зубца и Р-зубца определяется время проведения возбуждения по правому и левому предсердиям, а также время межпредсердного и внутрипредсердного проведения возбуждения.
Положительный эффект данного способа заключается в значительном повышении точности измерения времени проведения возбуждения по правому и левому предсердиям. Сопоставление выделенных нами волн для измерения времени предсердного проведения возбуждения с результатами одновременно проводимого эндокардиального электрофизиологического исследования сердца (ЭндоЭФИ) позволило проводить измерения с точностью, близкой к точности, достигаемой при инвазивном исследовании, считающимся «золотым стандартом» в электрофизиологии сердца [7, 18]. На основании полученных результатов нами разработан новый способ изучения электрических потенциалов предсердного комплекса ЭКГ и измерения внутрипредсердного и межпредсердного проведения возбуждения в норме и при патологии. В отличие от прототипа предлагаемый способ позволяет измерять время меж- и внутрипредсердного проведения возбуждения. Способ легковоспроизводим, не требует специальной дорогостоящей аппаратуры (эхокардиографа) и поэтому доступен большинству лечебно-профилактических учреждений, в том числе для проведения скрининговых обследований.
Нами выполнено 2017 исследований по разработанной методике. Только у двух пациентов с искривлением носовой перегородки в ходе выполнения исследования возникли сложности с извлечением чреспищеводного электрода, вероятно, из-за отека слизистой оболочки носового хода. После интраназального закапывания раствора адреналина произведено атравматичное извлечение электродов.
Способ проводится следующим образом. В положении лежа или сидя биполярный электрод вводится пациенту в пищевод через носовой ход на глубину 35-45 см и оптимальная локализация электрода определяется по максимальной амплитуде и двухфазной форме зубца Р с начальной положительной фазой, при регистрации ЭКГ на дистальном контакте электрода. Целесообразно дистальному концу стилета электрода придать изогнутую (дугообразную) форму и при необходимости для лучшей визуализации правопредсердной части электрограммы повернуть вдоль оси, ориентируясь на максимальную выраженность сигнала. Для исключения дислокации электрода применяется специальный зажим-фиксатор. Расстояние между проксимальным и дистальным контактами электрода 2,5 см. Осуществлялась униполярная регистрация электрограммы с дистального и проксимального контактов электрода и биполярная, при которой активный электрод регистратора подключался к дистальному контакту, а пассивный к проксимальному контакту. Наиболее практично использовать электрод ПЭДСП-2 в связи с круглой формой и достаточной величиной контактов, обеспечивающих максимальный контакт со стенками пищевода и возможностью изменения расстояния между проксимальным и дистальным контактами электрода. Запись исследования синхронно вводится в память компьютера. Анализ чреспищеводных электрограмм осуществляется при скорости развертки 100-400 мм/с, при чувствительности от 20 до 100 мм/мВ и последующем ручном измерении временных интервалов с помощью визиров. При регистрации и анализе чреспищеводной фильтрованной электрограммы применяются фильтры высоких и низких частот в диапазоне 0,5-40 Гц.
При регистрации фильтрованной ЧпЭКГ (фиг.1) нами выявлено низкоамплитудное и низкочастотное отклонение, предшествующее Р-зубцу, определяются две морфологии:куполообразная и сглаженная пологая волна (пре-Р-зубец).
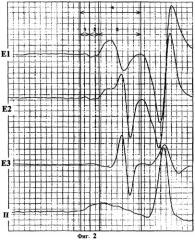
На полученной электрограмме выделены точки отсчета для определения внутри- и межпредсердного проведения возбуждения (фиг.2).
Время возбуждения правого предсердия определяется от начала восходящего колена первой положительной волны (пре-Р-зубец) до точки пересечения нисходящего колена этой волны с началом косовосходящего пре-Р-интервала. Время межпредсердного проведения измеряется от точки пересечения нисходящего колена первой положительной волны с началом косовосходящего пре-Р-интервала до пересечения этого интервала с точкой крутого подъема первой фазы зубца Р. Время возбуждения левого предсердия определяется от точки пересечения косовосходящего пре-Р-интервала с точкой крутого подъема первой фазы зубца Р до вершины второго спайка Р-зубца. Время внутрипредсердного проведения вычисляется от начала восходящего колена первой положительной волны пре-Р-зубца до вершины второго спайка Р-зубца.
Для оценки внутри- и межпредсердного проведения возбуждения наиболее информативной является электрограмма, зарегистрированная на дистальном контакте пищеводного электрода в связи с максимальной выраженностью сигнала.
Работа выполнялась на комплексе для проведения неинвазивного (чреспищеводного) электрофизиологического исследования сердца, автоматизированного "Astrocard-Polysystem - EP/L" ЗАО Медитек г.Москва.
В состав комплекса входят блок усилителей биопотенциалов, интерфейсная плата АЦП, электростимулятор "Astrocard ProgrammStim-2", кабель для соединения интерфейсной платы и регистрирующего блока, кабель отведений (12-канальный), кабель отведений (для экспериментальных каналов), комплект электродов электрокардиографических, персональный компьютер, принтер, программное обеспечение. Интерфейсная плата поставляется в составе комплекса и предназначена для ввода ЭКГ и ЭКС в ПК. Блок регистрации ЭКГ и ЭКС предназначен для регистрации ЭКГ по 12 каналам (6 стандартных и 6 грудных) и ЭКС по 3 каналам и ввода в ПК для дальнейшей обработки.
Для идентификации выделенных волн мы использовали в качестве "золотого стандарта" эдокардиальное электрофизиологическое исследование сердца, которое проводилось у 15 пациентов, направленных для хирургического лечения пароксизмальной реципрокной атриовентрикулярной узловой тахикардии, пароксизмальной реципрокной ортодромной атриовентрикулярной тахикардии и синдрома слабости синусового узла.
В условиях рентгеноперационной эндокардиальные электроды устанавливаются под флюороскопическим и контролем электрограмм. По методике Sherlag В. [6] через правую бедренную вену многополюсный электрод устанавливается в проекции септальной створки трикуспидального клапана и регистрируются потенциалы нижних отделов правого предсердия (LRA), (Н)-Гис потенциал и осцилляции правого желудочка (RV). Второй многополюсный электрод устанавливается в высоких отделах правого предсердия (HRA), в области синусового узла. Третий многополюсный электрод через правую подключичную вену проводим в правое предсердие и устанавливаем в области проксимального, медиального и дистального отделов коронарного синуса (CSp.), (CSm.) и (CSd.), характеризующих процессы возбуждения левого предсердия. Регистрация электрограмм проводилась на скорости 100 мм/с. Одновременно регистрируется ЧпЭКГ вышеописанным способом.
При синхронной регистрации эндокардиальных электрограмм с высоких и нижних отделов правого предсердия, а также с проксимальной и дистальной зон коронарного синуса, потенциала Гиса и правого желудочка установлено, что спайковые потенциалы, зарегистрированные из правого и левого предсердий, по времени точно совпадают со спайковыми потенциалами, зарегистрированными на ЧпЭГ предсердий (фиг.3).
В связи с неоднородностью тканей сердца и существования переходных зон при проведении возбуждения импульс, исходящий из синусового узла, распространяется по проводящим трактам в строго определенной последовательности и через соответствующие временные интервалы поочередно охватывает отдельные анатомоэлектрофизиологические единицы. Определение интервалов между спайками позволяет неинвазивно оценивать время проведения возбуждения по предсердиям.
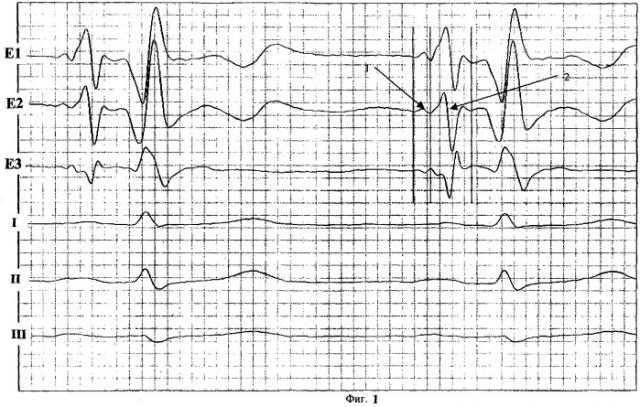
На фиг.1 представлена уни- и биполярная ЧпЭКГ (вариант нормы):
Е1 - регистрация униполярной ЧпЭКГ с проксимального контакта электрода
Е2 - регистрация униполярной ЧпЭКГ с дистального контакта электрода
Е3 - регистрация биполярной ЧпЭКГ
I, II, III - стандартные отведения ЭКГ
1 - пре-зубец Р
2 - зубец Р.
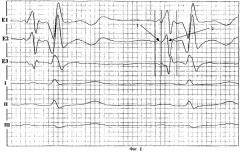
На фиг.2 представлена униполярная и биполярная ЧпЭКГ пациента, страдающего частыми и длительными пароксизмами фибрилляции предсердий:
Е1 - регистрация униполярной ЧпЭКГ с проксимального контакта электрода
Е2 - регистрация униполярной ЧпЭКГ с дистального контакта электрода
Е3 - регистрация биполярной ЧпЭКГ
II - второе стандартное отведение ЭКГ
1 - время возбуждения правого предсердия
2 - время межпредсердного проведения возбуждения
3 - время возбуждения левого предсердия
4 - время внутрипредсердного проведения возбуждения.
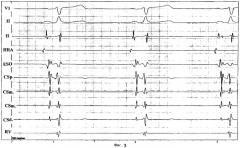
На фиг.3 представлена синхронная запись эндокардиальных электрограмм и ЧпЭКГ предсердий:
HRA - электрограмма из верхних отделов правого предсердия
CSp. - электрограмма из проксимальной зоны коронарного синуса
CSm. - электрограмма из медиальных отделов коронарного синуса
CSd. - электрограмма из дистальной зоны коронарного синуса
Н - потенциал пучка Гиса
RV - электрограмма правого желудочка
VI - первое грудное отведение ЭКГ
II - второе стандартное отведение ЭКГ
ESO - чреспищеводная электрограмма
1, 2, 3 - шкала на диаграммной ленте в Гц (скорость регистрации эндограмм 100 мм/с).
На основании полученных результатов нами разработан способ неинвазивной регистрации ЭКГ, дающей возможность изучения электрических потенциалов предсердного комплекса ЭКГ и оценки внутрипредсердного и межпредсердного проведения возбуждения в норме и при патологии.
Список литературы
1. Kistin A.D, Brill W.D, Robb G.P. Normal esophageal and gastric electrocardiograms. Description, statistical analysis and bearing on theories of "electrocardiographic position". Circulation 1950; 2:578-597.
2. Bincley P.F, Bush C.A, Fleisman B.L, Leier C.V. In vivo validation of the origin of the esophageal electrocardiogram. J Am Coil Cardiol 1986; 7:813-818.
3. Bagliani G, Meniconi L, Raggi F, Corea L. Left origin of the atrial esophageal signal as recorder in the pasing site. PACE 1998; 21:18-24.
4. З.И. Янушкевичус, Л.В. Чирейкин, А.А. Праневичус. Дополнительно усиленная кардиограмма. - Л.: Медицина, 1990.
5. Crawford T.M, Dick M, Jenkins J.M. Transesophageal atrial pasing. Med Instrument 1986; 20:40-44.
6. Scherlag B.J., Lau S.H., Heffant R.A. et al. Catheter technique for recording His bundle activity in men. Circulation. 1969; 39:13-17.
7. Horowits L.N. Safety of electrophysiologic studies. Circulation. 1986; 2:1128-1132.
8. Brown W.H. A study of the esophageal lead in clinical electrocardiography. Part I. The application of the esophageal lead to the human subject with observations on the Ta-wave, extrasistoles and bundle-branch bloc. Am Heart J 1936, 12:1-45.
9. Cosio F.G., Anderson R.H., Kuck K.H., et. al. Living anatomy of the atrioventricular junctions. A guide to electrophysiologic mapping. A Consensus Statement from the Cardiac Nomenclatyre Study Group, Working Group of Arrhythmias, European Society of Cardiology, and the Task Force on Cardiac Nomenclatyre from NASPE. Circulation. 1999; 5:31-37.
10. B.H.Орлов. Руководство по электрокардиографии. - М.: Медицина, 1983.
11. М.С.Кушаковский. Аритмии сердца. - С.-Петербург: "Фолиант", 1998.
12. Schricket J.W., Bielik H., Yang М., et al. Induction of atrial fibrillation in mice by rapid transesophageal atrial pacing. Basic Research in Cardiology. 2002; 6:452-460.
13. Sato Т., Mitamura H., Kurita Y., et al. Recovery of electrophysiological parameters after conversion of atrial fibrillation. Int J Cardiology. 2001; 79:183-189.
14. Saksema S, Giorgberisze I, Camm J.A., et al. Electrophysiology and endocardial mapping of induced atrial fibrillation in patients with spontaneous atrial fibrillation. Am J Cardiol 1999; 83:187-193.
15. Allessie M.A., Konings K., et al. Electrophysiologic mechanisms of perpetuation of atrial fibrillation. Am J Cardiol 1996; 77(3):10A-23A.
16. Allessie M.A., Boyden P.A., Camm J.A., et al. Pathophysiology and prevention of atrial fibrillation. Circulation 2001; 103; 769-777.
17. Wijffels M.C., Kirchhof C.J., Dorland R, Power J, Allessie M.A. Electrical remodeling due to atrial fibrillation in chronically instrumented conscious goats. Roles of neurohumoral changes, ischemia, atrial stretch, and high rate of electrical activation. Circulation 1997; 96:3710-20.
18. Josephson M.E., Scharf D.L., Kastor J.A., et al. Atrial endocardial activation in men. Electrode catheter technique of endocardial mapping. Am J Cardiol. 1977; 39:972-980.
19. Falk R.H. Atrial fibrillation. N Engi J Med. 2001; 344:1067-1078.
Способ измерения времени внутрипредсердного и межпредсердного проведения возбуждения, включающий регистрацию электрокардиограммы, отличающийся тем, что электрокардиограмму регистрируют в пищеводе, электрод устанавливают в месте, где регистрируется максимальная амплитуда сигнала, сигнал усиливают не менее чем в 5 раз, фильтруют в диапазоне 0,5-40 Гц, регистрируют со скоростью не менее 100 мм/с и время внутрипредсердного проведения измеряют от начала восходящего колена первой положительной волны пре - Р-зубца до вершины второго спайка Р-зубца, а время межпредсердного проведения измеряют от точки пересечения нисходящего колена первой положительной волны с началом косовосходящего пре - Р-интервала до пересечения этого интервала с точкой крутого подъема первой фазы зубца Р.