Имплантируемая композиция (варианты) и способ ее приготовления
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии и касается имплантируемой композиции, содержащей биосовместимый носитель и частицы, включающие в себя прессованную смесь активного вещества и гидрофобного агента, выбранного из C16-C24 жирных кислот, сложных эфиров жирных кислот и их фармацевтически приемлемых солей, а также их смесей, при этом частицы диспергированы в носителе, а также способа ее приготовления. Композиция обеспечивает контролируемый выход активного вещества. 3 н. и 28 з.п. ф-лы, 6 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится в основном к имплантируемым композициям, которые обеспечивают контролируемый выход полезного вещества. В частности, данное изобретение касается композиций носителя, такого как гель, и полезного вещества, в которых взаимодействие полезного вещества с компонентами геля или водной средой применения или растворимость в них может модулироваться объемными характеристиками геля и микросредой, ассоциированной с полезным веществом. Изобретение касается также способов приготовления композиций, соответствующих изобретению.
Уровень техники
Было описано множество систем для доставки лекарственных веществ и других полезных веществ из имплантируемых полимерных материалов. Репрезентативные патенты, относящиеся к данным системам, включают, например, Патент США No. 5085866, описывающий систему для пероральной имплантации. В Патенте США No. 5019400 описано получение микросфер с контролируемым выходом; Патент США No. 4938763 и выделенный из него Патент США No. 5278201 описывают образующиеся in-situ твердые биодеградируемые имплантаты; в Патенте США 5599552 раскрывают термопластичные и термореактивные полимерные композиции, в которых используют растворители, представленные от смешивающихся с водой до диспергирующихся в воде, такие как N-метил-2-пирролидон, что в результате приводит к образованию растворов полимеров, способных быстро поглощать воду из окружающей ткани; Патент США No. 5242910 описывает композицию с задержанным выходом, содержащую лекарственные вещества для лечения заболевания периодонта; Патент США No. 5620700 представляет матрицу, содержащую полимер и лекарственное вещество, необязательно включающую пластификаторы в количестве до приблизительно 30 мас.%, для местного применения лекарственного вещества в полости периодонта, и в Патенте США No. 5556905 описывают деградируемые термопластичные композиции, которые модифицированы пластификаторами, состоящими из различных частичных сложных эфиров лимонной кислоты.
Хорошо известно, что в имплантируемых системах часто имеются трудности в плане доставки активного вещества, особенно активного вещества, который обладает высокой растворимостью в воде, контролируемым образом в течение периода, следующего сразу за имплантацией, часто приводя к нежелательному эффекту "взрыва", при котором высвобождается слишком много активного вещества сразу после имплантации. В области техники описаны различные композиции и способы, касающиеся данной проблемы.
Патент США No. 5759563 описывает жидкие доставляющие системы, которые могут быть использованы для образования твердых структур, в которых активное вещество инкорпорировано в компонент, обеспечивающий контролируемый выход, который затем растворяют или диспергируют в жидком компоненте или нагружают им жидкий компонент. Как описано, компонент, обеспечивающий контролируемый выход, может включать микроструктуры, макроструктуры, конъюгаты, комплексы или соли с низкой растворимостью в воде. Компонент, обеспечивающий контролируемый выход, как полагают, обеспечивает дополнительное время для выхода активного вещества, что дает возможность сделать твердый препарат без исходной потери значительной части активного вещества. Среди различных описанных компонентов, обеспечивающих контролируемый выход, в патенте раскрыто, что активное вещество может быть введено в виде конъюгата в молекулу-носитель путем ковалентного связывания активного вещества с молекулой-носителем, которая, как правило, будет представлять собой полимер, но может быть маленькой органической молекулой, такой как стеариновая кислота, которая присоединяется посредством сложноэфирной или амидной связи. В Примере 2 данного патента порошок ганиреликса ацетата получают из полисебациновой кислоты, расплавленной при 80°С для получения порошка, который, как считают, снижает "взрыв" при выходе ганиреликса ацетата относительно наблюдаемого при простом растворении ганиреликса ацетата в растворе полимолочной кислоты/N-метил-2-пирролидона.
Патент США No. 5162057 представляет покрывающие агенты для твердых препаратов, которые состоят из сложных эфиров полиглицерина и жирных кислот или содержат их. Кроме того, в патенте описано, что покрывающий агент может содержать смягчающие компоненты, такие как липиды или воски, включая в числе прочих жирные кислоты, такие как стеариновая кислота и пальмитиновая кислота, или их соли. Описано, что покрытие выполняют способом покрытия на поддоне или, альтернативно, в форме эмульсии путем расплавления и смешивания агента с другими добавками или путем нагревания с последующим смешиванием с водой для обеспечения эмульгирования. Эмульсию распыляют на поверхности твердого препарата и сушат для получения покрытого препарата.
Патент США No. 4341759 описывает покрытую частицу, имеющую снижающуюся концентрацию активного агента в направлении к поверхности частицы. В патенте описаны неактивные липофильные субстанции, такие как воски, жирные кислоты и их сложные эфиры и спирты жирных кислот, включая стеариновую кислоту, глицерилмоностеарат и цетиловый спирт для контроля скорости выхода. Покрытие описано, как нанесенное в поддоне для нанесения покрытия или в устройстве с псевдоожиженным слоем.
В Патенте США No. 4351825 описывают производство таблеток с контролируемым выходом, в которых активный агент получают в гранулированной композиции, затем смешивают с контролирующими агентами, такими как сложный эфир жирных кислот с большой молекулой, и прессуют в таблетки. Контролирующие агенты описаны, как имеющие липидную природу и присутствующие в пространствах между гранулами активного агента для того, чтобы контролировать проникновение воды в таблетку.
В статье Mesiha и соавт. "Гипогликемический эффект пероральных препаратов инсулина, содержащих Brij 35, 52, 58 или 92 и стеариновую кислоту" ("Hypoglycaemic effect of oral insulin preparations containing Brij 35, 52, 58 or 92 and stearic acid", J. Pharm. Pharmacol., 33: 733-734, (1981)), описан расплав стеариновой кислоты со стимулятором поглощения Brij и инсулином, приготовленный при 85°С. В статье обсуждается, что мицеллы эмульгированной стеариновой кислоты могут переносить инсулин через слизистую мембрану и что гранулированные препараты стеариновой кислоты с Brij, будучи гидрофобными, могут повышать стабильность инсулина.
В статье Foldvari M. и Moreland A. "Клинические наблюдения, полученные при лечении инфекции генитального вируса папилломы инкапсулированным в липосомы интерфероном-α для наружного применения" ("Clinical Observations With Topical Liposome-Encapsulated Interferon Alpha For The Treatment Of Genital Papillomavirus Infections"), Journal of Liposome Research, 7 (1): 155-126, (1977)) описана инкапсуляция α-интерферона-2b в многослойные липосомы, состоящие из соевого фосфатидилхолина:холестерина: стеариновой кислоты в молярном соотношении 2:1:1,4 способом выпаривания растворителя.
В предшествующем уровне техники описаны различные соли жирных кислот и сложные эфиры жирных кислот, как используемые в случаях применения задержанной доставки. Например, Патент США No. 4851220 представляет маслянистый гель, который может включать гелирующие агенты, такие как сложные эфиры моно-жирной кислоты алюминия. В Патенте США No. 4650665 описана предпочтительная основа из стеарата кальция, декстрана и касторового масла. Патент США No. 5474980 представляет композиции для введения полипептидов, которые включают биосовместимое масло, приготовленное из сложных эфиров различных жирных кислот, например триглицеридов или смесей триглицеридов и жирных кислот (предпочтительно только в минорных пропорциях, например, меньше, чем приблизительно 10% свободной жирной кислоты). Патент США No. 5628993 описывает парентеральный фармацевтический препарат, образованный из основы, содержащей пептид или белок, и полиглицеринового сложного диэфира насыщенной жирной кислоты, такой как пальмитиновая кислота и стеариновая кислота.
Высокоэффективная система контроля взрывного выхода полезного вещества из имплантата описана в родственной заявке Serial No. 08/993208, поданной 18 декабря 1997 г. Данные системы основаны на композициях полимер/растворитель, которые образуют гель и контролируют скорость входа воды в объем полимерной системы, снижая таким образом взрывной выход полезного вещества, который в противном случае мог бы произойти под воздействием среды применения. Несмотря на эффективность данных систем и положительные результаты, достигнутые путем контроля объемных характеристик полимерной основы, было обнаружено, что дополнительные улучшения контролируемого выхода активного вещества могут быть достигнуты путем смешивания данных систем с полезным веществом, которое присутствует в контролируемой микросреде в геле, как описано в данном контексте.
Сущность изобретения
Изобретение представляет имплантируемые композиции, содержащие прессованные частицы полезного вещества, диспергированные в носителе, и способы их изготовления. Прессование снижает соотношение площади поверхности и массы частиц и снижает скорость растворения, дисперсию или диффузию полезного вещества при воздействии жидкостей тела в среде применения. Практическая реализация данного изобретения снижает взрывной выход полезного вещества, минимизируя таким образом потенциальные побочные эффекты и повышая способность носителя к нагрузке полезным веществом так, что доставка полезного вещества при проведении одной имплантации может продолжаться в течение длительного периода времени. Это позволяет проводить меньше имплантаций, когда должно осуществляться введение полезного вещества в течение длительного периода времени, который может выражаться в месяцах и даже годах.
В одном аспекте композиция, соответствующая изобретению, содержит носитель, например биосовместимый и биоразрушаемый вязкий гель, и частицы, содержащие прессованное полезное вещество, при этом частицы диспергированы в носителе. Частицы могут быть образованы из прессованного полезного вещества в виде монокомпонента или в смеси с фармацевтически приемлемыми инертными ингредиентами. Носитель может содержать биосовместимый полимер и быть смешанным с подходящими растворителями, как описано в данном контексте, с образованием геля.
В другом аспекте композиция, соответствующая изобретению, содержит носитель, например вязкий гель, и частицы, содержащие прессованное полезное вещество, при этом частицы диспергированы в носителе и прессованные частицы получают в смеси с агентами, которые модулируют скорость растворения полезного вещества при помещении в среду применения, или из прессованного полезного вещества в виде монокомпонента при том, что модулятор скорости растворения растворен или диспергирован в носителе, и (необязательно) с другими фармацевтически приемлемыми инертными ингредиентами. Носитель является биосовместимым и может быть биоразрушаемым.
В еще одном аспекте композиция, соответствующая данному изобретению, содержит носитель, например вязкий гель, и частицы, содержащие прессованную смесь полезного активного вещества и агента, характеризующегося низкой растворимостью в воде, при этом частицы диспергированы в носителе. Агент, характеризующийся низкой растворимостью в воде, может быть гидрофобным. Носитель является биосовместимым и может быть биоразрушаемым.
В одном аспекте гидрофобный агент может быть выбран из фармацевтически приемлемого масла, жира, жирной кислоты, сложного эфира жирной кислоты, воска или их производного и демонстрирует гидрофобное свойство. Предпочтительно, когда гидрофобный агент в композиции содержит C16-С24 жирную кислоту или ее сложный эфир или фармацевтически приемлемую соль или смеси вышеупомянутых материалов. Гидрофобный агент композиции может содержать смесь стеариновой кислоты и пальмитиновой кислоты. Обычно промышленно выпускаемую стеариновую кислоту добавляют в виде смеси стеариновой кислоты и пальмитиновой кислоты, в которой стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 90 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 40 мас.% жирных кислот гидрофобного агента. В более очищенной форме стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 96 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 90 мас.% жирных кислот гидрофобного агента. Имеющаяся в продаже стеариновая кислота другой степени очистки состоит из приблизительно 90 мас.% стеариновой кислоты, и остаток представлен в основном пальмитиновой кислотой.
В другом аспекте изобретения прессованные частицы вышеописанной композиции содержат порошок. Порошок может быть доведен до такого размера, что 90% или более частиц проходит через сито с меш (числом ячеек/единицу длины) 50 и остается на сите с меш 400. Часто частицы выбирают на основе того, что они проходят через сито с меш 70 и остаются на сите с меш 400. Ссылки на размер меш в данном случае и далее во всем описании соответствуют стандарту США.
Полезное вещество может быть водорастворимым или нерастворимым в воде и может быть представлено маленькой молекулой или большой молекулой. Однако преимущества изобретения могут быть наиболее эффективно реализованы в случае водорастворимых полезных веществ. В основном преимущества изобретения будут реализованы в случае нерастворимого в воде полезного вещества, если бы полезное вещество в противном случае взаимодействовало с компонентами носителя, такими как полимер или растворитель, как правило, присутствующие в вязком гелевом носителе, или с водной средой применения.
Изобретение представляет конкретный способ применения композиций, в которых полезное вещество выбрано из ДНК, кДНК, биологически активных макромолекул, белков, пептидов и полипептидов. Примерами некоторых из данных полезных веществ являются человеческий гормон роста, α-, β- или γ-интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкины, такие как интерлейкин-1, интерлейкин-2, интерлейкин-11 и интерлейкин-12, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретический фактор или филграстим.
В другом аспекте изобретения композиция содержит полимер, выбранный из группы, состоящей из полилактидов, полигликолидов, поликапролактонов, полиангидридов, полиаминов, полиуретанов, полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полиортокарбонатов, полифосфазенов, сукцинатов, полияблочной кислоты, полиаминокислот, поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, хитина, хитозана и их сополимеров, терполимеров и смесей.
В еще одном аспекте полимер может быть смешан с растворителем или системой растворителей, которая ограничивает объем поглощения воды имплантатом. Такие растворители и системы растворителей идентифицированы в данном контексте и могут включать сложные алкиловые или аралкиловые эфиры бензойной кислоты. В предпочтительных в настоящее время системах композиция содержит сополимер лактида и гликолевой кислоты ("PLGA") и растворитель бензилбензоат или этилбензоат, в котором диспергированы частицы прессованной смеси стеариновой кислоты и полезного вещества.
В другом аспекте изобретения продолжительность выхода полезного вещества может быть удобным образом модифицирована путем соответствующего выбора растворителя для полимера. Например, в случае PLGA с человеческим гормоном роста бензилбензоат может обеспечить продолжительность выхода порядка одного месяца или более, а этилбензоат может обеспечить продолжительность выхода порядка одной недели.
В еще одном аспекте изобретение представляет композицию, содержащую биоразрушаемый носитель, включающий полимер, выбранный из полилактидов, полигликолидов, поликапролактонов, полиангидридов, полиаминов, полиуретанов, полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полиортокарбонатов, полифосфазенов, сукцинатов, полияблочной кислоты, полиаминокислот, поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, хитина, хитозана и их сополимеров, терполимеров и смесей, и растворитель, выбранный из алкилового или аралкилового сложного эфира бензойной кислоты и частиц, содержащих прессованную смесь полезного вещества и агента, характеризующегося низкой растворимостью в воде, выбранного из группы, состоящей из фармацевтически приемлемого масла, жира, жирной кислоты, сложного эфира жирной кислоты, воска, их производного или смеси вышеперечисленных материалов, при этом частицы диспергированы в геле.
Предпочтительно, когда гидрофобный агент в композиции содержит C16-C24 жирную кислоту или сложный эфир или их фармацевтически приемлемую соль или смеси вышеперечисленных материалов. Наиболее предпочтительно, когда гидрофобный агент композиции содержит смесь стеариновой кислоты и пальмитиновой кислоты. Обычно промышленно выпускаемую стеариновую кислоту добавляют в виде смеси стеариновой кислоты и пальмитиновой кислоты, в которой стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 90 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 40 мас.% жирных кислот гидрофобного агента. В более очищенной форме стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 96 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 90 мас.% жирных кислот гидрофобного агента. Частицы вышеописанной композиции могут содержать порошок. Порошок может проходить через сито с меш 50 и предпочтительно, когда 90% и более частиц, содержащих порошок, проходят через сито с меш 70 и остаются на сите с меш 400.
В дополнительном аспекте изобретения представлен процесс приготовления композиций, соответствующих данному изобретению, предусматривающий прессование гранулированного или порошкового полезного вещества, необязательно смешанного с модулятором скорости растворения или агентом, характеризующимся низкой растворимостью в воде с целью получения после гранулирования прессованных частиц, содержащих активное вещество и необязательные ингредиенты. Прессование может быть осуществлено уплотнением одного полезного вещества или уплотнением смеси, в частности, может быть выполнено путем таблетирования, уплотнения валиком или экструзией через головку подходящего размера при давлениях, достаточно высоких для уплотнения материала и получения уплотненной массы. Затем уплотненную массу перемалывают или измельчают с образованием частиц прессованного материала, например гранул или частиц, измельченных до размера образования порошка. Прессованные частицы диспергируют в биосовместимом носителе с образованием имплантируемой композиции, соответствующей изобретению.
Вышеизложенное, а также другие объекты, признаки и преимущества данного изобретения будут легче пониматься после чтения следующего детального описания в сочетании с чертежами.
Перечень чертежей
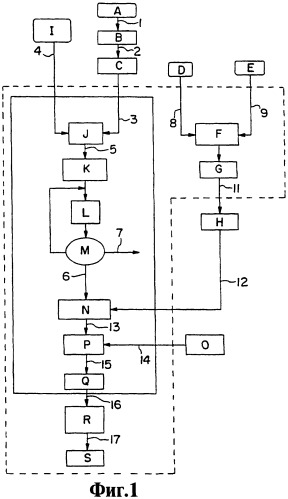
На фиг.1 представлена технологическая схема, иллюстрирующая основной процесс получения композиций, соответствующих данному изобретению.
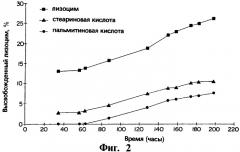
На фиг.2 представлен график, иллюстрирующий за период, измеряющийся часами, профили выхода in vitro лизоцима, полученные в емкости для растворения по USP (Фармакопея США) в среде фосфатного буфера, при 100 об/мин для трех различных композиций имплантатов, содержащих полимерный гель PLGA, в котором лизоцим присутствует в виде монокомпонента в полимерном геле (обозначено квадратами), лизоцим присутствует в виде прессованной смеси со стеариновой кислотой (обозначено треугольниками) и лизоцим присутствует в виде прессованной смеси с пальмитиновой кислотой (обозначено кругами) соответственно.
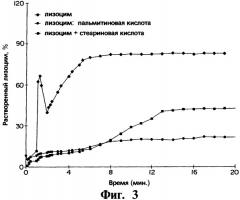
На фиг.3 представлен график, иллюстрирующий за период, измеряющийся минутами, профили выхода in vitro лизоцима, полученные в емкости для растворения по USP в среде фосфатного буфера, при 100 об/мин для трех различных композиций имплантатов, содержащих полимерный гель PLGA, в котором лизоцим присутствует в виде монокомпонента в полимерном геле (обозначено ромбами), лизоцим присутствует в виде прессованной смеси со стеариновой кислотой (обозначено квадратами) и лизоцим присутствует в виде прессованной смеси с пальмитиновой кислотой (обозначено кругами) соответственно.
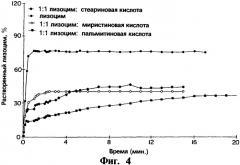
На фиг.4 представлен график, иллюстрирующий за период, измеряющийся минутами, профили выхода in vitro лизоцима, полученные в емкости для растворения по USP в среде фосфатного буфера, при 100 об/мин для трех различных композиций имплантатов, содержащих полимерный гель PLGA, в котором лизоцим присутствует в виде монокомпонента в полимерном геле (обозначено черными кругами, верхняя кривая), лизоцим присутствует в виде прессованной смеси с миристиновой кислотой в соотношении 1:1 (обозначено частично закрашенными кругами), лизоцим присутствует в виде прессованной смеси со стеариновой кислотой в соотношении 1:1 (обозначено ромбами) и лизоцим присутствует в виде прессованной смеси с пальмитиновой кислотой в соотношении 1:1 (обозначено квадратами) соответственно.
На фиг.5 представлен график, иллюстрирующий выход in vivo из репрезентативной инъекционной депо-формы, как измеряют в сыворотке крыс, двух различных препаратов человеческого гормона роста ("hGH")/стеариновой кислоты (1:1, hGH:стеариновая кислота, обозначено квадратами и 1:2 ПОН:стеариновая кислота, обозначено треугольниками) по сравнению с выходом частиц hGH в виде монокомпонента (обозначено кругами).
На фиг.6 представлен график, иллюстрирующий выход in vivo, как измеряют в сыворотке крыс, частиц человеческого гормона роста, которые получены в виде прессованных частиц со стеариновой кислотой в соответствии с описанием, приведенным в данном контексте, из геля PLGA, содержащего 2-N-метилпирролидон (обозначено ромбами), триацетин (обозначено квадратами), этилбензоат (обозначено кругами) и бензилбензоат (обозначено треугольниками) соответственно.
Сведения, подтверждающие возможность осуществления изобретения
Данное изобретение направлено на усовершенствованные композиции, используемые для системного или местного введения полезного вещества субъекту путем имплантации данному субъекту имплантируемой системы, содержащей композиции, соответствующие изобретению, и на способы приготовления данных композиций.
Определения.
Термин "AUC" означает площадь под кривой, полученной на основании проведенного у субъекта анализа in vivo при построении графика концентрации полезного вещества в плазме крови субъекта относительно времени, которую измеряют от времени имплантации композиции до времени "t" после имплантации. Время t будет соответствовать периоду доставки полезного вещества в организм субъекта.
Термин "полезное вещество" означает вещество, которое оказывает желательный полезный, часто фармакологический эффект при введении человеку или животному, либо в виде монокомпонента, либо в комбинации с другими фармакологическими наполнителями или инертными ингредиентами.
Термин "коэффициент взрывного выхода" означает касательно определенной композиции, предназначенной для системной доставки полезного вещества, частное, образующееся при делении (i) AUC, вычисленной для заданного периода времени после имплантации композиции субъекту, разделенной на число часов в заданном периоде на (ii) AUC, вычисленной для периода времени доставки полезного вещества, разделенной на число часов в полной продолжительности периода доставки. В целях ссылки на численные значения коэффициентов взрывного выхода, упоминаемых в данном контексте, заданный период будет составлять 24 часа. Однако известно, что в других вариантах применения продолжительность заданного периода может зависеть от природы полезного вещества и терапевтического применения, так что заданный период может быть коротким, но измеряемым периодом непосредственно после имплантации или представлять собой более длительный период. Однако в большинстве вариантов применения не предполагают, что более длительный период будет продолжаться более 96 часов.
Термин "прессованный" означает, касательно материала или смеси материалов, что материал или смесь материалов прессуют или уплотняют так, что его объемная плотность после прессования или уплотнения превышает значения, которые были до прессования или уплотнения. Прессование или уплотнение удобно осуществлять путем таблетирования или гранулирования вышеупомянутой смеси с использованием принятых процессов или путем уплотнения валиком или путем экструзии вышеупомянутых материалов с использованием принятых процессов.
Термин "прессованные частицы" означает касательно полезного вещества или смеси полезного вещества и модулятора скорости растворения, или смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, что частицы получены из прессованных или уплотненных частиц полезного вещества или прессованной или уплотненной смеси частиц полезного вещества и модулятора скорости растворения, или прессованной или уплотненной смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, соответственно. Прессованные частицы могут быть получены путем гранулирования из большей по размеру прессованной или уплотненной массы, такой, которая образуется при таблетировании, гранулировании, уплотнении роликом или путем операции экструзии, при измельчении массы с целью образования частиц, которые могут быть гранулами или порошком. Для целей данного изобретения частицы, как правило, имеют максимальный размер или класс крупности между от приблизительно 0,1 мкм до приблизительно 500 мкм, более часто от 5 мкм до приблизительно 400 мкм. Термин "гранулы" в основном будет относиться к частицам, имеющим средний размер, превышающий размер, характерный для порошка. Термин "частицы" включает гранулы и порошок.
Выражение "диспергированный" предназначено для того, чтобы охватывать все значения, связанные с обнаружением присутствия прессованных частиц полезного вещества или смеси полезного вещества и модулятора скорости растворения или смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, в носителе и включает дисперсию, суспензию и т.п.
Термин системный" означает касательно доставки или введения полезного вещества субъекту, что полезное вещество определяется на биологически значимом уровне в плазме крови субъекта.
Термин "местный" означает, касательно доставки или введения полезного вещества субъекту, что полезное вещество доставляется в ограниченную область тела субъекта, но не определяется на биологически значимом уровне в плазме крови субъекта.
Термин "гель" или "гелевый носитель", который в данном контексте может быть использован взаимозаменяемо, означает композицию, образованную смесью полимера и растворителя в отсутствие полезного вещества, и охватывает, например, растворы полимеров, гидрогели, эмульсии, желатины и т.п.
Термин "пролонгированный период" означает период времени, в течение которого происходит выход полезного вещества из имплантата, соответствующего изобретению, который будет, как правило, составлять приблизительно одну неделю или более и предпочтительно приблизительно 30 дней или более, но может составлять 3 месяца или более.
Термин "исходный взрывной выход" означает касательно определенной композиции, соответствующей изобретению, частное, образующееся при делении (i) количества (по массе) полезного вещества, высвободившегося из композиции в заданный исходный период времени после имплантации, обыкновенно, в период времени от времени сразу после имплантации до периода времени до 96 часов на (ii) общее количество полезного вещества, которое должно доставляться из имплантированной композиции. Понятно, что исходный взрывной выход может варьировать в зависимости от формы и площади поверхности имплантата. Соответственно, проценты и показатели взрывного выхода, связанные с исходным взрывным выходом, описанные в данном контексте, предназначены для применения в отношении композиций, тестируемых в форме, полученной в результате выхода композиции из стандартного шприца.
Термин "стеариновая кислота" как используют в данном описании, пока по контексту на требуется иначе, означает выпускаемые в промышленности смеси стеариновой кислоты (С18H36О2) и пальмитиновой кислоты (С16Н32О2,) которые продаются в качестве стеариновой кислоты. Предпочтительно, когда содержание стеариновой кислоты в смеси является не ниже, чем 40%, и суммы двух кислот не ниже, чем 90% от смеси. Стеариновую кислоту, как правило, производят путем гидрогенизации хлопкового и других растительных масел или путем гидролиза жира при высоком давлении и высокой температуре, получая вышеупомянутую смесь.
Термин "субъект" означает касательно применения композиции, соответствующей изобретению, животное или человека.
Поскольку все растворители по меньшей мере на молекулярном уровне будут растворимыми в воде (т.е. смешивающимися с водой) до некоторой очень ограниченной степени, термин "несмешивающийся", как используют в данном контексте, означает, что 7% или менее от массы растворителя является растворимым в воде или смешивающимся с водой. Для целей данного описания предполагают, что значения растворимости растворителя в воде определяют при 20°С. Поскольку в общем известно, что значения растворимости в том виде, как они опубликованы, не всегда могут быть определены в одних и тех же условиях, пределы растворимости, приведенные в данном контексте как процент массы, смешивающейся или растворимой в воде, могут не быть абсолютными в качестве части интервала или верхнего предела. Например, если верхний предел растворимости растворителя в воде представлен в данном контексте как "7 мас.%" и никаких дальнейших ограничений относительно растворителя не делают, то растворитель "триацетин", который обладает указанной растворимостью в воде 7,17 г в 100 мл воды, рассматривают как включенный в предел 7%. Предел растворимости в воде меньше, чем 7 мас.%, как используют в данном контексте, не включает растворитель триацетин или растворители, обладающие растворимостью в воде, равной или большей, чем у триацетина.
Данное изобретение содержит биоразрушаемый и биосовместимый носитель, например вязкий гель, и частицы, содержащие прессованное полезное вещество, при этом частицы диспергированы в носителе. Частицы могут быть образованы из полезного вещества в виде монокомпонента или в смеси с фармацевтически приемлемыми инертными ингредиентами. Кроме того, перед прессованием полезное вещество может быть смешано с модулятором скорости растворения или агентом, обладающим низкой растворимостью в воде, таким как гидрофобный агент. Биоразрушаемый носитель может содержать полимер, как описано в данном контексте, и быть смешанным с подходящими растворителями, как описано в данном контексте, для образования вязкого геля, такого как те гели, которые ограничивают объем поглощения воды.
Прессование полезного вещества в таблетки и последующее измельчение приводит к получению частиц полезного вещества, в которых соотношение площади поверхности и массы меньше, чем в случае, когда частицы полезного вещества получают принятыми способами, такими как распылительная сушка, осаждение из раствора и т.п. Хотя снижение отношения площади поверхности к массе не может значительно снизить скорость поглощения воды, последующее растворение или диспергирование полезного вещества в исследованиях растворения in vitro, смешивание таким образом прессованных частиц с вязкими полимерными гелями, как описано в данном контексте, дает значительное снижение поглощения воды частицами по сравнению с непрессованными частицами в данных гелях.
Например, хотя непрессованные частицы hGH, образованные путем распылительной сушки, со средним диаметром частиц порядка 5 мкм могут растворяться в анализе растворения по USP в период времени порядка секунд, прессованные частицы такого же или близкого диапазона размеров могут растворяться за период порядка минут. В вязких полимерных гелях, образованных с использованием несмешивающихся растворителей, как описано в данном контексте, прессованные частицы hGH могут сохранять свою целостность и продолжать процесс растворения и диффузии из имплантата в течение периода, исчисляющегося днями или неделями. Пониженное поглощение воды в микросреде, окружающей частицы полезного вещества, модулирует или устраняет взрывной выход и создает возможность пролонгированного выхода полезного вещества из имплантата.
В целях описания способ приготовления композиций, соответствующих изобретению, будет проиллюстрирован смесями полезного вещества и одного или более агентов, проявляющих низкую растворимость в воде, таких как гидрофобные агенты. Прессованные частицы полезного вещества в виде монокомпонента, которые могут содержать фармацевтически приемлемый наполнитель, или необязательно в смеси с модулятором скорости растворения могут быть получены таким же образом, как с гидрофобными агентами за исключением устранения стадий, включающих гидрофобные агенты, в случае использования полезного вещества в виде монокомпонента. Если частицы содержат смесь полезного вещества и модуляторов скорости растворения, замена модулятора скорости гидрофобным агентом в описанном процессе, как правило, будет приводить к получению необходимого материала для дальнейшей обработки. Обычно после этого прессованные таблетки полезного вещества как в виде монокомпонента, так и в виде смеси получают принятыми способами таблетирования, таблетки измельчают или перемалывают и полученные в результате частицы разделяют по размеру с помощью сита для просеивания с целью получения частиц размера, лежащего и интервалах, описанных в других разделах данного описания. После разделения по размеру частицы смешивают с гелем и в предпочтительном варианте осуществления набирают в шприцы.
Альтернативно полезное вещество либо в виде монокомпонента, либо в виде вышеописанных смесей может быть уплотнено с помощью уплотнителя с валиком, а затем измельчено или размолото до получения частиц подходящего размера.
Соответственно, в одном варианте осуществления изобретения прессованные частицы, содержащие прессованную смесь полезного вещества и агента, характеризующегося низкой растворимостью в воде, диспергируют в имплантируемом носителе. Прессованные частицы удобно получать путем изначального таблетирования или гранулирования смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде. Не будучи абсолютным требованием, является предпочтительным, когда два компонента будут тщательно перемешаны до значительной степени гомогенности, такой, что концентрация различных компонентов является в основном одинаковой во всей смеси. Для получения желательной степени перемешивания полезное вещество и агент, характеризующийся низкой растворимостью в воде, могут быть измельчены до состояния порошка, если они уже не находятся в данном состоянии, перед тем, как их смешивают.
После перемешивания смесь частиц прессуют в форме таблетки или гранулы или уплотняют валиком, или экструдируют с формированием прессованной массы, которая имеет плотность, превышающую плотность агрегации частиц смеси до стадии прессования. Удобно, когда смесь полезного вещества и агента, характеризующегося низкой растворимостью в воде, таблетируют с помощью принятого пресса для таблетирования, такого, как прессы, хорошо известные в промышленном производстве фармацевтических препаратов. Для производства в маленьких объемах может быть использован простой ручной пресс Carver. При большем объеме производства могут быть использованы автоматизированные прессы. Ряд промышленно выпускаемых прессов для таблетирования описан в Справочнике по фармацевтическим наукам Ремингтона (Remington's Pharmaceutical Sciences), 18-oe издание, с.1647-1653 (1990), Mack Publishing Company, Easton, Pennsylvania, и включает такие прессы, как выпускаемые фирмами Stokes-Pennwalt, Manesty и др. Затем табле