Спиро- или диспиро-1, 2, 4-триоксолан, фармацевтическая композиция на его основе и способ лечения
Иллюстрации
Показать всеНастоящее изобретение относится к спиро- или диспиро-1,2,4-триоксолану общей формулы I
где R1 и R2, взятые вместе, представляют собой спироадамантил, 3,3,5,5-тетраметилспироциклогексил, спироциклододеканил;
R3 и R4 являются одинаковыми или различными и выбраны из замещенной или незамещенной ароматической или пиридильной группы, где ни один из R3 и R4 не может представлять водород, и, кроме того, R3 и R4, взятые вместе, могут образовывать замещенную или незамещенную алициклическую группу, которая необязательно прерывается одним атомом кислорода, серы или азота. Соединения данного изобретения являются структурно простыми, легкими для синтеза, нетоксичными и активными против малярийных паразитов. Описана также фармацевтическая композиция на основе соединений I и способ лечения малярии и шистосомоза. 7 н. и 12 з.п. ф-лы, 10 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к композициям и способам для лечения малярии. В особенности, данное изобретение относится к фармацевтическим композициям, включающим спиро- и диспиротриоксоланы, способам их применения и производства.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Малярия представляет собой острое, а зачастую и хроническое инфекционное заболевание, обусловленное присутствием относящихся к простейшим паразитов в красных кровяных клетках. Вызываемая одноклеточными паразитами рода Plasmodium малярия переносится от субъекта к субъекту через укус самки комара.
Хотя ранее малярия была широко распространена в Северной Америке и других областях мира с умеренным климатом, сегодня она в основном встречается в тропических и субтропических странах. Каждый год от 400 до 600 миллионов людей заражаются данной болезнью и от 1,5 до 2,7 миллионов умирают от нее.
В целом, за малярию ответственны четыре вида простейших паразитов Plasmodium, включая Plasmodium vivax, Plasmodium falciparum, Plasmodium malariae и Plasmodium ovale. Из четырех наиболее опасным является Plasmodium falciparum, являющийся причиной половины всех клинических случаев малярии и 90% смертей от данной болезни.
Передача малярии начинается, когда самка комара кусает человека, уже инфицированного малярийным паразитом. Если инфицированный комар кусает другого человека, спорозоиты со слюной комара переносятся в кровь, которая затем попадает в печень. В печени спорозоиты быстро делятся, затем поступают в кровоток, где они внедряются в красные кровяные клетки. Внутри указанных кровяных клеток мерозоиты быстро делятся до тех пор, пока они не вызовут разрушения красных кровяных клеток с высвобождением в кровоток нового поколения мерозоитов, которые затем инфицируют другие красные кровяные клетки.
Связанные с малярией симптомы, как правило, обусловлены разрушением красных кровяных клеток. В результате разрушения красных кровяных клеток происходит выброс в кровь загрязняющих веществ, токсина и других продуктов разрушения. Это, в свою очередь, вызывает сильный жар, который делает инфицированного субъекта изнуренным и обессиленным. Более тяжелые симптомы, связанные с повторяющимися инфекциями и/или инфекцией Plasmodium falciparum, включают анемию, тяжелые головные боли, судороги, делириозный синдром и, в некоторых случаях, смерть.
Лечение малярии является особенно сложным из-за способности малярийных паразитов развивать устойчивость к лекарственным средствам. Хинин - противомалярийное соединение, которое экстрагируют из коры южноамериканского хинного дерева, - является одним из наиболее старых и наиболее эффективных из существующих фармацевтических препаратов. Недостатком хинина является кратковременность действия и неспособность предотвратить рецидив заболевания. Кроме того, хинин обладает побочными эффектами, варьирующими от головокружения до глухоты.
Хлорохин является синтетическим химическим препаратом, подобным хинину. Он стал препаратом, избранным для лечения малярии, когда он был разработан в 1940-х годах благодаря его эффективности, простоте получения и, как правило, отсутствию побочных эффектов. Однако на протяжении нескольких последних десятилетий малярийные паразиты во многих областях мира стали устойчивыми к хлорохину.
Мефлохин является другим синтетическим аналогом хинина, применявшимся для лечения малярии. Однако у малярийных паразитов также развилась устойчивость и к мефлохину. Кроме того, в некоторых случаях мефлохин также имеет нежелательные побочные эффекты, связанные с центральной нервной системой, включая галлюцинации и образные ночные кошмары.
Антифолатные лекарственные средства действуют против малярийных паразитов, ингибируя их репродуктивные функции. Хотя у паразитов развивается устойчивость и к антифолатным лекарственным средствам, данные лекарственные средства еще можно эффективно использовать в сочетании с другими типами противомалярийных препаратов. Однако применение сочетанных терапий для лечения малярии имеет недостатки, а именно оно является неудобным и дорогим.
Разработки, проводимые в последнее время в области лечения малярии, включают применение пероксидной функциональной группы, присутствующей, например, в лекарственном средстве артемизинине, который содержит уникальный 1,2,4-триоксановый гетероциклический фармакофор. Противомалярийная активность артемизинина обусловлена его способностью взаимодействовать с железом молекул свободного гема малярийного паразита с образованием свободных радикалов, приводящих к разрушению клетки.
Открытие артемизинина (хингхаосу (qinghaosu)), встречающегося в природе эндопероксидного сесквитерпенового лактона (Meshnick et al., 1996; Vroman et al., 1999; Dhingra et al., 2000), положило начало интенсивным попыткам выяснить молекулярный механизм его действия (Jefford, 1997; Cumming et al., 1997) и идентифицировать новые противомалярийные пероксиды (Dong and Vennerstrom, 2001). Были получены многочисленные синтетические 1,2,4-триоксаны, 1,2,4,5-тетраоксаны и другие эндопероксиды.
Хотя применимые в клинике полусинтетические производные артемизинина являются быстродействующими и сильными противомалярийными средствами, они имеют несколько недостатков, включая возобновляемость заболевания, нейротоксичность (Wesche et al., 1994) и метаболическую нестабильность (White, 1994). Значительное количество данных соединений является весьма активным in vitro, но большинство из них обладает низкой активностью при пероральном применении (White, 1994; van Agtmael et al., 1999). Хотя позже были получены многочисленные противомалярийные 1,2,4-триоксаны (Cumming et al., 1996; Jefford, 1997), в данной области существует потребность в идентификации новых пероксидных противомалярийных агентов, особенно таких, которые можно легко синтезировать, которые не являются нейротоксичными и которые обладают улучшенными фармакокинетическими свойствами, например улучшенной стабильностью, абсорбцией при пероральном применении и др.
Соответственно, первой целью настоящего изобретения является предоставление композиций и способов, предназначенных для профилактики и лечения малярии с использованием спиро- и диспиро-1,2,4-триоксоланов.
Другой целью настоящего изобретения является предоставление композиции и способа, предназначенных для профилактики и лечения малярии с использованием нетоксичных спиро- и диспиро-1,2,4-триоксоланов.
Следующей целью настоящего изобретения является предоставление композиции и способа, предназначенных для профилактики и лечения малярии с использованием метаболически стабильных и активных при пероральном применении спиро- и диспиро-1,2,4-триоксоланов.
Очередной целью настоящего изобретения является предоставление композиции и способа, предназначенных для профилактики и экономически выгодного лечения малярии с использованием спиро- и диспиро-1,2,4-триоксоланов, которые не сопряжены с режимом лечения продолжительностью более чем 3 дня.
Следующей целью настоящего изобретения является предоставление композиций и способов, предназначенных для профилактики и лечения малярии с использованием спиро- и диспиро-1,2,4-триоксоланов, которые можно использовать либо как самостоятельные лекарственные средства, либо в сочетании с другими агентами.
Еще одной целью настоящего изобретения является предоставление новых промежуточных соединений для синтеза композиций, предназначенных для профилактики и лечения малярии.
Способ и средства осуществления каждой из упомянутых выше целей, также как и других, станут очевидны из приведенного ниже подробного описания изобретения.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение описывает способ и композицию для лечения малярии с помощью спиро- и диспиро-1,2,4-триоксоланов, их пролекарств и аналогов. Триоксоланы данного изобретения являются стерически затрудненными с одной стороны триоксоланового гетероцикла для обеспечения химической и метаболической стабильности триоксоланового цикла для лучшей активности in vivo. В одном воплощении спиро- и диспиротриоксоланы стерически затрудняют с помощью незамещенной, моно-, ди- или полизамещенной С5-С12-спироциклоалкильной группы, которая может являться спироадамантаном. В данном воплощении спиро- и диспиротриоксоланы могут включать спироциклогексил, который функционализирован или замещен по 4-положению или спиропиперидильное кольцо, которое функционализировано или замещено по атому азота. Еще в одном воплощении триоксоланы данного изобретения включают алкильный мостик от 4-положения спироциклогексильного цикла, связывающий заместитель, который наиболее предпочтительно представляет собой слабое основание. Изобретение охватывает ахиральные диастереомеры, рацемические смеси, а также энантиомерные формы соединений.
Триоксоланы данного изобретения обладают превосходной активностью и эффективностью против паразитов Plasmodium и низкой степенью нейротоксичности. Дополнительно некоторые триоксоланы являются пригодными как для перорального, так и неперорального введения. Кроме того, в сравнении с полусинтетическими производными артемизинина соединения данного изобретения являются простыми в структурном отношении, их легко и экономично синтезировать и они могут эффективно применяться отдельно или в сочетании с другими противомалярийными средствами.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВОПЛОЩЕНИЯ
Настоящее изобретение относится к разработке спиро- и диспиро-1,2,4-триоксоланов для применения в профилактике и лечении малярии. Настоящее изобретение основано на неожиданном открытии, что триоксоланы, которые являются относительно стерически затрудненными, по меньшей мере, по одной стороне триоксоланового гетероцикла, обеспечивают метаболическую и химическую стабильность триоксоланового цикла, таким образом обеспечивая лучшую активность in vivo, особенно по отношению к пероральному введению.
Как он использован в настоящем описании, термин "профилактически эффективное количество" относится к концентрации соединения данного изобретения, которая эффективна при ингибировании или профилактике инфекции и последующего заболевания, вызванного малярийными паразитами. Аналогично термин "лечебно-эффективное количество" относится к концентрации соединения, которая эффективна при лечении малярии с точки зрения предотвращения увеличения концентрации малярийных паразитов, уменьшения концентрации малярийных паразитов и/или "лечения" малярийной инфекции, т.е. обеспечения выживания в течение 30 дней после инфицирования.
Четырехзамещенные триоксоланы являются относительно стабильными пероксидными соединениями, исходя из предшествующей литературы (Griesbaum et al., 1997a; 1997b). Данный эффект может быть частично обусловлен недостатком α-водородных атомов. Авторы настоящего изобретения синтезировали новые соединения в классе триоксоланов, обладающие как превосходной противомалярийной активностью, так и эффективностью при пероральном введении. Кроме того, соединения данного изобретения имеют низкую токсичность, и периоды полураспада, пригодные для лечения малярии, которые, как полагают, позволяют осуществлять непродолжительные режимы лечения, что является благоприятным фактором при сравнении с другими лекарствами, подобными артемизинину. Данные соединения можно также применять для профилактики малярии.
В предыдущей заявке авторы настоящего изобретения раскрыли некоторые новые четырехзамещенные триоксоланы, имеющие следующую структурную формулу:
где R1, R2, R3 и R4 представляют комбинации циклических систем, ациклических систем и функциональных групп, которые обеспечивают достаточное стерическое затруднение вокруг триоксоланового цикла для придания циклу химической и метаболической стабильности. R1, R2, R3 и R4 могут быть одинаковыми или различными и могут представлять собой линейную или разветвленную алкильную, арильную и алкарильную группу, которая необязательно является замещенной. Альтернативно, R1 и R2, взятые вместе, и/или R3 и R4, взятые вместе, могут образовывать алициклическую группу, которая необязательно прерывается одним или несколькими атомами кислорода, серы или азота и является необязательно замещенной. Ни в каком случае любой из R1, R2, R3 или R4 не может представлять собой водород.
В одном воплощении соединения включают такие соединения, где R1 и R2, взятые вместе, и/или R3 и R4, взятые вместе, представляют собой моно- или дизамещенную C5-C12-спироциклоалкильную группу, которая необязательно прерывается одним или несколькими атомами кислорода, серы или азота и является необязательно замещенной. В другом воплощении R1 и R2, взятые вместе, или R3 и R4 представляют собой спироадамантан.
Настоящее изобретение раскрывает новое воплощение триоксолановых соединений, имеющих следующую структуру:
Спироциклогексильный цикл может необязательно прерываться одним или несколькими атомами кислорода, серы или азота. В данном случае R1' и R2' могут быть одинаковыми или различными и могут представлять собой водород, замещенные или незамещенные линейные или разветвленные алкильную, арильную и алкарильную группы, гидроксильную группу, галоген или замещенные либо незамещенные алициклические группы, или же замещенные или незамещенные ароматические или гетероциклические группы, где данные гетероароматические и гетероциклические группы содержат в цикле один или два атома, выбранных из кислорода, серы или азота. В одном воплощении R1' и R2' представляют собой функциональную группу, являющуюся амидом. Авторы неожиданно обнаружили, что амидсодержащие заместители по 4-положению обеспечивают противомалярийным соединениям хорошую абсорбцию при пероральном введении, хорошую противомалярийную активность и хорошую фармакокинетику, т.е. степени абсорбции, метаболизма и выведения, которые являются подходящими и благоприятными для профилактики и лечения малярии.
Еще в одном воплощении соединения данного изобретения имеют следующую структурную формулу:
где R3 представляет собой (CH2)n-Y. В данной формуле Y представляет собой функциональную группу, которая в одном воплощении является не кислотной, а в еще одном воплощении является слабым основанием. Функциональная группа Y может представлять собой алкил, кетон, кислоту, спирт, амин, амид, сульфонамид, гуанидин, простой эфир, сложный эфир, оксим, мочевину, оксимный эфир, сульфон, лактон, карбамат, семикарбазон, фенил или гетероцикл. В одном воплощении n=1. Было обнаружено, что алкильная "мостиковая" группа улучшает метаболическую стабильность (т.е. пероральную активность и фармакокинетику) противомалярийных соединений по данному изобретению.
В еще одном воплощении данного изобретения такие триоксолановые соединения представляют собой слабые основания, которые предоставляют идеальное сочетание высокой характеристической активности и хорошей пероральной активности. Два перспективных структурных подтипа триоксолана представляют собой слабоосновные амиды, образуемые амином триоксолана OZ209 и триоксолановой кислотой OZ78. Данные соединения имеют одну из следующих двух структурных формул:
Возможны также другие заместители по 4-положению спироциклогексильного цикла, которые попадают в объем данного изобретения. Спироциклогексильный цикл может также быть замещен по другим положениям, кроме 4-положения. Например, авторы синтезировали несколько соединений, замещенных по 2-положению спироциклогексильного цикла, которые проявляют превосходную противомалярийную активность.
В еще одном воплощении предпочтительные соединения данного изобретения включают алкильную группу, связывающую заместитель по 4-положению со спироциклогексильным циклом. В одном воплощении алкильная группа представляет собой метил или этил. Еще в одном воплощении алкильная группа с метилом представляет предпочтительный вариант. Алкильная "мостиковая" группа, также непосредственно присоединенная к 4-положению, улучшает метаболическую стабильность (т.е. пероральную активность и фармакокинетику) спироциклогексильного цикла противомалярийных соединений данного изобретения.
Авторы настоящего изобретения идентифицировали два активных при пероральном введении ведущих диспиро-1,2,4-триоксолана, OZ03 и OZ05:
Данные триоксоланы имеют значения IC50S против P. Falciparum in vitro между 1 и 5 нг/мл и, по-видимому, обладают хорошими терапевтическими показателями при том, что не наблюдали очевидной токсичности для соединений как на клеточной линии нейробластомы, так и при однократных дозах 640 мг/кг на мышах в тесте Рэйна. Данные результаты противоречат опубликованным данным (de Almeida Barbosa et al., 1992; 1996), раскрывающим слабую противомалярийную активность in vitro для нескольких трициклических триоксоланов, лучший из которых имел значение IC50 против P. Falciparum in vitro, равное 2000 нг/мл.
Отличительным признаком данных триоксоланов в сравнении с полусинтетическими производными артемизинина является их структурная простота. Возможным преимуществом триоксоланов перед как триоксанами (Jefford, 1997; Cumming et al., 1997), так и тетраоксанами (Vennerstrom et al., 2000) является более удобный доступ к структурно разнообразным, несимметричным и, во многих случаях, ахиральным соединениям.
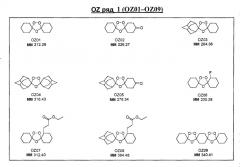
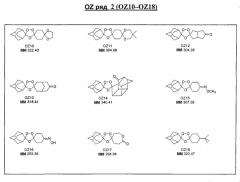
Ниже приведены некоторые диспиро-1,2,4-триоксоланы, синтезированные в соответствии с указаниями данного изобретения. "OZ" является внутренним обозначением для данных соединений, которое будет использовано во всей остальной части заявки для удобства.
\
Прототипными триоксоланами данного изобретения являются OZ03 и OZ05. Предпочтительные соединения, идентифицированные до настоящего времени, включают OZ03, OZ05, OZ11, OZ25, OZ27, OZ61, OZ71, OZ78, OZ127, OZ145, OZ156, OZ163, OZ175, OZ177, OZ179, OZ181, OZ189, OZ205, OZ207, OZ209, 0Z210, OZ219, OZ227, OZ229, OZ235, OZ255, OZ256, OZ257, OZ263, OZ264, OZ265, OZ266, OZ267, OZ268, OZ269, OZ270, OZ271, OZ277, OZ279, OZ281, OZ288, OZ289, OZ290, OZ296, OZ297, OZ298, OZ301, OZ305, OZ309, OZ315, OZ317, OZ319, OZ320, OZ323, OZ329, OZ333, OZ335, OZ336, OZ337, OZ338, OZ339, OZ343, OZ349, OZ351, OZ353, OZ354, OZ357, OZ358, OZ359, OZ365 и OZ368. Наиболее предпочтительными соединениями являются OZ78, OZ163, OZ181, OZ207, OZ209, OZ255, OZ256, OZ257, OZ263, OZ264, OZ267, OZ271, OZ277, OZ279, OZ301, OZ305, OZ315, OZ317, OZ319, OZ323, OZ329, OZ338, OZ339, OZ349, OZ351, OZ354, OZ357, OZ359 и OZ368, причем наилучшими из данных соединений, идентифицированных таким образом, являются OZ277 и OZ279. В общем случае, наибольшую активность in vitro против малярийных паразитов получают для триоксоланов, функционализированных или замещенных по 4-положению спироциклогексильного цикла. Как правило, также предпочтительными являются несимметричные, ахиральные триоксоланы.
Отличительными признаками данных спиро- и диспиро-1,2,4-триоксоланов по сравнению с полусинтетическими производными артемизинина являются их структурная простота и легкость синтеза. Например, диспиротриоксоланы могут быть легко синтезированы посредством соозонолиза O-метилоксимов циклоалканонов в присутствии необходимых производных циклоалканона в соответствии со способом Griesbaum et al. (1997a; 1997b), как проиллюстрировано ниже для симметричного диспироциклогексилтриоксолана:
Если в данной реакции соозонолиза выходы являются низкими, то их можно значительно увеличить, когда O-метилоксим и кетон "обращаются". Новая методика обеспечивает исключительно удобный способ для синтеза спиро- и диспиротриоксоланов. Преимущества оксим-эфирного пути перед алкеновым подходом включают удобный синтез исходных веществ (оксимных простых эфиров по сравнению с четырехзамещенными алкенами), более высокие выход и селективность целевых триоксоланов за счет целенаправленного выбора парных реакционных субстратов. Триоксоланы можно очищать кристаллизацией или колоночной флэш-хроматографией. Их структуры и чистоту можно подтвердить аналитической ВЭЖХ, 1Н- и 13С-ЯМР, ИК, температурой плавления и элементным анализом.
Недавно Griesbaum et al. (1997b) обнаружили, что четырехзамещенные 1,2,4-триоксоланы удобно получать озонолизом O-алкилоксимов кетона в присутствии карбонильных соединений.
Предполагают, что образование триоксолана из оксимного простого эфира и кетона является трехстадийным процессом. Последовательность начинается электрофильным присоединением озона к двойной связи оксима с образованием первичного озонида. На втором этапе очень нестабильный первичный аддукт фрагментируется до реакционноспособного оксида карбонила, что частично сопровождается попутным выделением относительно стабильного метилнитрита. На третьем этапе оксид карбонила претерпевает [3+2]циклоприсоединение с кетоном с образованием вторичного озонида или 1,2,4-триоксолана. Остается определить, является ли данный рекомбинационный процесс постадийным или протекающим одновременно.
Как продемонстрировано выше синтезом OZ03, наибольшая часть новых диспиротриоксоланов содержит спироадамантан и может быть синтезирована соозонолизом O-метилоксима адамантанона в присутствии необходимого производного циклоалканона. Предпочтительными реакционными растворителями для реакций соозонолиза являются углеводородные растворители, такие как пентан или циклогексан; более полярные растворители имеют тенденцию уменьшать выход реакции. Когда кетоны не являются легко растворимыми в пентане или циклогексане, можно применять смешанный растворитель (пентан/метиленхлорид) или один метиленхлорид. Несколько факторов определяют отношение оксимного простого эфира к кетону. В некоторых реакциях, чтобы избежать образования дипероксида (1,2,4,5-тетраоксана), предотвратить образование диозонида из дикетонов и активизировать реакцию с кетонами, легко растворимыми в пентане, применяют избыток кетона (2:1). В самом общем случае, на стадии исследовательского синтеза и особенно в случаях, когда кетоны не являются легко растворимыми в пентане, являются дорогими или трудноудалимыми, при обработке реакционной смеси можно использовать отношение кетона к оксимному простому эфиру 1:1. При крупномасштабных триоксолановых синтезах можно использовать 1,5-кратный избыток оксимного простого эфира для достижения более высоких степеней конверсии кетонов в целевые триоксолановые продукты, не создавая проблем с очисткой.
Существует несколько примеров, где применяют превращения после озонолиза для получения целевых триоксолановых соединений, которые трудно или в некоторых случаях невозможно получать непосредственно (Kashima et al., 1987) способом соозонолиза.
Триоксолановые третичные спирты OZ90 и OZ108 могут быть получены обработкой метиллитием триоксоланового кетона OZ05 и триоксоланового сложного эфира OZ70 соответственно. В других реакциях триоксолановый лактон OZ17 и триоксолановый спирт OZ32 получают обработкой OZ05 м-CPBA (мета-хлопербензойная кислота) и боргидридом натрия, соответственно. Кроме того, различные оксимные простые эфиры, гидразоны, кетали и амины (восстановительное аминирование с триацетоксиборгидридом натрия) также получают из триоксоланового кетона OZ05 с хорошими и отличными выходами. В примерах, отмеченных выше, является очевидным, что триоксолановый кетон OZ05 представляет собой ключевой интермедиат, так как его кетоновая функциональная группа предоставляет удобное средство для трансформации функциональной группы.
Дальнейшее очевидное свидетельство устойчивости данных триоксоланов к восстанавливающим агентам продемонстрировано восстановлением сложных триоксолановых эфиров OZ70 и OZ61 в их соответствующие триоксолановые спирты OZ119 и OZ89 смесью боргидрида лития и триэтилборгидрида лития и гидразинолизом триоксолановых фталимидов OZ136 и OZ146 в их соответствующие амины OZ137 и OZ209.
Как показано ниже в примерах, триоксолановые сложные эфиры можно удобным образом превратить в их соответствующие триоксолановые кислоты.
В дополнение к триоксолановому кетону OZ05, триоксолановому амину мезилата OZ209, триоксолановому сложному эфиру OZ61 и триоксолановой кислоте OZ78 триоксолановые спирты OZ119 и OZ89 должны и будут являться ключевыми интермедиатами для синтетических превращений после озонолиза. Недавним примером является синтез триоксоланового триазола OZ177 в реакции между мезилатным производным OZ119 и натриевой солью 1,2,4-триазола.
Было обнаружено, что способ соозонолиза с использованием эфиров метилоксима предоставляет быстрый, гибкий и предсказуемый доступ к структурно разнообразным триоксоланам. Фактически некоторые ключевые триоксоланы, которые служили важными билдинг-блоками, были получены в большом масштабе, включая OZ05 (100 ммоль), OZ61 (100 ммоль), OZ146 (60 ммоль), без уменьшения реакционных выходов по сравнению с обычным масштабом 5-10 ммоль. Кроме того, как OZ61, так и OZ146 могут быть удобным образом выделены в виде белых твердых веществ добавлением этанола к неочищенным реакционным смесям.
Эксперименты с дифференциальной сканирующей калориметрией (ДСК) (Cammenga and Epple, 1995) демонстрируют, что данные соединения обладают хорошей термической стабильностью, сравнимой с артемизинином. Средняя т.пл. с разложением составляет 160+15°С по сравнению с т.пл. с разложением 181°С для артемизинина. Предполагают, что термическое разложение данных триоксоланов инициируется образованием 1,5-дирадикала, образуемого гомолитическим расщеплением пероксидной связи триоксоланового цикла.Так как большая часть целевых триоксоланов содержит симметричный спироадамантановый структурный каркас, их стереохимия в значительной степени является функцией структуры кетона исходного вещества или реагентов, применяемых для реакций после озонолиза. Для OZ27 и других аналогичных 1,4-замещенных триоксоланов возможно наличие двух ахиральных диастереомеров. Однако, как продемонстрировано примером с OZ27, большую часть данных триоксоланов выделяют в виде единственных ахиральных диастереомеров в большей степени, чем в виде смесей двух ахиральных диастереомеров. Например, для OZ27 хиральность отсутствует, так как триоксолановый цикл и фенильный заместитель находятся в 1,4-взаиморасположении в шестичленном цикле. Такие соединения имеют плоскость симметрии.
Как определяют методом рентгеновской кристаллографии, OZ78, OZ209 и их производные имеют цис-конфигурацию в тех случаях, когда пероксидные кислороды находятся в аксиальном положении.
Исходное вещество, 2-адамантанон, может быть получен от Aldrich Chemical Co. или от TCI American Organic Chemicals или может также быть синтезировано. Специалисты в данной области могут легко предложить другие подходящие средства для синтеза исходных веществ и соединений в соответствии с данным изобретением.
Спиро- и диспиротриоксолановые композиции настоящего изобретения в основном могут быть использованы для профилактики и лечения малярии. Триоксолановые композиции настоящего изобретения вводят вместе с фармацевтически приемлемым носителем. Как правило, для данной цели можно использовать любой фармацевтически приемлемый носитель при условии, что носитель не оказывает значительного неблагоприятного влияния на стабильность или биодоступность триоксолановых соединений данного изобретения.
Триоксоланы данного изобретения можно вводить теплокровным животным, включая человека и других животных, в любой эффективной фармацевтически приемлемой форме, например в виде лекарственных форм для местного введения, промывания, перорального введения, парентерального введения, в виде свечей или в виде лекарственных форм для инфузии, таких как средства для местного, щечного, подъязычного введения или назальный спрей, или любым другим способом, обеспечивающим эффективную доставку этих средств. Предпочтительно способ введения должен обеспечивать оптимизацию доставки и/или локализацию средств в направлении клеток-мишеней.
В добавление к активным соединениям, т.е. триоксоланам, фармацевтические композиции данного изобретения могут содержать подходящие среды для лекарств и вспомогательные средства, облегчающие получение препаратов на основе активных соединений, которые могут использоваться как фармацевтические препараты. Лекарственные формы для перорального введения включают таблетки, капсулы и гранулы.
Препараты, которые могут быть введены ректально, включают свечи. Другие лекарственные формы включают растворы, подходящие для парентерального или перорального введения, а также композиции, которые могут быть введены щечным или подъязычным способом.
Фармацевтические композиции настоящего изобретения получают таким путем, который сам по себе хорошо известен в данной области. Например, фармацевтические композиции могут быть получены с помощью традиционных способов смешивания, гранулирования, получения драже, растворения, лиофилизации. В конечном итоге, способ выбирают в зависимости от физических свойств используемого активного ингредиента.
Подходящими средами для лекарств являются, в частности, наполнители, такие как сахара, например лактоза или сахароза, маннит или сорбит, целлюлозные препараты и/или фосфаты кальция, например трикальция фосфат или гидрофосфат кальция, а также связующие средства, такие как крахмал, паста, полученная, например, с использованием кукурузного крахмала, пшеничного крахмала, рисового крахмала, картофельного крахмала, желатина, трагакантовой камеди, метилцеллюлозы, гидроксипропилметилцеллюлозы, натрийкарбоксиметилцеллюлозы и/или поливинилпирролидона. По желанию могут быть добавлены дезинтегрирующие средства, такие как вышеупомянутые крахмалы, а также карбоксиметилкрахмал, поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, например альгинат натрия. Вспомогательными средствами являются средства, регулирующие текучесть, а также смазывающие средства, например, такие как диоксид кремния, тальк, стеариновая кислота или ее соли, например стеарат магния или стеарат кальция, и/или полиэтиленгликоль. Лекарственные формы для перорального введения могут быть снабжены подходящими покрытиями, которые по желанию могут быть устойчивыми к желудочным сокам.
Для данной цели можно использовать концентрированные растворы сахаров, которые необязательно могут содержать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. Для получения покрытий, устойчивых к желудочному соку, к покрытиям таблеток могут быть добавлены растворы подходящих целлюлозных препаратов, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы, красящие средства и пигменты, например, для идентификации или для характеристики разных сочетаний доз соединений.
Другие фармацевтические композиции, которые могут использоваться для перорального введения, включают плотно набитые капсулы из желатина, мягкие, герметично запечатанные капсулы из желатина, а также пластификатор, такой как глицерин или сорбит. Плотно набитые капсулы могут содержать активные соединения в виде гранул, которые могут быть смешаны с наполнителями, такими как лактоза, связующими средствами, такими как крахмалы, и/или смазывающими средствами, такими как тальк или стеарат магния, и необязательно со стабилизиаторами. В мягких капсулах активные соединения предпочтительно растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Возможные фармацевтические препараты, которые могут применяться путем ректального введения, включают, например, свечи, которые состоят из сочетания активных соединений и основы свечей. Подходящими основами для свечей являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы. Кроме того, можно также использовать желатиновые ректальные капсулы, которые состоят из сочетания активных соединений и основы. Возможные вещества для основы включают, например, жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды.
Подходящие композиции для парентерального введения включают водные растворы активных соединений в водорастворимой или вододиспергируемой форме. Кроме того, могут быть введены суспензии активных соединений в виде соответствующих масляных суспензий, предназначенных для инъекций.
Подходящие липофильные растворители или среды включают жирные масла, например кунжутное масло, или синтетические эфиры жирных кислот, например этилолеат или триглицериды. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, включающие, например, натрийкарбоксиметилцеллюлозу, сорбит и/или декстран. Такие композиции могут также включать вспомогательные средства, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие средства. Их также можно стерилизовать, например, фильтрацией через фильтр, задерживающий бактерии, или путем включения в композицию стерилизующих средств. Они могут быть также получены в виде стерильных твердых композиций, которые перед введ