Рекомбинантная плазмидная днк pfgm17, кодирующая полипептид гранулоцитарно-макрофагального колониестимулирующего фактора человека, и штамм бактерий escherichia coli bl21(de3)/pfgm17 - продуцент полипептида гранулоцитарно-макрофагального колониестимулирующего фактора человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к генетической инженерии и может быть использовано для получения гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека. Конструируют рекомбинантную плазмидную ДНК pFGM17, кодирующую конститутивный синтез полипептида ГМ-КСФ человека и состоящую из KpnI/EcoRI-фрагмента ДНК плазмиды pSPF1 и искусственной последовательности ДНК, кодирующей сигнальный пептид белка Caf1 Yersinia pestis, а также KpnI/EcoRI-фрагмента промежуточной плазмиды pSK-GM, включающего синтетический ген ГМ-КСФ человека. Клетки E. coli трансформируют плазмидной ДНК pFGM17 и получают штамм E. coli BL21(DE3)/pFGM17 - продуцент полипептида ГМ-КСФ человека. Изобретение позволяет повысить технологичность и экономичность процесса получения рекомбинантного ГМ-КСФ за счет исключения стадии индукции процесса биосинтеза при одновременном увеличении выхода целевого продукта в 2 раза. 2 н. п. ф-лы, 4 ил.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии. Может быть использовано для получения гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека.
Гранулоцитарно-макрофагальный колониестимулирующий фактор человека (ГМ-КСФ) может быть использован в терапии различных патологических состояний иммунной и кроветворной систем (анемических и миелодиспластических синдромов, нейтропении, СПИДа и др.), последствий лучевой и химиотерапии опухолевых заболеваний [Sakamoto K.M., Golde D.W., Gasson J.C. The biology and clinical applications of granulocyte-macrophage colony-stimulating factor. J. of Pediatrics, 1991, v.118, № 3, p.s17-s20], а также в иммунотерапии рака для экстракорпоральной активации дендритных клеток и стимуляции иммунного ответа на раковые антигены [Nestle F.О., Alijagic S., Gilliet M., Sun Y., Grabbe S., Dummer R., Burg G., Schadendorf D. Vaccination ofmelanoma patients with peptide - or tumor lysine - pulsed dendritic cells. Nature Med., 1998, v.4, p.328-332].
Известны способы получения ГМ-КСФ человека, основанные на экспрессии в трансформированных клетках млекопитающих [Wong G.G., Witek J.S., Temple P.A., Wilkens K.M., Leary A.C., Luxenberg D.P., Jones S.S., Brown E.L., Kay R.M., Orr E.G., Shoemaker C., Golde D.W., Kaufman R.J., Hewick R.M., Wang E.A., Clark S.C. Human GM-CSF: Molecular cloning of the complementary DNA and purification of the natural and recombinant proteins. Science, 1985, v.228, № 4701, p.810-815] и в дрожжах [Miyajima A., Otsu К., Schreurs J., Bond M.W., Abrams J.S., Arai K. Expression ofmurine and human GM-CSF in S. cerevisiae: mutagenesis of the potential glycosvlation sites. EMBO J., 1986, v.5., № 6, p.1193-1197]. Недостатком первого метода является крайне низкий выход целевого продукта (50 мкг белка из 1 л среды). Дрожжевые клетки обеспечивают более высокий уровень синтеза (0,5 мг из 1 л среды), однако в этом случае препятствием для использования препарата является видоспецифическое посттрансляционное гликозилирование.
Микробиологический синтез представляет собой перспективный способ получения ГМ-КСФ человека. Наиболее близким к заявляемому является способ, описанный в работе [Libby R.T., Braedt G., Kronheim S.R., March C.J., Urdal D.L., Chiaverotti S.R., Tushinski R.J., Mochizuki D.Y., Hopp T.P., Cosman D. Expression and purification of native human granulocyte-macrophage colony-stimulating factor from an e. coli secretion vector. DNA, 1987, v.6, №3, p.221-229]. Рекомбинантная плазмидная ДНК содержит ген искусственного предшественника ГМ-КСФ человека, который состоит из последовательности, кодирующей сигнальный пептид OmpA E. coli и кДНК зрелого ГМ-КСФ человека под контролем гибридного промотора Ipp-lac.
Синтез белка осуществляют при добавлении индуктора, изопропил-β-D-тиогалактопиранозида (ИПТГ), до конечной концентрации 2 мМ. Синтезируемый целевой белок после отщепления сигнальной последовательности оказывается в нерастворимом состоянии. Полученный белок очищают с помощью ионообменной и гидрофобной хроматографии в денатурирующих условиях, после чего проводят ренатурацию. В результате получают зрелый ГМ-КСФ человека с общим выходом 2,5 мг/л культуральной жидкости.
Недостатком способа является относительно низкий уровень синтеза ГМ-КСФ и использование больших количеств ИПТГ для индукции.
Изобретение решает задачу получения полипептида со свойствами ГМ-КСФ человека путем конститутивного синтеза, а также увеличение уровня его биосинтеза в бактериальных клетках.
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pFGM17, кодирующей конститутивный синтез полипептида со свойствами ГМ-КСФ человека, и штамма Escherichia coli BL21(DE3)/pEGM17, обеспечивающего синтез этого полипептида с уровнем экспрессии не ниже 15% суммарного клеточного белка. Высокий конститутивный уровень синтеза целевого полипептида обеспечивается тем, что плазмида pFGM17 обладает высокой копийностью и содержит lac-промотор E. coli, который в штаммах, не являющихся суперпродуцентами lac-репрессора, работает как конститутивный.
Рекомбинантная плазмидная ДНК pFGM17, кодирующая полипептид со структурой ГМ-КСФ человека, характеризуется следующими признаками:
имеет молекулярную массу 2,04 Md (3,133 т.п.о.);
кодирует аминокислотную последовательность искусственного предшественника ГМ-КСФ человека;
состоит из KpnI/EcoRI - фрагмента ДНК плазмиды pSPFl [Петровская Л.Е., Крюкова Е.А., Якимов С.А., Вульфсон А.Н., Алибаева Р.А., Гузаев А.А., Абрамов В.М., Коробко В.Г. Влияние топографии сайта сигнальной пептидазы на эффективность секреции в периплазму Escherichia coli рекомбинантного гранулоцитарно-макрофагального колониестимулмрующего фактора человека. Биоорган. химия, 1995, т.21, № 12, с.912-919] длиной 2,686 т.п.о., содержащего lac-промотор Е. coli, ген bla β-лактамазы, фрагмент гена lacZ Е. coli, участок ori инициации репликации и искусственную последовательность ДНК, кодирующую сигнальный пептид белка Cafl Yersinia pestis; а также из KpnI/EcoRI фрагмента промежуточной плазмиды pSK-GM длиной 447 п.о., включающего синтетический ген ГМ-КСФ человека;
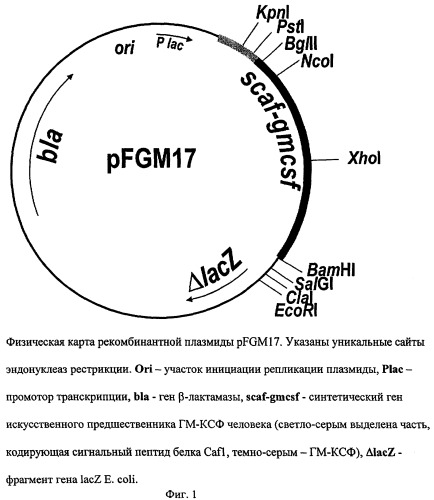
содержит: lac-промотор Е. coli, синтетический ген искусственного предшественника ГМ-КСФ человека, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pFGM17 клеток к ампициллину, участок ori инициации репликации; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: KpnI - 280, PstI - 293, BglII - 309, NcoI - 333, Xhol - 474, BamHI - 688, SalGI - 700, ClaI - 710, EcoRI - 727.
Особенностью предложенной плазмидной конструкции является то, что нуклеотидная последовательность зрелого ГМ-КСФ человека вместе с последовательностью, кодирующей сигнальный пептид белка Cafl Yersinia pestis, входит в состав гена искусственного предшественника, который находится под контролем lac-промотора Е. coli. При использовании штаммов Е. coli, являющихся суперпродуцентами lac-penpeccopa (laclq-штаммов, например, JM101), для индукции промотора и синтеза целевого белка требуется добавление IPTG в небольших концентрациях (0,1 мМ). В штаммах, не являющихся суперпродуцентами lac-penpeccopa (например, BL21(DE3)), экспрессия данного гена не зависит от наличия индуктора, что обеспечивает высокоэффективный конститутивный синтез белка-предшественника, который расщепляется сигнальной пептидазой клеток бактерий с образованием зрелого ГМ-КСФ (целевого продукта).
Использование секреторного аппарата бактериальных клеток для гетерологичной экспрессии обладает рядом преимуществ, в частности, позволяет получать целевой белок, лишенный N-концевого метионина, в растворимом состоянии из периплазмы, минуя стадию разрушения клеточной стенки. Кроме того, наличие последовательности, кодирующей сигнальный пептид, на 5'-конце гена искусственного предшественника позволяет обойти затруднения, часто возникающие при экспрессии GC-богатых последовательностей. Использование сигнальной последовательности Cafl Yersinia pestis объясняется тем, что данный белок, который является компонентом бактериальной капсулы, синтезируется и секретируется с высокой эффективностью.
N-концевая последовательность зрелого ГМ-КСФ содержит остаток аргинина и, следовательно, несет положительный заряд, отрицательно влияющий на эффективность отщепления сигнальной последовательности [Yamane К., Mizushima S. Introduction of basic amino acid residues after the signal peptide inhibits protein translation across the cytoplasmic membrane of E. coli. J. Biol. Chem., 1988, v.263, №36, p.19690-19696]. Для устранения этого влияния остаток аспарагина в положении (-2) относительно сайта отщепления был заменен остатком аспарагиновой кислоты, что привело к нейтрализации заряда данного участка и повышению эффективности отщепления сигнальной последовательности. Первичная структура зрелого ГМ-КСФ при этом не изменилась. Эта замена была осуществлена путем клонирования олигонуклеотидного дуплекса соответствующей структуры (см. пример 1) между сайтами расщепления рестриктаз Kpnl (в 3'-концевой части последовательности, кодирующей сигнальный пептид) и BglII (в 5'-концевой части гена gmcsf).
Экспрессия гена гибридного предшественника в клетках Е. coli сопровождается частичной транслокацией зрелого ГМ-КСФ в периплазматическое пространство, откуда целевой белок может быть выделен в растворимом виде, однако большая часть белка после отщепления сигнальной последовательности остается в нерастворимом состоянии. Для его выделения необходимо использование денатурирующих агентов.
Для получения штамма-продуцента полипептида со структурой ГМ-КСФ человека трансформируют компетентные клетки Escherichia coli BL21(DE3) рекомбинантной плазмидой pFGM17.
Полученный штамм Escherichia coli BL21(DE3)/pFGM17 характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1×3-5 мкм, подвижные.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный, диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-42°С при оптимуме рН 6,8-7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена беталактамазы.
Штамм Е. coli BL21(DE3)/pFGM17 обеспечивает конститутивный синтез полипептида со свойствами ГМ-КСФ человека в количестве не менее 15% от суммарного клеточного белка, что в 2 раза выше, чем в прототипе, при этом в отличие от прототипа проведение операции индукции в ходе культивирования штамма не требуется. Совокупность перечисленных свойств штамма Е. coli BL21(DE3)/pFGM17 обусловливает большую технологичность процесса получения рекомбинантного полипептида.
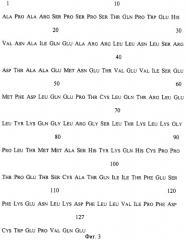
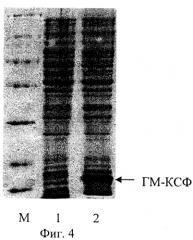
На фиг.1 представлена физическая карта рекомбинантной плазмиды pFGM17; на фиг.2 - нуклеотидная последовательность синтетического гена искусственного предшественника ГМ-КСФ человека с прилегающими регуляторными элементами: lac - промотор (1-84 п.о.), последовательность ДНК, кодирующая сигнальный пептид белка Cafl (123-206 п.о.), ген gmcsf (207-590 п.о.); инициирующий и терминирующий кодоны выделены жирным шрифтом, подчеркнуты сайты рестриктаз: KpnI, Pstl, BgIII и BamHI; на фиг.3 - аминокислотная последовательность полипептида ГМ-КСФ, кодируемого рекомбинантной плазмидой pFGM17; на фиг.4 - электрофореграмма лизатов клеток штамма-реципиента Е. coli BL21(DE3) (дорожка 1), штамма-продуцента Е. coli BL21(DE3)/pFGM17 (дорожка 2) в 13%-ном полиакриламидном геле (М - белковые маркеры молекулярной массы; стрелкой указан полипептид ГМ-КСФ).
Изобретение иллюстрируют следующие примеры.
Пример 1. Конструирование промежуточной рекомбинантной плазмидной ДНК pSK-GM.
5 мкг плазмидной ДНК pBluescript (SK)+("Stratagene", США) обрабатывают последовательно рестриктазами Kpnl и SalGI (Fermentas, Литва) в фирменных буферных растворах и из полученного гидролизата выделяют в 0,8%-ном геле легкоплавкой агарозы линеаризованную векторную плазмидную ДНК.
5 мкг плазмидной ДНК pGMS231 [Петровская Л.Е., Рузин А.В., Шингарова Л.Н., Коробко В.Г. "Конструирование рекомбинантных штаммов Escherichia coli, детерминирующих секреторную экспрессию искусственных генов гранулоцитарно-макрофагального колониестимулирующего фактора человека." Биоорган. химия, 1995, т.21, № 12, с.845-854] обрабатывают совместно рестриктазами BglII и SalGI и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы фрагмент длиной 0,391 т.п.о., содержащий ген gmcsf.
0,5 мкг полученного фрагмента длиной 0,391 т.п.о. и 0,1 мкг векторной части плазмиды pBluescript (SK)+ сшивают при помощи 3 ед. Т4 ДНК-лигазы (Fermentas, Литва) в 20 мкл буфера для лигирования (Fermentas) с 50-кратным молярным избытком олигонуклеотидного дуплекса:
CATTGCAACTGCAGATGCGGCACCTGCTA
CATGGTAACGTTGACGTCTACGCCGTGGACGATCTAG
10 мкл реакционной смеси используют для трансформации 100 мкл компетентных клеток Escherichia coli XL-1 Blue ("Stratagene", США). 1/10 часть от общего количества клеток, использованных для трансформации, высевают на LB-агар, содержащий 75 мкг/мл ампициллина. В процессе рассева клеток на поверхность агара добавляют 100 мкл 0,1 М раствора ИПТГ и 20 мкл 4%-ного раствора 5-бромо-4-хлоро-3-индоксил-β-D-галактозида.
Конструирование промежуточной рекомбинантной плазмидной ДНК pSK-GM позволяет использовать принцип цветной селекции для поиска клонов, содержащих встраиваемый фрагмент. Из выросших белых клонов выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность отобранных ДНК и окончательно отбирают плазмидные ДНК, в которых нуклеотидная последовательность гена gmcsf полностью соответствует данным, приведенным на фиг.2.
Пример 2. Конструирование рекомбинантной плазмидной ДНК pFGM17.
5 мкг плазмидной ДНК pSK-GM обрабатывают последовательно рестриктазами Kpnl и EcoRI (Fermentas, Литва) и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы фрагмент длиной 0,447 т.п.о., содержащий ген gmcsf.
5 мкг плазмидной ДНК pSPFl обрабатывают последовательно рестриктазами Kpnl и EcoRI и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы векторную ДНК длиной 2,686 т.п.о.
Полученный фрагмент и векторную ДНК соединяют при помощи лигазной реакции в 20 мкл буфера для лигирования (Fermentas), содержащего 2 ед. Т4 ДНК-лигазы. 10 мкл реакционной смеси используют для трансформации 100 мкл компетентных клеток XL-1 Blue. 1/10 клеток, использованных для трансформации, высевают на LB-агар, содержащий 75 мкг/мл ампициллина. Из выросших клонов выделяют целевую плазмидную ДНК pFGM17 и анализируют ее путем обработки набором эндонуклеаз рестрикции HaeIII, HinDIII, EcoRV, Kpnl и EcoRI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 5% лолиакриламидном геле.
Окончательно структуру рекомбинантной ДНК pFGM17 подтверждают определением нуклеотидной последовательности в области встроенного фрагмента, содержащего синтетический ген ГМ-КСФ человека.
Пример 3. Получение и определение продуктивности штамма-продуцента полипептида со свойствами ГМ-КСФ человека.
Рекомбинантной плазмидной ДНК pFGM17 трансформируют компетентные клетки Escherichia coli BL21(DE3) (Novagen) и получают штамм-продуцент полипептида со свойствами ГМ-КСФ человека. Клетки Е. coli BL21(DE3)/pFGM17 выращивают при 37°С в 20 мл жидкой среды LB, содержащей 75 мкг/мл ампициллина, в течение 16 ч на качалке при 175 об/мин. Отбирают пробу 1 мл и центрифугируют 5 мин при скорости 6000 об/мин, после чего клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 5 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси R-250 (фиг.4), сканируют и рассчитывают процентное содержание рекомбинантного белка в лизатах с использованием программы Scion Image (Scion Corp., США). По данным сканирования полипептид ГМ-КСФ составляет 15% от общего клеточного белка.
Пример 4. Выделение и характеризация рекомбинантного полипептида со свойствами ГМ-КСФ человека.
Клетки Е. coli BL21(DE3)/pFGM17 выращивают при 37°С в 200 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, в течение 16 ч на качалке при 175 об/мин. Клетки центрифугируют, после чего 1 г влажной биомассы суспендируют в 10 мл буфера А (20 мМ трис, рН 8, 300 мМ NaCl, 0,1% Тритон Х-100, 10% сахароза, 1 мМ фенилметилсульфонилфторид, 5 мМ ЭДТА) и подвергают обработке ультразвуком (6-10 импульсов по 10 секунд каждый) на ледяной бане. Осадок после центрифугирования промывают 2 раза буфером В (50 мМ трис, рН 8, 20 мМ ЭДТА, 0,5% Тритон Х-100), растворяют в 2 мл буфера С (10 мМ трис, рН 8, 6 М мочевина, 10 мм бета-меркаптоэтанол, 20 мМ NaCl) и наносят на колонку с Sephadex G-100 (Pharmacia) объемом 70 мл, предварительно уравновешенную буфером С. Гель-фильтрацию проводят в том же буфере в течение 20 ч при скорости элюции 2 мл/ч. Содержащие очищенный белок фракции определяют по результатам электрофореза в SDS-ПААГ по Лэммли.
Ренатурацию проводят путем медленного добавления раствора белка к равному объему буфера D (10 мМ трис, рН 8,5, 500 мМ NaCl, 1 мМ ЭДТА) с последующим диализом в 50-кратном объеме буфера Е (10 мМ трис, рН 8, 100 мМ NaCI, 1 мМ ЭДТА) в течение ночи. Полученный раствор стерилизуют фильтрованием через 0,22 мкм фильтр (Millipore).
Описываемый способ выделения позволяет получить 1,5 мг ГМ-КСФ из 1 г влажной биомассы, что соответствует 1,5 мг белка из 100 мг лиофилизированной биомассы.
N-концевую аминокислотную последовательность определяют на секвенаторе 477А и ФТГ анализаторе 120А фирмы "Applied Biosystems", США. Препарат рекомбинантного ГМ-КСФ человека имеет следующую структуру N-конца молекулы: Ala Pro Ala Arg Ser Pro Ser..., т.е. полностью соответствует структуре N-конца природного ГМ-КСФ человека.
Таким образом, заявляемое техническое решение позволяет получить полипептид со структурой и свойствами, идентичными структуре и свойствам природного ГМ-КСФ человека; биосинтез полипептида конститутивен, и при этом уровень его синтеза составляет не менее 15% от суммарного клеточного белка за счет того, что ген ГМ-КСФ находится под контролем lac-промотора Е. coli в составе высококопийной плазмиды. Все это позволяет значительно повысить технологичность и экономичность процесса получения рекомбинантного ГМ-КСФ за счет исключения стадии индукции процесса биосинтеза при одновременном увеличении выхода целевого продукта в 2 раза.
1. Рекомбинантная плазмидная ДНК pFGM 17, кодирующая полипептид гранулоцитарно-макрофагального колониестимулирующего фактора человека (ГМ-КСФ), имеющая молекулярную массу 2,04 Md (3,133 т.п.о.) и состоящая из KpnI/EcoRI - фрагмента ДНК плазмиды pSPFl, длиной 2,686 т.п.о., содержащего lac-промотор Е. coli, ген bla β-лактамазы, фрагмент гена lacZ E. coli, участок ori инициации репликации и искусственную последовательность ДНК, кодирующую сигнальный пептид белка Cafl Yersinia pestis, а также KpnI/EcoRI фрагмента промежуточной плазмиды pSK-GM длиной 0,447 т.п.о., включающего синтетический ген ГМ-КСФ человека, последовательность которого приведена на фиг.2, и содержащая уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: KpnI - 280, PstI - 293, BglII - 309, NcoI - 333, Xhol - 474, BamHI - 688, SalGI - 700, ClaI - 710, EcoRI - 727.
2. Штамм бактерий Escherichia coli BL21(DE3)/pFGM17 - продуцент полипептида гранулоцитарно-макрофагального колониестимулирующего фактора человека .