Способ лечения онкологических заболеваний
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для лечения злокачественных новообразований. Способ включает введение вакцины, представляющей собой комплексы "белок теплового шока-опухолевый пептид", выделенные из опухолевой ткани пациента, и радиоактивного препарата "Онкофер". Причем "Онкофер" вводят как в течение проводимого курса вакцинации, так и после вакцинации. Способ позволяет получить стойкий противоопухолевый иммунитет, усилить апоптоз опухолевых клеток и блокировать кровоснабжение опухолевых метастазов за счет изменения радиоактивным препаратом свойств эритроцитов в опухолевых сосудах и активации в них тромбообразования. 1 з.п. ф-лы, 2 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины и может быть использовано для лечения злокачественных новообразований сочетанием иммунотерапевтического и радиотерапевтического методов, в частности с использованием аутологичных вакцин.
Уровень техники
Иммунологические подходы регуляции опухолевого роста известны довольно давно. Попытки использовать опухолевые антигены в качестве основ для вакцин имели успех, однако с большими оговорками. В отличие от заболеваний вирусной природы, в которых зачастую Т-клеточные антигены известны, в подавляющем большинстве опухолей структура опухолевых антигенов неизвестна. Кроме того, они часто мутируют и не всегда представляются опухолевыми клетками, поскольку опухоли могут обладать слабой иммуногенностью и иметь нарушения в механизмах, связанных с экспрессией субъединиц главного комплекса гистосовместимости I типа (МНС I), как одного из важнейших структурных образований, необходимых для представления антигена CD8+-Т-лимфоцитам.
Современная иммунотерапия приняла в качестве основ противоопухолевой защиты белки теплового шока (БТШ) в комплексе с опухолевыми пептидами (ОП). Эти комплексы содержатся в большом количестве в опухолевой ткани пациента, удаляемой при операции. Они могут быть выделены из опухоли и возвращены этому же пациенту для индукции специфического противоопухолевого ответа (т.н. аутологичная вакцинация).
Иммуностимулирующая активность комплексов "БТШ-ОП" имеет молекулярно-биологическую основу. БТШ являются полифункциональными объектами клеточного метаболизма. С одной стороны, они выполняют функцию чаперонов, обеспечивая корректный фолдинг денатурированных в результате клеточного стресса белков, а с другой - являются стимуляторами неспецифического иммунитета, что очень важно в ослабленном организме. Кроме того, БТШ очень редко или вообще никогда не мутируют в опухолях: идентичность БТШ-последовательностей на нуклеотидном уровне из нормальной и опухолевой тканей одного происхождения составляет 100%. Так опухоль стремится сохранить важнейшие для ее жизнедеятельности функции, завязанные на решение структурной судьбы других белков. Родоначальником направления, связанного с иммунотерапией опухолей аутологичными белками теплового шока, является Р.Srivastava. Метод, предложенный ученым, защищен во множестве патентов: US Patent 5837251, US Patent 5935576, US Patent 5750119, US Patent 5948646, US Patent 5961979, US Patent 5985270, US Patent 6475490, US Patent 6468540, US Patent 6461615, US Patent 6455503, US Patent 6447781, US Patent 6410028, US Patent 6403095, US Patent 6399070, US Patent 6322790, US Patent 6162436, US Patent 5830464.
Наряду с иммунотерапией актуален радиотерапевтический метод, который является дополнительным средством и применяется как в лечебных, так и диагностических целях (см., например, RU 2053776, 10.02.1996). Однако применение только одних изотопов не способно защитить пациента от рецидива заболевания и сформировать противоопухолевый иммунитет: они могут, в случае рецидива опухоли, быть использованными еще раз, что может превысить допустимую дозу облучения. В связи с этим существует реальная необходимость в комбинированном подходе, в сочетании иммуностимулирующего и радиологического компонентов, которые могут удачно дополнять друг друга в плане усиления апоптотической, антипролиферативной активностей.
Широко используемая в настоящее время радиотерапия опухолей также имеет массу недостатков. Прежде всего, под неконтролируемое воздействие луча попадают и здоровые клетки, в том числе клетки иммунной системы. Кроме того, в опухолевых клетках, которые выживают после такого воздействия, происходит индукция пролиферации эндотелия, что обеспечивает молекулярную основу для неоангиогенеза. На фоне проведенного облучения, таким образом, создаются все условия для дальнейшего опухолевого роста.
Нельзя также не учитывать тот факт, что хирургическое удаление опухоли, из которой в дальнейшем выделяются комплексы "БТШ-ОП", сильно стимулирует рост и инвазивность метастазов, возможно имеющихся в организме к моменту хирургического вмешательства. Клетки материнской опухоли экспрессируют ангиостатин - белок, "тормозящий" рост новых сосудов на периферии. С удалением опухоли, источника ангиостатина, рост метастазов становится неконтролируем. В этой связи использование компонента, блокирующего кровоснабжение метастазов, является приоритетным на фоне применяемой иммунотерапии.
Известен способ лечения, предусматривающий введение пациенту белков теплового шока, ковалентно связанных с радиоизотопами (US Patent 6455493). Альтернативный метод использования БТШ изложен в другом патенте, - US Patent 6455493. Согласно методу, БТШ, либо его фрагмент, используется в комплексе (ковалентном, нековалентном, в качестве слитых белков) с токсинами, а также с радиоактивными изотопами, т.е. применяются БТШ-иммунотоксины. Авторами предложен способ уменьшения количества иммунных клеток за счет индукции их апоптоза, вызванном цитотоксическими Т-лимфоцитами. При этом киллерная активность опосредуется за счет того факта, что на клетках-мишенях имеются собственные БТШ, которые являются антигенами. С одной стороны, имеет место классический иммунологический сценарий, согласно которому эндогенные БТШ проходят протеосомный путь деградации и представляют свои антигены, против которых вырабатывается иммунный ответ. При этом недостатком данного подхода является тот факт, что БТШ-иммунотоксины, связываясь со своими рецепторами на поверхности антиген-представляющих клеток (АПК), могут вызвать апоптоз самих АПК, что ослабляет возможность организма для представления антигенов. Совершенно очевидно, что для противоопухолевой терапии данный подход абсолютно неприменим, и использование токсинов можно применять в сочетании с другими белковыми факторами, не имеющими рецепторов на поверхности АПК.
За прототип предложенного изобретения принят способ лечения онкологических заболеваний, предусматривающий введение пациенту вакцины, содержащей композицию антиапоптотических белков теплового шока, состоящую из БТШ70, БТШ90, БТШ96 (US Patent 6468540). Согласно данным, диапазон концентраций, необходимых для иммунизации больного, составляет от 7,5 до 18.75 мг на человека средним весом 75 кг. При этом, согласно данным клинических испытаний, адекватный противоопухолевый иммунитет достигается у 75% пациентов. Это говорит о том, что суммарная конечная концентрация БТШ является фактором, зависящим от исходного сырья, которое не всегда, в силу понятных причин, бывает в достаточном количестве. Поэтому вводимую концентрацию трудно однозначно определить либо стандартизовать: иммунный ответ всегда персональный, и на одну и ту же концентрацию разные пациенты реагируют по-разному. У оставшихся 25% пациентов наблюдается рост метастазов, который проведенная иммунотерапия не смогла нивелировать. Поэтому, в случае недостаточной концентрации комплексов БТШ, необходим дополнительный фактор, который позволит усилить апоптоз опухолевых клеток. С учетом специфики постхирургической стимуляции опухолевых метастазов, необходим фактор блокирования их кровоснабжения.
Сущность изобретения
Задачей настоящего изобретения является разработка комплексного метода лечения новообразований различного рода, который обеспечивает, с одной стороны, иммунотерапию опухоли, а с другой - блокаду кровоснабжения опухолевых метастазов, стимулируемых после удаления материнской опухоли.
Поставленная задача решается описываемым способом лечения злокачественных новообразований, включающий введение вакцины, представляющей собой комплекс "белков теплового шока-опухолевый пептид", выделенных из опухолевой ткани пациента, в комбинации с введением радиоизотопов в эффективных количествах, как в течение курса вакцинации, а также после вакцинации на рекомендованный врачом период.
Эффективность предложенного метода лечения основана на следующем. В зависимости от стресса, который испытывает опухоль (гипоксия, кислородное или глюкозное голодание, облучение, гипертермия и т.п.) повышается фракция индуцибельных форм анти-апоптотических БТШ, и иммуногенность опухоли может значительно повыситься. На ее поверхности формируются комплексы "МНС1-ОП", и в этот момент она становится доступной для атаки CD8+ - Т-лимфоцитов. Фактически, традиционное противоопухолевое лечение сводится к повышению иммуногенности опухоли с формированием стрессовых условий, использованию неспецифических цитостатиков, и облучению, которое губит, в том числе, необходимые в этой ситуации нормальные клетки Т-клеточной защиты. Применение комплексов "БТШ-ОП" в качестве иммунотерапевтического средства имеет неоспоримые преимущества перед традиционным лечением. Во-первых, в данной ситуации не нужно знать структуру антигена, который образует комплекс с БТШ. Выделение и очистка комплексов целиком и полностью завязана на БТШ как на носитель.
Во-вторых, иммунизация аутологичными БТШ стимулирует цитотоксическую и макрофагальную активность - ценнейшее достижение противоопухолевой неспецифической защиты, которого нет в традиционном подходе. В-третьих, иммунизация комплексами "БТШ-ОП" формирует стойкий противоопухолевый иммунитет против того вида опухоли, откуда комплексы были выделены. Активируются CD4+ и CD8+-Т-лимфоциты, NK-клетки, созревание дендритных клеток.
В качестве составляющей в комбинированном противоопухолевом лечении был выбран "Онкофер", - радиоактивное железо Fe59 с наведенной радиоактивностью 0,8 мКи. Выбор в пользу данного препарата основывался на следующих его свойствах. Во-первых, Fe59 образует комплекс с белком транспортной системы железа - трансферрином. В составе этого комплекса, за счет трансферриновых рецепторов, которые имеются в изобилии на опухолевой клетке, путем рецептор-опосредованного эндоцитоза Fe59 проникает в опухолевую клетку и избирательно вызывает ее некроз. Во-вторых, радиоактивное железо вытесняет нормальное железо гемоглобина, что изменяет свойства эритроцитов в сосудах, питающих опухоль. При этом имеет место активная стимуляция тромбообразования, что нарушает кровоснабжение опухоли с последующей ее гибелью. Использование такого подхода несет своеобразную терапевтическую и диагностическую ценность.
Радиотерапия, в сочетании с вакцинированием, позволяет достичь более эффективных результатов, особенно в случае сниженного иммунитета у пациентов.
Сведения, подтверждающие возможность осуществления изобретения
Ниже приведены конкретные примеры активации противоопухолевого ответа, не ограничивающие объем изобретения:
Пример 1. Оценка протективного иммунитета, индуцируемая комплексами "БТШ-ОП", а также некроза клеток, вызванного радиоактивными изтотопами, проведена на животных. Для иммунизации брались мыши BALB/C. Опухолевые клетки брались от животных-опухоленосителей с карциномой молочной железы. Из опухолевых клеток была приготовлена вакцина, обогащенная фракциями БТШ. Первая группа мышей получала вакцину "БТШmix", вторая - комбинацию вакцины с препаратом "Онкофер" (БТШ+Fe59). Животным из контрольной группы вводился фосфатно-солевой буфер. Животным из опытных групп вакцина вводилась подкожно в объеме 100-500 мкл в область затылка дважды с недельным интервалом (-14 день, -7 день), при этом в группе (БТШmix+Fe59) вакцинация проводилась на фоне введения изотопа. Препарат измельчали и вводили мышам с 15 мл воды для инъекций. Полученную смесь вводили перорально каждой мыши в объеме 0.5 мл. Через неделю после второй вакцинации всем животным вводили живые опухолевые клетки, в течение 1 месяца проводили мониторирование роста опухоли. После декапитации оценивали размер привитой опухоли, текстуру, признаки воспаления, некроза. Визуальная оценка показала, что у всех мышей контрольной группы, получивших живые опухолевые клетки, наблюдался рост и быстрое развитие опухолевой ткани. В группе БТШmix наблюдались слабые признаки опухолеобразования, с уверенной тенденцией к некрозу, а в группе БТШmix+Fe59 участки опухолевого роста практически отсутствовали. Это говорит о сильном влиянии радиологической составляющей на модуляцию опухолевого роста, об ускорении апоптоза опухолевых клеток за счет повышения иммуногенности опухолевой ткани in vivo.
Пример 2. Оценка цитотоксичности комплексов "БТШ-опухолевый пептид" в комбинации с "Онкофером" проводилась in vitro спленоцитах, Т-лимфоцитах. Иммунизация животных проводилась в соответствии со схемой, описанной в предыдущем примере. На 7-10 день мышей декапитировали. 8 мл спленоцитов культивировали с 40000 опухолевых клеток, обработанных гамма-излучением (10000 рад) в 3 мл среды РРМ1, содержащей 10% фетальной бычьей сыворотки. Через 6 дней проводили оценку цитотоксичности Т-лимфоцитов (CTL). Отличия в CTL-активности в группах БТШmix и БТШmix+Fe59, по сравнению с контрольной, были статистически достоверными (Р<0.05), хотя между ними отличия были недостоверными. Эти результаты говорят о том, что фоновое использование Fe59 не влияет на иммунный ответ (т.е. не влияет на активность Т-клеток), а в сочетании с экспериментами in vivo позволяет сделать вывод о необходимости дополнительной стимуляции апоптоза опухолевых клеток за счет наведенной радиоактивности.
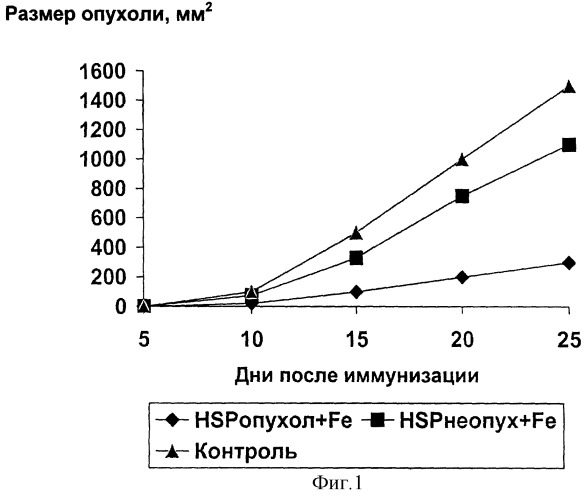
Пример 3. Проводилась сравнительная оценка противоопухолевой активности между аутологичными БТШ-комплексами, взятыми из опухолевой и неопухолевой ткани, в комбинации с препаратом "Онкофер". В экспериментах участвовало 3 группы животных - мышей C57BL/6. На фоне "Онкофера" первая группа иммунизирована лизатом опухолевых клеток меланомы В16Р10, вторая группа - лизатом, обогащенным БТШ из печени, третья группа получала только "Онкофер". Индукция антиопухолевой активности оценивалась по размеру опухоли (Фиг.1). Различия в размере опухоли установлены с использованием Т-критерия Стъюдента (уровень значимости Р<0.05). Показано, что противоопухолевой активностью обладают комплексы "БТШ-пептид" в сочетании с радиоактивным изотопом, в то время как комплексы БТШ не из опухоли, даже в сочетании с радиоактивным изотопом, не обладали достаточной противоопухолевой активностью.
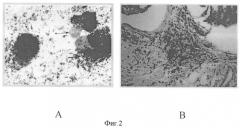
Пример 4. Изучалось влияние "Онкофера" на блокаду кровоснабжения некоторых типов опухолевых тканей in vivo. Препарат назначался в соответствии со стандартными схемами в диагностических целях для мониторирования пролиферативной активности. Показано, что, вне зависимости от вида и размера опухоли, происходило избирательное накопление Fe59 в сосудистой сети, что вызывало тромбообразование и некроз опухолевых клеток (Фиг.2).
Таким образом, преимущество предлагаемого метода противоопухолевой терапии выражается в следующем.
Во-первых, использование только одной вакцинации вызывает, в зависимости от вида опухоли, стимуляцию противоопухолевой активности у 75% пациентов. С одной стороны, эти показатели являются довольно высокими, однако и они требуют определенного уровня собственного, неспецифического иммунитета пациента. В ряде случаев состояние пациентов не позволяет достичь желаемого эффекта. Радиологическая составляющая позволяет внести дополнительный вклад в избирательную гибель опухолевых клеток, нарушая кровоснабжение опухолевых метастазов, чей рост и инвазивная активность незамедлительно стимулируются после хирургического удаления материнской опухоли.
Во-вторых, для выделения необходимого количества БТШ-белков для вакцинации требуется определенное количество опухолевой ткани: согласно клиническим испытаниям, минимальное количество составляет 1-3 г опухоли. Не всегда имеется возможность получить требуемое количество ткани, что является существенным недостатком моно-иммунотерапии: при наличии меньшего количества ткани есть вероятность, что противоопухолевый иммунитет будет недостаточен. Фоновое использование радиотерапии позволяет увеличить противоопухолевую активность за счет повышения иммуногенности опухоли и/или метастазов при воздействии наведенной изотопами реактивности.
В третьих, применение "Онкофера" является также диагностическим методом, позволяющим мониторировать поствакцинальное состояние пациента, визуализируя накопление Fe59 в оставшейся опухолевой ткани.
Предложенный способ лечения, представляющий собой удачную комбинацию иммунотерапевтических, диагностических и радиотерапевтических методов лечения опухолей и метастазов, рекомендован для использования в медицине, ветеринарии и/или в научно-исследовательских целях.
Краткое описание фигур чертежей
Фиг.1. Индукция противоопухолевой активности комплексов "БТШ-ОП", взятых их опухолевой ткани, из неопухолевой ткани, в комбинации с "Онкофером" (HSPопухол+Fe, HSPнеопухол+Fe, Контроль).
Фиг.2. Гистопрепарат увеальной меланомы (А) и опухоли молочной железы (В). На обоих препаратах отчетливо видны участки некроза, вызванные "Онкофером", а также сохранившиеся участки опухоли с включениями гранул железа. Препарат избирательно накапливается в опухоли (А, пунктирная стрелка) в зависимости от ее размера, вызывает в месте накопления тромбообразование в микроциркуляторном русле, что индуцирует нарушение кровоснабжения опухоли с последующим некрозом (А и В, жирная стрелка).
1. Способ лечения злокачественных новообразований, включающий введение вакцины, представляющей собой комплексы "белок теплового шока - опухолевый пептид", выделенные из опухолевой ткани пациента, и радиоактивного препарата "Онкофер".
2. Способ по п.1, отличающийся тем, что "Онкофер" вводят как в течение проводимого курса вакцинации, так и после вакцинации.