Способ оценки степени ионности химической связи атомов в молекуле
Иллюстрации
Показать всеИзобретение относится к области аналитической химии. Технический результат изобретения: повышение достоверности количественной оценки степени ионности химической связи атомов в молекуле. Сущность: способ включает определение физическими методами величины потенциалов ионизации и энергию сродства атомов к электрону, потенциал ионизации положительно заряженного иона, радиусы нейтральных атомов и их ионов и по расчетной формуле проводят оценку степени ионности химической связи атомов в молекуле.
Реферат
Изобретение относится к области химии, в частности к обоснованию механизма химической связи.
Известен способ оценки степени ионности химической связи i по отношению эффективного Zэф. к расчетному Zрасч. заряду атома (Князев Д.А., Смарыгин С.Н. Неорганическая химия. - М.: Высшая школа, 1990 г., 430 с.).
Однако эффективные заряды атомов трудно определимы и для многих соединений неизвестны. Поэтому достоверность оценки ионности связи атомов по этому способу низка.
Известен также способ оценки степени ионности химической связи, определяемой через электроотрицательность атомов, образующих полярную связь по формуле Полинга (Глинка Н.Л. Общая химия. Издание двадцать девятое. М.: Интеграл-пресс, 2002 г., 727 с.).
где Δχ=χA-χB; χA, χB - электроотрицательности атомов А и В; а - постоянная, значение которой принимается равным 0,2.
Электроотрицательность χ - это условная величина, характеризующая способность атома притягивать к себе электроны. Причем предложено три шкалы электроотрицательности:
1. Шкала Полинга разработана на основе представлений о величине энергии резонанса между ковалентной и ионной связями. За энергию резонанса принимается величина, на которую энергия смешанного состояния с волновой функцией ψ=aψI+bψII меньше энергии более устойчивого из двух простых состояний (ΨI или ΨII). Энергия резонанса зависит от взаимодействия между состояниями I и II и от разности их энергий (Слета Л.А. Химия. Справочник. Харьков: Фолио; М., OOO "Издательство ACT", 2000 г., 496 с.).
2. Шкала Малликена предполагает, что электроотрицательность равна полусумме потенциала ионизации (ϕi) атома и энергии сродства атома к электрону (Е), т.е. (Слета Л.А. Химия. Справочник. Харьков: Фолио; М., OOO "Издательство ACT", 2000 г., 496 с.) или равна их сумме: χ=ϕi+Е (Князев Д.А., Смарыгин С.Н. Неорганическая химия. - М.: Высшая школа, 1990 г., 430 с.).
3. Шкала Оллреда-Рохова за величину электроотрицательности принимает величину электростатической силы ядра, действующей на электрон (Слета Л.А. Химия. Справочник. Харьков: Фолио; М., OOO "Издательство ACT", 2000 г., 496 с.)
где е - заряд электрона; r - ковалентный радиус; Zэфф. - эффективный заряд ядра, учитывающий экранирование.
Неоднозначность определения понятия и вычисления величины электроотрицательности дает основание утверждать, что способ оценки степени ионности химической связи по формуле Полинга также не достаточно обоснован.
Также известен способ оценки степени ионности химической связи атомов в молекуле, определяемой приближенно по графику зависимости i=f(Δχ) (Князев Д.А., Смарыгин С.Н. Неорганическая химия. - М.: Высшая школа, 1990 г., 430 с.).
Степень ионности, равная 50%, соответствует разности электроотрицательностей χA-χB≈1,7, поэтому условно принимают, что химические связи с меньшей разностью электроотрицательностей являются преимущественно ковалентными, а с большей разностью - преимущественно ионными. Однако, по мнению Князева Д.А. и Смарыгина С.Н. [1], используемая эмпирическая зависимость не является точной.
Техническим решением задачи является повышение достоверности количественной оценки степени ионности химической связи атомов в молекуле. Поставленная задача достигается тем, что в способе оценки степени ионности химической связи атомов в молекуле, включающем определение электроотрицательности атомов χA и χB на основе их составляющих - величин потенциалов ионизации (ϕA и ϕB) и сродства к электрону (EA и ЕB) этих атомов, дополнительно физическими методами определяют величину потенциала ионизации положительно заряженного иона (ϕB+), т.е. атома с меньшей электроотрицательностью, радиусы нейтральных атомов (RA и RB) и их ионов (RB+, RB- и RA-) и осуществляют оценку степени ионности химической связи атомов в молекуле по формуле:
Эффект повышения достоверности оценки степени ионности химической связи атомов в молекуле достигается за счет того, что учитывается соотношение сил электростатического притяжения электрона к ядрам собственного и соседнего атомов, как в условиях нейтральности атомов, так и их ионного состояния, и импульс действующих сил на электрон в момент перемещения его от одного атома к другому, и в результате оценивается время пребывания перемещающегося электрона вокруг одного и другого атомов. Величину силы электростатического взаимодействия электрона с ядром атома или его иона наиболее достоверно, без необходимости учета эффективного заряда ядра и экранирующего влияния других электронов, осуществляют через потенциал ионизации соответствующего атома (ϕA, ϕB) или его положительного иона (ϕB+) и через энергию сродства атома к электрону (ЕA, ЕB) по формулам:
здесь е - заряд электрона
При FA>FB валентный электрон, вращающийся по орбите атома В, в момент пролета между атомами А и В будет испытывать в сторону ядра атома А силу притяжения
Под действием этой силы будет создаваться импульс силы ΔFAB·tAB, который должен быть не меньше импульса (количества движения) электрона, вращающегося по орбите атома В, т.е.:
здесь m - масса электрона; υB - скорость движения электрона по орбите в атоме В. Таким образом, время перемещения электрона с орбиты атома В на орбиту атома А составит:
Для нахождения неизвестного параметра υB воспользуемся условием, что сила притяжения электрона к ядру атома В равна силе ионизации этого атома и определяет центробежную силу этого электрона, т.е.:
и, следовательно,
тогда
Учитывая, что m=9,1·10-31 кг, а е=1,6·10-19 Кл, получаем
Это выражение и определяет время перехода электрона от атома В к атому А под действием разности сил величин потенциалов ионизации атомов А и В. Как только электрон перейдет от атома В к атому А, то образуется положительный ион атома В и отрицательный ион атома А. Под действием величины энергии сродства атома к электрону (ЕA) создается сила притяжения FA- электрона к ядру иона атома А и электрон совершает один оборот вокруг ядра иона атома А. Время одного оборота электрона вокруг ядра иона атома А и является временем полной ионизации атомов в молекуле и определяется как:
здесь RA- - радиус отрицательного иона атома А, υA- - скорость вращения электрона по орбите вокруг ядра в ионе атома А.
Скорость υA- - можно оценить, исходя из условия, что сила притяжения электрона к ядру в ионе атома А определяется величиной энергии сродства к электрону атома А, т.е. ЕA, причем:
Эта сила создает центробежную силу движения электрона по орбите в ионе атома А, т.е.
здесь m - масса электрона.
Следовательно,
Отсюда
В результате
С учетом того, что m=9,1·10-31 кг, а е=1,6·10-19 Кл,
Так как диапазон распределения потенциалов ионизации (ϕi) всех атомов химических элементов не перекрывается с диапазоном распределения энергии сродства атомов к электрону (Еi), причем нижний предел параметра ϕi больше верхнего предела параметра Ei, то для любого сочетания атомов А и В потенциал ионизации электрона атома всегда будет больше величины энергии сродства атома к электрону.
Поэтому, пройдя полный оборот по орбите вокруг ядра иона атома А, электрон выходит на линию взаимодействия ядер атомов А и В и испытывает избыточное действие силы ΔFAB потенциала ионизации положительного иона атома В над величиной силы энергии сродства атома А к электрону и поэтому возвратится на свою орбиту атома В. Время перехода электрона с орбиты иона атома А на орбиту иона атома В (tBA) можно оценить на основании равенства импульса этой силы ΔFBA·tBA импульсу (количеству движения) электрона на орбите иона атома А, т.е. mυA-.
Тогда
Скорость электрону υA- при движении по орбите в ионе атома А можно оценить, исходя из условия, что сила притяжения электрона к ядру в ионе атома А определяется величиной силы энергии сродства атома к электрону (ЕA), причем
Эта сила создает центробежную силу движения электрона по орбите:
Из равенства выражений (25) и (26) получаем
Тогда
С учетом того, что m=9,1·10-31 кг, а е=1,6·10-19 Кл,
Возвратившись на свою прежнюю орбиту атома В, электрон совершит полный оборот вокруг ядра атома В за время
здесь υB - скорость вращения электрона по орбите радиуса RB атома В.
Скорость υB можно оценить, исходя из условия, что сила притяжения электрона к ядру атома В определяется величиной потенциала ионизации этого атома В (ϕB),т.е.
Эта сила создает центробежную силу движения электрона по орбите с радиусом RB
На основании равенства выражений (31) и (32) находим
И тогда
Это время, в течение которого химическая связь между атомами А и В является ковалентной.
Далее под действием разности сил потенциалов ионизации атомов А и В, т.е. ΔFAB·=FA-FB электрон опять перейдет на орбиту атома А с радиусом RA- и т.д.. Полное время одного цикла перемещения электрона с одного атома к другому и возврат его к прежнему атому составит t=tBA+tA-+tAB+tB, а степень ионизации химической связи атомов в молекуле можно оценить как
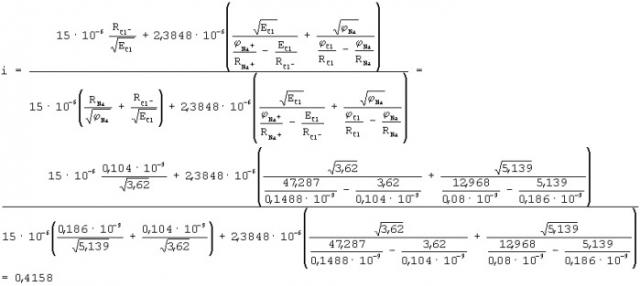
После подстановки исходных данных
Новизна заявленного способа заключается в том, что наряду с известными физическими параметрами - потенциалом ионизации и энергии сродства к электрону, определяющих электроотрицательность атомов, учитываются величины радиусов нейтральных атомов и их ионов, а также потенциал ионизации второго электрона положительно заряженного иона атома с меньшей величиной потенциала ионизации первого внешнего электрона по сравнению с другим атомом, на основании чего рассчитываются силы взаимодействия электрона с ядрами одного и другого атома и их ионов, определяется время полного периода обращения электрона вокруг ядра одного и другого атомов, а по величине импульса силы за счет разности сил взаимодействия электрона с ядрами атомов оценивается время перехода электрона с орбиты одного атома на орбиту другого. В результате такого подхода по отношению времени пребывания электрона в пределах своего или другого атома обеспечивается объективная оценка степени ионности химической связи атомов в молекуле.
Заявленный способ обладает изобретательским уровнем, поскольку из данных научно-исследовательской и патентной литературы не известна аналогичная заявляемой совокупность признаков, обеспечивающих достижение поставленной задачи. Изобретение нашло применение при оценке степени ионности химической связи атомов в молекулах и возможности его использования в промышленности при необходимости учета степени ионности химической связи атомов в молекуле при оценке скорости протекания химических реакций.
Пример конкретной реализации способа оценки степени ионности химической связи атомов рассмотрим для молекулы NaCl.
Исходные данные для расчета:
ϕNa=5,139 эВ, ϕCl=12,968 эВ, ECl=3,62 эВ, ϕNa+=47,287 эВ, RNa=0,186·10-9 м, RCl=0,08·10-9 м, RNa+=0,1488·10-9 м, RCl-=0,08·10-9 м
при этом
Следовательно, степень полной ионности связи, когда электрон от атома Na полностью перешел на орбиту к атому Cl
Степень переходного состояния связи атомов в молекуле
Переходное состояние атомов в молекуле, когда электрон переходит от атома Na к атому Cl и, следовательно, уже образовался ион Na+ и когда электрон переходит от иона Cl- к иону атома Na+, можно отнести если не к полной, то к частичной ионности связи атомов в молекуле. Поэтому суммарная степень ионности атомов в молекуле NaCl:
Способ оценки степени ионности химической связи атомов в молекуле, включающий определение электроотрицательности атомов путем определения физическими методами их составляющих величин - потенциалов ионизации и энергии сродства к электрону этих атомов, отличающийся тем, что дополнительно определяют величину потенциала ионизации положительно заряженного иона, радиусы нейтральных атомов и их ионов и оценку степени ионности химической связи атомов в молекуле осуществляют по формуле
где ϕА и ϕВ - потенциалы ионизации атомов А и В, вступивших в реакцию с образованием молекулы АВ;
ЕА - энергия сродства атома А к электрону;
ϕB+ - потенциал ионизации положительного иона атома В;
RA, RB - радиусы нейтральных атомов А и В;
RA- - радиус отрицательно заряженного иона атома А;
RB+ - радиус положительно заряженного иона атома В.