Фармацевтическая композиция, содержащая фактор viia и фактор xiii
Иллюстрации
Показать всеИзобретение относится к области фармации. Сущность его заключается в разработке композиции для внутривенного введения при лечении или профилактике эпизодических кровотечений и нарушений свертываемости крови. Композиция содержит фактор VIIa и фактор XIII, композиция дополнительно может содержать ингибитор TFPI. Другими объектами настоящего изобретения являются набор, содержащий фактор VIIa и фактор XIII в дозированной форме и соответствующий фармацевтически приемлемый носитель; применение композиции; способ усиления образования фибринового сгустка; способ лечения эпизодического кровотечения. Технический результат - повышение эффективности терапии эпизодических кровотечений и нарушений свертываемости крови. 5 н. и 16 з.п. ф-лы, 3 ил., 1 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической композиции, содержащей фактор VIIa и фактор XIII. Настоящее изобретение относится также к применению комбинации фактора VIIa и фактора XIII для производства лекарственного средства для лечения лиц, страдающих эпизодическими кровотечениями, или для профилактики таких кровотечений. Настоящее изобретение относится также к способу лечения эпизодических кровотечений у пациентов и к способу усиления образования сгустка крови у пациента. Настоящее изобретение относится также к наборам, включающим в себя указанные соединения.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Гемостаз начинается с образования комплекса между тканевым фактором (TF), который появляется в циркулирующей крови после повреждения стенки сосуда, и FVIIa, который присутствует в циркулирующей крови в количестве, соответствующем приблизительно 1% от общей массы белка FVII. Указанный комплекс сцеплен с клеткой, несущей TF, и активирует превращение FX в FXa и FIX в FIXa на клеточной поверхности. FXa активирует превращение протромбина в тромбин, который активирует FVIII, FV, FXI и FXIII. Помимо этого ограниченное количество тромбина, образованного на этой первоначальной стадии гемостаза, также активирует тромбоциты. После воздействия тромбина тромбоциты изменяют форму и обнажают на своей поверхности заряженные фосфолипиды. Указанная поверхность активированного тромбоцита образует матрицу для дальнейшей активации FX и полного образования тромбина. Дальнейшая активация FX на поверхности активированного тромбоцита опосредована комплексом FIXa-FVIIIa, образованным на поверхности активированного тромбоцита, а FXa затем превращает протромбин в тромбин, все еще оставаясь на поверхности. Тромбин затем превращает фибриноген в фибрин, который является нерастворимым и который стабилизирует первоначальную тромбоцитарную пробку. Указанный процесс пространственно разделен, т.е. локализован на участке экспрессии или экспозиции TF, что сводит к минимуму риск системной активации системы свертывания крови. Нерастворимый фибрин, образующий пробку, дополнительно стабилизируется образованием поперечных связей между волокнами фибрина, которое катализируется FXIII.
FVIIa существует в плазме крови главным образом в виде одноцепочечного зимогена, который расщепляется FXa на двухцепочечную, активированную форму FVIIa. В качестве прогемостатического агента был разработан рекомбинантный активированный фактор VIIa (rFVIIa). Введение rFVIIa обеспечивает быстрый и высокоэффективный прогемостатический ответ у лиц, страдающих гемофилией, у которых кровотечения не поддаются лечению продуктами факторов свертывания из-за образования антител. Также с помощью FVIIa можно успешно лечить пациентов с кровотечением, у которых имеется дефицит фактора VII, или пациентов, не имеющих патологии системы свертывания крови, у которых имеет место чрезмерное кровотечение. В данных исследованиях неблагоприятных побочных эффектов rFVIIa (в частности, тромбоэмболий) не наблюдалось.
Дополнительно экзогенно введенный FVIIa увеличивает образование тромбина на поверхности активированных тромбоцитов. Указанное явление наблюдается у лиц, страдающих гемофилией, не имеющих FIX или FVIII, и, таким образом, не имеющих наиболее эффективного пути для полного образования тромбина. Дополнительное введение FVIIa увеличивает образование тромбина также в присутствии уменьшенного количества тромбоцитов или тромбоцитов с нарушенной функцией.
FXIII, фактор, стабилизирующий фибрин, представляет собой трансглутаминазу, которая образует поперечные связи между мономерами фибрина, создавая, таким образом, структуру фибрина с повышенной устойчивостью к растворению плазмином и другими протеолитическими ферментами. Фактор XIII известен также, как "фибринолигаза" и "фактор, стабилизирующий фибрин". Будучи активированным FXIIIa способен образовывать межмолекулярные гамма-глутамил-эпсилон-лизин поперечные связи между боковыми цепями молекул фибрина и между другими субстратами. FXIII обнаружен в плазме и в тромбоцитах. Данный фермент существует в плазме в виде тетрамерного зимогена, состоящего из двух альфа-субъединиц и двух бета-субъединиц (обозначается a2b2), а также в тромбоцитах в виде зимогена, состоящего из двух альфа-субъединиц (обозначается a2-димер).
Оба зимогена активируются тромбином и Са2+. Кальций высвобождается из тромбоцитов после их агрегации на участке повреждения. Тромбин отщепляет N-концевые аминокислотные остатки 1-37 (a2-димера). В случае a2b2-зимогена бета-субъединицы затем диссоциируют от активированных альфа-субъединиц. Кальций одинаково хорошо связывается с зимогеном и с молекулой, модифицированной тромбином. После активации тромбином и кальцием активный центр цистеин на альфа-цепи обнажается, и образуется полностью активированный фермент. Установлено, что у лиц с тяжелой тромбоцитопенией имеются низкие уровни FXIII в плазме.
Хорошо известно, что у лиц с избыточным кровотечением в связи с хирургическим вмешательством или обширной травмой, которые нуждаются в переливаниях крови, развивается больше осложнений, чем у лиц, не имевших кровотечения. Однако также умеренные кровотечения, требующие введения человеческой крови или продуктов крови (тромбоцитов, лейкоцитов, концентратов, полученных из плазмы крови, для лечения дефектов свертывания, и т.п.) могут приводить к осложнениям, связанным с риском переноса человеческих вирусов (гепатита, ВИЧ, парвовируса и других, не известных на настоящий момент вирусов). Большие кровопотери, требующие массивных гемотрансфузий, могут приводить к развитию полиорганной недостаточности, включая нарушения функции легких и почек. При развитии у пациента указанных тяжелых осложнений начинается каскад событий, вовлекающих ряд цитокинов и воспалительные реакции, которые делают лечение крайне затруднительным и, к несчастью, зачастую безуспешным. Таким образом, главная задача при оперативных вмешательствах, а также при лечении обширных тканевых повреждений - избежать кровотечения или свести его к минимуму.
Для того чтобы избежать подобного кровотечения или свести его к минимуму, важно обеспечить образование стабильных и твердых гемостатических пробок, которые нелегко растворяются фибринолитическими ферментами. Кроме того, важно обеспечить быстрое и эффективное образование подобных пробок или сгустков.
Патентная заявка Японии №2-167234 А относится к адгезиву для биологической ткани, который отличается содержанием фибриногена, протромбина, фактора VII свертывания крови, фактора IX свертывания крови, фактора X свертывания крови, фактора XIII свертывания крови, антитромбина, ингибитора протеаз и ионов кальция.
Патентная заявка Японии №59-116213А относится к аэрозольной композиции для применения в качестве клея для тканей, содержащей коагулянт крови в качестве активного компонента. Коагулянт крови может быть выбран из факторов свертывания крови I, II, III, IV, V, VII, VIII, IX, X, XI, XII и XIII, прекалликреина, высомолекулярного полимера кининогена и тромбина. Предпочтительной является комбинация FXIII и тромбина.
WO 93/12813 (ZymoGenetics) относится к применению FXIII для сокращения периоперационной кровопотери у лица, которое подвергается оперативному вмешательству. Данная композиция может также включать в себя апротинин. FXIII вводят пациенту в виде болюсной инъекции, обычно за день до оперативного вмешательства.
Европейский патент №225160 (Novo Nordisk) относится к композициям FVIIa и способам лечения патологических кровотечений, не вызванных дефектами факторов свертывания или ингибиторами факторов свертывания.
Европейский патент №82182 (Baxter Travenol Lab.) относится к композиции фактора VIIa для применения с целью противодействия дефицитам факторов свертывания крови или эффектам ингибиторов факторов свертывания крови у пациента.
Международная патентная публикация №WO 93/06855 (Novo Nordisk) относится к местному применению FVIIa.
Kjalke et al., Thrombosis and Haemostasis, 1999 (Suppl.), 095 1 относится к введению дополнительного экзогенного FVIIa и влиянию на образование тромбина на поверхности активированных тромбоцитов на модельной системе, имитирующей условия гемофилии А или В.
В данной области остается потребность в улучшенном, надежном и широко применимом способе усиления свертывания крови, быстрого образования стабильных гемостатических пробок и достижения полного гемостаза у пациентов, в частности у пациентов с нарушенной выработкой тромбина. Существует также потребность в способе, при котором количество FVIIa, необходимое для достижения полного гемостаза, уменьшено.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Одной целью настоящего изобретения является создание композиций, которые можно эффективно применять для лечения или профилактики эпизодических кровотечений и нарушений свертывания крови.
Второй целью настоящего изобретения является создание композиций в одной лекарственной форме, которые можно эффективно применять для лечения или профилактики эпизодов кровотечения или в качестве прокоагулянта.
Другой целью настоящего изобретения является создание композиций, способов лечения или наборов, оказывающих синергическое действие.
Еще одной целью настоящего изобретения является создание композиций, способов лечения или наборов, не имеющих существенных побочных эффектов, таких как высокий уровень системной активации системы свертывания крови.
Другие цели настоящего изобретения будут ясны после ознакомления с настоящим описанием.
Авторы настоящего изобретения показали, что комбинация фактора VIIa и фактора XIII может уменьшить время образования сгустка в нормальной плазме крови человека более эффективно, чем один из факторов VIIa или XIII по отдельности. Было показано также, что комбинация фактора VIIa и фактора XIII может повышать прочность сгустка более эффективно, чем один из факторов VIIa или XIII по отдельности. Путем объединения фактора VIIa в концентрации, при которой не наблюдалось дальнейшего повышения прочности сгустка, с фактором XIII, также в концентрации, при которой не наблюдалось дальнейшего повышения прочности сгустка, неожиданно было получено дальнейшее повышение прочности сгустка. Было показано также, что комбинация фактора VIIa и фактора XIII может in vitro продлевать время лизиса сгустка в нормальной плазме крови человека более эффективно, чем один из ингибиторов фактора VIIa или фактора XIII по отдельности. Таким образом, путем усиления коагуляции можно добиться более эффективного лечения кровотечения у пациентов. Кроме того, пациентов можно лечить с помощью относительно более низких концентраций фактора VIIa, что уменьшает, таким образом, относительно высокую стоимость лечения по сравнению с обычным лечением одним только фактором VIIa.
В первой своей особенности настоящее изобретение относится к фармацевтической композиции, включающей в себя фактор VIIa и фактор XIII и необязательно фармацевтически приемлемый носитель.
В другой своей особенности настоящее изобретение относится к фармацевтической композиции, включающей в себя только в качестве активных агентов фактор VIIa и фактор XIII и необязательно фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, изготовленной для внутривенного введения, и содержащей фактор VIIa, и фактор XIII, и необязательно фармацевтически приемлемый носитель.
Другой аспект настоящего изобретения связан с фармацевтической композицией, изготовленной для внутривенного введения и содержащей фактор VIIa и фактор XIII в качестве единственных активных агентов и необязательно фармацевтически приемлемый носитель.
В одном варианте осуществления настоящего изобретения фактор VIIa представляет собой рекомбинантный фактор VIIa, а фактор XIII представляет собой рекомбинантный фактор XIII.
В одном варианте осуществления настоящего изобретения фактор VIIa представляет собой рекомбинантный фактор VIIa. Еще в одном варианте осуществления настоящего изобретения фактор VIIa представляет собой рекомбинантный человеческий фактор VIIa. Еще в одном варианте осуществления настоящего изобретения фактор VIIa представляет собой вариант фактора VIIa.
В одном варианте осуществления настоящего изобретения варианты фактора VIIa представляют собой варианты аминокислотных последовательностей, имеющие не более 20 аминокислотных замен, делеций или вставок по сравнению с фактором VIIa дикого типа (т.е. полипептид, имеющий аминокислотную последовательность, описанную в патенте США №4784950). В другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 15 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 10 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 8 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 6 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 5 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 3 аминокислотных замен, делеций или вставок по сравнению с фактором VIIa дикого типа. В одном варианте осуществления настоящего изобретения варианты фактора VIIa выбраны из [L305V]-FVIIa, [L305V/M306D/D309S]-FVIIa, [L305I]-FVIIa, [L305T]-FVIIa, [F374P]-FVIIa, [V158T/M298Q]-FVIIa, [V158D/E296V/M298Q]-FVIIa и [K337A]-FVIIa.
В одном варианте осуществления настоящего изобретения фактор XIII представляет собой FXIII a2b2. В другом аспекте осуществления настоящего изобретения фактор XIII представляет собой FXIII a2. Еще в одном варианте осуществления настоящего изобретения фактор XIII представляет собой активированный фактор XIII (FXIIIa). В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой вариант фактора XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой человеческий фактор XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой рекомбинантный фактор XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой рекомбинантный человеческий фактор XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой человеческий а2-димер.
В одном из аспектов настоящая композиция дополнительно содержит ингибитор TFPI. В другом аспекте настоящая композиция дополнительно содержит фактор VIII. В другом варианте настоящая композиция дополнительно содержит фактор VIII и ингибитор TFPI.
В одном аспекте настоящая композиция дополнительно содержит ингибитор фибринолитической системы, например апротинин, ε-аминокапроновую кислоту или транэкзамовую кислоту.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В одном варианте указанный набор включает в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa, и фактора XIII, и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в четвертой дозированной лекарственной форме;
е) контейнер для размещения в нем указанных первой, второй, третьей и четвертой дозированных лекарственных форм.
В другом варианте указанный набор включает в себя
а) эффективное количество фактора VIIa и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и фактора VIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIII и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора XIII и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
е) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество ингибитора TFPI и фактора VIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
f) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество ингибитора TFPI и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и фактора VIIa и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом аспекте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для лечения эпизодического кровотечения.
В другом варианте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для уменьшения времени образования сгустка крови у пациента.
В другом варианте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для увеличения времени лизиса сгустка в плазме крови млекопитающего.
В другом аспекте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для повышения прочности сгустка в плазме крови млекопитающего.
В другом аспекте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для усиления образования фибринового сгустка в плазме крови млекопитающего.
В одном варианте осуществления настоящего изобретения плазма крови млекопитающего представляет собой плазму крови человека. В другом варианте осуществления настоящего изобретения плазма крови млекопитающего представляет собой нормальную плазму крови; в другом варианте осуществления настоящего изобретения плазма крови млекопитающего представляет собой нормальную плазму крови человека; в одном варианте осуществления настоящего изобретения плазма крови представляет собой плазму крови пациента с нарушенной выработкой тромбина. В одном варианте осуществления настоящего изобретения плазма крови представляет собой плазму крови пациента с пониженной концентрацией фибриногена.
В одном варианте осуществления настоящего изобретения фактор VIIa и фактор XIII продлевают время лизиса сгустка in vitro в нормальной плазме крови человека.
В другом аспекте настоящее изобретение относится к способу усиления образования сгустка фибрина у пациента; указанный способ включает в себя введение пациенту эффективного количества фактора VIIa в комбинации с эффективным количеством фактора XIII.
В другом аспекте настоящее изобретение относится к способу лечения эпизодического кровотечения у пациента, включающему в себя введение пациенту эффективного количества фактора VIIa в комбинации с эффективным количеством фактора XIII.
В другом аспекте настоящее изобретение относится к способу сокращения времени образования сгустка в плазме млекопитающего, включающему в себя контактирование плазмы с эффективным количеством фактора VIIa в комбинации с эффективным количеством фактора XIII. В одном варианте осуществления настоящего изобретения эффективное количество фактора VIIa в комбинации с эффективным количеством фактора XIII вводят пациенту, который нуждается в указанном лечении.
В другом аспекте настоящее изобретение относится к способу усиления образования фибрина у пациента, включающему в себя введение пациенту эффективного количества фактора VIIa в комбинации с эффективным количеством фактора XIII.
В одном варианте осуществления способов согласно изобретению только фактор VIIa и фактор XIII представляют собой активные агенты, которые вводят пациенту. В другом варианте осуществления настоящего изобретения фармацевтическая композиция включает в себя только фактор VIIa и фактор XIII в качестве активных агентов.
В одном варианте осуществления настоящего изобретения фактор VIIa и фактор XIII вводят одновременно и в одной лекарственной форме. В другом варианте осуществления настоящего изобретения фактор VIIa и фактор XIII вводят последовательно. Еще в одном варианте осуществления настоящего изобретения фактор VIIa и фактор XIII вводят друг за другом с интервалами приблизительно 1-2 часа, например через 30 минут один вслед за другим, например через 10 минут один вслед за другим, например, в виде набора, включающего в себя фактор VIIa в первой лекарственной форме и фактор XIII во второй лекарственной форме.
В одном варианте осуществления настоящего изобретения эффективное количество фактора VIIa составляет от 0,05 мг в день до 500 мг в день (для пациента с массой тела 70 кг). В одном варианте осуществления настоящего изобретения эффективное количество фактора XIII составляет от 0,05 мг в день до 500 мг в день (для пациента с массой тела 70 кг).
В одном варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой форму единого препарата) состоит преимущественно из фактора VIIa и фактора XIII, и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой форму единого препарата) состоит преимущественно из фактора VIIa и фактора XIII, и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой форму единого препарата) состоит преимущественно из фактора VIIa и фактора XIII, и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI, и/или фактора VIII.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой набор) состоит из первой дозированной лекарственной формы, состоящей преимущественно из фактора VIIa и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз; и второй дозированной лекарственной формы, состоящей преимущественно из фактора XIII и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой набор) состоит из первой дозированной лекарственной формы, состоящей преимущественно из фактора VIIa и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI; и второй дозированной лекарственной формы, состоящей преимущественно из фактора XIII и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI, и/или фактора VIII.
Еще в одном варианте осуществления настоящего изобретения пациентом является человек; в другом варианте осуществления у пациента имеется нарушение выработки тромбина; в одном варианте осуществления у пациента имеется пониженная концентрация фибриногена в плазме крови (например, в случае, когда пациент перенес многочисленные трансфузии).
Еще в одном аспекте композиция дополнительно содержит фактор VIII. В одном варианте осуществления настоящего изобретения фактор VIII представляет собой активированный фактор VIII (фактор VIIIa). Еще в одном варианте осуществления фактор VIII представляет собой рекомбинантный фактор VIII. Еще в одном варианте осуществления фактор VIII представляет собой рекомбинантный человеческий фактор VIIIa.
Еще в одном варианте композиция дополнительно содержит ингибитор фибринолитической системы, например апротинин, ε-аминокапроновую кислоту или транэкзамовую кислоту.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
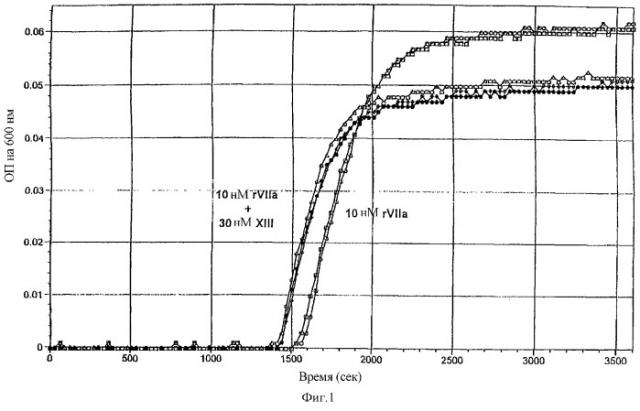
На фигуре 1 показано, что в лунке микротитрационного планшета (общий объем 250 мкл) спонтанное образование сгустка в цитратной нормальной плазме человека (NHP), разбавленной до 1/10 буфером, содержащим 20 нМ Hepes, 150 мМ NaCl и 5 мМ CaCl2, рН 7,4, было получено приблизительно через 2500-3000 сек. Мониторинг образования фибринового сгустка осуществляли по повышению оптической плотности при 600 нм при использовании Spectramax™ 340. Molecular Devices, Sunny-vale CA. На фиг.1 показано, что 10 нМ рекомбинантный фактор VIIa (rFVIIa) от компании Novo Nordisk A/S Bagsvaerd, Дания, сокращает время образования сгустка до 1600 сек (n=2). Дальнейшее сокращение времени образования сгустка было получено, когда добавляли 30 нМ фактора XIII (FXIII) от компании American Diagnostica Inc., Greenwich, CT, вместе с 10 нМ rFVIIa (n=3). Сгусток, образованный в присутствии FXIII, был более прозрачным (более низкая максимальная ОП), чем в его отсутствии, что указывает на то, что добавление FXIII приводит к образованию более мелкоячеистой структуры фибринового геля с более тонкими волокнами.
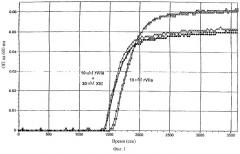
На фигуре 2 показано, что дополнительный FXIII (30 нМ) продлевает время лизиса фибриновых сгустков, образованных в присутствии rFVIIa и активатора тканевого плазминогена (tPA). Образование сгустка было индуцировано в присутствии или в отсутствие 30 нМ XIII путем добавления 25 мкл NHP к 225 мкл 20 нМ Hepes, 150 мМ NaCl, 5 мМ CaCl2, рН 7,4, содержавшего 50 нМ rFVIIa и 0,5 нМ рекомбинантного tPA от компании Novo Nordisk A/S Bagsvaerd, Дания. Образование сгустка и последующий лизис сгустка, индуцированные tPA-опосредованной активацией плазминогена, мониторировали с использованием Spectramax™ 340 при 600 нм по повышению ОП600нм с последующим возвратом следа до исходного уровня. На фиг.2 показано, что время лизиса сгустка при указанных условиях достоверно увеличивается в присутствии FXIII.
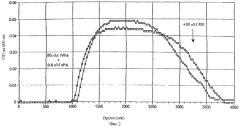
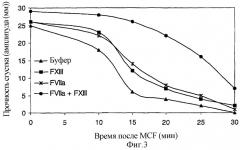
На фигуре 3 показано влияние rFVIIa и FXIII на максимальную прочность сгустка (MCF), а также на устойчивость сгустка к tPA-опосредованному лизису. До добавления rFVIIa и/или FXIII полученная MCF составляла 25 мм, а время, которое требовалось для лизиса половины сгустка, составляло 12,3 минуты (фиг.3). Добавление повышающихся концентраций FXIII (0-40 нМ) не изменяло MCF; однако наблюдалось дозозависимое пролонгирование лизиса половины сгустка, оптимальное при 30 нМ FXIII (время полулизиса сгустка: 14,3 мин, фиг.3). Подобно этому добавление rFVIIa (1 нМ) приводило к защите сгустка от tPA-опосредованного фибринолиза (время полулизиса сгустка: 16,4 мин) при отсутствии какого бы то ни было влияния на MCF (фиг.3). Однако после добавления rFVIIa (1 нМ) вместе с FXIII (30 нМ) наблюдалось повышение MCF (29 мм), а также выраженная защита от фибринолиза (время полулизиса сгустка 27,1 мин) (фиг.3). Вместе данные результаты показывают, что добавление к плазме rFVIIa и FXIII синергическим образом улучшает механическую прочность и резистентность сгустка к tPA-опосредованному фибринолизу.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции, содержащей комбинацию фактора VIIa и фактора XIII. Настоящее изобретение относится также к композиции, включающей в себя только комбинацию фактора VIIa и фактора XIII в качестве активных ингредиентов. Данная композиция может быть в форме единой композиции или может быть в форме многокомпонентного набора. Настоящие композиции являются пригодными в качестве терапевтических и профилактических прокоагулянтных и стабилизирующих фибриновый сгусток агентов и быстро образуют фибриновые сгустки у млекопитающих, включая приматов и человека.
В данном описании, где бы ни употреблялся термин первая, или вторая, или третья стандартная доза, это не указывает на предпочтительный порядок введения, а сделано только для удобства.
Настоящее изобретение относится также к способу лечения (включая профилактическое лечение или предупреждение) эпизодического к