Способ подготовки препарата крови к электронно-микроскопическому исследованию
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лабораторным исследованиям. Сущность способа подготовки препарата крови к электронно-микроскопическому исследованию: осуществляют центрифугирование суспензии нефиксированных выделенных клеток со скоростью 1500 об/мин, удаляют надосадочную жидкость, ресуспендируют осадок в 0,25 мл 10%-ного человеческого сывороточного альбумина, добавляют к полученной смеси одну каплю 25%-ного глутарового альдегида и центрифугируют до получения геля, полученный гель заливают 10%-ным формалином на фосфатном буфере с рН 7,5 на срок до одних суток, затем разделяют на дольки, дольки геля дофиксируют в 2%-ном растворе тетраоксида осмия, затем обезвоживают, заливают в эпоксидные смолы, приготавливают срезы, окрашивают их и контрастируют. Использование способа позволяет значительно улучшить качество препарата. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к медицинским, а именно к лабораторным исследованиям с помощью электронного микроскопа, в частности к подготовке препаратов крови для осуществления электронно-микроскопических исследований.
Известен способ подготовки ткани к электронно-микроскопическому исследованию, включающий внутрисосудистую фиксацию ткани путем перфузии буферным раствором глутарового альдегида с последующим контрастированием взвесью китайской туши, при этом ткань предварительно перфузируют в течение 15-20 минут фиксирующим раствором, а контрастирование проводят в фиксирующем растворе до насыщения ткани красителем (авт. св-во СССР №1298580, Мкл. G 01 N 1/06, 33/483, опубл. 23.03.87).
Данный способ позволяет повысить качество исследуемого объекта за счет естественного сохранения тканевых структур при фиксации в два этапа.
Однако данный способ предназначен для исследования другого объекта - не клеток крови, а ткани биологического объекта.
При этом исследование ткани биологического объекта осуществляется «in vivo», что не осуществимо при исследовании препарата крови.
Способ более трудоемкий и для его осуществления требуется выведение биологического объекта из эксперимента, что также неосуществимо при большинстве исследований.
Известен способ подготовки препарата к электронно-микроскопическому исследованию, выбранный в качестве ближайшего аналога, включающий фиксацию изолированной клетки или их фрагментов в суспензии в центрифужной пробирке, отцентрифугирование данной суспензии при низкой скорости и слив образовавшейся надосадочной жидкости, ресуспендирование осадка в 0,25 мл 2%-ного бычьего сывороточного альбумина на 0,05 М трис-буфере (рН 7,5) и перенос в пробирку из целлюлозы, смешивание суспензии исследуемых частиц и альбумина с одной каплей 25%-ного глутаральдегида и немедленное центрифугирование полученной смеси до образования геля (до помутнения суспензии), разрезание пробирки из целлюлозы с их содержимым на дольки толщиной 1 мм, обезвоживание и заливка в эпон (Г.Гайер. Электронная гистохимия. Перевод с немецкого И.Б.Бухвалова, Издательство «Мир», М., 1974, стр.241-242).
В процессе множественных апробаций известного способа установлено, что при соблюдении всех перечисленных в известной методике переходов, не происходит образование качественного геля и по этой причине невозможно приготовление срезов для электронно-микроскопического исследования.
Полученный по известной методике так называемый «некачественный гель» представляет собой неплотную, практически жидкую массу, плотность которой не позволяет приготовить из нее срезы для дальнейшего исследования препарата при помощи электронно-микроскопического исследования.
Кроме того, промежуточные исследования полученного по известной методике препарата (исследование при увеличении в 1000 раз при световой микроскопии) показали отсутствие целых клеток, наличие большого скопления их фрагментов, наложение фрагментов разрушенных клеток друг на друга, отсутствие границ как клетки, так и ядра, отсутствие целостности внутриклеточных структур (мембраны, ядра, митохондрий и т.д.), что является свидетельством того, что во время приготовления препарата по известной методике происходит разрушение клетки и внутриклеточных структур.
Следовательно, известная методика не обеспечивает эффективного получения качественного препарата для электронно-микроскопического исследования, что ухудшает результаты производимых исследований.
Таким образом, техническим результатом, на решение которого направлено данное изобретение, является улучшение результатов электронно-микроскопических исследований за счет повышения качества подготавливаемого к исследованиям препарата.
Указанный технический результат достигается тем, что в известном способе подготовки препарата крови к электронно-микроскопическому исследованию, включающем центрифугирование суспензии выделенных клеток, удаление надосадочной жидкости, ресуспендирование осадка в 0,25 мл сывороточного альбумина, добавление к полученной смеси одной капли 25%-ного глутарового альдегида и центрифугирование до получения геля, разделение на дольки, обезвоживание, заливку в эпоксидные смолы, приготовление срезов, их окрашивание и контрастирование, согласно изобретению осуществляют центрифугирование суспензии нефиксированных выделенных клеток со скоростью 1500 об/мин, полученный гель дополнительно заливают 10%-ным формалином на фосфатном буфере (рН 7,5) на срок до одних суток, в качестве сывороточного альбумина используют 10%-ный человеческий сывороточный альбумин, а полученные при разделении дольки геля дофиксируют в 2%-ном растворе тетраоксида осмия.
А центрифугирование до получения геля осуществляют при 3000 об/мин.
По мнению авторов применение для центрифугирования суспензии именно нефиксированных выделенных клеток обеспечивает повышение достоверности результатов за счет исключения влияния на выделенные клетки других тканей, коим является фиксирующий раствор именно на стадии до получения геля.
Это объясняется тем, что фиксирование выделенных клеток до получения геля, то есть до начала приготовления препарата для электронно-микроскопического исследования, приводит к тому, что зафиксированная выделенная клетка с внутриклеточными элементами после осуществления на нее какого-либо воздействия с целью выявления в них изменений, происходящих под действием данного воздействия, останутся в неизмененном виде, то есть в том виде, в котором их зафиксировали после выделения.
Величина скорости вращения, при которой осуществляют данное центрифугирование, подобраны авторами экспериментально: заявляемая величина является оптимальной скоростью, при которой не происходит разрушение именно нефиксированных клеток. При этом установлено, что скорость меньше 1500 об/мин из-за увеличения длительности центрифугирования, а скорость, большая 1500 об/мин, приводит к разрушению клеток и внутриклеточных структур препарата на данной стадии его подготовки.
Дополнительная заливка геля 10%-ным формалином на фосфатном буфере (рН 7,5) на срок до одних суток и использование в качестве сывороточного альбумина 10%-ного человеческого альбумина способствует значительному повышению качества получаемого препарата крови для электронно-микроскопического исследования. Это обеспечивается за счет того, что именно использование данных компонентов позволяет добиться требуемой плотности геля, в последующем обеспечивающей получение качественных срезов для электронно-микроскопического исследования.
За счет достигаемого с помощью используемых компонентов уплотнения геля обеспечивается возможность получения идеального (качественного) среза клеток исследуемого препарата, в котором достигается однослойное, разрозненное расположение клеток, которые полностью сохраняют свою морфологию, обеспечивается соответствие формы элементов крови их естественным формам, достигается полная сохранность внутриклеточных структур (мембран, ядер, митохондрий и т.п.), четкость их границ, отсутствие разрушенных и деформированных клеток, за счет чего при исследовании препарата под электронным микроскопом достигается возможность детально изучить отдельно каждую клетку и изменения, происходящие с ее ультраструктурами.
Причем отсутствие в полученном препарате разрушенных и деформированных клеток дополнительно обеспечивается за счет использования 10%-ного человеческого сывороточного альбумина, который создает для исследуемого препарата условия, близкие к естественным, поскольку человеческий сывороточный альбумин является естественной средой, не оказывающей повреждающего действия на исследуемый материал.
Дофиксирование полученных при разделении долек в 2%-ном растворе тетраоксида осмия еще в большей степени способствует повышению качества получаемого препарата.
Это обеспечивается за счет еще большего повышения плотности разделенных долек геля, достигаемой за счет способности 2%-ного раствора тетраоксида осмия к дополнительному обезвоживанию. Кроме того, 2%-ный раствор тетраоксида осмия обеспечивает дополнительную фиксацию липидов и контрастирование мембран, что в еще большей степени обеспечивает целостность внутриклеточных структур и повышает четкость их контуров.
Осуществление центрифугирования до получения геля со скоростью 3000 об/мин способствует сокращению времени центрифугирования, что обеспечивает сохранность клеток и внутриклеточных структур от разрушения.
В результате осуществления предложенного авторами способа получают препарат, в котором клетки сохраняют свою морфологию. Кроме того, клетки располагаются разрозненно, что позволяет детально изучить отдельно каждую клетку и изменения, происходящие с ее ультраструктурами. Все это несомненно повышает качество препарата, предназначенного для электронно-микроскопических исследований, и, как следствие, значительно повышает качество самих исследований.
Заявляемый способ поясняется следующими чертежами.
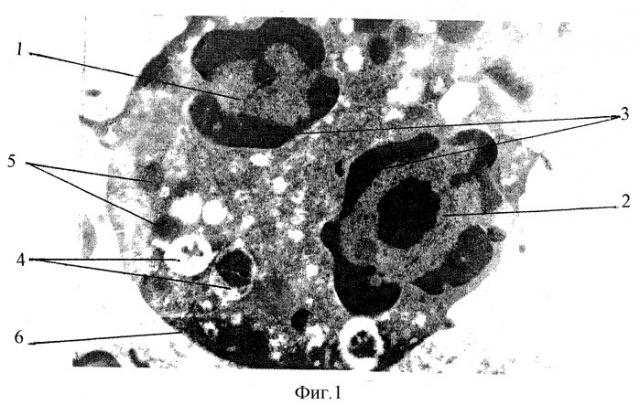
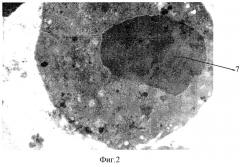
На фиг.1 изображена электронограмма интактного эозинофила (не подвергшегося воздействию лазерного излучения), увеличение х15000; на фиг.2 - электронограмма эозинофила, подвергшегося воздействию лазерного излучения с режимами λ=0,98 мкм, доза излучения 14,4 Дж, увеличение х15000; на фиг.3 - снимок препарата, приготовленного по известной методике, полученного при исследовании с помощью световой микроскопии. Увеличение x1000.
Способ подготовки препарата крови к электронно-микроскопическому исследованию осуществляется следующим образом.
В качестве примера приведено исследование эозинофилов периферической крови (ЭПК), выделенных от больных с аллергической реакцией. Часть исследуемых выделенных клеток эозинофилов подвергают предварительному воздействию лазерного излучения, часть исследуемых клеток остается интактной.
Данное исследование ставит перед собой задачу оценить изменения в клетке и внутриклеточных структурах, происходящие под воздействием лазерного излучения, в частности установить дозу лазерного излучения, вызывающую дегрануляцию эозинофилов, вызывающую у больного отеки, спазмы, явление агрегации тромбоцитов. Установление дозы лазерного излучения, вызывающей вышеуказанные изменения эозинофилов, позволит определить до начала лечения оптимальную не повреждающую дозу лазерного излучения для лечении больных с аллергической реакцией.
Забор осуществляют из периферической вены (10 мл) с гепарином, из расчета 500 ЕД гепарина на 10 мл крови. Выделение ЭПК осуществляют на непрерывном градиенте плотности фиколлаурографина (1,115 г/мл, 1,120 г/мл). Примесь других клеток составляет около 20%. После выделения 10 мкл взвеси выделенных ЭПК часть их наносят на предметное стекло, расположенное над водяной баней при 37°С, и облучают.
Для исследования изменений, происшедших в структуре эозинофилов, подвергнутых воздействию лазерного излучения и интактных клеток, готовят препараты тех и других клеток для электронно-микроскопического исследования, выполняя следующие переходы.
Суспензии выделенных нефиксированных, облученных лазером и интактных клеток эозинофилов отдельно каждую центрифугируют при скорости 1500 об/мин, затем удаляют надосадосную жидкость. После удаления надосадочной жидкости осадок ресуспендируют в 0,25 мл 10%-ного человеческого сывороточного альбумина в 0,05 М трис-буфере (рН 7,5) в пробирке типа эппиндорф на 2,0 мл. В полученную смесь добавляют одну каплю 25%-ного глутарового альдегида и сразу начинают центрифугировать при скорости 3000 об/мин до получения геля (до помутнения массы). Полученный гель заливают 10%-ным формалином на фосфатном буфере (рН 7,5) на срок до суток и затем разделяют на дольки (фрагменты) не более 1 мм, полученные при разделении дольки геля дофиксируют в 2%-ном водном растворе тетраоксида осмия. Далее материал обрабатывают по общепринятой схеме: дольки (фрагменты) геля дегидратируют, заливают в эпоксидные смолы с использованием компонентов из набора API-PON 812 KIT (фирма «SIGMA chemical company»). Полученные с готовых блоков эпоксидные срезы толщиной 0,5-1,0 мкм окрашивают (при нагревании) 1%-ным раствором метиленового голубого в 1%-ном растворе тетрабората натрия. Ультратонкие срезы последовательно контрастируют в растворах ацетата уранила и цитрата свинца (по Рейнольдсу). После чего изучают полученные срезы на трансмиссионном электронном микроскопе ЭМВ-100ЛМ (Россия) при увеличении 15000х.
В проведенных исследованиях изучалось действие двух видов низкоинтенсивных лазеров с длиной волны 0,63 мкм и 0,89 мкм. При этом констатировано, что существенные структурные изменения в ЭПК наблюдаются при действии лазерного луча с λ=0,89 мкм, дозе излучения 12,0-14,4 Дж.
При наблюдении препарата, не подвергавшегося воздействию лазерного излучения (интактного), под электронным микроскопом обнаружено, что в необлученных ЭПК четко видны два сегмента ядра (1 и 2) с контрастной окраской хроматина по периметру ядерной оболочки (3), вазикулотубулярные структуры (4), гранулы (5), мембрана (6).
При наблюдении препарата, подвергшегося воздействию лазерного излучения с повреждающими режимами (λ=0,89 мкм, доза излучения 14,4 Дж) под электронным микроскопом обнаружено, что повреждающий эффект выразился в уменьшении количества гранул (5) - дегрануляции эозинофилов, в изменении формы ядра - компактное бисегментарное ядро (1, 2) трансформировалось в крупный овал (7) с рыхло расположенным хроматином без каких-либо участков контрастирования. Последний стал гомогенным, слабо окрашенным.
Результаты проведенного исследования показали, что с помощью разработанной авторами методики достигнута возможность получения препарата для электронно-микроскопического исследования, обеспечивающего проведение исследования отдельной изолированной, морфологически неизмененной, целой, недеформированной клетки, с сохраненными внутриклеточными структурами, имеющими четкие границы, а также изменения, происходящие с данной клеткой и ее ультраструктурами, в результате различных воздействий на нее, в отличие от препарата, полученного известным способом, который не позволяет провести вышеперечисленные исследования, поскольку во время приготовления препарата по известной методике происходит разрушение как клетки, так и ее внутриклеточных структур, что хорошо видно на снимке, полученном при исследовании данного препарата с помощью световой микроскопии при увеличении x1000: полное отсутствие в исследуемом препарате целых клеток, наличие большого скопления их фрагментов (8), наложение фрагментов разрушенных клеток друг на друга, отсутствие границ как клетки, так и ядра, отсутствие целостности внутриклеточных структур (мембраны (6), ядра (не обнаружено).
1. Способ подготовки препарата крови к электронно-микроскопическому исследованию, включающий центрифугирование суспензии выделенных клеток, удаление надосадочной жидкости, ресуспендирование осадка в 0,25 мл сывороточного альбумина, добавление к полученной смеси одной капли 25%-ного глутарового альдегида и центрифугирование до получения геля, разделение на дольки, обезвоживание, заливка в эпоксидные смолы, приготовление срезов, их окрашивание и контрастирование, отличающийся тем, что осуществляют центрифугирование суспензии нефиксированных выделенных клеток со скоростью 1500 об/мин, полученный гель дополнительно заливают 10%-ным формалином на фосфатном буфере с рН 7,5 на срок до одних суток, в качестве сыворточного альбумина используют 10%-ный человеческий сывороточный альбумин, а полученные при разделении дольки геля дофиксируют в 2%-ном растворе тетраоксида осмия.
2. Способ по п.1, отличающийся тем, что центрифугирование до получения геля осуществляют со скоростью 3000 об/мин.