Опухоль-адресованный пептид
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в медицине для лечения и диагностики аденокарциномы легкого и ее метастазов. В результате селекции фаговой пептидной библиотеки по признаку избирательного связывания с клетками - мишенями выявлены пептиды, обладающие способностью накапливаться в клетках аденокарциномы легких, со следующими аминокислотными последовательностями: RNVPPIFNDVYWIAF, SVAILPRSFSPFXVG, PFARAPVEHHDVVGL. Новые опухоль-адресованные пептиды позволяют осуществлять целенаправленную доставку препаратов различного назначения в клетки аденокарциномы легких. 2 ил.
Реферат
Изобретение относится к биотехнологии, генной и белковой инженерии, конкретно - к получению с помощью фагового дисплея пептидов, специфически взаимодействующих с аденокарциномой легких.
В последние годы с помощью селекции фаговых библиотек против очищенных клеточных маркеров, культур клеток и даже in vivo на животных удалось идентифицировать целый ряд пептидов, специфичных в отношении тех или иных клеток [1]. Ранние работы в этой области касаются выделения пептидных лигандов для интегринов, представляющих класс гетеродимерных белков клеточной адгезии, выполняющих многие важные биологические функции, такие как рецепция матриксных белков и факторов роста, иммунологический контроль и др. [2]. Было показано, что пептиды, селектированные на очищенных интегринах, могут использоваться для избирательного связывания с клетками-мишенями. Селекция фаговых библиотек по связыванию с интактными клетками имеет ряд преимуществ, так как не требуется информация о предполагаемых рецепторах. Впервые этот подход был использован для выделения 20-мерного пептида, связывающегося с фибробластами [1]. Группа Ruoslahti из La Jolla Cancer Research Center разработала систему селекции in vivo, позволяющую выделять из пептидной фаговой библиотеки фаги, избирательно связывающиеся с различными органами и тканями [3]. Было показано, что органоспецифические фаги связываются с соответствующим органом в 4-9 раз лучше, чем в контроле. Органоспецифические фаги идентифицированы для легких, кожи, поджелудочной железы, тонкого кишечника, матки, надпочечников и сетчатки. При этом установлено, что фаг, связывающийся с легочной тканью, обладал наибольшей селективностью - в 35 раз больше, чем неселективный фаг [4].
Исследуя первичные структуры этих пептидов и получая в дальнейшем химическим синтезом такие пептиды, можно создавать конъюгаты с известными цитотоксическими препаратами, используемыми в настоящее время при терапии рака. Это позволит повысить эффективность доставки препаратов в опухолевую ткань и уменьшить их токсическое воздействия на здоровые ткани, а также использовать для диагностики опухолей и их метастазов с большей точностью и эффективностью.
Адресная доставка лекарственных препаратов к опухолям возможна пока лишь в некоторых случаях и ограничивается использованием моноклональных антител, причем с переменным успехом [5, прототип]. Одним из главных ограничений применения антител для диагностики опухолей в клинике является плохое поглощение и распределение антител в опухолях. Это обусловлено главным образом физиологическими факторами (неравномерным кровотоком и интерстициальной гипертензией), а также большими размерами молекул антител [6].
Один из путей преодоления этой проблемы состоит в использовании опухоль-специфичных лигандов небольшого размера. Малые молекулы часто имеют более высокие коэффициенты проницаемости и интерстициальной диффузии и способны проникать в опухоли более глубоко. Принципиально новый подход к решению проблемы адресованной химиотерапии опухолей состоит в использовании фаговых пептидных библиотек, включающих в себя набор статистических пептидов, экспонированных в составе одного из поверхностных белков нитчатых бактериофагов.
Технической задачей изобретения является поиск опухоль-специфических пептидов, взаимодействующих с аденокарциномой легкого с помощью фаговых пептидных библиотек.
Поставленная цель достигается путем аффинной селекции из фаговых пептидных библиотек, содержащих десятки миллионов разных пептидов длиной 15 а.о, тех пептидов, которые способны специфично накапливаться в аденокарциноме легких. Пептиды в библиотеке экспонированы на поверхности бактериофагов в составе минорного белка оболочки pIII, при этом каждая фаговая частица содержит 5 копий одного пептида [7].
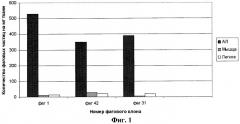
Метод аффинной селекции in vivo заключается в следующем. Фаговую библиотеку в количестве 1013 фаговых частиц (TU - трансдуцирующих единиц) вводят в хвостовую вену мыши с привитой аденокарциномой легкого. Через несколько минут мышь усыпляют и выделяют ткань, на которую ведут селекцию. Ткань гомогенизируют, отмывают от несвязавшихся фагов, а связавшиеся фаги после амплификации в E.coli повторно вводят мышам. После нескольких таких раундов из библиотеки отбираются фаги, экспонирующие на своей поверхности ткане-специфичные пептиды [3]. Обогащение фаговой популяции определяют по увеличению выхода фагов после каждого раунда селекции. Из обогащенной таким образом фаговой библиотеки после 1, 2, 3-го раундов аффинной селекции отбирают индивидуальные фаговые клоны и определяют их специфичность. Для подтверждения ткане-специфичности отдельных фаговых популяций, полученных после аффинной селекции, фаги вводились мышам на 24 часа. После чего в органах и тканях определялось количество накопившихся фагов (Tu/мг ткани)[8].
По результатам скрининга отбирают фаги, наиболее активно накапливающиеся в опухоли. Аминокислотный состав специфичных к опухоли пептидов, расположенных на поверхности фаговых частиц, определяют секвенированием фаговых ДНК по модифицированному методу Сэнгера [9] в кодирующей пептид области.
Для практического использования селектированные таким образом пептиды-миметики можно получать химическим синтезом и создавать на их основе конъюгаты с известными цитотоксическими препаратами, которые разрешены для терапии онкологических заболеваний, включать в состав липосомальных препаратов. А также создавать конъюгаты с радиоактивными изотопами для использования как в терапии, так и диагностике опухолей и их метастазов.
Сущность изобретения заключается в том, что селектированные из фаговой пептидной библиотеки пептиды, аминокислотные последовательности которых приведены на фиг.2, обладают свойством избирательно накапливаться в аденокарциноме легких.
Таким образом, впервые получены пептиды, избирательно накапливающиеся в аденокарциноме легких. Пептиды экспонированы на поверхности нитчатых бактериофагов в составе минорного белка оболочки pIII, при этом каждая фаговая частица содержит 5 копий одного пептида.
Изобретение иллюстрируется следующими фигурами:
Фиг.1. Скрининг индивидуальных фаговых клонов на мышах с привитой аденокарциномой легких. В качестве отрицательного контроля взят фаг fuse2, который не экспонирует рандомизованный пептид.
Фиг.2. Аминокислотные последовательности пептидов, экспонированные на поверхности фагов.
Для лучшего понимания сущности предлагаемого изобретения ниже следуют примеры его осуществления.
Пример 1. Способ проведения аффинной селекции пептидов, накапливающихся в аденокарциноме легких.
Первый раунд аффинной селекции фаговой библиотеки проводят по следующей схеме [3]. Мышам линии A/Sn с привитой подкожно аденокарциномой легких, которая достигла размера ˜1 см, вводят в хвостовую вену пептидную фаговую библиотеку 1014 трансдуцирующих единиц в 200 мл DMEM. Через 5 минут мышь усыпляют эфиром. Опухоль удаляют, взвешивают и гомогенизируют в 1 мл DMEM-PI (DMEM, содержащая ингибиторы протеаз: PMSF 1 mM, aprotinin 20 мкг/мл, leupeptin 1 мкг/мл). Опухоль трижды промывают DMEM-PI (4°С), содержащей 1% BSA и инкубируют с 1 мл компетентной культурой E.coli 1 час. Добавляют 10 мл питательной среды YT×2, содержащей 0,2 мкг/мл тетрациклина, и инкубируют, перемешивая, при 37°С 1 час. 200 мкл смеси переносят на чашку Петри с агаром, содержащим 40 мкг/мл тетрациклина, и инкубируют ночь при 37°С. Колонии смывают 1 мл YT×2, содержащей 20 мкг/мл тетрациклина, и инкубируют в 5 мл, перемешивая 16 часов при 37°С. Выделяют фаг и проводят второй и третий раунды аффинной селекции, как описано выше. Фаги титруют с использованием клеток К91Каn, выращенных на ТВ-среде, с последующим высевом на чашки с агаром, содержащим канамицин (100 мкг/мл) и тетрациклин (40 мкг/мл), титр фагов определют по числу колоний (трансдуцирующих единиц (TU)) по G.P.Smith [5]. Количество фаговых частиц рассчитывают по формуле 1 TU=20 вирионов.
После третьего раунда селекции получают индивидуальные фаговые колонии, которые используют для наработки одноцепочечной ДНК и фагов для имммуноферментного анализа (ИФА). Определение последовательности ДНК проводят по модифицированному методу Сэнгера [9]. В качестве праймера используют олигонуклеотид 5'-TGAATTTTCTGTATGAGG [7].
Пример 2. Скрининг индивидуальных фаговых клонов на мышах линии СВА с привитой аденокарциномой легких.
Мышам линии СВА с привитой подкожно аденокарциномой легких, которая достигла размера ˜1 см, вводят в хвостовую вену фаг в количестве 109 трансдуцирующих единиц в 500 мл DMEM. Через 24 часа мышь усыпляют эфиром. Опухоль и контрольные органы (мышца, легкое и др.) удаляют, взвешивают и гомогенизируют в 1 мл DMEM-PI (DMEM, содержащая ингибиторы протеаз: PMSF 1 mM, aprotinin 20 мкг/мл, leupeptin 1 мкг/мл). Опухоль и контрольные органы трижды промывают DMEM-PI (4°С), содержащей 1% BSA, и инкубируют с 1 мл компетентной культурой E.coli 20 минут при комнатной температуре. Добавляют 3 мл питательной среды YT×2, содержащей 0,2 мкг/мл тетрациклина, и инкубируют, медленно перемешивая, при 37°С 20 мин. Образцы охлаждают до 4°С, отбирают аликвоты по 5 мкл и 50 мкл и высевают на чашки Петри с агаром, содержащим канамицин (100 мкг/мл) и тетрациклин (40 мкг/мл). Через 16 часов подсчитывают выросшие колонии и вычисляют количество фаговых частиц, содержащихся в 1 мг исследуемой ткани.
Таким образом, получены специфичные пептиды, избирательно накапливающиеся в аденокарциноме легких, которые могут быть успешно использованы в терапии и диагностике злокачественных новообразований у онкологических больных.
Опухоль-адресованный пептид, обладающий способностью накапливаться в аденокарциноме легких, имеющий последовательность, выбранную из группы последовательностей:
RNVPPIFNDVYWIAF,
SVAILPRSFSPFXVG,
PFARAPVEHHDVVGL.