Полипептид, обладающий способностью связываться с внутриклеточным доменом p-55 tnf-рецептора, молекула днк, кодирующая этот полипептид, вектор экспрессии и способ получения полипептида
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и генетической инженерии и может быть использовано в медицине при лечении заболеваний, связанных с передачей TNF-сигнала. При использовании двухгибридной дрожжевой системы выявлены последовательности ДНК, кодирующие полипептиды (55.1 и 55.3), которые обладают способностью связываться с внутриклеточным доменом р-55 (р-551С) TNF-рецептора. Установлено, что названные полипептиды представляют собой фрагменты аминокислотной последовательности р-55IС, соответственно, от 328 до 426 и от 277 до 426 остатка. В результате встраивания фрагментов ДНК с кодирующей полипептид 55.1 или 55.3 последовательностью в состав экспрессирующего вектора и трансформации им подходящих клеток-хозяев получены рекомбинантные формы названных полипептидов. Применение настоящего изобретения обеспечивает возможность модулирования функции интактного р-55 TNF-рецептора. 4 с. и 5 з.п. ф-лы, 12 ил., 3 табл.
Реферат
Настоящее изобретение относится к рецепторам, принадлежащим к суперсемейству рецепторов TNF/NGF, и к регулированию их биологических функций. К суперсемейству рецепторов TNF/NGF принадлежат рецепторы факторов роста некроза опухолей р55 - и р75 (TNF-R), рецептор лиганда FAS (называемый также FAS/AP01 или FAS-R, и обозначаемый далее FAS-R) и другие рецепторы. Более конкретно, настоящее изобретение относится к новым белкам, которые связываются с внутриклеточными доменами (1C) р55- и p75-TNF-R и FAS-R (обозначаемыми далее р551С, р751С и FAS-1C, соответственно), и которые обладают способностью модулировать функции р55- и р75-TNF-рецепторов, а также FAS -рецептора. Одним из таких белков, способных связываться с р551С интактного p55-TNF-R, является сам р551С в виде молекулы р551С или ее части, например, так называемого "домена смерти" р551С. Таким образом, настоящее изобретение также относится к новым TMF-ассоциированным эффектам, которые могут быть индуцированы в клетках внутриклеточным доменом p55-TNF (р551С) или его частью лиганд (TNF)-независимым образом. Кроме того, настоящее изобретение относится к получению и использованию указанных новых белков, связывающихся с р55- и p75-TNF-R, и белков, связывающихся с FAS-R, которые в настоящем описании именуются р551С-, р751С- и FAS -1C-связывающими белками.
В другом аспекте, настоящее изобретение также относится к новым растворимым олигомерным TNF-R, олигомерным FAS-R и олигомерным рецепторам, представляющим собой смесь TNF-R и FAS-R; к использованию этих рецепторов, и к способам их получения.
Предпосылки создания изобретения
Фактор некроза опухолей (THF-α) и лимфотоксин (TNF-β) (обозначаемые далее TNF-α и TNF-β, соответственно) представляют собой многофунциональные цитокины, образуемые, главным образом, мононуклеарными фагоцитами, и обладающие множественным действием на клетку (Wallach, D. (1986), в "Interferon 7 (Ion, Gresser, eo.), pp.83-122, Academic Press, London; и Beutler & Cerami (1987)). Действие обоих указанных цитокинов, TNF-α и TNF-β инициируется посредством их связывания со специфическими рецепторами клеточной поверхности. Очевидно, что некоторые действия этих цитокинов благоприятно влияют на организм, то есть, они могут, например, разрушать опухолевые или вирус-инфицированные клетки и усиливать антибактериальную активность гранулоцитов. В этом случае TNF обеспечивают защиту организма от опухолей и инфекционных агентов, а также способствует заживлению ран. Таким образом, TNF может быть использован в качестве противоопухолевого агента, который связывается со своими рецепторами на поверхности опухолевых клеток и тем самым инициирует события, приводящие к гибели этих опухолевых клеток. TNF может быть также использован в качестве противоинфекционного средства.
Однако оба эти фактора, т.е. TNF-α и TNF-β, обладают также неблагоприятным действием. Было показано, что сверхпродуцирование TNF-α может играть важную роль в патогенезе некоторых заболеваний. Так, например, в настоящее время уже известно, что действие TNF-α, главным образом на сосудистую сеть органа, вызывает симптомы септического шока (Tracey et al., 1986). При некоторых заболеваниях, TNF может также вызывать резкое снижение массы тела (кахексию) в результате подавления активности адипоцитов и провоцирования анорексии, а поэтому фактор некроза опухолей TNF-α имеет также название кахексин. Сообщалось также, что TNF опосредует разрушение тканей при ревматических заболеваниях (Beutler & Cerami, 1987) и является главным медиатором отторжения, наблюдаемого в реакциях "трансплантант против хозяина" (Piquet и др. 1987). Кроме того, известно, что TNF участвует в процессе воспаления и опосредует многие другие заболевания.
Два отличающихся друг от друга и независимо экспрессируемых рецептора р55- и p75-TNF-R, которые специфически связываются с TNF-α и TNF-β инициируют и/или опосредуют биологические функции вышеуказанных TNF. Эти два рецептора имеют структурно отличающиеся внутриклеточные домены, что позволяет предположить, что они передают разные сигналы (см., Hohnman и др., 1989; Engelmann и др., 1990; Brockhaus и др., 1990; Leotscher и др., 1990; Schall и др., 1990; Nophar и др., 1990; Smith и др., 1990; и Heller и др., 1990). Однако клеточные механизмы, например различные белки и возможно другие факторы, участвующие в передаче внутриклеточного сигнала р55- и р75-TNF-R, пока еще не выявлены (ниже впервые описываются новые белки, способные связываться с р751С и р551С). Но именно такая передача сигналов, которая происходит обычно после связывания лиганда (т.е. TNF-α или ТМР-β) с рецептором, ответственна за инициацию каскада реакций, которые, в конце концов, приводят к наблюдаемому клеточному ответу на TNF.
Что касается вышеупомянутого цитоцидного действия TNF, то в большинстве клеток, изученных до настоящего времени, это действие стимулируется, главным образом, рецептором p55-TNF. Антитела против внеклеточного домена (домен, связывающийся с лигандом) р55-TNF-R, могут сами по себе быть стимуляторами цитоцидного эффекта (см., ЕР 412486), который коррелирует с эффективностью перекрестного связывания рецептора с антителами, и который является, очевидно, первой стадией процесса передачи внутриклеточного сигнала. Кроме того, исследования, проведенные методом мутаций (Brackebuch и др., 1992, Tartaglia и др., 1993), показали, что биологическая функция p55-TNF-R зависит от целостности его внеклеточного домена, что дает основания предположить, что инициация трансдукции внутриклеточного сигнала, индуцирующая цитоцидное действие TNF, происходит в результате объединения двух или нескольких внутриклеточных доменов р55-TNF-R. Кроме того, TNF (α и β) пфигутствует в виде гомотридимера, и, как было предположено, индуцирует p55-TNF-R -опосредованную передачу внутриклеточных сигналов благодаря своей способности к связыванию и перекрестному сшиванию с рецепторными молекулами, т.е. к созданию агрегации с рецептором. Ниже, в настоящей заявке, будет описано, каким образом р551С и р55DD могут ассоциироваться друг с другом, и индуцировать лиганд-независимым способом, TNF-ассоциированные эффекты в клетках.
Другим членом суперсемейства TNF/NGF-рецепторов является рецептор FAS (FAS-R), который называют также FAS-антигеном, и который представляет собой белок клеточной поверхности, экспрессируемый в различных тканях, и обладающий гомогией с рядом рецепторов клеточной поверхности, включая TNF-R и NGF-R, FAS-R опосредует гибель клеток по типу апоптоза (Iton. и др., 1991), и служит, очевидно, в качестве негативного селектора аутореактивных Т-клеток, т.е. в процессе созревания Т-клеток, FAS-R опосредует апоптоз Т-клеток, распознающих аутоантигены. Было также обнаружено, что мутации в гене FAS-R (1 pr) вызывают нарушение лимфопролиферации у мышей, которые имеют сходную с человеческой картину такого аутоиммунного заболевания, как системная красная волчанка (SLE) (Watanabe-Fukunaga и др., 1992). Лигандом для FAS-R является, очевидно, молекула, ассоциируемая с клеточной поверхностью, и несомая, среди прочих, Т-клетками-киллерами (или цитотоксическими Т-лимфоцитами - CTL), а поэтому, когда такие CTL контактируют с клетками, несущими FAS-R, они способны индуцировать апоптоз FAS-R-несущих клеток. Кроме того, было получено моноклональное антитело со специфичностью к FAS-R, которое обладало способностью индуцировать апоптоз клеток, несущих FAS-R, включая мышиные клетки, трансформированные кДНК, кодирующей FAS-R человека (Iton и др., 1991).
Было также обнаружено, что помимо Т-лимфоцитов, имеются и другие нормальные клетки, которые экспрессируют FAS-R на своей поверхности, и которые могут быть уничтожены путем стимуляции этого рецептора. Было высказано предположение, что нерегулируемая индукция такого процесса цитолиза приводит, при некоторых заболеваниях, к разрушению тканей организма, например, к деструкции клеток печени при остром гепатите. Поэтому разработка способов ограничения цитотоксической активности FAS-R может привести к получению методов терапии, имеющих важное значение.
И наоборот, поскольку было также обнаружено, что некоторые злокачественные клетки и ВИЧ-инфицированные клетки несут FAS-R на своей поверхности, то антитела против FAS-R, или FAS-R-лиганда могут быть использованы для стимуляции FAS-R-опосредованных цитотоксических эффектов, что позволит получить средство уничтожения указанных злокачественных или ВИЧ-инфицированных клеток (см., Iton. и др., 1991). Кроме того, получение других способов усиления цитотоксической активности FAS-R может также иметь важное терапевтическое значение.
Уже давно назрела необходимость в получении способа модуляции клеточного ответа к TNF (α или β) FAS-R-лиганду. Так, например, в патологических процессах, упомянутых выше, где происходит сверхсинтез TNF или FAS-R-лиганда, желательно ингибировать TNF- или PAS-R-лиганд-индуцированные цитоцидные эффекты; а в других ситуациях, например при заживлении ран, желательно стимулировать действие TNF, либо, в случае опухолевых или ВИЧ-инфицированных клеток, желательно стимулировать FAS-R-опосредованный ответ.
Авторами настоящего изобретения было разработано несколько способов (см., например, заявку на Европейский патент ЕР 186833, ЕР 308078, ЕР 398327 и ЕР 412486) регулирования нежелательных эффектов TNF путем ингибирования связывания TNF с его рецепторами с помощью антител против TNF или путем использования растворимых TNF-рецепторов (являющихся, в основном, растворимыми внеклеточными доменами рецепторов) для конкурирования на связывание TNF со TNF-рецепторами, ассоциированными с клеточной поверхностью. Кроме того, исходя из того, что для получения TNF-индуцированного клеточного ответа необходимо связывание TNF со своими рецепторами, авторами настоящего изобретения были разработаны способы (см., например ЕРО 568925) регулирования действия TNF путем модулирования активности TNF-рецепторов. В частности, в ЕРО № 568925 описан способ модуляции трансдукции сигнала и/или гидролиза в TNF-R, в результате чего пептиды или другие молекулы могут взаимодействовать либо с самим рецептором, либо с эффекторными белками, взаимодействующими с рецептором, осуществляя тем самым модуляцию нормального функционирования TNF-R. В ЕРО 568925 также описываются конструирование и характеризация различных мутантных р55-TNF-рецепторов, имеющих мутации во внеклеточном, трансмембранном и внутриклеточном доменах p55-TNF-R. Таким образом, области, находящиеся в вышеуказанных доменах р55-TNF-R, были идентифицированы как главные области функционирования рецептора (т.е. связывания с лигандом TNF) с последующей трансдукцией сигнала и внутриклеточной передачей сигнала, приводящих, в конечном счете, к TNF-эффекту, наблюдаемому на клетках. Кроме того, в этом патенте описан ряд методов выделения и идентификации белков, пептидов и других факторов, которые способны связываться с различными областями в вышеуказанных доменах TNF-R, причем указанные белки, пептиды и другие факторы могут участвовать в регуляции или модуляции активности TNF-R. В ЕРО 568925 также раскрываются способы выделения и клонирования ДНК-последовательностей, кодирующих указанные белки и пептиды; способы конструирования экспрессирующих векторов для продуцирования этих белков и пептидов; и способы получения антител или их фрагментов, которые взаимодействуют с TNF-рецепторами или с вышеуказанными белками и пептидами, связывающимися с различными областями TNF-R. Однако в ЕРО 568925 отсутствуют какие-либо описания белков и пептидов настоящего изобретения, которые связываются с внутриклеточными доменами TNF-R (например, p55-TNF-R), a также отсутствуют какие-либо описания способа выделения и идентификации таких белков или пептидов с использованием дрожжевой двухгибридной системы. Кроме того, до сих пор также не были описаны белки или пептиды, способные связываться с внутриклеточным доменом FAS-R.
Таким образом, для ингибирования действия TNF или FAS-R-лиганда необходимо уменьшить количество или активность TNF-R, или FAS-R на поверхности клетки, тогда как для стимуляции действия TNF или FAS -R-лиганда необходимо увеличить количество или активность TNF-R или FAS-R. Для этой цели недавно авторами настоящего изобретения были секвенированы и проанализированы промоторы р55-TNF-R и p75-TNF-R, в результате чего было установлено, что ряд их ключевых "мотивов" имеют последовательности, характерные для различных факторов регуляции транскрипции; а поэтому, в сущности, экспрессия TNF-R может регулироваться на уровне их промотора, т.е. может быть достигнуто ингибирование транскрипции, инициируемой промотором, в целях снижения числа рецепторов, либо усиление транскрипции, инициируемой промотором, в целях увеличения числа рецепторов (см., 1L 104355 и 1L 109633, и их соответствующие, еще не опубликованные Европейский патент и РСТ-патент). О соответствующих исследованиях, относящихся к регулированию FAS -R на уровне промотора FAS-R-гена, пока еще не сообщалось.
Кроме того, следует также отметить, что хотя, как известно, рецепторы фактора некроза опухолей (TNF) и их структурно родственный рецептор FAS-R (стимулятор в клетках), после стимуляции лейкоцит-продуцированными лигандами, проявляют деструктивную активность, что приводит к их собственному разрушению, тем не менее, механизмы такой стимуляции остаются все еще малопонятными. Мутационные исследования показали, что FAS-R и Р55-TNF-рецептор (р55-R), передающие сигналы цитотоксичности, имеют в своих внутриклеточных доменах особые области (Brackebush и др. 1992; Tartaglia и др., 1993; Iton и Nagata, 1993). Эти области ("домены смерти") имеют сходные последовательности. Такие "домены смерти" обоих FAS-R и р55-R имеют тенденцию к самоассоциации. Самоассоциация этих доменов, очевидно, стимулирует агрегацию этих рецепторов, которая является необходимой для инициации передачи сигнала (как показано ниже, а также как описано Song и др., 1994; Wallach и др.; 1994; Boldin и др., 1995), и при высоких уровнях экспрессии рецептора может приводить к стимуляции лиганд-независимой передачи сигнала (как показано ниже, и как описано Boldin и др., 1995).
Таким образом, до появления настоящего изобретения не было каких-либо сообщений о получении белков, которые могут регулировать действие лигандов, принадлежащих к суперсемейству TNF/NGF (например, действие TNF или FAS-R-лиганда на клетки), опосредуя передачу внутриклеточного сигнала, управляемую, по всей вероятности, внутриклеточными доменами (1C) рецепторов, принадлежащих к суперсемейству рецепторов TNF/NGF, (таких как TNF-рецепторы), а именно внутриклеточными доменами р55- и p75-TNF-R (p551C и р751С, соответственно), а также FAS-1C.
В соответствии с этим, одной из целей настоящего изобретения является получение белков, обладающих способностью связываться с внутриклеточными доменами TNF-R, и FAS-R, причем, эти белки, как предполагается в настоящее время, участвуют во внутриклеточной передаче сигнала, инициируемой посредством связывания TNF с его рецепторами, или связывания FAS-лиганда с его рецепторами.
Другой целью настоящего изобретения является получение антагонистов (например, антител) против указанных белков, связывающихся с внутриклеточным доменом (1C-связывающее антитело), которые, если это необходимо, могут быть использованы для ингибирования передачи сигнала, в том случае, если такие 1C-связывающие белки являются позитивными эффекторами сигнала (т.е. индуцируют передачу сигнала), либо они могут быть использованы для усиления передачи сигнала, в том случае, если такие 1C-связывающие белки являются негативными эффекторами сигнала (т.е., ингибируют передачу сигнала).
Еще одной целью настоящего изобретения является использование таких 1C-связывающих белков для выделения и характеризации других белков или факторов, которые могут, например, участвовать в последующих процессах передачи сигнала, и/или для выделения и идентификации других рецепторов, участвующих в предшествующем процессе передачи сигнала, с которыми связываются эти 1C-связывающие белки (например, другие TNF-R или родственные рецепторы), и следовательно, за функции которых эти белки также ответственны.
Кроме того, целью настоящего изобретения является использование вышеупомянутых 1C-связывающих белков в качестве антигенов для продуцирования поликлональных и/или моноклональных антител против этих белков. Полученные таким образом антитела могут быть, в свою очередь, использованы для очистки новых 1C-связывающихся белков из различных источников, таких, как клеточные экстракты или трансформированные клеточные линии.
Эти антитела могут быть также использованы в диагностических целях, например, для идентификации расстройств, связанных с нарушением клеточных функций, опосредуемых рецепторами, принадлежащими к суперсемейству рецепторов TNF/NCP.
Другой целью настоящего изобретения является получение фармацевтических композиций, содержащих вышеуказанные 1С-связывающие белки, и фармацевтических композиций, содержащих антагонисты 1C-связывающих белков, для лечения или профилактики TNF-индуцированных или FAS-лиганд-индуцированных состояний; причем указанные композиции могут быть использованы для усиления действия TNF или FAS-лиганда, либо для ингибирования действия TNF или FAS -лиганда в зависимости от природы вышеуказанного 1C-связывающего белка или его антагониста, содержащегося в данной композиции.
Кроме того, в соответствии с еще одной целью настоящего изобретения, в настоящем описании раскрываются другие способы элиминации или ингибирования эндогенно образуемого или экзогенно введенного TNF или FAS-R-лиганда посредством использования растворимых олигомерных TNF-рецепторов, олигомерных FAS-рецепторов, или олигомеров, представляющих собой смесь TNF-рецепторов и FAS-рецепторов. В этой связи следует отметить, что была предпринята одна попытка выделить и продуцировать с помощью техники рекомбинантных ДНК TNF-связывающий белок, названный ТВР-1, который, как было показано, обладал способностью ингибировать действие TNF. Антагонизм указанного белка был определен путем измерения снижения цитотоксической активности TNF, а также путем измерения уровня его ингибирования связывания TNF со своими рецепторами (ЕР 308378). Как было обнаружено, ТВР-1 обеспечивает защиту клеток от токсического действия TNF при концентрациях в несколько нанограммов на один миллилитр и противодействует связыванию TNF-α и TNF-β с клетками при одновременном введении этого белка с указанными цитокинами. Последующее исследование механизма, по которому действует ТВР-1, выявило, что ТВР-1 не взаимодействует с клеткой-мишенью, а скорее всего блокирует функцию TNF путем специфического связывания с TNF, конкурируя, тем самым, с его рецептором.
Позднее, с использованием другого метода очистки было обнаружено пфигутствие двух активных компонентов, одним из которых является ТВР-1, а другим является второй TNF-связывающий белок, названный нами ТВР-11 (впервые описан в ЕР 398327). Оба эти белка обеспечивали защиту клеток от цитоцидного in vitro - действия TNF, и оба белка связывались с TNF-β менее эффективно, чем TNF-α. Хотя в анализе, проведенным с помощью электрофореза в ПААГ с ДСН, было установлено, что белки ТВР-1 и ТВР-11 имеют очень близкие молекулярные массы, однако, их можно отличить друг от друга по отсутствию иммунологической перекрестной реактивности, по различию N-концевых аминокислотных последовательностей и по различию аминокислотного состава.
Однако вышеупомянутые TNF-связывающие белки являются мономерными и способны связываться лишь с одним мономером гомотримера TNF, натурального лиганда, в результате чего этот TNF все еще остается активным (т.е. неполностью нейтрализованным) благодаря тому, что у этого тримера имеется еще два активных мономера, не связанных TNF-связывающими белками. Кроме того, до сих пор не были описаны растворимые FAS-R (растворимые белки, связывающиеся с FAS-R-лигандом), способные связываться с лигандом для FAS-R, который, как известно, представляет собой гомотримерную молекулу, ассоциированную с клеточной поверхностью.
Так называемый "домен смерти (клеток)" рецептора р55-TNF (обозначенного р55-1С) был описан в работе Tartaglia и др. (1993), однако, в этой работе не показано (как это сделано в настоящей заявке), что р55-1С и его "домен смерти" являются самоассоциирующимися, и эта самоассоциация ответственна, главным образом, за передачу сигнала, приводящего к индуцированию цитотоксического воздействия на клетку. Кроме того, в этой публикации ничего не сообщается в возможности продуцирования растворимых олигомерных TNF-рецепторой или растворимых олигомерных FAS-рецепторов, а также умалчивается о других TNF-ассоциированных эффектах, индуцируемых р55-1С или его фрагментами, например, о таких эффектах как индуцирование экспрессии гена 1L-8, которые рассматриваются в настоящем изобретении. В другой работе, опубликованной после подачи настоящей заявки, раскрывается способность к агрегации (т.е. к самоассоциации) р55-1С, но также ничего не упоминается ни о получении растворимых олигормерных TNF-рецепторов и FAS-рецепторов, ни о других TNF-ассоциированных эффектах, индуцируемых лиганд-независимым способом р55-1С или его фрагментами, раскрываемыми в настоящей заявке.
Краткое описание изобретения
При работе над настоящим изобретением мы обнаружили новые белки, способные связываться с внутриклеточным доменом р55-TNF-рецептора (р551С-связывающие белки), р75-TNF-рецептора (р751С-связывающие белки), и FAS-рецептора (FAS-1C-связывающие белки). Эти р551С, р751С и FAS-1С-связывающие белки могут действовать как медиаторы или модуляторы эффекторного действия TNF или FAS-R-лиганда на клетки путем опосредования или модуляции внутриклеточной передачи сигнала, которая происходит после связывания TNF с р55- и/или р75-TNF-R или связывания FAS -R-лиганда на клеточной поверхности. Кроме того, было неожиданно обнаружено, что р551С и FAS-1C обладают способностью к самоассоциации, и что фрагменты р551С и FAS-1C одинаково способны связываться с р55-1С, особенно с так называемыми "доменами смерти (клеток)" (DD), находящимися во внутриклеточных доменах (1C) этих рецепторов, т.е. р55DD и FAS-DD. Таким образом, р55-1С и FAS-1C и их фрагменты также представляют собой белки, способные связываться с р551С и FAS-1C, а поэтому они могут быть модуляторами действия TNF или FAS-R-лиганда на клетки.
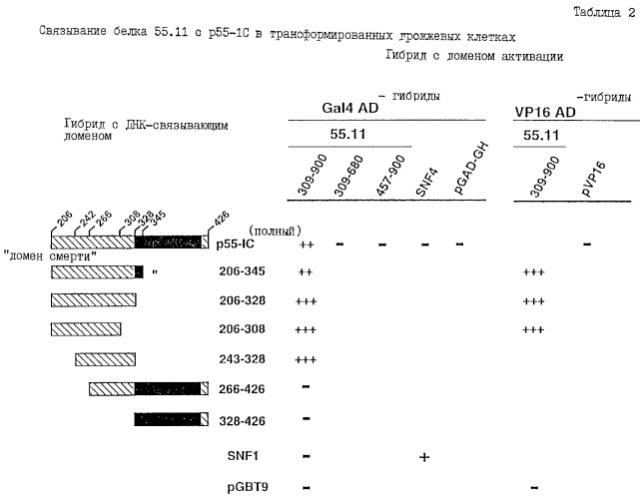
Кроме того, в соответствии с настоящим изобретением была более полно раскрыта природа связывания одного из новых белков (обозначенного в настоящем описании белком 55.11) с внутриклеточным доменом р55-TNF-рецептора (см. Пример 1).
Более того, в другом своем аспекте, настоящее изобретение основано на обнаружении того факта, что внутриклеточный домен рецептора p55-TNF (р55-1С); область, содержащаяся в нем (так называемый "домен смерти" р55-1С); а также внутриклеточный домен рецептора FAS/APO1 (FAS-1C); и область, содержащаяся в нем (так называемый "домен смерти" FAS-1C), обладают способностью к самоассоциации. В соответствии с этим, можно, с помощью стандартной техники рекомбинантных ДНК, сконструировать растворимый олигомерный TNF-рецептор, который является гибридным продуктом, содержащим, у одного своего конца, по крайней мере, два внеклеточных домена TNF-рецептора, и у другого своего конца, по крайней мере, два из вышеуказанных самоассоциирующихся внутриклеточных доменов или их фрагментов, где в результате такой самоассоциации образуется олигомер, имеющий, по крайней мере, два гибридных продукта, соединенных вместе. Таким образом, указанный растворимый олигомерный TNF-рецептор способен связываться с двумя мономерами натурального гомотримера TNF, и как таковой эффективно нейтрализует активность TNF. Нейтрализация активности TNF является желательной во всех вышеупомянутых условиях, где наблюдается продуцированное эндогенно или введенное экзогенно чрезмерное количество TNF, приводящее к нежелательным побочным эффектам. Кроме того, эффективное связывание TNF с растворимыми олигомерными рецепторами настоящего изобретения может также служить для связывания экзогенно добавленного TNF и его последующего желательного прологнированного высвобождения в условиях, при которых введение TNF оказывает благоприятное действие, например при опухолевой терапии. Аналогичным образом, с использованием стандартной техники рекомбинантных ДНК, может быть сконструирован олигомерный FAS-рецептор, являющийся гибридным продуктом, содержащим, по крайней мере, два внеклеточных домена FAS-рецептора на одном своем конце, и по крайней мере, два вышеуказанных самоассоциирующихся внутриклеточных домена или его фрагментов, где в результате такой самоассоциации образуется олигомер, имеющий, по крайней мере, два гибридных продукта, соединенных вместе. Таким образом, указанный олигомерный FAS -R способен связываться с двумя мономерами натурального гомотримера FAS-R-лиганда, и эффективно нейтрализовать активность FAS-R-лиганда. Нейтрализация активности FAS-R-лиганда является желательной во всех вышеупомянутых ситуациях, где избыточное количество этого лиганда ассоциируется с нежелательными побочными эффектами. Аналогичным образом, если принять во внимание недавние сообщения, указывающие на возможную связь между TNF и FAS-R-лиганд-индуцированными воздействиями на клетки, а следовательно, на возможную их географическую ассоциацию на клеточной поверхности, где они связываются со своими рецепторами, то становится очевидным, что с помощью стандартной техники рекомбинантных ДНК можно сконструировать смешанный олигомерный рецептор, обладающий специфичностью как к TNF, так и к FAS-R-лиганду. Такой смешанный олигомер должен представлять собой смесь вышеуказанных гибридных продуктов, содержащих, по крайней мере, один внеклеточный домен TNF-рецептора и, по крайней мере, один внеклеточный домен FAS-рецептора у своего одного конца, и, по крайней мере, два вышеупомянутых самоассоциирующихся внутриклеточных домена или их фрагментов у своего другого конца, где в результате такой самоассоциации образуется смешанный олигомер, имеющий, по крайней мере, два таких гибридных продукта, соединенные вместе. Таким образом, указанный смешанный олигомер способен связываться в одно и то же время, по крайней мере, с одним мономером TNF и с одним мономером FAS-R-лиганда, способствуя, тем самым, снижению или эффективной нейтрализации активности TNF и FAS-R-лиганда ни клеточной поверхности в условиях, при которых, как указано выше, избыточные количества этих двух цитокинов ассоциируются с нежелательными побочными клеточными эффектами. Как указывалось выше, FAS-R-лиганд, в основном, ассоциирован с клеточной поверхностью, а в недавних публикациях также описаны формы TNF, ассоциированные с клеточной поверхностью. Поэтому указанные смешанные олигомеры TNF/FAS-R являются особенно эффективными для нейтрализации активности TNF и FAS-R-лиганда на клеточной поверхности.
В соответствии с этим настоящее изобретение относится к ДНК-последовательности, кодирующей белок, способный связываться с одним или несколькими внутриклеточными доменами одного или нескольких рецепторов, принадлежащих к суперсемейству рецепторов фактора некроза опухолей/фактора роста нервной ткани (TNF/NGF).
В частности, настоящее изобретение относится к ДНК-последовательности, выбранной из группы, включающей в себя:
а) кДНК-последовательность, происходящую от области, кодирующей нативный белок, связывающийся с внутриклеточным доменом TNF-R;
b) ДНК-последовательности, способные к гибридизации с ДНК а) в условиях умеренной жесткости, и кодирующие биологически активный белок, который связывается с внутриклеточным доменом TNF-R;
с) ДНК-последовательности, которые являются вырожденными по отношению к ДНК-посдедовательностям, определенным в а) и b), в результате вырожденности генетического кода, и которые кодируют биологически активный белок, связывающийся с внутриклеточным доменом TNF-R.
Настоящее изобретение также относится к ДНК-последовательности, выбранной из группы, включающей в себя:
а) кДНК-последовательность, происходящую от области, кодирующей нативный белок, связывающийся с внутриклеточным доменом FAS-R;
b) ДНК-последовательности, которые способны к гибридизации с кДНК (а) в умеренно строгих условиях, и которые кодируют биологически активный белок, связывающийся с внутриклеточным доменом FAS-рецептора;
с) ДНК-последовательности, которые являются вырожденными по отношению к ДНК-последовательностям, определенным в а) и b), в результате вырожденности генетического кода, и которые кодируют биологически активный белок, связывающийся с внутриклеточным доменом FAS-R.
В конкретных вариантах своего осуществления, настоящее изобретение относится к ДНК-последовательностям, кодирующим белки, которые связываются с внутриклеточным доменом р55-TNF-рецептора, р75-TNF-рецептора и FAS-рецептора, например, к ДНК-последовательностям, кодирующим белки, обозначенные 55.1; 55.3; 55.11; 75.3; 75.16; F2; F9 и DD11.
Настоящее изобретение также относится к белкам, их аналогам или производным, кодированным любой из вышеуказанных последовательностей настоящего изобретения, и способным связываться с одним или несколькими внутриклеточными доменами одного или нескольких TNF-рецепторов или FAS-рецептора. Варианты этого аспекта настоящего изобретения включают в себя белки, обозначенные 55.1, 55.3, 55.11, 75.3, 75.16, F2, F9 и DD11, их аналоги и их производные.
Настоящее изобретение также относится к векторам, кодирующим вышеуказанные белки настоящего изобретения, и содержащим вышеуказанные ДНК-последовательности настоящего изобретения; причем указанные векторы способны экспрессироваться в соответствующих аукариотических или прокариотических клетках-хозяевах. Кроме того, настоящее изобретение относится к трансформированным эукариотическим или прокариотическим клеткам-хозяевам, содержащим указанные векторы; и к способу продуцирования белков, их аналогов или производных настоящего изобретения путем культивирования таких трансформированных клеток-хозяев в условиях, подходящих для экспрессии указанных белков, с последующей пост-трансляционной модификацией указанных белков, если это необходимо, и экстракцией экспрессированного белка, его аналога или производного из культуральной среды указанных трансформированных клеток или из клеточных экстрактов указанных трансформированных клеток.
В другом своем аспекте, настоящее изобретение относится к антителам или к их активным производным или фрагментам, специфичным к белкам, аналогам и производным белков настоящего изобретения.
В еще одном своем аспекте, настоящее изобретение относится к использованию ДНК-последовательностей настоящего изобретения или белков настоящего изобретения, кодируемых этими последовательностями; причем это использование предусматривает осуществление, в частности, следующих способов:
i) способа модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-рецептор или FAS-рецептор, заключающегося в обработке указанных клеток одним или несколькими белками, выбранными из группы, включающей в себя белки, аналоги и производные настоящего изобретения, и белки р551С, р55DD FAS-1C или FAS-DD, их аналоги или производные, где все указанные белки способны связываться с внутриклеточным доменом и модулировать активность TNF-R или FAS-R, а указанная обработка клеток предусматривает введение в эти клетки одного или нескольких белков, их аналогов или производных в форме, подходящей для внутриклеточного введения; либо указанная обработка предусматривает введение в эти клетки ДНК-последовательности, в форме подходящего экспрессирующего вектора, кодирующей указанный один или указанные несколько белков, их аналогов или производных;
ii) способ модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, заключающегося в обработке этих клеток антителами, их активными производными или фрагментами настоящего изобретения;
iii) способа модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, заключающегося в обработке этих клеток олигонуклеотидной последовательностью, кодирующей последовательность, являющуюся антисмысловой, по крайней мере, к части последовательности настоящего изобретения; либо олигонуклеотидной последовательностью, кодирующей последовательность, являющуюся антисмысловой по отношению к последовательности р551С, р55DD, FA5-1C или FAS-DD); причем указанная олигонуклеотидная последовательность способна блокировать экспрессию, по крайней мере, одного из белков, связывающихся с внутриклеточным доменом TNF-R или FAS-R;
iv) способа модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, предусматривающего:
а) конструирование рекомбинантного вектора, происходящего от вируса животных, и несущего последовательность, кодирующую белок вирусной поверхности, который способен связываться со специфическим рецептором клеточной поверхности, и последовательность, выбранную из олигонуклеотидной последовательности, кодирующей последовательность, являющуюся антисмысловой, по крайней мере, к части последовательности настоящего изобретения, и олигонуклеотидной последовательности, кодирующей последовательность, являющуюся антисмысловой по отношению к последовательности р551С, р55DD, FAS-1C или FAS-DD; причем при введении в указанные клетки указанного вируса, указанная олигонуклеотидная последовательность способна блокировать экспрессию, по крайней мере, одного из белков, связывающихся с внутриклеточным доменом TNF-R или FAS-R; и
b) инфицирование указанных клеток вектором, определенным в а);
v) способ модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, заключающегося в обработке этих клеток соответствующим вектором, кодирующим рибозиму, имеющую последовательность, специфичную к последовательности, выбранной из мРНК-последовательности, кодирующей белок, аналог или производное настоящего изобретения, и мРНК-последовательности, кодирующей р551С, р55DD, FAS-1C или FAS-DD); причем указанная последовательность рибозимы способна взаимодействовать с мРНК-последовательностью, а также способна расщеплять указанную мРНК-последовательность, что приводит к ингибированию экспрессии белка, аналога или производного настоящего изобретения или к ингибированию экспрессии р551С, р55DD, FAS-1C или FAS-DD;
vi) способа обработки опухолевых клеток или ВИЧ-инфицированных клеток или клеток, подверженных другим заболеваниям, предусматривающего:
а) конструирование рекомбинантного вектора, происходящего от вируса животных, и несущего последовательность, кодирующую белок вирусной поверхности, который обладает способностью связываться с рецептором поверхности опухолевой клетки или рецептором поверхности ВИЧ-инфицированной клетки, или который обладает способностью связываться с другим рецептором поверхности клетки, подверженной другим нарушениям; и последовательность, выбранную из последовательности настоящего изобретения, кодирующей белок, аналог или производное настоящего изобретения, и последовательности, кодирующей р551С, р55DD, FAS-1C, FAS-DD, или их биологически активный аналог или производное; причем указанный белок, аналог или производное настоящего изобретения, или р551С, p55DD, FAS-1C, FAS-DD или их аналог или производное, при введении в указанные опухолевые или ВИЧ-инфицированные клетки или клетки с другими нарушениями, обладают способностью к уничтожению этих клеток;
b) инфицирование указанных опухолевых клеток или ВИЧ-инфицированных клеток или клеток с другими нарушениями вектором, определенным в (а);
vii) способа, выделения и идентификации белков, факторов или рецепторов, способных связываться с белками настоящего изобретения, связывающимися с внутриклеточным доменом, где указанный способ предусматривает осуществление аффинной хроматографии, в которой указанный белок настоящего изобретения связывают с матриксом для аффинной хроматографии, и этот связанный белок подвергают контакту с клеточным экстрактом, после чего белки, факторы или рецепторы из этого клеточного экстракта, которые связываются с указанным связанным белком, элюируют, выделяют и анализируют;
viii) способа выделения и идентификации белков, способных связываться с белками настоящего изобретения, связывающихся с внутриклеточным доменом, где указанный способ предусматривает получение дрожжевой двухгибридной системы, в которой последовательность, кодирующую указанный белок, связывающийся с внутриклеточным доменом, несет один гибридный вектор, а последовательность, происходящую из библиотеки кДНК или геномной ДНК, несет второй гибридный вектор, после чего, векторы, используемые для трансформации дрожжевых клеток-хозяев, выделяют с последующей экстракцией второго гибридного вектора для получения последовательности, кодирующей белок, который связывается с указанным белком, связываю