Сшитый высокоамилозный крахмал для использования в фармацевтических композициях с регулируемым высвобождением и способы его получения
Иллюстрации
Показать всеСшитый высокоамилозный крахмал содержит, по меньшей мере, 70 мас.% амилозы и может быть использован в качестве эксципиента в фармацевтической композиции с регулируемым высвобождением, где указанный эксципиент спрессовывают с фармацевтическим агентом в таблетку. Сшитый высокоамилозный крахмал получают путем (а) сшивания и химической модификации высокоамилозного крахмала, (в) желатинизации, и (с) сушки с получением порошка указанного регулирующего высвобождение эксципиента. Сшивку производят сшивающим реагентом в количестве от 0,005 до 0,3 г на 100 г сухого высокоамилозного крахмала. Использование химической обработки высокоамилозного крахмала, проводимой перед желатинизацией, позволяет получить продукт, проявляющий характеристики регулируемого высвобождения. Применение модифицированного крахмала в таблетке в качестве матрицы обеспечивает практически линейный профиль высвобождения, а время высвобождения составляет от 2 часов до 24 часов. 4 н. и 33 з.п. ф-лы, 23 ил., 10 табл.
Реферат
1. Область изобретения
Настоящее изобретение относится к новой форме сшитого высокоамилозного крахмала и к способам его получения. Указанный сшитый высокоамилозный крахмал пригоден в качестве эксципиента в фармацевтической композиции с регулируемым высвобождением, когда он спрессован с фармацевтическим агентом(ами) в таблетку.
2. Предшествующий уровень техники
Одним из решающих факторов, влияющих на скорость абсорбции лекарственного средства, вводимого в виде таблетки или в виде другой твердой лекарственной формы, является скорость растворения лекарственной формы в физиологической жидкости человека или животного.
Этот фактор лежит в основе так называемых фармацевтических препаратов с регулируемым высвобождением, более длительным высвобождением, замедленным высвобождением или пролонгированным высвобождением, предназначенных для получения замедленного равномерного высвобождения и абсорбции лекарственного средства в течение нескольких часов, дней, недель, месяцев или лет. По сравнению со стандартными лекарственными формами преимуществами композиций с регулируемым высвобождением являются уменьшение частоты введения лекарственного средства (результатом чего часто является лучшее соблюдение пациентом режима лечения), сохранение терапевтического эффекта в течение установленного промежутка времени и снижения количества и/или интенсивности нежелательных побочных эффектов от лекарственного средства путем элиминации пиков концентрации в плазме, которые часто наблюдаются после введения лекарственных форм быстрого высвобождения.
В качестве матриц для высвобождения лекарственных средств было предложено и разработано много систем. Так, например, в качестве носителей для замедленного высвобождения лекарственных средств были предложены такие полимерные материалы, как поливинилхлорид, полиэтиленамиды, этилцеллюлоза, силикон и поли(гидроксиметилметакрилат). См., патент США №3087860, Endicott et al., патент США №2987445, Levesque et al., Salomon et. al., Pharm. Acta. Helv., 55, 174-182 (1980); Korsmeyer, Diffusion Controlled Systems; Hydrogels, Chap. 2, pp.15-37 in Polymers for Controlled Drug Delivery, Ed. Tarcha, CRC Press, Boca Raton, Fla.USA (1991); Buri et al., Pharm. Acta. Helv. 55, 189-197 (1980).
Таким образом, получение композиции с регулируемым высвобождением, которая способна обеспечивать доставку различных лекарственных средств, как гидрофильных, так и гидрофобных, подходящим и надежным способом, является крайне необходимым. Кроме того, указанная композиция должна удовлетворять всем требованиям, предъявляемым к способам изготовления таблеток, включая, но не ограничиваясь ими, прямое прессование, достижение соответствующей твердости и стойкости к разрушению, а также совместимость с активным(и) ингредиентом(ами), содержащемся(имися) в таблетке. Кроме того, композиция должна быть легко синтезируемой, биологически разлагаемой и нетоксичной при высвобождении лекарственного средства.
Одним из наиболее широко изученных соединений, используемых для регулируемого высвобождения, является крахмал, отчасти из-за его биологической разлагаемости и природной способности к метаболизму в организме человека [Kost et al., Biomaterials 11, 695-698 (1990)]. Крахмал имеет широкое применение в фармацевтических продуктах. Он может действовать как разбавитель, наполнитель, носитель, связующий агент, дезинтегрирующий агент, вещество для покрытия, загуститель и вещество, впитывающее влагу. См. патент США №2938901, Kerr et al., в котором описано использование гранулированного крахмала, сшитого с триметафосфатом натрия, в качестве хирургической присылки; патент США №3034911, МсКее et al., в котором описано использование крахмала, набухающего в холодной воде, и нерастворимого в холодной воде крахмала в интактной гранулированной форме в качестве дезинтегрирующего агента; патент США №3453368, Magid, в котором описано использование предварительно желатинированных и необязательно модифицированных крахмалов в качестве связующих агентов для спрессованных таблеток аскорбиновой кислоты; патент США №3490742, Nichols et al., в котором описана негранулированная амилоза (по крайней мере, 50%), полученная путем фракционирования кукурузного крахмала и используемая в качестве связующего агента - дезинтегрирующего агента при прямом прессовании и сухом гранулировании таблеток; патент США №3622677, Short et al., в котором описано использование крахмала, частично растворимого в холодной воде и набухающего в холодной воде, полученного из спрессованного гранулированного крахмала, в качестве связующего агента - дезинтегрирующего агента; патент США №4072535, Short et al., в котором описан предварительно спрессованный крахмал, имеющий двоякопреломляющие гранулы, недвоякопреломляющие гранулы и некоторые агрегаты и фрагменты для использования в качестве связующего агента - деэинтегрирующего агента; патент США №4026986, Christen et al., в котором описано использование эфиров водорастворимого крахмала (например, гидроксиалкиловых эфиров), содержащих, по крайней мере, 50% амилозы для использования при формировании оболочек капсул; патент США №4308251, Dunn et al., в котором описано использование кукурузного, рисового, картофельного и модифицированных крахмалов в качестве стимулирующего разложение агента в композициях регулируемого высвобождения, полученных путем мокрой грануляции; патент США №4551177, Trabiano et al., в котором описано использование крахмалов, модифицированных под действием кислоты и/или альфа-амилазы, в качестве связующих веществ для таблеток; патент США №4904476, Mehta et al., в котором описано использование натрий-гликолят крахмала в качестве дезинтегрирующего агента; патент США №4818542, DeLuca et al., в котором описан крахмал как биологически разлагаемый и биологически разрушаемый полимер для изготовления пористых микросфер, которые могут быть покрыты сшивающим агентом в целях ингибирования или регуляции высвобождения лекарственного средства; патент США №4888178, Rotini et al., в котором описано использование крахмала, предпочтительно кукурузного крахмала, и натрий-гляколят крахмала в качестве дезинтегрирующих агентов при быстром высвобождении композиции напроксена® с запрограммированным высвобождением, содержащей грануляты быстрого и регулируемого высвобождения в форме таблеток, капсул или суспензии в подходящей жидкой среде; патент США №5004614, Staniforth et al., в котором описано использование крахмалов в качестве фармацевтических наполнителей в системах регулируемого высвобождения, содержащих активный агент и агент высвобождения, и использование сшитого или несшитого натрийкарбоксиметилкрахмала для покрытий.
В патенте США №4369308, Trubiano et al., описаны модифицированные крахмалы, которые имеют низкую набухаемость в холодной воде и которые могут быть использованы в качестве дезинтегрирующих агентов в спрессованных таблетках. Это достигается посредством сшивания и предварительной желатинизации нерастворимого в холодной воде гранулированного крахмала в присутствии воды, сушки сшитого предварительно желатинированного крахмала, если необходимо, и затем распыления сухого крахмала. Не было указано или заявлено, что эти крахмалы обладают способностью регулировать высвобождение.
Сшитый крахмал был ранее оценен как агент, обеспечивающий замедленное высвобождение. В работе Visavarungroj et al. [Drug Development And Industrial Pharmacy, 16(7), 1091-1108 (1990)] была описана оценка использования различных типов сшитых крахмалов и предварительно желатинированных сшитых крахмалов в качестве гидрофильных матриц. Было определено, что сшитые крахмалы обладают низкой способностью набухания и дисперсионной вязкостью по сравнению с предварительно желатинированным крахмалом и предварительно желатинированным сшитым крахмалом. Эти исследования выявили, что по сравнению с полностью предварительно желатинированным крахмалом восковидной кукурузы сшитые модифицированные крахмалы восковидной кукурузы, либо предварительно желатинированные, либо нет, являются непригодными для использования в композиции замедленного высвобождения в качестве гидрофильной матрицы.
В работе Nakano et al. [Chem.Pharm.Bull. 35(10), 4346-4350 (1987) описано использование физически модифицированного крахмала (предварительно желатинированнного крахмала) в таблетках замедленного высвобождения в качестве эксципиента. В этой статье ничего не упоминается о специфической роли амилозы, присутствующей в крахмале, и даже не упоминается сама амилоза.
В работе Van Aerde et al. [Int. J. Pharm. 45, 145-152, (1988)] описано использование модифицированных крахмалов, полученных путем сушки на барабане или предварительной желатинизации с экструзией, гидролиза частиц или сшивания с триметафосфатом натрия, в качестве эксципиента в таблетках замедленного высвобождения. И в этой статье ничего не упоминается о специфической роли амилозы, присутствующей в крахмале, и даже не упоминается сама амилоза.
В работе Herman et al. [Int. J. Pharm., 56, 51-63 & 65-70 (1989) & Int. J. Pharm. 63, 201-205 (1990)] описано использование термомодифицированных крахмалов в качестве гидрофильных матриц в пероральных препаратах с регулируемой доставкой. В этой статье указано, что термомодифицированиые крахмалы с низким содержанием амилозы (25% и ниже) обладают хорошими свойствами замедленного высвобождения по сравнению с крахмалами с высоким содержанием амилозы, которые обладают плохими свойствами регулированного высвобождения.
В патенте США №3490742, Nichols et al. описан связующий агент - дезинтегрирующий агент, содержащий негранулированную амилозу. Этот материал получают либо путем фракционирования крахмала, либо путем растворения гранулированного высокоамилозного крахмала в воде при повышенной температуре. В этой работе не упоминается о какой-либо способности к регулируемому высвобождению.
В патенте США №5108758, Alwood et al. описана пероральная композиция отсроченного высвобождения, содержащая активное соединение и стекловидную амилозу. Эта композиция была конкретно адаптирована для достижения селективного высвобождения активного соединения в толстой кишке. Такое отсроченное высвобождение обеспечивается покрытием. Стекловидная амилоза представляет собой одну из двух форм преимущественно аморфной амилозы, при этом другой ее формой является каучукоподобная форма. В данном случае стекловидная амилоза отсрочивает (замедляет) высвобождение активного соединения из композиции в водной среде, но делает возможным его высвобождение при воздействии фермента, способного расщеплять амилозу. Амилозу, используемую в данной композиции, выделяют из крахмала гладкосемянного гороха и очищают путем осаждения из водного раствора в виде комплекса с н-бутанолом. Затем спирт удаляют из водной дисперсии указанного комплекса путем продувки через подходящий нагретый инертный газ. Как указывается выше, механизм высвобождения основан на ферментативной реакции. При этом не происходит непрерывного высвобождения через желудочно-кишечный тракт, а происходит лишь отсроченное высвобождение, обусловленное разложением покрытия в толстой кишке. Кроме того, было показано, что стекловидная амилоза, предпочтительно, не должна содержать гидрокси-групп в форме производного.
В Европейской патентной заявке № ЕР-А-499648, Wai-Chiu et al., описан эксципиент для таблетки. Более конкретно, в этой заявке описан крахмал, используемый в качестве связующего и/или наполнителя для изготовления таблеток, драже, капсул или гранул. Эксципиент для таблеток получают путем ферментативного деветвления крахмала под действием α-1,6-D-глюканогидролазы с получением, по крайней мере, 20 мас.% "амилозы с короткой цепью". Причем в этой работе не указано, что описанный эксципиент обладает регулирующими высвобождение свойствами. Кроме того, крахмал (немодифицированный, модифицированный или сшитый) должен быть ферментативно обработан α-1,6-D-глюканогидролазой с образованием неразветвленного крахмала и получением так называемой "амилозы с короткой цепью". Таким образом, очевидно, что крахмал с высоким содержанием амилопектина является предпочтительным, и амилоза должна быть отброшена как непригодная из-за невозможности ее деветвления, поскольку амилоза не имеет разветвления. Роль амилозы не только игнорируется, но и рассматривается как негативная.
В работах Mateescu et al. [патент США №5456921] и Lenaerts et al. [J.Controlled Rel. 15, 39-46 (1991)] указано, что сшитая амилоза является в высокой степени эффективной для регулированного высвобождения лекарственного средства. Сшитую амилозу получают посредством взаимодействия амилозы со сшивающим агентом, таким как эпихлоргидрин, в щелочной среде. Различные степени сшивания могут быть достигнуты путем изменения отношения эпихлоргидрина к амилозе в реакционном сосуде. Таблетки получали путем прямого прессования сухой смеси сшитой амилозы и лекарственного средства, набухшего в растворе, и таким образом обеспечивалось замедленное высвобождение лекарственного средства. В зависимости от степени сшивания матрицы достигались различные степени набухания. Увеличение степени сшивания амилозы сначала приводит к увеличению периода высвобождения лекарственного средства с последующим уменьшением этого периода. Максимальный период высвобождения лекарственного средства наблюдался при степени сшивания 7,5. Последующее увеличение степени сшивания приводило к ускоренному высвобождению лекарственного средства из таблеток, содержащих сшитую амилозу, что обусловлено процессом разложения. В случае когда степень сшивания была равна или превышала 7,5, то увеличение степени сшивания амилозы приводило к снижению времени высвобождения лекарственного средства. Если степень сшивания превышала 11, то набухшая полимерная матрица при in vitro дезинтеграции присутствовала в течение примерно 90 минут.
В работах Mateescu et al. [Международная выложенная патентная заявка № WO 94/02121] и Dumoulin et al. [Intern. Symp. Control. Rel. Bioact. Mater. 20, 306-307, (1993)] описана система ферментативно регулируемого высвобождения лекарственного средства, полученная путем добавления α-амилазы в таблетку, содержащую сшитую амилозу. α-Амилаза способна гидролизовать α-1,4-глюкозидные связи, присутствующие в полусинтетической матрице сшитой амилозы. Увеличение количества α-амилазы (5-25 ед.) в таблетках индуцирует значительное снижение времени высвобождения с 24 до 6 часов. Следовательно, высвобождение лекарственного средства контролируется двумя последовательными механизмами: (а) гидратацией и набуханием таблеток с сшитой амилозой, а затем, (b) внутренним ферментативным гидролизом гидратированной гелевой фазы.
В работе Cartilier et al [Международная выложенная патентная заявка WO 94/21236] описаны порошки сшитой амилозы, имеющей конкретную степень сшивания, для использования в таблетках в качестве связующего агента и/или дезинтегрирующего агента. Указанные таблетки получают путем прямого прессования. Концентрация сшитой амилозы в таблетках составляет ниже, чем 35 мас.%. Если необходимо получить дезинтегрирующие свойства, то степени сшивания предпочтительно составляют 6-30, и более предпочтительно, 15-30.
В патенте США №5830884, Kasica et al., описаны термодезактивированные крахмалы, которые используются в фармацевтических продуктах в качестве разбавителей, наполнителей, носителей, связующих агентов, дезинтегрирующих агентов, загустителей и покрытий. Они могут быть получены дегидратацией крахмала до по существу безводного или безводного состояния и тепловой обработкой безводного или по существу безводного крахмала в течение периода времени и при температуре, достаточных для дезактивации крахмала. Крахмалы, которые являются, по существу, термодезактивированными, устойчивы к желатинизации и лишь имитируют химически сшитый крахмал.
Патент США №5879707, Cartilier et al., относится к использованию замещенной амилозы в качестве матрицы для замедленного высвобождения лекарственного средства. Указанную матрицу для замедленного высвобождения изготавливают из замещенной амилозы, полученной посредством взаимодействия амилозы в щелочной среде с органическим заместителем, имеющим реакционноспособные функциональные группы, которые вступают в реакцию с гидроксигруппами молекулы амилозы. Заместителем предпочтительно является эпокси или галогеналкан или спирт. Однако в указанном патенте используется только линейно замещенная амилоза и она отличается от сшитой амилозы, используемой в настоящем изобретении.
В работе Dumoulin [Международная выложенная патентная заявка № WO 98/35992] описан способ изготовления эксципиента замедленного высвобождения, который состоит, главным образом, из сшитой амилозы, обладающей свойствами регулированного высвобождения, и который используется в изготовлении таблеток или драже. Крахмал, содержащий большое количество амилозы (высокоамилозный крахмал), сначала подвергают желатинизации. Желатинированный высокоамилозный крахмал представляет собой крахмал, сшитый с 1-5 граммами сшивающего агента на 100 г сухого желатинированного высокоамилозного крахмала в щелочной среде, создающей реакционную среду, которая содержит реакционный продукт, состоящий из суспензии сшитого высокоамилозного крахмала. Затем полученную реакционную среду нейтрализуют, в результате чего образуются побочные продукты, состоящие из солей, которые удаляют из реакционной среды. Затем выделенную суспензию сшитого высокоамилозного крахмала подвергают тепловой обработке при температуре, по крайней мере, 60°С, и этот термообработанный продукт сушат с получением эксципиента замедленного высвобождения, содержащего значительное количество примесей.
В работе Lenaerts et al. [J. Controlled Release 53, 225-234 (1998)] было продемонстрировано, что желатинированные сшитые высокоамилозные крахмалы являются пригодными эксципиентами для приготовления твердых лекарственных форм с регулируемым высвобождением для пероральной доставки лекарственных средств. Эти эксципиенты не оказывают разлагающего действия и имеют ограниченную степень набухания, и увеличение степени сшивания приводит к увеличению поглощения воды, скорости высвобождения лекарственного средства и к равновесному набуханию. Эти исследователи также смогли продемонстрировать, что среди протестированных систем матрицы из сшитого высокоамилозного крахмала имеют наиболее низкую внутригрупповую вариабельность у индивидуумов и обнаруживают полное отсутствие пищевого эффекта. Lenaerts et al. также пришли к выводу, что по мере возрастания степени сшивания лекарственное средство будет высвобождаться быстрее. Эти авторы пришли к заключению, что для желатинированного сшитого высокоамилозного крахмала для достижения характеристик, требуемых для регулируемого высвобождения вводимых лекарственных средств, необходимо, чтобы поверхность амилопектиновых кластеров была покрыта амилозой, химически связанной с амилопектином посредством осуществления процедуры сшивания. Действительно, такой структурой является структура, полученная сначала путем желатинирования высокоамилозного крахмала с экстракцией амилозы из гранул с последующим проведением химической реакции для химического связывания амилозы с поверхностью амилопектиновых кластеров так, как это было осуществлено способом Dumoulin et al., в WO 98/35992.
Во всех вышеупомянутых работах, которые относятся к сшитому высокоамилозному крахмалу, указано, что исходный амилозный материал должен быть желатинирован перед сшиванием. Целостность гранул крахмала в сухом состоянии зависит от водородных связей между амилопектином и амилозой. При нагревании водной суспензии крахмала до определенной температуры водородная связь между амилопектином и амилозой ослабевает и гранулы набухают до их деструкции. Этот процесс называется "желатинизацией". Первая стадия этого процесса позволяет выщелачивать амилозу из гранул крахмала до проведения реакции со сшивающим реагентом, в результате чего образуется сшитая амилоза со свойствами регулируемого высвобождения. Кроме того, было установлено, что для получения продукта, обладающего желательной способностью регулировать высвобождение, желатинизацию высокоамилозного крахмала необходимо проводить перед сшиванием. См., Dumoulin et al., в WO 98/35992.
3. Краткое описание изобретения
Было неожиданно обнаружено, что высокоамилозный крахмал может быть подвергнут химической обработке (то есть сшиванию и гидроксипропилированию) в гранулированном состоянии с использованием химического реагента в очень низкой концентрации с последующей желатинизацией и сушкой с получением эксципиента для регулируемого высвобождения, который по своей способности к высвобождению лекарственного средства превосходит эксципиенты из высокоамилозного крахмала, полученные способом, где на первой стадии указанный высокоамилозный крахмал подвергают желатинизации, а затем подвергают химической обработке и сушке.
Описанные здесь новые способы, композиции и способность (активность) к регулируемому высвобождению лекарственного средства являются контринтуитивными для специалистов в данной области. Ни один специалист не мог бы предположить, что путем химической обработки (то есть сшивания) высокоамилозного крахмала, проводимой перед желатинизацией, можно получить продукт, проявляющий характеристики регулируемого высвобождения. Сшивание высокоамилозного крахмала перед желатинизацией, по всей вероятности, должно приводить к получению материала, который не будет обладать способностью регулировать высвобождение лекарственного средства, а будет иметь профиль высвобождения, подобный профилю быстрого высвобождения, поскольку сшитый высокоамилозный крахмал будет неспособен поддерживать способность матрицы к регулируемому высвобождению, что свидетельствует о главных структурных различиях между этими двумя сшитыми продуктами. В соответствии с работой Lenaerts et al. [J. Controlled Rel., 1998), такие структурные различия должны приводить к неспособности данного материала иметь свойства, обеспечивающие регулируемое высвобождение. В работе Jane et al. [Cereal Chemistry, 69(4), 405-409 (1992)] указывается, что сшивание предварительно желатинированного и диспергированного крахмала приводит к меньшему различию в соотношениях растворимой амилозы и амилопектина, чем сшивание природного гранулированного крахмала. В работе Jane et al. ничего не упоминается об увеличении размера амилозы в результате сшивания двух или более молекул амилозы после сшивания указанного крахмала в гранулированной форме, а также ничего не упоминается о какой-либо способности сшитых крахмалов в гранулированной форме регулировать высвобождение лекарственного средства. Кроме того, в работе Mateescu et al. (патент США №5456921) указывается, что оптимальное регулируемое высвобождение достигается в том случае, когда количество сшивающего агента составляет 7,5 г на 100 г сухого крахмала, тогда как в соответствии с настоящим изобретением сшивающий агент может быть добавлен в количестве менее чем 0,3 г на 100 г сухого крахмала. Такое низкое количество сшивающего агента является предпочтительным, поскольку соответствует количеству модифицированного пищевого крахмала, определенному в монографиях Управления по контролю за качеством пищевых продуктов и медикаментов (FDA) и в Своде правил для изготовления пищевых добавок, употребляемых в пищу (США), а также в Директивах Европейского парламента и Совета Nr/95/2/EC 20 февраля 1995 по пищевым добавкам, не относящимся к красителям и подсластителям (Директивы по прочим добавкам).
Было обнаружено, что новый эксципиент для регулируемого высвобождения может быть получен в следующих стадиях:
(1) гранулярного сшивания и дополнительной химической модификации (например, гидроксипропилирования) высокоамилозного крахмала;
(2) тепловой желатинизации крахмала, полученного на стадии (1); и
(3) сушки крахмала, полученного на стадии (2), с получением порошка, который может быть использован в качестве эксципиента для регулируемого высвобождения.
Преимуществами этого эксципиента являются, но не ограничиваются ими: (1) простота обработки, (2) возможность отказаться от использования каких-либо органических растворителей в процессе, (3) возможность получить продукты высокой чистоты, удовлетворяющие требованиям FDA и Своду правил для изготовления пищевых добавок, употребляемых в пищу (США), а также Директивам Европейского парламента и Совета Nr/95/2/EC 20 февраля 1995 по пищевым добавкам, не относящимся к красителям и подсластителям (Директивы по прочим добавкам), (4) возможность осуществлять прямое прессование таблеток, (5) совместимость с гидрофильными и гидрофобными лекарственными средствами, (6) совместимость с широким интервалом концентраций лекарственного средства и их растворимостями, (7) безопасность сшитого высокоамилозного крахмала, (8) превосходная устойчивость по отношению к параметрам производства и растворения, (9) превосходная воспроизводимость от партии к партии и (10) возможность легкого и предсказуемого увеличения масштаба производства.
Более конкретно, было обнаружено, что регулируемое высвобождение лекарственного средства может быть достигнуто с использованием высокоамилозного крахмала, который подвергают последовательной трансформации, описанной выше, с получением порошкообразного эксципиента. Использование этого модифицированного крахмала в таблетке в качестве матрицы дает хороший почти линейный профиль высвобождения, а время высвобождения составляет от 2 часов до 24 часов.
Было также обнаружено, что этот модифицированный крахмал может быть использован для изготовления имплантатов для местной замедленной доставки лекарственных средств, где время in vivo высвобождения увеличивается от периода 1-3 дня до периода в 3-4 недели.
В соответствии с настоящим изобретением предлагается фармацевтическая композиция, представляющая таблетку с регулируемым высвобождением, которая дополнительно содержит смесь для прямого прессования, состоящую из порошкообразного сшитого и дополнительно модифицированного высокоамилозного крахмала в качестве эксципиента для регулируемого высвобождения лекарственного средства, и из порошка, по крайней мере, одного лекарственного средства. Матрица для регулируемого высвобождения состоит, по существу, из сшитого высокоамилозного крахмала, полученного путем сшивания высокоамилозного крахмала с подходящим сшивающим агентом. Кроме того, указанный сшитый высокоамилозный крахмал является химически модифицированным. Последовательность двух реакций (то есть реакции сшивания и дополнительной химической модификации) может быть проведена альтернативно, в обратном порядке или одновременно.
Сшитый высокоамилозный крахмал может быть получен с использованием предпочтительных количеств сшивающего агента, составляющих примерно 0,005-0,3 г на 100 г сухого крахмала.
Если используемое в настоящем изобретении фармацевтическое лекарственное средство(а) очень плохо растворяется в воде, то порошок такого лекарственного средства (b) может присутствовать в количестве вплоть от примерно 70% до примерно 90% по массе таблетки. Если фармацевтическое лекарственное средство(а) хорошо растворяется в воде, то его количество не должно превышать от примерно 30% до примерно 50% по массе таблетки.
В соответствии с настоящим изобретением таблетка может также иметь сухое покрытие. В этом случае сердцевина таблетки содержит большую часть порошка лекарственного средства(ств). Внешняя оболочка будет состоять, главным образом, из эксципиента для регулируемого высвобождения за исключением того случая, когда необходимо создать определенные профили доставки (например, двухфазный или двойной импульс).
Таким образом, в своем широком аспекте настоящее изобретение предлагает способ получения нового регулирующего высвобождение эксципиента, состоящего, главным образом, из сшитого высокоамилозного крахмала, используемого для изготовления таблеток. Указанный способ включает:
(а) сшивание высокоамилозного крахмала (предпочтительно, такой высокоамилозный крахмал содержит, по крайней мере, 70 мас.% амилозы), предпочтительно с использованием от примерно 0,005 г до примерно 0,3 г, более предпочтительно от примерно 0,01 г до примерно 0,12 г, даже более предпочтительно от примерно 0,04 г до примерно 0,1 г, наиболее предпочтительно примерно 0,075 г сшивающего агента на 100 г сухого высокоамилозного крахмала в щелочной водной среде при подходящей температуре (предпочтительно от примерно 10°С до примерно 90°С, более предпочтительно от примерно 20°С до примерно 80°С, даже более предпочтительно от примерно 20°С до примерно 60°С и наиболее предпочтительно примерно 30°С), в течение подходящего периода времени проведения реакции (предпочтительно от примерно 1 минуты до примерно 24 часов, более предпочтительно от примерно 15 минут до примерно 4 часов, даже более предпочтительно от примерно 30 минут до примерно 2 часов, наиболее предпочтительно примерно 60 минут) с образованием при этом реакционной среды, содержащей реакционный продукт, состоящий из суспензии сшитого высокоамилозного крахмала (предпочтительно в концентрации от примерно 5% до примерно 45%, более предпочтительно от примерно 20% до примерно 42%, даже более предпочтительно от примерно 30% до примерно 40%, наиболее предпочтительно примерно 35%);
(b) химическую модификацию суспензии сшитого высокоамилозного крахмала, полученной на стадии (а) (например, реакцию гидроксипропилирования с пропиленоксидом, предпочтительно примерно 0,5%-20%, более предпочтительно от примерно 1% до примерно 10%, даже более предпочтительно примерно 3%-9%, и наиболее предпочтительно примерно пропиленоксида 6%), при температуре от примерно 10°С до примерно 90°С, предпочтительно от примерно 20°С до примерно 80°С, более предпочтительно от примерно 20°С до примерно 50°С и наиболее предпочтительно примерно 40°С, в течение периода времени от примерно 1 часа до примерно 72 часов, предпочтительно от примерно 2 часов до примерно 48 часов, более предпочтительно от примерно 10 часов до примерно 40 часов и наиболее предпочтительно примерно 29 часов: Альтернативно, стадии (а) и (b) осуществляются в обратном порядке или одновременно;
(c) нейтрализацию реакционной среды, полученной на стадии (b) кислотой (предпочтительно разбавленной водной неорганической кислотой), промывку образованной суспензии и необязательно удаление воды или сушку;
(d) получение суспензии при концентрации от примерно 2% до примерно 40 мас.%, предпочтительно от примерно 5% до примерно 35 мас.%, более предпочтительно от примерно 5% до примерно 25 мас.%, и наиболее предпочтительно, примерно 9 мас.%, доведение рН до нужного значения в пределах от 3 до 12 (предпочтительно примерно 6,0) и желатинизацию суспензии при температуре от примерно 80°С до примерно 180°С, предпочтительно от примерно 120°С до примерно 170°С, более предпочтительно от примерно 140°С до примерно 165°С и наиболее предпочтительно примерно 160°С, в течение периода времени от примерно 1 секунды до примерно 120 минут, предпочтительно от примерно 30 секунд до примерно 60 минут, более предпочтительно от примерно 1 минуты до примерно 20 минут и наиболее предпочтительно примерно 8 минут; и
(e) сушку термообработанного продукта со стадии (d) с получением регулирующего высвобождения эксципиента, состоящего, главным образом, из химически модифицированного и сшитого высокоамилозного крахмала в форме порошка.
Описание чертежей
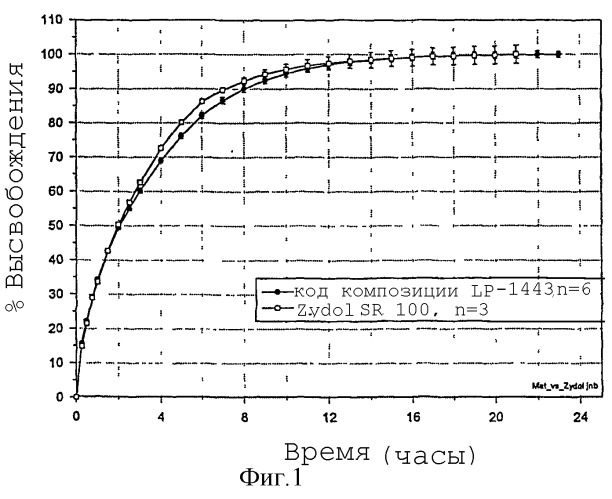
Фигура 1: Профили высвобождения в стандартных условиях растворения для композиций LP-1443 и Zydol SR 100®.
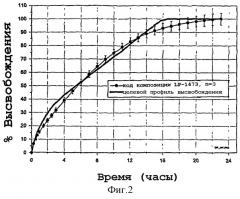
Фигура 2: Целевые и фактические профили in vitro растворения для композиции LP-1473. In vifcro-профиль был получен в стандартных условиях растворения.
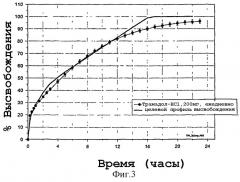
Фигура 3: Целевой и in vitro-профиль растворения для Tramadol® HCl, 200 мг.
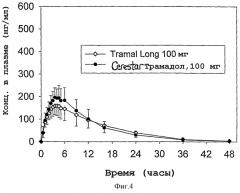
Фигура 4: Фармакокинетика таблеток LP-1443 по сравнению с Tramal Long 100® у человека.
Фигура 5: Фармакокинетика таблеток LP-1473 (с пленочным покрытием) у человека.
Фигура 6: Влияние рН растворяющей среды на профиль растворения композиции LP-1443.
Фигура 7: Влияние α-амилазы Bacillus в растворяющей среде на профиль растворения композиции LP-1443.
Фигура 8: Влияние ионной силы растворяющей среды на профиль растворения композиции LP-1443.
Фигура 9: Влияние скорости смешивания на профиль растворения композиции LP-1443.
Фигура 10: Влияние рН растворяющей среды на профиль растворения композиции LP-1473 (без пленочного покрытия).
Фигура 11: Влияние α-амилазы Bacillus в растворяющей среде на профиль растворения композиции LP-1473 (без пленочного покрытия).
Фигура 12: Влияние ионной силы растворяющей среды на профиль растворения композиции LP-1473 (без пленочного покрытия).
Фигура 13: Влияние скорости смешивания на профиль растворения композиции LP-1473 (без пленочного покрытия).
Фигура 14: Квазиобратимые вязкоупругие свойства таблетки Cerestar.
Фигура 15: Кривые "напряжение-релаксация", полученные исходя из постадийного наложения 1%-ного напряжения.
Фигура 16: СЭМ: Поверхность таблетки Cerestar, высушенной вымораживанием и набухшей в воде.
Фигура 17: СЭМ: Высушенная вымораживанием супернатантная суспензия, присутствующая вокруг набухшей в воде таблетки Cerestar.
Фигура 18: СЭМ: таблетки Rougier при равновесном набухании в воде при 37°С.
Фигура 19: Результат ГПХ,% углеводов в Amylogel 3003, Contramid-Rougier 333, серии Cerestar 3808, 1903, 3825 в зависимости от фракции.
Фигура 20: Результат ГПХ,% углеводов в Amylogel 3003, Contramid-Rougier 333, серии Cerestar 3808, 1903, 3825 в зависимости от log [г/М].
Фигура 21: Jn vitro кумулятивное высвобождение ципрофлоксацина-HCl при трех различных нагрузках имплантата.
Фигура 22: Концентрации ципрофлоксацина в сыворотке.
Фигура 23: Концентрации ципрофлоксацина в мышце.
5. Подробное описание изобретения
Крахмал является одним из наиболее распространенных биополимеров на земле. Крахмал представляет собой, главным образом, углевод, состоящий из двух отдельных фракций: одной из которых является амилоза, представляющая собой, по существу, линейный полимер из глюкопиранозных звеньев, связанных посредством α-D(1,4)-связей. Вторым компонентом является амилопектин, который представляет собой в высокой степени разветвленный полимер, связанный с гидроксилом в С-6-положении некоторых глюкозных остатков в амилозе посредством α-D(1,6)связей. Амилоза содержит примерно 4000 глюкозных звеньев. Амилопектин содержит примерно 100000 глюкозных звеньев.
Сшивание крахмала представляет собой высокоэффективный метод модификации крахмала. Обычно сшитые крахмальные гранулы придают пасте устойчивость к сдвигу или нагреванию. Такие химически сшитые крахмалы обеспечивают желательную равномерную структуру и обладают стабильной вязкостью в процессе обработки и нормальным сроком годности при хранении. Как указывалось выше, в соответствии с настоящим изобретением было обнаружено, что особенно желательным является сшивание высокоамилозного крахмала с последующей желатинизацией. Более конкретно, было обнаружено, что сшивание высокоамилозного крахмала вместе с его дополнительной химической модификацией (например, гидроксипропилированием), проводимой перед желатинизацией, позволяет получить новый эксципиент, обладающий нужными свойствами, обеспечивающими регулируемое высвобождение.
Сшивание высокоамилозного крахмала может быть осуществлено в соответствии с процедурами, известными специалистам в данной области. Так, например, сшивание амилозы может быть осуществлено способом, описанным в работе Mateescu [BIOCHEMIE, 60, 535-537 (1978)], посредством взаимодействия амилозы с эпихлоргидрином в щелочной среде. Аналогичным образом, крахмал может быть также сшит реагентом, выбранным из группы, состоящей из эпихлоргидрина, ангидрида адипиновой кислоты, триметафосфата натрия и оксихлорида фосфора или другими сшивающими агентами, включая, но не ограничиваясь ими, 2,3-дибромпропанол, линейные смешанные ангидриды уксусной и ди- или трехосновных карбоновых кислот, винилсульфон, диэпоксиды, хлорангидрид циануровой кислоты, гексагидро-1,3,5-трисакрилоил-s-триазин, гексаметилендиизоцианат, толуол-2,4-диизоцианат, N,N-метиленбисакриламид, N,N'-бис(гидроксиметил)этиленмочевину, смешанные ангидриды угольной-карбоновой кислот, имидазолиды угольной кислоты и многоосновной карбоновой кислоты, имидазолиевые соли многоосновных карбоновых кислот и гуанидиновые производные поликарбоновых кислот.
Используемые реакционные условия могут варьироваться в зависимости от типа и количества используемого сшивающего аген