Способ получения гидроксида натрия
Иллюстрации
Показать всеИзобретение относится к химической промышленности и может быть использовано в производстве мыл, красок, целлюлозы и других отраслях промышленности. Способ включает получение плава CaO·Na2O путем обжига отходов производства кальцинированной соды, содержащих CaO, СаСО3 и Na2CO3, при температуре 1000-1100°С, последующее выщелачивание и упаривание образовавшегося гидроксида натрия. Получаемый на стадии выщелачивания гидроксид кальция подвергают карбонизации углекислым газом, выделяемым на стадии получения плава. Предложенный способ позволяет увеличить концентрацию гидроксида натрия в целевом продукте и утилизировать отходы производства кальцинированной соды. 3 з.п. ф-лы, 1 ил., 1 табл.
Реферат
Изобретение относится к химической промышленности, в частности к технологии получения гидроксида натрия, который находит широкое применение в производстве мыл, красок, целлюлозы и других отраслях промышленности.
Еще из школьных учебников известны способы получения едкого натра, например, согласно следующим реакциям:
Na+HOH=NaOH+½H2
[Г.Реми. Курс неорганической химии. Т.I, Издательство иностранной литературы, М., 1963].
Получают едкий натр либо электролизом водных растворов хлористого натрия, либо химическими методами.
При электролизе водных растворов хлористого натрия происходит образование щелочи: выделение на аноде хлора, а на катоде - водорода приводит к увеличению в прикатодном пространстве концентрации ОН-ионов. В промышленности для получения едкого натра и хлора применяют два типа ванн: с твердыми электродами и проточным электролитом, движущимся от анода к катоду ( ртутный катод) [Краткая химическая энциклопедия. Изд. «Советская энциклопедия», т.3, М., 1964, с.376-377].
Согласно способу получения едкого натра, описанному в книге «Технология содопродуктов» [С.В.Беленький, С.М.Круглый, С.К.Секованный - Изд. «Химия», М., 1972, с.205-258] в результате электролиза в диафрагменных ваннах с твердым катодом получают электролитическую щелочь, хлор и водород. Технологическая схема осуществления процесса в цехе электролиза приводится в этом же литературном источнике на стр.250-253. Получаемая в цехе электролизера электролитическая щелочь, содержащая 110-135 г/л гидроксида натрия и 170-190 г/л неразложившегося хлорида натрия, перекачивается в цех выпарки, где концентрируется до 42-50% товарного гидроксида натрия.
Получение гидроксида натрия по способу электролиза с твердым катодом, в качестве которого используют ртуть, осуществляют на многих промышленных предприятиях, в частности в г.Стерлитамаке на объединении «Каустик».
Основным недостатком вышеуказанного способа является использование ртутного катода, а также выделение большого количество хлора, как побочного продукта, что экологически небезопасно.
Известен способ получения гидроксида натрия электролизом водного раствора хлорида натрия при повышенной температуре в электролизере с фильтрующей диафрагмой, разделяющей анолит и католит при непрерывной подпитке анолита очищенным концентрированным нагретым раствором хлорида натрия до температуры 35-80°С [SU №1269540, МПК С 25 В 1/46, 1985], сначала при рН раствора хлорида натрия, равном 2-3, в течение 24-48 часов, а затем при рН, равном 3,5-5,0 [SU №1672751, МПК С 25 В 1/16, 1989].
К недостаткам известных способов следует отнести также сравнительно низкую концентрацию получаемого гидроксида натрия.
Для повышения концентрации гидроксида натрия предложен способ получения гидроксида натрия, который включает электролиз поваренной соли, упаривание электролитической щелочи на первой стадии до концентрации гидроксида натрия в растворе 22-30%, отделение кристаллов поваренной соли с последующим упариванием щелочи, смешение упаренного раствора гидроксида натрия, содержащего кристаллы поваренной соли и сульфата натрия с охлажденным раствором, подачи части охлажденного раствора на смешение с упаренным раствором гидроксида натрия, отделение полученного целевого продукта [SU №1736093, МПК С 01 D 1/42, 1989].
К недостаткам известных способов следует отнести также низкую концентрацию и чистоту получаемого гидроксида натрия за счет содержания в нем сульфата натрия.
Известен усовершенствованный способ получения водного гидроксида натрия, включающий электролиз подачей водного раствора карбоната натрия в анодную камеру, а в катодную камеру подают воду, где в качестве анодов используют платину, платинированный титан, титан, покрытый окисью платины [RU №2002112284, МПК С 01 D 1/46, 2002].
Данный способ также характеризуется получением гидроксида натрия никой концентрации и к тому же является дорогостоящим из-за применения дорогих платиновых материалов, что позволяет использовать этот способ в препаративном применении.
Из химических методов известен ферритный способ производства едкого натра, заключающийся в каустификации карбоната натрия путем ее взаимодействия с окисью железа при температуре 1000-1100°С с последующим гашением, выщелачиванием образовавшегося феррита натрия водой
[С.В.Беленький, С.М.Круглый, С.К.Секованный. Технология содопродуктов. Изд. «Химия», М., 1972, с.285-287] или раствором едкого натра, содержащим 200-360 г/л NaOH [SU №372174, МПК С 01 D 1/20, 1971].
К недостаткам ферритного способа получения гидроксида натрия следует отнести неэкономичность процесса из-за длительности разложения феррита натрия до равновесного состояния, для чего требуется аппаратура большой емкости и ведение процесса при кипении, что представляет определенную трудность.
Из химических методов наиболее распространен известковый метод производства едкого натра.
В основе способа лежит реакция взаимодействия раствора соды с гашеной известью или известковым молоком (каустификация):
Равновесие реакции смещено в сторону образования NaOH вследствие плохой растворимости СаСО3. Обработанная таким образом сода становится едкой (каустической). Поэтому получаемый таким путем гидроксид натрия называют каустической содой (обычно 12-15%) [Н.С.Ахметов. Неорганическая химия. М.: Высшая школа, 1975, с.591-592].
Подача на каустификацию известкового молока извести позволяет использовать теплоту гашения СаО. Кроме того, образуется более концентрированный раствор едкого натра за счет вывода из процесса воды, поступающей с известковым молоком [И.Н.Шокин, С.А.Крашенинников. Технология соды. М.: Химия, 1975, с.205].
В этом же источнике на странице 218-220 приведено описание технологической схемы производства едкого натра известковым способом, включающей взаимодействие жженой извести с содовым раствором.
Основным недостатком этого метода является низкая концентрация получаемого гидроксида натрия и сложность технологии, связанная с концентрированием гидроксида натрия, что в целом увеличивает его себестоимость.
Известен способ получения гидроксида натрия путем взаимодействия кальцинированной соды с известью с последующим упариванием образовавшихся щелоков, отделением раствора гидроксида натрия [SU №331663, МПК С 01 D 7/05, 1970].
Также известен способ получения гидроксида натрия путем взаимодействия нормального содового раствора с известковым молоком в три стадии с последующим упариванием осветленного щелока первой и второй стадии, выпавшие при этом в осадок соли смешивают с суспензией третьей стадии каустификации и фильтратом, отделением и выщелачиванием соды и едкого натра из суспензии с переходом их в раствор [SU №422690, МПК С 01 D 1/22, 1970].
Недостатком известного способа является невысокая степень регенерации соды и едкого натра (96,0-96,5%), а также большое содержание сульфата натрия, которое направляют в отвал, а следствие этого - невысокая концентрация целевого едкого натра.
Наиболее близким техническим решением к прототипу является способ получения гидроксида натрия, включающий взаимодействие карбоната натрия с известью, карбонизацию извести, разделение образовавшихся карбоната кальция, гидроксида натрия, упаривание раствора гидроксида натрия RU №2143398, МПК С 01 D 1/22, С 01 F 11/18, 1995].
К недостаткам известного метода следует отнести основной недостаток - небольшая концентрация получаемого гидроксида натрия, а также высокая себестоимость получаемых продуктов из-за применения дорогого исходного сырья.
Задачей предлагаемого изобретения является разработка способа получения гидроксида натрия с использованием дешевого сырья, увеличение концентрации гидроксида натрия в целевом продукте, утилизация отходов производства кальцинированной соды.
Поставленная задача достигается тем, что на выщелачивание подают плав CaO·Na2O, предварительно полученный путем обжига отходов производства кальцинированной соды, содержащих СаО, СаСО3 и Na2CO3, при температуре 1000-1100°С, и упаривание образовавшегося щелока производят до коцентрации гидроксида натрия не менее 40 мас.%, а получаемый гидроксид кальция на стадии выщелачивания подвергают карбонизации углекислым газом, выделяемым на стадии получения плава.
В качестве исходных продуктов, подаваемых на обжиг, используют отходы производства кальцинированной соды, которые не находили широкого квалифицированного применения:
- карбонат кальция - мелкий «недопал» (10-40 мм) после обжига известняка в печах;
- известь - отход после печей обжига;
- некондицию карбоната натрия (например, сорт «В»)
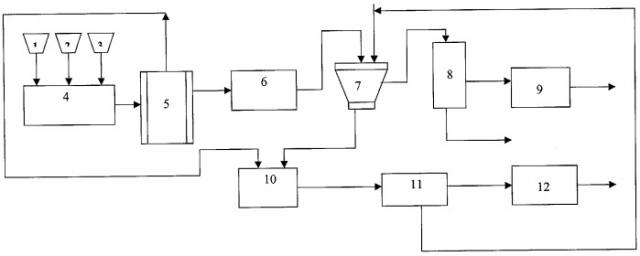
Процесс осуществляют следующим образом (чертеж).
Отходы производства кальцинированной соды - кальцийсодержащие отходы - недопал - с практически постоянным содержанием СаСО3 60-70%, с размером кусков 10-40 мм, а также некондиция Na2CO3 (например, марка В) с содержанием Na2СО3 99,2% и известь после печей обжига с содержанием СаО 60-80% - в стехиометрическом соотношении из бункеров 1-3 подают на смешение и гранулирование в гранулятор 4.
Полученные гранулы (размер гранул 5-30 мм) далее подают в печь обжига 5. Обжиг гранул проводят при температуре 1000-1100°С в течение 1,5-2,0 час в токе дымовых газов.
Полученный плав CaO·Na2O направляют на выщелачивание в шаровой мельнице 6 при температуре 80-95°С
Полученный гидроксид натрия после отделения в радиальном отстойнике 7 гидроксида кальция подают на упаривание на установку выпарки 8. Целевой гидроксид натрия получают 40%-ной концентрации. Для получения гидроксида натрия более высокой концентрации проводят дополнительное упаривание в аппарате 9.
А выделенную гидроокись кальция из отстойника 7 подают на взаимодействие с углекислым газом, образовавшимся в результате обжига плава (I), в карбонизатор 10, после чего полученный карбонат кальция подают на вакуум-фильтр 11, далее на сушку в сушилку 12, после чего - на склад готовой продукции.
Сущность способа подтверждается следующими примерами.
Пример 1.
Из бункера 1 недопал с рамером кусков 10-40 мм с содержанием СаСО3 60 мас.% в количестве 71,4 кг, из бункера 2 известь после печей обжига с содержанием СаО 60 мас.% в количестве 40 кг, из бункера 3 кальцинированную соду марки "В" с содержанием Na2СО3 99,2 мас.% в количестве 100 кг подают на гранулирование в гранулятор 4. После гранулятора смесь исходных компонентов подают в печь обжига 5, где обжиг проводят при температуре 1000°С в течение 1,5 час. Далее полученный плав подают на выщелачивание, которое осуществляют подачей воды в шаровую мельницу 6. Выщелачивание проводят при температуре 90°С. В результате выщелачивания получают гидроксид натрия 300 кг 25%-ной концентрации и гидроксид кальция в количестве 111,6 кг. Гидроксид натрия направляют на упаривание и получают целевой гидроксид натрия 40%-ной концентрации. А гидроксид кальция в количестве 111,6 кг влажностью 45% подают в карбонизатор 10, куда также подают углекислый газ после печи обжига 5. Полученную суспензию карбоната кальция подают на вакуум-фильтр 11 и далее в сушилку 12. Получают 150 кг карбоната кальция с содержанием основного вещества 92%.
Другие примеры представлены в таблице.
На основании приведенных данных видно, что предлагаемый способ получения гидроксида натрия является безотходным, позволит получить гидроксид натрия высокой концентрации. Кроме того, получают высокочистый карбонат кальция, который может найти применение в медицине, для изготовления зубных паст. А также предлагаемый способ позволит утилизировать отходы производства кальцинированной соды, которые в настоящее время недостаточно квалифицированно используются.
| Таблица | ||||||||||||
| № примера | Исходные компоненты, 1:1:1 (моль) на основное вещество | Температура обжига, °С | Стадия выщелачивания | Стадия упарки | Стадия карбонизации | |||||||
| недопал | известь - после печей обжига | кальц. сода (марка «В») | Кол-во плава, кг | Т-ра, °С | Кол-во NaOH, кг | СNaOH (полученная), % | Т-ра, °С | CNaOH, (конечная), % | Кол-во Са(ОН)2,кг | Кол-во СаСО3, кг | ||
| 2 | 71,4 | 40 | 100 | 1000 | 186 | 80 | 322 | 25 | 80 | 40 | 111,6 | 150 |
| 3 | 80,4 | 45 | 100 | 1100 | 180 | 90 | 320 | 23 | 90 | 40 | 112,0 | 155 |
| 4 | 71,4 | 50 | 100 | 1050 | 184 | 95 | 323 | 20 | 85 | 40 | 111,6 | 155 |
| 5 | 70,0 | 50 | 150 | 1150 | Происходит образование спека и плав не выгружается | |||||||
| 6 | 71,4 | 40 | 100 | 950 | Недостаточная температура для образования плава | |||||||
| 7 | 71,4 | 45 | 100 | 1050 | 186 | 90 | 321 | 25 | 85 | 40 | 112,1 | 154 |
1. Способ получения гидроксида натрия, включающий взаимодействие карбоната натрия с известью с последующим выщелачиванием получаемой смеси, упариванием образовавшегося щелока и выделением целевого продукта, а также дополнительно получаемого карбоната кальция, отличающийся тем, что на выщелачивание подают плав СаО·Na2O, предварительно полученный путем обжига отходов производства кальцинированной соды, содержащих СаО, СаСО3 и Na2CO3, при температуре 1000-1100°С, и упаривание образовавшегося щелока производят до концентрации гидроксида натрия не менее 40 мас.%, а получаемый гидроксид кальция на стадии выщелачивания подвергают карбонизации углекислым газом, выделяемым на стадии получения плава.
2. Способ по п.1, отличающийся тем, что в качестве отходов производства кальцинированной соды используют мелкий "недопал", образующийся на стадии обжига карбоната кальция, фракции 5-30 мм с содержанием СаСО3 60-70%, негашеную известь после печей обжига с содержанием СаО 60-80%, а также отходы производства кальцинированной соды с содержанием Na2CO3 не менее 92%.
3. Способ по пп.1 и 2, отличающийся тем, что для получения плава СаО·Na2O отходы производства кальцинированной соды - "недопал", негашеную известь и некондицию Na2CO3 - предварительно смешивают в стехиометрическом соотношении, гранулируют до размера гранул 5-30 мм.
4. Способ по пп.1 и 2, отличающийся тем, что выщелачивание плава СаО·Na2O проводят водой при температуре 80-95°С.