Выделенный оболочечный белок hcv, способ его получения и лекарство, вакцина, фармацевтическая композиция (варианты) его содержащие
Иллюстрации
Показать всеИзобретение относится к области вирусологии и биотехнологии. Предложен оболочечный белок HCV (вирус гепатита С). Белок характеризуется тем, что 80% его сайтов гликозилирования являются кор-гликозилированными. Такой белок является более предпочтительным для его диагностического, профилактического и терапевтического применения. Предложен также способ получения такого белка, а также лекарство, вакцина и различные фармацевтические композиции, содержащие такой белок. Предложенная группа изобретения может быть использована в медицине для диагностики, лечения и профилактики HCV инфекции, а также к прогнозированию клинической эффективности лечения. 12 н. и 25 з.п. ф-лы, 68 ил., 16 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к общей области экспрессии рекомбинантных белков, к диагностике HCV (вирус гепатита С) инфекции, к лечению или профилактике HCV инфекции и к прогнозированию/мониторингу клинической эффективности лечения индивида с хроническим гепатитом или прогнозированию/мониторингу естественной болезни.
Более конкретно настоящее изобретение относится к экспрессии оболочечных белков вируса гепатита С в дрожжах, штаммам дрожжей для экспрессии кор-гликозилированных оболочечных вирусных белков HCV и к применению оболочечных белков HCV по настоящему изобретению в диагностике, профилактике или лечении.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Инфекция вирусом гепатита С (HCV) является серьезной проблемой для здоровья как в развитых, так и развивающихся странах. Установлено, что примерно от 1 до 5% мирового населения поражено этим вирусом. HCV инфекция оказывается самой главной причиной гепатита, связанного с переливанием крови, и часто прогрессирует в хроническое повреждение печени. Более того, существуют свидетельства участия HCV в индукции гепатоцеллюлярной карциномы. Следовательно, потребность в надежных диагностических методах и эффективных терапевтических агентах высока. Кроме того, нужны чувствительные и специфичные способы скрининга кровепродуктов, зараженных HCV, и улучшенные способы культивирования HCV.
HCV представляет собой вирус, содержащий положительную цепь РНК размером приблизительно 9600 оснований, которая кодирует единственный полипротеин-предшественник, состоящий примерно из 3000 аминокислот. Показано, что протеолитическое расщепление этого предшественника, сопряженное с ко- и пост-трансляционными модификациями, приводит по меньшей мере к трем структурным и шести неструктурным белкам. На основании гомологии последовательностей структурные белки можно в функциональном отношении определить как один коровый белок и два оболочечных гликопротеина: Е1 и Е2. Белок Е1 состоит из 192 аминокислот и содержит от 4 до 5 сайтов N-гликозилирования, в зависимости от генотипа HCV. Белок Е2 состоит из 363-370 аминокислот и содержит от 9 до 11 сайтов N-гликозилирования, в зависимости от генотипа HCV (обзоры см. в: Major and Feinstone, 1997; Maertens and Stuyver, 1997). Белок Е1 содержит различные вариабельные домены (Maertens and Stuyver, 1997). Белок Е2 содержит три сверхвариабельных домена, из которых главный домен локализован на N-конце этого белка (Maertens and Stuyver, 1997). Гликопротеины HCV локализуются главным образом в ЭР, где они модифицируются и собираются в олигомерные комплексы.
У эукариотов остатки сахара обычно присоединены к четырем разным аминокислотным остаткам. Эти аминокислотные остатки классифицируются как O-связанные (серии, треонин и гидроксилизин) и N-связанные (аспарагин). O-связанные сахара синтезируются в аппарате Гольджи или шероховатом эндоплазматическом ретикулюме (ЭР) из нуклеотидных сахаров. N-связанные сахара синтезируются из общего предшественника и затем подвергаются процессингу. Считают, что оболочечные белки HCV N-гликозилированы. Из уровня техники известно, что добавление N-связанных углеводных цепей важно для стабилизации складчатых интермедиатов и, таким образом, для эффективной укладки, предотвращения неправильной укладки и деградации в эндоплазматическом ретикулюме, олигомеризации, биологической активности и транспорта гликопротеинов (см. обзоры Rose et al., 1988; Doms et al., 1993; Helenius, 1994). Консенсусными сайтами для присоединения N-связанных олигосахаридов являются трипептидные последовательности Asn-X-Ser и Asn-X-Thr (где Х может быть любой аминокислотой) в составе полипептидов. После добавления N-связанного олигосахарида к полипептиду этот олигосахарид подвергается дальнейшему процессингу в сложный тип (содержащий N-ацетилглюкозамин, маннозу, фукозу, галактозу и сиаловую кислоту) или высокоманнозный тип (содержащий N-ацетилглюкозамин и маннозу). Считается, что оболочечные белки HCV относятся к высокоманнозному типу. Процессинг N-связанных олигосахаридов в дрожжах сильно отличается от процессинга в аппарате Гольджи млекопитающих. В дрожжах олигосахаридные цепи удлиняются в аппарате Гольджи поэтапным добавлением маннозы, что приводит к сложным высокоманнозным структурам и называется гипергликозилированием. В отличие от этого белки, экспрессируемые в прокариотах, никогда не гликозилируются.
Типы гликозилирования белков или пептидов высокоманнозного типа определены для множества разных эукариотических клеток. В клетках млекопитающих в среднем от 5 до 9 маннозных единиц связаны с двумя N-ацетилглюкозаминовыми группировками в олигосахариде с гликозилированием корового типа (структура кратко представлена как Man(5-9)GlcNAc(2)). Kop-гликозилирование относится к структуре, похожей на структуры, обведенные рамками на Фиг.3 в Herscovics and Orleans (1993).
Имеются сообщения, что метилотрофные дрожжи Pichia pastoris присоединяют в среднем от 8 до 14 маннозных единиц, то есть Man(8-14)GlcNAc(2), на каждый сайт гликозилирования (Tschopp в ЕР 0256421), и что приблизительно 85% N-связанных олигосахаридов находятся в диапазоне размеров Man(8-14)GlcNAc(2) (Grinna and Tschopp 1989). Другие исследователи опубликовали несколько отличные олигосахаридные структуры, присоединенные к гетерологичным белкам, экспрессируемым в Р.pastoris: Man(8-9)GlcNAc(2) (Montesino et al. 1989), Man(9-14)GlcNAc(2) или Man(9-15)GlcNAc(2) (Kalidas et al. 2001) и Man(8-18)GlcNAc(2) с преобладанием Man(9-12)GlcNAc(2), причем основным олисахаридом в целом является Man(10)GlcNAc(2) (Miele et al. 1998). Trimble et al. (1991) сообщили, что примерно в 75% N-связанных олигосахаридов имеется примерно поровну Man(8)GlcNAc(2) и Man(9)GlcNAc(2), причем дополнительно 17% сайтов гликозилирования занимает Man(10)GlcNAc(2), а остальные 8% сайтов - Man(11)GtcNAc(2). О гипергликозилировании белков, экспрессируемых в Р.pastoris, сообщают редко (Scorer et al. 1993).
Aspergillus niger добавляет к сайтам гликозилирования Man(5-10)GlcNAc(2) (Panchal and Wodzinski 1998).
Дефектный по гликозилированию мутант mnn9 Saccharomyces cerevisiae отличается от S.cerevisiae дикого типа тем, что клетки mnn9 продуцируют гликозилированные белки с модифицированным олигосахаридом, состоящим из Man(9-13)GlcNAc(2), вместо гипергликозилированных белков (Mackay et al., в US 5135854 и Kniskern et al. в WO 94/01132). О другом мутанте S.cerevisiae, och1mnn9, сообщали, что к сайтам гликозилирования в белках он добавляет Man(8)GlcNAc(2) (Yoshifumi et al., JP 06277086).
Для коровых олигосахаридов S.cerevisiae (дикий тип и мутант mnn9) характерно присутствие концевых α1,3-связанных маннозных остатков (Montesino et al., 1998). Олигосахариды, присоединенные к сайтам гликозилирования белков, экспрессируемых в Р.pastoris или в S.cerevisiae och1mnn1, лишены таких концевых α1,3-связанных манноз (Gellissen et al. 2000). Концевые α1,3-связанные маннозы считаются аллергенными (Jenkins et al. 1996). Поэтому белки, несущие на своих олигосахаридах концевые остатки α1,3-связанной маннозы, не пригодны для диагностических или терапевтических целей.
Тип гликозилирования белков, экспрессируемых в метилотрофных дрожжах Hansenula polymorpha, несмотря на использование этих дрожжей для продуцирования значительного числа гетерологичных белков (см. Табл.3 в Gellisen et al. 2000), не был исследован в деталях. Эксперименты Janowicz et al. (1991) и Diminskiy et al. (1997) создают впечатление, что Н.polymorpha не гликозилирует или очень слабо гликозилирует большой или малый поверхностный антиген вируса гепатита В (HBsAg). Наиболее вероятно это происходит из-за того, что HBsAg экспрессировался без сигнального пептида, что предотвращало поступление продуцированного HBsAg в просвет эндоплазматического ретикулюма (ЭР) и гликозилирование. Есть сообщение об ограниченном добавлении моно- и дигексоз к G-CSF (гранулоцитарный колониестимулирующий фактор), продуцируемому в Н.polymorpha (Fischer et al. в WO 00/40727). С другой стороны, наблюдали гипергликозилирование гетерологичной α-галактозидазы, экспрессируемой в клетках Н.polymorpha (Fellinger et al. 1991).
В настоящее время доказано, что вакцинация против болезни является одним из самых экономически эффективных и действенных способов контроля болезней. Однако, несмотря на многообещающие результаты, усилия по разработке эффективной вакцины против HVC были спряжены с трудностями. Непременным условием для вакцин является индукция иммунного ответа у пациентов. Следовательно, надо идентифицировать антигенные детерминанты HVC и в надлежащих условиях вводить их пациентам. Антигенные детерминанты можно разделить по меньшей мере на две формы, а именно, линейные и конформационные эпитопы. Конформационные эпитопы являются результатом складывания молекулы в трехмерном пространстве, что включает в себя ко- и пост-трансляционные модификации, такие как гликозилирование. В общем, считают, что реализацией самых эффективных вакцин будут конформационные эпитопы, поскольку они представляют собой эпитопы, которые напоминают подобные нативным эпитопы HVC и которые могут быть сохранены лучше, чем действительные линейные аминокислотные последовательности. Следовательно, первоочередную важность для генерирования анигенных детерминант HVC, подобных нативным, имеет окончательная степень гликозилирования оболочечных белков HVC. Однако есть кажущиеся непреодолимыми проблемы с культивированием HVC, которые приводят ко всего лишь ничтожным количествам вирионов. Кроме того, имеются обширные проблемы с экспрессией и очисткой рекомбинантных белков, приводящие как к малым количествам белков, так и к гипергликозилированным белкам или белкам, которые не гликозилированы.
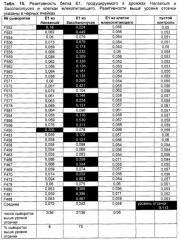
Оболочечные белки HCV были получены рекомбинантными методами в Escherichia coli, клетках насекомых, клетках дрожжей и клетках млекопитающих. Однако у высших эукариот экспрессия характеризуется трудностями в получении больших количеств антигенов для получения, в конечном счете, вакцины. Результатом экспрессия в прокариотах, таких как Е.coli, являются оболочечные белки HCV, которые не гликозилированы. Результатом экспрессии оболочечных белков HCV в дрожжах является гипергликозилирование. Как уже продемонстрировали Maertens et al. в WO 96/04385, экспрессия оболочечного белка Е2 HCV в Saccharomyces cerevisiae приводит к белкам, которые сильно гликозилированы. Это гипергликозилирование приводит к экранированию эпитопов белка. Хотя Mustilli et al. (1999) утверждают, что результатом экспрессии белка Е2 HCV в S.cerevisiae является кор-гликозилирование, результаты внутриклеточной экспрессии этого материала показывают, что по меньшей мере его часть гипергликозилирована, тогда как корректный процессинг остальной части этого материала не продемонстрирован. Более того, гипергликозилирование, которое наблюдали Mustilli et al. (1999), могло быть предотвращено только присутствием туникамицина, инигибитора гликозилирования, и это, таким образом, не отражает гликозилирование, происходящее в нормальных, естественных условиях роста. Потребность в оболочечных белках HCV, происходящих из внутриклеточного источника, вполне признана (Maertens et al. в WO 96/04385, Heile et al., 2000). Еще одним примером этой потребности является плохая реакционная способность секретируемого Е2, происходящего из дрожжей, с сыворотками шимпанзе, иммунизированных белком Е2, происходящим из культуры клеток млекопитающего, как засвидетельствовано на Фиг.5 в Mustilli et al (1999). Это далее документируют Rosa et al. (1996), которые показывают, что иммунизация оболочечными белками HCV дрожжевого происхождения не может защитить от контрольного инфицирования.
Следовательно, существует потребность в эффективных системах экспрессии, результатом которых являются большие и экономически эффективные количества белков, имеющих в то же время тип гликозилирования, подобный нативному, с отсутствием концевой α1,3-связанной маннозы. В частности, такие системы необходимы для продукции оболочечных белков HCV.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Первый аспект настоящего изобретения относится к выделенному оболочечному белку HCV или его фрагменту, содержащему по меньшей мере один сайт N-гликозилирования, отличающемуся тем, что он является продуктом экспрессии в эукариотической клетке, и дополнительно отличающемуся тем, что в среднем вплоть до 80% сайтов N-гликозилирования кор-гликозилированы. В частности, более 70% указанных кор-гликозилированных сайтов гликозилированы олигоманнозой со структурой, определяемой как Man(8-10)-GlcNAc(2). Более того, соотношение олигоманнозы, имеющей структуру Man(7)-GlcNAc(2) и олигоманнозы, имеющей структуру Man(8)-GlcNAc(2), меньше или равно 0,45. Более конкретно, указанные олигоманнозы содержат менее 10% концевой α1,3-маннозы. Эукариотической клеткой, экспрессирующей указанный выделенный оболочечный белок HCV или его часть, может быть дрожжевая клетка, такая как клетка Hansenula.
Еще один аспект настоящего изобретения относится к выделенному оболочечному белку HCV или его части согласно изобретению, который(ая) получен(а) из белка, содержащего лидерный пептид птичьего лизоцима или его функциональный вариант, присоединенный к указанному оболочечному белку HCV или его фрагменту. Более конкретно, указанный выделенный оболочечный белок HCV или его часть получен(а) из белка, характеризуемого структурой
CL-[(A1)a-(PS1)b-(A2)c]-HCVENV-[(A3)d-(PS2)e-(A4)f]
где:
CL является лидерным пептидом птичьего лизоцима или его функциональным эквивалентом,
А1, А2, A3 и А4 являются адаптерными пептидами, которые могут быть одинаковыми или разными,
PS1 и PS2 являются сайтами процессинга, которые могут быть одинаковыми или разными,
HCVENV является оболочечным белком HCV или его частью,
а, b, с, d, e и f равны 0 или 1, и
где, возможно, А1 и/или А2 представляют собой часть PS1, и/или где A3 и/или А4 представляют собой часть PS2.
Другой аспект этого изобретения охватывает выделенный оболочечный белок HCV или его фрагмент согласно изобретению, который содержится в структуре, выбранной из группы, состоящей из мономеров, гомодимеров, гетеродимеров, гомо-олигомеров и гетеро-олигомеров. Альтернативно указанный выделенный оболочечный белок HCV или его фрагмент согласно изобретению содержится в вирусоподобной частице. Более конкретно, любой выделенный оболочечный белок HCV или его фрагмент согласно изобретению может содержать цистеины, у которых цистеиновые тиольные группы модифицированы химическим путем.
Конкретные аспекты этого изобретения относятся к выделенным оболочечным белкам HCV или их фрагменту согласно изобретению, которые являются антигенными или иммуногенными и/или которые содержат эпитоп, стимулирующий Т-клетки.
Дальнейший аспект относится к композиции, содержащей выделенный оболочечный белок HCV или его фрагмент согласно изобретению. Указанная композиция может дополнительно содержать фармацевтически приемлемый носитель и может быть лекарством или вакциной.
Это изобретение также относится к способу получения выделенного оболочечного белка HCV или его фрагмента согласно изобретению.
Другой способ по этому изобретению представляет собой способ обнаружения присутствия анти-HCV антител в образце, подозреваемом в том, что он содержит анти-HCV антитела, при котором:
1) оболочечный белок HCV или его часть по любому из пп.1-15 формулы изобретения приводят в контакт с указанным образцом в условиях, допускающих образование комплекса указанного оболочечного белка HCV или его части с указанными анти-HCV антителами,
2) выявляют комплекс, образованный на стадии (1),
3) на основании результатов стадии (2) делают вывод о присутствии указанных анти-HCV антител в указанном образце.
Более конкретно, указанный способ может включать в себя стадию (1), на которой указанное приведение в контакт происходит к конкурентных условиях. В частности, в указанных способах может быть использована твердая подложка, к которой присоединен указанный оболочечный белок HCV или его часть.
Далее это изобретение относится к диагностическому набору для обнаружения присутствия анти-HCV антител в образце, подозреваемом в том, что он содержит анти-HCV антитела, содержащему оболочечный белок HCV или его часть согласно изобретению. Более конкретно, указанный набор содержит указанный оболочечный белок HCV или его часть, присоединенный(ую) к твердой подложке.
Это изобретение также относится к лекарству или вакцине, которые содержат оболочечный белок HCV или его часть согласно изобретению.
Также это изобретение охватывает фармацевтическую композицию для индукции у млекопитающего HCV-специфичного иммунного ответа, содержащую эффективное количество оболочечного белка HCV или его части согласно изобретению и, возможно, фармацевтически приемлемый адъювант. Указанная фармацевтическая композиция может альтернативно быть способна индуцировать у млекопитающего HCV-специфичные антитела и/или индуцировать у млекопитающего Т-клеточную функцию. Более того, указанная фармацевтическая комсайт может быть профилактической композицией или терапевтической композицией. В частности, указанное млекопитающее является человеком.
ПОЯСНЕНИЯ К ФИГУРАМ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1. Схематическая карта вектора pGEMT-E1sH6RB, который имеет последовательность, определенную в SEQ ID NO:6.
Фиг.2. Схематическая карта вектора pCHH-Hir, который имеет последовательность, определенную в SEQ ID NO:9.
Фиг.3. Схематическая карта вектора pFPMT121, который имеет последовательность, определенную в SEQ ID NO:12.
Фиг.4. Схематическая карта вектора pFPMT-CHH-Е1-Н6, который имеет последовательность, определенную в SEQ ID NO:13.
Фиг.5. Схематическая карта вектора pFPMT-MFa-E1-H6, который имеет последовательность, определенную в SEQ ID NO:16.
Фиг.6. Схематическая карта вектора pUC18-FMD-MFa-E1-H6, который имеет последовательность, определенную в SEQ ID NO:17.
Фиг.7. Схематическая карта вектора pUC18-FMD-CL-E1-H6, который имеет последовательность, определенную в SEQ ID NO:20.
Фиг.8. Схематическая карта вектора pFPMT-CL-E1-Н6, который имеет последовательность, определенную в SEQ ID NO:21.
Фиг.9. Схематическая карта вектора pSР72Е2Н6, который имеет последовательность, определенную в SEQ ID NO:22.
Фиг.10. Схематическая карта вектора рМРТ121, который имеет последовательность, определенную в SEQ ID NO:23.
Фиг.11. Схематическая карта вектора pFPMT-MFa-E2-H6, который имеет последовательность, определенную в SEQ ID NO:24.
Фиг.12. Схематическая карта вектора pMPT-MFa-E2-H6, который имеет последовательность, определенную в SEQ ID NO:25.
Фиг.13. Схематическая карта вектора pMF30, который имеет последовательность, определенную в SEQ ID NO:28.
Фиг.14. Схематическая карта вектора pFPMT-CL-E2-H6, который имеет последовательность, определенную в SEQ ID NO:32.
Фиг.15. Схематическая карта вектора pUC18-FMD-CL-E1, который имеет последовательность, определенную в SEQ ID NO:35.
Фиг.16. Схематическая карта вектора pFPMT-CL-E1, который имеет последовательность, определенную в SEQ ID NO:36.
Фиг.17. Схематическая карта вектора pUC18-FMD-CL-H6-E1-K-H6, который имеет последовательность, определенную в SEQ ID NO:39.
Фиг.18. Схематическая карта вектора pFPMT-CL-H6-K-E1, который имеет последовательность, определенную в SEQ ID NO:40.
Фиг.19. Схематическая карта вектора pYIG5, который имеет последовательность, определенную в SEQ ID NO:41.
Фиг.20. Схематическая карта вектора pYIG5E1H6, который имеет последовательность, определенную в SEQ ID NO:42.
Фиг.21. Схематическая карта вектора pSY1, который имеет последовательность, определенную в SEQ ID NO:43.
Фиг.22. Схематическая карта вектора pSY1aMFE1sH6a, который имеет последовательность, определенную в SEQ ID NO:44.
Фиг.23. Схематическая карта вектора pBSK-E2sH6, который имеет последовательность, определенную в SEQ ID NO:45.
Фиг.24. Схематическая карта вектора pYIG5HCCL-22aH6, который имеет последовательность, определенную в SEQ ID NO:46.
Фиг.25. Схематическая карта вектора pYYIGSE2H6, который имеет последовательность, определенную в SEQ ID NO:47.
Фиг.26. Схематическая карта вектора pYIG7, который имеет последовательность, определенную в SEQ ID NO:48.
Фиг.27. Схематическая карта вектора pYIG7E1, который имеет последовательность, определенную в SEQ ID NO:49.
Фиг.28. Схематическая карта вектора pSY1YIG7E1s, который имеет последовательность, определенную в SEQ ID NO:50.
Фиг.29. Схематическая карта вектора pPICZalphaA, который имеет последовательность, определенную в SEQ ID NO:51.
Фиг.30. Схематическая карта вектора pPICZalphaD', который имеет последовательность, определенную в SEQ ID NO:52.
Фиг.31. Схематическая карта вектора pPICZalphaE', который имеет последовательность, определенную в SEQ ID NO:53.
Фиг.32. Схематическая карта вектора pPICZalphaD'E1sH6, который имеет последовательность, определенную в SEQ ID NO:58.
Фиг.33. Схематическая карта вектора pPICZalphaE'E1sH6, который имеет последовательность, определенную в SEQ ID NO:59.
Фиг.34. Схематическая карта вектора pPICZalphaD'E2sH6, который имеет последовательность, определенную в SEQ ID NO:60.
Фиг.35. Схематическая карта вектора pPICZalphaE'E2sH6, который имеет последовательность, определенную в SEQ ID NO:61.
Фиг.36. Схематическая карта вектора pUC18MFa, который имеет последовательность, определенную в SEQ ID NO:62.
Фиг.37. Профиль элюции хроматографии с вытеснением по размеру частиц белка Е2-Н6, очищенного с помощью IMAC, экспрессированного в MFa-Е2-Н6-экспрессирующей Hansenula polymorpha (см. Пример 15). На оси Х показан объем элюции (в мл). Вертикальные линии через профиль элюции показывают собранные фракции. "Р1"=объединенные фракции 4-9, "Р2"=объединенные фракции 30-35, "Р3"=объединенные фракции 37-44. Ось Y показывает спектральную поглощательную способность, приведенную в мЕА (милли единицы абсорбции). На оси Х показан объем элюции в мл.
Фиг.38. Различные пулы и фракции, собранные после хроматографии с вытеснением по размеру частиц (см. Фиг.37), были проанализированы с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия в невосстанавливающих условиях (Na-ДДС-ПААГ электрофорез) с последующим окрашиванием полиакриламидного геля серебром. Проанализированные пулы ("Р1", "Р2" и "Р3") и фракции (с 16 по 26) указаны в верхней части изображения геля, окрашенного серебром. Слева (дорожка "М") указаны размеры маркеров молекулярной массы.
Фиг.39. Фракции 17-23 после стадии хроматографии с вытеснением по размеру частиц как показано на Фиг.37, были объединены и проалкилированы. После этого белковый материал был подвергнут обработке посредством Endo H для дегликозилирования. Необработанный и обработанный посредством Endo H материал был разделен на Na-ДДС-ПААГ геле и подвергнут блоттингу на мембране PVDF (поливинилдифторид). Блот был окрашен красителем амидо черный.
Дорожка 1: алкилированный Е2-Н2 до обработки посредством Endo H.
Дорожка 2: алкилированный Е2-Н2 после обработки посредством Endo H.
Фиг.40. Вестерн-блот-анализ клеточных лизатов Е1, экспрессированного в Saccharomyces cerevisiae.
Вестерн-блот обрабатывали с использованием El-специфичного моноклонального антитела IGH 201.
Дорожки 1-4: продукт экспрессии после 2, 3, 5 или 7 дней экспрессии, соответственно, в клоне Saccharomyces, трансформированном pSY1Y1G7E1s (SEQ ID NO:50, Фиг.28), содержащей нуклеотидную последовательность, которая кодирует лидерный пептид куриного лизоцима, присоединенный к Е1-Н6.
Дорожки 5-7: продукт экспрессии через 2, 3 или 5 дней экспрессии, соответственно, в клоне Saccharomyces, трансформированном pSY1aMFE1sH6aYIG1 (SEQ ID NO:44, Фиг.22), содержащей нуклеотидную последовательность, которая кодирует лидерный пептид α-фактора спаривания, присоединенный к Е1-Н6.
Дорожка 8: маркеры молекулярной массы, как указано.
Дорожка 9: очищенный E1s, продуцируемый клетками млекопитающего, инфицированными HCV-рекомбинантным вирусом коровьей оспы.
Фиг.41. Анализ белка Е2-Е6, экспрессированного и процессированного из CL-E2-H6 до Е2-Н6 в Н.polymorpha, который был очищен афинной хроматографией с иммобилизованными ионами металлов (IMAC) (см. Пример 17). Белки из разных промывочных фракций (дорожки 2-4) и элюированных фракций (дорожки 5-7) были проанализированы с помощью Na-ДДС-ПААГ электрофореза в восстанавливающих условиях с последующим окрашиванием геля серебром (А, верхнее изображение) или посредством вестерн-блоттинга с использованием специфического моноклонального антитела, направленного против Е2 (В, нижнее изображение). Размеры маркеров молекулярной массы указаны слева.
Фиг.42. Профиль элюции первого этапа IMAC-хроматографии на колонке Ni-IDA (хелатирующая Sepharose FF, нагруженная Ni2+, Pharmacia) для очистки сульфонированного белка Н6-К-Е1, продуцированного Н.polymorpha (см. Пример 18). Колонку уравновешивали буфером А (50 мМ фосфат, 6М GuHCl, 1% Empigen ВВ (об./об.), рН 7,2), обогащенным 20 мМ имидазола. После нанесения образца колонку последовательно промывали буфером А, содержащим 20 мМ и 50 мМ имидазола, соответственно (как показано на хроматограмме). Следующий этап промывки и элюции His-меченых продуктов выполнялся последовательным нанесением буфера В (забуференный фосфатами физиологический раствор (PBS), 1% empigen ВВ, рН 7,2), обогащенного 50 мМ имидазола и 200 мМ имидазола, соответственно (как указано на хроматограмме). Были объединены следующие фракции: пул промывки 1 (фракции 8-11, промывка с 50 мМ имидазола). Элюированный материал собирали отдельными фракциями от 63-й до 72-й или объединяли в пул элюции (фракции 63-69). На оси Y показано поглощение в мЕА (милли единицы абсорбции). На оси Х показан объем элюции в мл.
Фиг.43. Анализ очищенного посредством IMAC белка Н6-К-Е1 (см. Фиг.42), экспрессированного и процессированного из CL-H6-K-E1 до Н6-К-Е1 в Н.polymorpha. Белки в пуле промывки 1 (дорожка 12) и фракциях элюции от 63 до 72 (дорожки 2-11) были проанализированы посредством Na-ДДС-ПААГ электрофореза в восстанавливающих условиях с последующим окрашиванием геля серебром (А, верхнее изображение). Белки, присутствовавшие в образце перед IMAC (дорожка 2), в проходном пуле (дорожка 4), в промывочном пуле 1 (дорожка 5) и в пуле элюции (дорожка 6), были проанализированы вестерн-блоттингом с использованием специфического моноклонального антитела, направленного против Е1 (В, нижнее изображение, на дорожку 3 образец не наносили). Размеры маркеров молекулярной массы (дорожка М) указаны слева.
Фиг.44. Профиль элюции второго этапа IMAC-хроматографии на колонке Ni-IDA (хелатирующая Sepharose PF, нагруженная Mi2+, Pharmacia) для очистки Е1, являющегося результатом процессинга Н6-К-Е1 in vitro (очистка: см. Фиг.42) посредством Endo Lys-C. Поток собирали в разные фракции (1-40), которые были подвергнуты скринингу на присутствие Els-продуктов. Фракции (7-28), содержавшие интактный Е1, процессированный из Н6-К-Е1, объединяли. На оси Y показана спектральная поглощательная способность, приведенная в мЕА (миллиединицы абсорбции). На оси Х показан объем элюции в мл.
Фиг.45. Вестерн-блот-анализ, демонстрирующий специфические полосы белка E1s, прореагировавшие с биотинилированным гепарином (см. также Пример 19). Были проанализированы препараты E1s, очищенные из культуры клеток млекопитающего, инфицированных HCV-рекомбинантным вирусом коровьей оспы, или экспрессируемые Н.polymorpha. Панель справа от вертикальной линии показывает вестерн-блот, проявленный моноклональным биотинилированным E1-специфичным IGH 200. Панель слева от вертикальной линии показывает вестерн-блот, проявленный биотинилированным гепарином. Из этих результатов сделан вывод, что высокую аффинность к гепарину имеет главным образом E1s с низким уровнем гликозилирования.
Дорожки М: маркер молекулярной массы (молекулярные массы указаны слева).
Дорожки 1: E1s из клеток млекопитающего, алкилированный в ходе выделения.
Дорожки 2: E1s-H6, экспрессируемый Н.polymorpha и сульфонированный в ходе выделения.
Дорожки 3: E1s-H6, экспрессируемый Н.polymorpha и алкилированный в ходе выделения.
Дорожки 4: тот же материал, что был загружен на дорожку 2, но обработанный дитиортреитолом для превращения сульфонированных Cys-тиольных группы в Cys-тиольные.
Фиг.46. Профиль хроматографии с вытеснением по размеру частиц (SEC, size exclusion chromatography) очищенного белка Е2-Н6, экспрессированного в Н.polymorpha, в его сульфонированной форме, который прогнали в PBS, 3% бетаина для того, чтобы вызвать образование вирусоподобных частиц (VLP) заменой Empigen BB на бетаин. Объединенные фракции, содержащие VLPs, которые были использованы в дальнейшем исследовании, указаны знаком "↔". Ось Y показывает абсорбцию, приведенную в мЕА (миллиединицы абсорбции). На оси Х показан объем элюции в мл. См. также Пример 20.
Фиг.47. Профиль хроматографии с вытеснением по размеру частиц (SEC, size exclusion chromatography) очищенного белка Е2-Н6, экспрессированного в Н.polymorpha, в его алкилированной форме, который прогнали в PBS, 3% бетаина для того, чтобы вызвать образование вирусоподобных частиц (VLP) заменой Empigen BB на бетаин. Объединенные фракции, содержащие VLPs, указаны знаком "↔". Ось Y показывает абсорбцию, приведенную в мЕА (миллиединицы абсорбции). На оси Х показан объем элюции в мл. См. также Пример 20.
Фиг.48. Профиль хроматографии с вытеснением по размеру частиц (SEC, size exclusion chromatography) очищенного белка Е1, экспрессированного в Н.polymorpha, в его сульфонированной форме, который прогнали в PBS, 3% бетаина для того, чтобы вызвать образование вирусоподобных частиц (VLP) заменой Empigen BB на бетаин. Объединенные фракции, содержащие VLPs, указаны знаком "↔". Ось Y показывает абсорбцию, приведенную в мЕА (миллиединицы абсорбции). На оси Х показан объем элюции в мл. См. также Пример 20.
Фиг.49. Профиль хроматографии с вытеснением по размеру частиц (SEC, size exclusion chromatography) очищенного белка Е1, экспрессированного в Н.polymorpha, в его алкилированной форме, который прогнали в PBS, 3% бетаина для того, чтобы вызвать образование вирусоподобных частиц (VLP) заменой Empigen BB на бетаин. Объединенные фракции, содержащие VLPs, указаны знаком "↔". Ось Y показывает абсорбцию, приведенную в мЕА (миллиединицы абсорбции). На оси Х показан объем элюции в мл. См. также Пример 20.
Фиг.50. Na-ДДС-ПААГ (в восстанавливающих условиях) и анализ вестерн-блоттингом вирусоподобных частиц, выделенных после хроматографии с вытеснением по размеру частиц, как описано для Фиг.48 и 49. Левая панель: окрашенный серебром Na-ДДС-ПААГ гель. Правая панель: вестерн-блот с использованием специфических моноклональных антител против белка Е1 (IGH201). Дорожки 1: маркеры молекулярной массы (молекулярные массы указаны слева); дорожки 2: пул VLPs, содержащих сульфонированный Е1 (Фиг.48); дорожки 3: пул VLPs, содержащих алкилированный Е1 (Фиг.49). См. также Пример 20.
Фиг.51. Е1, продуцированный в клетках млекопитающего ("М"), или Е1, продуцируемый в Hansenula ("H"), были нанесены на твердую подложку для твердофазного иммуноферментного анализа (ELISA), чтобы определить конечную точку титрования антител, присутствующих в сыворотках после вакцинации мышей белком Е1, продуцированным в клетках млекопитающего (верхняя панель), или после вакцинации мышей белком Е1, продуцируемым в Hansenula (нижняя панель). Горизонтальная полоса представляет средний титр антител. Конечные титры (кратности разведения) указаны на оси Y. См. также Пример 22.
Фиг.52. Е1, продуцированный в Hansenula, был алкилирован ("А") или сульфонирован ("S") и нанесен на твердую подложку для твердофазного иммуноферментного анализа (ELISA), чтобы определить конечную точку титрования антител, присутствующих в сыворотках после вакцинации мышей белком Е1, продуцируемым в Hansenula, который был алкилирован (верхняя панель) или после вакцинации мышей белком Е1, продуцируемым в Hansenuta, который был сульфонирован (нижняя панель). Горизонтальная полоса представляет средний титр антител. Конечные титры (кратности разведения) указаны на оси Y. См. также Пример 23.
Фиг.53. HCV E1, продуцированный клетками млекопитающего, которые были инфицированы HCV-рекомбинантным вирусом коровьей оспы, и HCV E1, продуцированный Н.polymorpha, были нанесены непосредственно на планшеты для ELISA. Были определены титры в конечных точках для антител в сыворотках от шимпанзе, вакцинированных белком E1, который был продуцирован клетками млекопитающего (верхняя панель), или мышиных моноклональных антител, наработанных против белка E1, продуцированного клетками млекопитающего (нижняя панель). Шимпанзе Yoran и Marti получили профилактические вакцинации. Шимпанзе Ton, Phil, Marcel, Peggy и Femma получили терапевтические вакцинации. Черные сплошные столбики: планшет для ELISA, покрытый белком E1, продуцированным клетками млекопитающих. Незакрашенные столбики: планшет для ELISA, покрытый белком E1, продуцированным Hansenula. Титры в конечных точках (кратности разведения) указаны на оси Y. См. также Пример 24.
Фиг.54. Проведенный с применением флуорофоров углеводный гель-электрофорез олигосахаридов, высвобождаемых из белка E1, продуцированного клетками млекопитающего, которые были инфицированы HCV-рекомбинантным вирусом коровьей оспы, и из белка Е1-Н6, продуцированного Hansenula.
Дорожка 1: Многоступенчатый глюкозный стандарт, слева указано количество моносахаридов (от 3 до 10, обозначенные как G3-G10).
Дорожка 2: 25 мкг N-связанных олигосахаридов, высвобожденных из (алкилированного) белка E1, продуцированного клетками млекопитающего.
Дорожка 3: 25 мкг N-связанных олигосахаридов, высвобожденных из (алкилированного) белка E1, продуцированного Hansenula.
Дорожка 4: 100 пмоль мальтотетраозы.
См. также Пример 25.
Фиг.55. На данном рисунке представлены упрощенные структуры эталонных олигоманноз Man-9 (Фиг.55.А), Man-8 (Фиг.55.В), Man-7 (Фиг.55.С), Man-6 (Фиг.55.D) и Man-5 (Фиг.55.Е). "Man"=манноза; "GlcNAc"=N-ацетилглюкозамин; "α"=α-связь между двумя маннозами; "β"=β-связь между двумя маннозами; "(1-3)", "(1-4)" и "(1-6)"=связи (1-3), (1-4) и (1-6), соответственно, между двумя маннозами. Скобки на Фиг.55.В и 55.С показывают, что 2 и 1, соответственно, маннозных остатка слева от скобок связаны связью α(1-2) с 2 и 1, соответственно, из 3 маннозных остатков справа от скобок. См. также Пример 26.
Фиг.56. На этом рисунке представлена высшая олигоманноза, состоящая из 10 маннозных группировок, присоединенных к хитобиозе. Каждый концевой маннозный остаток связан α(1-3)-связью с неконцевым маннозным остатком. Тонкая направленная вверх указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α(1-2)-маннозидазой (таковых в данной олигоманнозе нет), толстая направленная вверх или влево указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α-маннозидазой после удаления α(1-2)-связанных манноз (не применимо к данной олигоманнозе), а незакрашенная направленная вниз указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению β-маннозидазой после удаления α-связанных манноз. См. также Пример 26.
Фиг.57. На этом рисунке представлена высшая олигоманноза, состоящая из 9 маннозных группировок, присоединенных к хитобиозе. В этой олигоманнозе один концевой маннозный остаток связан α(1-2)-связью с неконцевым маннозным остатком. Тонкая направленная вверх указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α(1-2)-маннозидазой, толстая направленная вверх или влево указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α-маннозидазой после удаления α(1-2)-связанных манноз, а незакрашенная направленная вниз указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению β-маннозидазой после удаления α-связанных манноз. См. также Пример 26.
Фиг.58. На этом рисунке представлена эталонная высшая олигоманноза Man-9, состоящую из 9 маннозных группировок, присоединенных к хитобиозе. В этой олигоманнозе все концевые маннозные остатки связаны α(1-2)-связью с неконцевым маннозным остатком. Тонкая направленная вверх указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α(1-2)-маннозидазой, толстая направленная вверх или влево указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α-маннозидазой после удаления α(1-2)-связанных манноз, а незакрашенная направленная вниз указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению β-маннозидазой после удаления α-связанных манноз. См. также Пример 26.
Фиг.59. На этом рисунке представлена высшая олигоманноза Man-8, состоящая из 8 маннозных группировок, присоединенных к хитобиозе. В этой олигоманнозе все концевые маннозные остатки связаны α(1-3)-связью или α(1-6)-связью с неконцевым маннозным остатком, что делает эту структуру полностью устойчивой к расщеплению α(1-2)-маннозидазой. Толстая направленная вверх указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению α-маннозидазой, а незакрашенная направленная вниз указательная стрелка показывает связи олигосахарида, которые подвержены расщеплению β-маннозидазой после удаления α-связанных манноз. См. также Пример 26.
Фиг.60. На этом рисунке представлена высшая олигоманноза Man-7, состоящая из 7 маннозных группировок, присоединенных к хитобиозе. В этой олигоманнозе все концевые маннозные остатки связаны α(1-3)-связью с неконцевым маннозным остатком, что делает эту структуру полностью устойчивой к расщепл