Определение комплекса hcv-антиген/антитело
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к диагностике гепатита С, и касается определения комплекса HCV-антиген/антитело и включает способ определения комплекса, образуемого между HCV-антикоровым антигеном и NS3/4a-антителом, который может распознавать как HCV антигены, так и антитела, присутствующие в образце, при использовании единой твердой основы, а также и твердые подложки для применения в иммуноанализе. Преимущество изобретения заключается в повышении чувствительности диагностики гепатита С. 16 н. и 31 з.п. ф-лы, 10 табл., 8 ил.
Реферат
Область изобретения
Настоящее изобретение относится, в общем, к диагностике вирусов. В частности, изобретение относится к определению комплекса антиген/антитело для точного диагностирования инфекции вируса гепатита С.
Предпосылки изобретения
Вирус гепатита С (HCV) - основная причина парентерального гепатита не-А, не-В (NANBH), который в основном передается при переливании крови и половых контактах. Вирус присутствует у 0,4-2,0% доноров крови. Хронический гепатит развивается примерно у 50% инфицированных, и примерно у 20% из них развивается цирроз печени, который иногда приводит к гепатоцеллюлярной карциноме. Поэтому изучение и контроль этого заболевания являются важными для медицины.
HCV был впервые определен и характеризован как причина NANBH Хофтеном с соавторами (Houghten et al.). См. также Международную Публикацию № WO 89/04699, WO 90/11089 и WO 90/14436. HCV имеет геном, представленный 9,5 т.п.н. смысловой, одно-цепочечной РНК и является членом семейства вирусов Flaviridae. По меньшей мере шесть отдельных, хотя и родственных генотипов HCV было идентифицировано на основе филогенетических анализов (Simmonds et al., J.Gen.Virol (1993) 74: 2391-2399). Вирус кодирует единственный полипротеин, имеющий более 3000 аминокислотных остатков (Choo et al., Science (1989) 244:359-362; Choo et al., Proc. Natl. Acad. Sci. USA (1991) 88:2451-2455; Han et al., Proc. Natl. Acad. Sci USA (1991) 88: 1711-1715). Во время и после трансляции этот протеин преобразуется как в структурные, так в неструктурные (NS) белки.
В частности, как показано на фиг.1, геном HCV кодирует несколько белков. Порядок и номенклатура продуктов расщепления полипротеина HCV следующая: NH2-C-E1-E2-p7-NS2-NS3-NS4a-NS4b-NS5a-NS5b-COOH. Начальное расщепление полипротеина катализируется протеазами хозяина, которые высвобождают три структурных белка, N-концевой нуклеокапсидный белок (обозначаемый «кор») и два оболочечных гликопротеина, «Е1» (также известный как «Е») и «Е2» (также известный, как «E2/NS1»), также как неструктурные (NS) белки, содержащие вирусные ферменты. NS области обозначены NS2, NS3, NS4 и NS5. NS2 - интегральный мембранный протеин с протеолитической активностью. NS2, как один, так и вместе с N33, расщепляет NS2-NS3 слабую связь, которая, в свою очередь, создает N-конец NS3 и высвобождает большой полипротеин, который обладает активностью как сериновой протеазы, так и РНК-хеликазы. NS3-протеаза служит для преобразования оставшегося полипротеина. Окончание созревания полипротеина инициируется автокаталитическим расщеплением соединения NS3-NS4a, катализируемым NS3 сериновой протеазой. Последующие расщепления полипротеина HCV, опосредованные NS3, скорее всего, включают в себя распознавание расщепляющихся связей полипротеина молекулой N33 другого полипептида. В этих реакциях NS3 высвобождает NS3 кофактор - (NS4a), два белка (NS4b и NS5a) и РНК зависимую РНК-полимеразу (NS5b).
Описан ряд общих и специфических полипептидов, полученных из полипротеина HCV, пригодных в качестве иммунологических и диагностических реагентов. Например, Houghton et al., Европейская публикация №318,216 и 388,232; Choo et al., Science (1989) 244:359-362; Kuo et al., Science (1989) 244:362-364; Houghton et al., Hepatology (1991) 14:381-388; Chien et al., Proc. Natl. Acad. Sci. USA (1992) 89:10011-10015; Chien et al., J. Gastroent. Hepatol. (1993) 8-S33-39; Chien et al., Международная публикация № WO 93/00365, Chinen D. Y. Международная публикация № WO 94/01778. Эти публикации создают значительные предпосылки как для исследований HCV в целом, так и для производства и применения иммунологических реагентов для полипептида HCV.
Чувствительные, специфические способы отбора и идентификации носителей HCV и крови и ее продуктов, зараженных HCV, создадут значительный прогресс в медицине. Пост-трансфузионный гепатит встречается примерно у 10% пациентов, перенесших переливание крови, и HCV отмечен вплоть до 90% в этих случаях. Лечение больных, а также профилактика и передача HCV с кровью и продуктами крови или при близком личном контакте требует надежных диагностических и прогностических средств. Таким образом, было разработано несколько анализов для серодиагностики HCV инфекции. Например, см. Choo et al., Science (1989) 244:359-362; Kuo et al.. Science (1989) 244,: 362-364; Choo et al., Br. Med. Bull. (1990) 46:423-441; Ebeling et al., Lancet (1990) 335:982-983; van der Poel et al.. Lancet (1990) 335:558-560; van der Poel et al., Lancet. (1991) 337:317-319; Chien, D.Y., Международная публикация № WO 97/01178; Valenzuela et al., Международная публикация № WO 97/44469; и Kashiwakuma et al., U.S. Patent No. 5,871,904.
В некоторых анализах на базе сыворотки возникла серьезная проблема из-за значительного интервала между заражением и обнаружением вируса, который часто превышает 80 дней. Этот интервал может создать большой риск для реципиентов крови. Для преодоления этой проблемы были разработаны тесты на основе нуклеиновой кислоты (NAT), которые непосредственно определяют вирусную РНК, и тесты на коровый HCV антиген, которые являются анализом на вирусный антиген, вместо ответной реакции антитела. См., например, Kashiwakuma et al., Патент США №5,871,904; Beld et al.. Transfusion (2000) 40:575-579.
Тем не менее сохранилась необходимость в чувствительных и точных диагностических и прогностических средствах, позволяющих как организовать соответствующее лечение пациентов, так и предотвратить передачу HCV с кровью и продуктами крови или при близком личном контакте.
Краткое описание изобретения
Настоящее изобретение частично основано на открытии того, что отвечающие на HCV сывороточные антитела являются типично антикбровыми и анти-NS3 (хеликаза). Соответственно, изобретение связано с определением комплекса коревого антигена HCV и NS3-антитела, которое дает возможность обнаруживать как HCV-антигены, так и антитела, находящиеся в образце, с использованием отдельного твердого матрикса.
Таким образом, в одном из вариантов осуществления, предметом изобретения является твердая подложка для иммуноанализа, включающая в себя по меньшей мере одно HCV-антикоровое антитело и по меньшей мере один выделенный NS3/4a-эпитоп HCV, связанные с ней. Антитело и NS3/4а-эпитоп могут быть любыми из описанных здесь молекул. Кроме того, твердая подложка может включать в себя любой из описанных здесь слитых антигенов со множественными эпитопами, таких как слитый антиген со множественными эпитопами, включающий в себя аминокислотную последовательность, изображенную на фиг.7A-7F.
В определенных вариантах осуществления, твердая подложка включает в себя по меньшей мере два связанных с ней HCV-антикоровых антитела. Кроме того, антикоровое антитело может быть моноклональным антителом. К тому же NS3/4а-эпитоп может быть конформационным эпитопом, таким как конформационный NS3/4a-эпитоп, содержащий аминокислотную последовательность, изображенную на фиг.4A-4D.
В другом варианте осуществления, изобретение относится к твердой подложке для иммуноанализа, содержащей по меньшей мере два HCV-антикоровых моноклональных антитела и по меньшей мере один конформационный эпитоп NS3/4a HCV, содержащий аминокислотную последовательность, изображенную на фиг.4A-4D, связанные с ней.
В следующем варианте осуществления, изобретение относится к способу определения инфекции HCV в биологическом образце. Способ включает в себя в себя: (а) получение твердой подложки для иммуноанализа, как описано выше; (b) комбинирование биологического образца с твердой подложкой в условиях, которые позволяют HCV-антигенам и антителам, когда они присутствуют в биологическом образце, связываться по меньшей мере с одним антикоровым антителом и NS3/4a-эпитопом, соответственно; (с) добавление к твердой подложке со стадии (b) при комплексообразующих условиях (i) первого меченого антитела, где первое обнаруживаемое меченое антитело является антикоровым антителом HCV с обнаруживаемой меткой, где меченое антикоровое антитело направлено против другого коревого эпитопа HCV, чем по меньшей мере одно антикоровое антитело, связанное с твердой подложкой; (ii) антигена, который взаимодействует с HCV-антителом из биологического образца, реагирующим с NS3/4a-эпитопом и (iii) второго меченого антитела, где второе антитело с определяемой меткой может реагировать с антигеном (ii); и (d) определение комплексов, образованных между антителами и антигенами, если они присутствуют, в качестве указания на наличие инфекции HCV в биологическом образце. NS3/4a-эпитоп может быть конформационным эпитопом, таким как конформационный эпитоп, представленный последовательностью NS3/4a, изображенной на фигурах 4A-4D.
Еще в одном варианте осуществления, изобретение относится к,способу определения HCV инфекции в биологическом образце. Данный способ включает в себя в себя: (а) получение твердой подложки иммуноанализа как минимум с двумя связанными с ней антикоровыми антителами HCV, как было описано выше; (b) добавление биологического образца к твердой подложке в условиях, позволяющих антигенам и антителам HCV, в случае их присутствия в биологическом образце, связываться по меньшей мере с двумя антикоровыми антителами и NS3/4a-эпитопом, соответственно; (с) добавление к твердой подложке со стадии (b) в комплексообразующих условиях (i), первого антитела с обнаруживаемой меткой, где это первое антитело с обнаруживаемой меткой мечено обнаруживаемым образом антикоровым антителом HCV, где меченое антикоровое антитело направлено против иного коревого эпитопа HCV, чем антикоровые антитела, связанные с твердой подложкой; (ii) эпитопа из области с33с полипротеина HCV, соединенного с аминокислотной последовательностью hSOD; и (iii) второе антитело с обнаруживаемой меткой, где это второе антитело с обнаруживаемой меткой реагирует с аминокислотной последовательностью hSOD; и (d) определение комплексов, образованных между антителами и антигенами, если они присутствуют, в качестве указания на HCV-инфекцию в биологическом образце. NS3/4a-эпитоп может быть конформационным эпитопом, таким как конформационный эпитоп, представленный последовательностью NS3/4a, изображенной на фигурах 4A-4D.
В любом из вышеупомянутых вариантов осуществления, антикоровое антитело может быть направлено против N-концевой области HCV коревого антигена, такой как аминокислоты 10-53 HCV, пронумерованные относительно HCV1 полипротеиновой последовательности, и/или определяемо меченое HCV антикоровое антитело может быть направлено против С-концевой области HCV корового антигена, такого как аминокислоты 120-130 HCV, пронумерованные относительно HCV1 полипротеиновой последовательности. К тому же антиген, который реагирует с HCV-ангителом из биологического образца, может быть из NS3 области, например, эпитоп из с33с области полипротеина HCV, и может быть слит с аминокислотной последовательностью супероксиддисмутазы человека (hSOD). В этом варианте осуществления, второе антитело с обнаруживаемой меткой реагирует с аминокислотной последовательностью hSOD.
Еще в одном варианте осуществления изобретение направлено способ определения инфекции HCV в биологическом образце. Способ включает в себя в себя: (а) получение твердой подложки для иммунологического анализа, включающей в себя два HCV антикоровых моноклональных антитела и конформационный эпитоп, включающий в себя аминокислотную последовательность, изображенную на фигурах" 4A-4D; (b) добавление биологического образца к твердой подложке, в условиях, позволяющих антигенам и антителам HCV, когда они присутствуют в биологическом образце, связываться по меньшей мере с двумя антикбровыми антителами и NS3/4а конформационням эпитопом, соответственно; (с) добавление к твердой подложке со стадии (b) в комплексообразующих условиях (i) первого антитела с обнаруживаемой меткой, где это антитело с обнаруживаемой меткой обнаруживаемо помечено HCV антикоровым антителом, и где это антикоровое антитело с обнаруживаемой меткой направлено против другого коревого эпитопа HCV, чем как минимум два антикоровых антитела, связанных с твердой подложкой; (ii) эпитопа из области с33с полипротеина HCV, соединенного с аминокислотной последовательностью hSOD; и (iii) второго антитела с обнаруживаемой меткой, где это второе антитело с обнаруживаемой меткой реагирует с упомянутой аминокислотной последовательностью hSOD; (d) определение образующихся комплексов между антителами и антигенами, если они присутствуют, в качестве указания на присутствие HCV-инфекции в биологическом образце.
В некоторых вариантах осуществления, как минимум два антикоровых антитела направлены против N-концевой области коревого антигена HCV, например, против аминокислот 10-53 HCV, пронумерованных относительно полипротеина HCV1, и HCV-антикбровое антитело с обнаруживаемой меткой направлено против С-концевой области HCV коревого антигена, как, например, против аминокислот 120-130 HCV, пронумерованных относительно последовательности HCV1 полипротеина.
В следующем варианте осуществления, изобретение относится к способу определения HCV-инфекции в биологическом образце. Способ включает в себя: (а) получение твердой подложки для иммунологического анализа, которая включает в себя слитый антиген со множественными эпитопами; (b) комбинирование биологического образца с твердой подложкой в условиях, которые позволяют антигенам и антителам HCV, когда они присутствуют в биологическом образце, связываться по меньшей мере с одним антикоровым антителом, NS3/4a-эпитопом и слитым антигеном с множественными эпитопами; (с) добавление к твердой подложке со стадии (b) в комплексообразующих условиях (i) первого антитела с обнаруживаемой меткой, где это первое антитело с обнаруживаемой меткой является антикоровым антителом HCV с обнаруживаемой меткой, где это меченое антикоровое антитело направлено против другого HCV коревого эпитопа, чем по меньшей мере одно антикоровое антитело, связанное с твердой подложкой; (ii) первого и второго антигенов, которые реагируют с HCV-антителом из биологического образца, реагирующего с NS3/4a-эпитопом, и слитым антигеном со множественными эпитопами, соответственно; (iii) второго антитела с обнаруживаемой меткой, способного реагировать с антигенами из (ii); (d) определение комплексов, образовавшихся между антителами и антигенами, если они присутствуют, в качестве указания на присутствие инфекции HCV в биологическом образце.
Антикоровое антитело может быть направлено против N-концевой области HCV-корового антигена, и упомянутое первое HCV-антикоровое антитело с обнаруживаемой меткой может быть направлено против С-концевой области HCV-корового антигена, как описано выше. Кроме того, первый антиген, реагирующий с HCV-антителом из биологического образца, может включать в себя эпитоп из области с33с полипротеина HCV и может быть слит с аминокислотной последовательностью hSOD. Таким образом, второе определяемо меченое антитело реагирует с аминокислотной последовательностью hSOD. К тому же, второй антиген, реагирующий с HCV-антителом из биологического образца, может включать в себя эпитоп из с22 области полипротеина HCV, такой как эпитоп, включающий в себя аминокислоты Lys10-Ser99 долипротеина HCV, с делецией Аrg47 и заменой Trp на Leu в положении 44, пронумерованной относительно последовательности полипротеина HCV1. Эпитоп может быть слит с аминокислотной последовательностью hSOD. В этом случае второе антитело с обнаруживаемой меткой реагирует с аминокислотной последовательностью hSOD. Слитый антиген с множественными эпитопами может включать в себя аминокислотную последовательность, изображенную на фигурах 7A-7F.
Еще в одном варианте осуществления, изобретение относится к способу определения HCV инфекции в биологическом образце, причем указанный способ включает в себя: (а) получение твердой подложки для иммуноанализа, которая включает в себя два антикоровых моноклональных антитела HCV, NS3/4a-конформационный эпитоп HCV, включающий в себя аминокислотную последовательность, изображенную на фигурах 4A-4D, и слитый антиген с множественными эпитопами, содержащий аминокислотную последовательность, изображенную на фигурах 7A-7F, связанную с ним; (b) комбинирование биологического образца с твердой подложкой в условиях, которые позволяют антигенам и антителам HCV, когда они присутствуют в биологическом образце, связываться по меньшей мере с двумя антикоровыми антителами, NS3/4а конформационным эпитопом и слитым антигеном со множественными эпитопами, соответственно; (с) добавление к твердой подложке из стадии (b) при комплексообразующих условиях (i) первого антитела с обнаруживаемой меткой, где первое антитело с обнаруживаемой меткой является HCV антикоровым антителом с обнаруживаемой меткой, где меченое антикоровое антитело направлено против иного HCV-корового эпитопа, чем как минимум два антикоровых антитела, связанных с твердой подложкой; (ii) эпитопа из области с33с полипротеина HCV, слитого с аминокислотной последовательностью hSOD, и эпитопа из области с22 полипротеина HCV, слитого с аминокислотной последовательностью hSOD; и (iii) второго антитела с обнаруживаемой меткой, где указанное второе антитело с обнаруживаемой меткой способно реагировать с упомянутыми аминокислотными последовательностями hSOD; (d) определение комплексов, образующихся между антителами и антигенами, если они присутствуют, в качестве указания на присутствие HCV инфекции в биологическом образце.
В этом варианте осуществления, по меньшей мере два антикоровых антитела могут быть направлены против N-концевой области HCV-корового антигена, такой как аминокислоты 10-53 HCV, нумерованные относительно HCVl-полипротеина, и HCV-антикоровое антитело с обнаруживаемой меткой направлено против С-концевой области HCV-корового антигена, такой как аминокислоты 120-130 HCV, пронумерованные в соответствии с последовательностью полипротеина HVC1. К тому же, эпитоп из области с22 может включать в себя аминокислоты Lys10-Ser99, полипротеина HCV с делецией Аrg47 и заменой Trp на Leu в положении 44, пронумерованные соответственно с последовательностью полипротеина HVC1.
В других вариантах осуществления, изобретение относится к получению иммунодиагностического тестового набора, включающего в себя твердую подложку для иммуноанализа, описанную выше, и инструкции для проведения иммунодиагностического теста.
Еще в одном варианте осуществления, изобретение относится к способам получения твердой подложки для иммуноанализа, включающим в себя в себя: (а) получение твердой подложки; и (b) связывание с ней по меньшей мере одного HCV-антикорового антитела, например одного, двух или больше, и по меньшей мере одного выделенного NS3/4a-эпитопа HCV, и, необязательно, слитого антигена с множественными эпитопами. Антикоровые антитела, NS3/4a-эпитопы и слитые антигены с множественными эпитопами описаны выше.
В дополнительных вариантах осуществления, изобретение относится к слитому антигену со множественными эпитопами, включающему в себя в себя аминокислотную последовательность, изображенную на фигурах 7A-7F, или аминокислотную последовательность, идентичную ей по меньшей мере на 80%, например, идентичную на 90% или более и, кроме того, имеющего специфическую реакцию на анти-HVC антитела, находящиеся в биологическом образце от HCV-инфицированного субъекта. В определенных вариантах осуществления, слитый антиген с множественными эпитопами состоит из аминокислотной последовательности, изображенной на фигурах 5A-5F.
В последующих вариантах осуществления, изобретение относится к полинуклеотиду, включающему в себя кодирующую последовательность для вышеупомянутого слитого антигена со множественными эпитопами, рекомбинантным векторам, включающим в себя полинуклеотиды, клеткам-хозяевам, трансформированным рекомбинантными векторами, и способам получения рекомбинантного слитого антигена со множественными эпитопами, включающим в себя: (а) получение популяции вышеупомянутых клеток-хозяев; и (b) культурирование популяции клеток в условиях, при которых экспрессируется слитый антиген с множественными эпитопами, кодируемый кодирующей последовательностью, находящейся в рекомбинантном векторе.
Эти и другие аспекты настоящего изобретения станут очевидными при ознакомлении с нижеследующим детальным описанием и прилагаемыми чертежами.
Краткое описание чертежей.
Фигура 1 представляет собой графическое изображение генома HCV, изображающее различные области полипротеина, из которого получают реагенты для настоящего анализа (белки и антитела).
Фигура 2 представляет собой схематический рисунок иллюстративного комплекса антиген/антитело согласно изобретению.
На фигуре 3 изображена аминокислотная последовательность иллюстративного NS3/4a конформационного антигена, для использования в настоящих анализах. Выделенный жирным аланин в положении 182 заменяется природным серином, в норме находящимся в этом положении.
На фигурах 4A-4D изображают ДНК и соответствующую аминокислотную последовательность другого иллюстративного NS3/4a конформационного эпитопа для использования в настоящих анализах. Аминокислоты в положениях 403-404 фигур 4A-4D представляют собой замены Thr на Pro и Ser на Ile в природной аминокислотной последовательности HCV-1.
На фигуре 5 - диаграмма строения pd.HCV1a.ns3ns4aPI
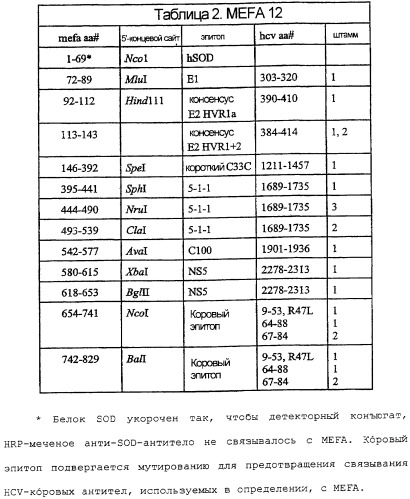
На фигуре 6 - графическое представление MEFA 12.
На фигурах 7A-7F изображены последовательность ДНК и соответствующая аминокислотная последовательность MEFA 12.
Фигура 8 является схематическим рисуноком иллюстративного иммунологического анализа согласно изобретению с использованием MEFA 12.
Подробное описание изобретения
В практическом применении настоящего изобретения будут использованы, если не указано иначе, обычные методы химии, биохимии, методики рекомбинации ДНК и иммунологии, в -пределах квалификации специалистов данной области. Такие методики полно представлены в литературе. См., например. Fundamental Virology, 2nd Edition, vol. I & II (B.N.Fields and D.M.Knipe, eds.); Handbook of Experimental Immunology, Vols. I-IV (D.M.Weir and C.C.Blackwell eds., Blackwell Scientific Publications); Т.Е.Creighton, Proteins: Structures and Molecular Properties (W.H.Freeman and Company, 1993); A.L.Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S.Colowick and N.Kaplan eds.. Academic Press, Inc.).
Необходимо отметить, что в данном описании и прилагаемой формуле изобретения формы единственного числа следует понимать во множественном числе, если содержание явно не диктует обратного. Так, например, «антиген» подразумевает смесь двух или более антигенов, и тому подобное.
В тексте использованы следующие сокращения названий аминокислот:
| Аланин: Ala (А) | Аргинин: Arg (R) |
| Аспарагин: Asn (N) | Аспарагиновая кислота: Asp (D) |
| Цистеин: Cys (С) | Глутамин: Gin (Q) |
| Глутаминовая кислота: Glu (E) | Глицин: Gly (G) |
| Гистидин: His (Н) | Изолейцин: Ile (I) |
| Лейцин: Leu (L) | Лизин: Lys (К) |
| Метионин: Met (М) | Фенилаланин: Phe (F) |
| Пролин: Pro (Р) | Серин: Ser (S) |
| Треонин: Thr (Т) | Триптофан: Trp (W) |
| Тирозин: Туг (Y) | Валин: Val (V) |
Определения
Ниже приводятся термины, используемые в описании настоящего изобретения, и их определения.
Термины «полипептид» и «белок» относятся к полимерам аминокислотных остатков и не ограничены минимальной длиной продукта. Таким образом, пептиды, олигопептиды, димеры, мультимеры и им подобное включены в это определение. Как полноразмерные белки, так и их фрагменты также включены в это определение.
Термины также включают в себя постэкспрессионные модификации полипептида, например гликозилрование, ацетилирование, фосфорилирование и им подобные. Кроме того, для целей данного изобретения, термин «полипептид» относится к белку, который содержит модификации в природной последовательности, такие как делеции, добавки или замены (как правило, консервативные по природе), до тех пор, пока этот белок сохраняет необходимую активность. Эти модификации могут быть созданы намеренно, например, при сайт-специфическом мутагенезе, или случайно, например, при мутациях у хозяина, продуцирующего белки, или ошибках ПЦР-амплификации.
Полипептид HCV является полипептидом, как определено выше, получаемым из полипротеина HCV. Нет необходимости в том, чтобы этот полипептид физически происходил из HCV, он может быть получен с помощью синтеза или рекомбинации. К тому же полипептид может быть получен из различных штаммов HCV, таких как штаммы HCV 1, 2, 3 или 4. У этих штаммов известен ряд сохраняющихся и вариабельных областей, и в целом аминокислотные последовательности эпитопов, происходящих из этих областей, будут иметь высокую степень гомологии последовательности, более 30%, предпочтительно более 40%, когда обе последовательности выровнены. Так, например, термин полипептид «NS3/4a» относится к природному NS3/4a любого из различных штаммов HCV, также как и аналоги NS3/4a, мутеины и иммуногенные фрагменты, как будет определено ниже. Известны полные генотипы многих из этих штаммов. См., например. Патент США №6150087 и GenBank поступление № AJ 238800 и AJ 238799.
Термины «аналог» и «мутеин» относятся к биологически активных производным базовой молекулы или фрагментов таких производных, которые сохраняют желаемую активность, такую как иммунореактивность в описанных здесь анализах. Обычно термин «аналог» относится к соединениям, имеющим природную полипептидную последовательность и структуру с одной или более аминокислотными вставками, заменами (обычно консервативными по природе) и/или делениями, по сравнению с природной молекулой, до тех пор, пока эти модификации не нарушают иммуногенной активности. Термин «мутеин» относится к пептидам, имеющим одну или более пептидных имитаций (пептоидов), таких, как описанные в Международной публикации № WO 091/04282. Предпочтительно, аналог или мутеин обладает по меньшей мере такой же иммуноактивностью, как и природная молекула. Способы создания аналогов и мутеинов полипептидов известны в данной области и описаны ниже.
Наиболее предпочтительные аналоги включают в себя замены, которые консервативны по природе, т. е. такие замены, которые происходят в пределах семейства аминокислот, родственного своими боковыми цепями. В частности, аминокислоты в целом разделены на четыре семейства: (1) кислотные - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, вполне предсказуемо, что изолированная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серии или подобная консервативная замена аминокислоты на структурно близкую аминокислоту не будет иметь большого эффекта на биологическую активность. Например, полипептид, представляющий интерес, может нести примерно до 5-10 консервативных и неконсервативных аминокислотных замен, или даже примерно до 15-25 консервативных или неконсервативных замен, или любое целое число между 5-25, при условии, что желаемая функция молекулы остается невредимой. Специалист в данной области может легко определить области в интересующей молекуле, допускающие замены, обратившись к схемам Hopp/Woods и Kyte-Doolittle, хорошо известным в данной области.
Термином «фрагмент» обозначен полипептид, состоящий только из части последовательности и структуры целого, полноразмерного полипептида. Этот фрагмент может включать в себя С-концевую делецию и/или N-концевую делецию природного полипептида. «Иммуногенный фрагмент» HCV - белка, в частности, обычно включает в себя не менее примерно 5-10 смежных аминокислотных остатков из полноразмерной молекулы, предпочтительно не менее 15-20 смежных аминокислотных остатков из полноразмерной молекулы, и наиболее предпочтительно - не менее примерно 20-50 или более смежных аминокислотных остатков из полноразмерной молекулы, определяющих эпитоп, или любое целое число от 5 аминокислотных остатков до полноразмерной последовательности, при условии, что рассматриваемый фрагмент сохраняет иммунореактивность в описанных здесь анализах. Например, предпочтительный иммуногенный фрагмент включает в себя, хотя и не ограничен ими, коровые фрагменты HCV, которые содержат, например, аминокислоты 10-45, 10-53, 67-88 и 120-130 полипротеина, эпитоп 5-1-1 (в NS3-области вирусного генома), также как и определенные эпитопы, полученные из областей Е1, Е2, с33с (NS3), c100 (NS4), NS3/4a и NS5 полипротеина HCV, a также любой из различных эпитопов, определенных в HCV-полипротеине. Например, см. Chien et al., Proc. Natl. Acad. Sci. USA (1992) 89:10011-10015; Chien et al., J. Gastroent. Hepatol. (1993) 8:S33-39; Chien et al., Международная публикация № WO 93/00365; Chien D. Y.,. Международная публикация № WO 94/01778; Патент США №6150087 и 6121020.
Термин «эпитоп», как он использован в данном описании, относится к последовательности, состоящей по меньшей мере примерно из 3-5 аминокислот, предпочтительно, примерно из 5-10 или 15, и не более, чем примерно из 1000 (или любое целое число в данном диапазоне), которые определяют последовательность, которая сама по себе или как часть большей последовательности связывается с антителом, которое генерируется в ответ на эту последовательность. Нет критического верхнего предела длины фрагмента, который может включать в себя почти полноразмерную белковую последовательность или даже слитый белок, включающий в себя два или больше эпитопов из полипротеина HCV. Эпитоп для использования в объекте изобретения не ограничен полипептидом, обладающим точной последовательностью той части родительского белка, из которой он был получен. Действительно, вирусные геномы находятся в состоянии постоянного изменения и содержат несколько вариабельных доменов, которые демонстрируют высокие уровни изменчивости между изолятами. Таким образом, термин «эпитоп» включает в себя как последовательности, идентичные природной последовательности, так и модификации природной последовательности, такие как делеции, вставки и замены (обычно консервативной природы).
Области данного полипептида, содержащие эпитоп, могут быть идентифицированы с использованием любого числа методик картирования эпитопов, хорошо известных в данной области. Например, см. Epitope Mapping Protocols in Methods in Molecular Bioligy, Vol. 66 (Glenn E. Morris, Ed., 1966) Humana Press, Totowa, New Jersey. В частности, линейные эпитопы можно определять с помощью, например, одновременного синтеза большого числа пептидов на твердых подложках, сопоставления этих пептидов с частями молекулы белка и проведения реакции этих пептидов с антителами, когда пептиды еще связаны с подложками. Подобные методики известны в данной области и описаны, в частности, Патент США 4,708,871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1985) Proc. Natl. Acad. Sci. USA 82:178-182; Geysen etal (1986) Molec. Immunol. 23:709-715. С использованием этой методики было определено число эпитопов HCV. Например, см. Chien et al., Viral Hepatitis and Liver Disease (1994) pp. 320-324, и далее ниже. Также конформационные эпитопы легко определяются при определении пространственной конформации аминокислот с помощью, например, рентгеновской кристаллографии и 2-мерного ядерного магнитного резонанса. Например, см. Epitope mapping protocol, supra. Антигенные области белка можно также определить, используя стандартные графики антигенности и гидропатии, такие как вычисляемые программой Omiga, версия 1.0, доступной в Oxford Molecular Group. В этой компьютерной программе используется метод Hopp/Woods, Hopp et al, Proc. Natl. Acad. Sci USA (1981) 78:3824-3828 для определения профилей антигенности, и методика Kyte-Doolittle, Kyte et al., J. Mol. Biol. (1982) 152:105-132 для графиков гидропатии.
Термин «конформационный эпитоп», используемый здесь, означает часть полноразмерного белка, или аналог, или мутеин, обладающий' природными структурными свойствами аминокислотной последовательности, кодирующей эпитоп в полноразмерном природном белке. Природные структурные свойства включают в себя, не ограничиваясь ими, гликозилирование и трехмерную структуру. Длина последовательности, определяющей эпитоп, может широко варьировать, так как считается, что эпитопы формируются трехмерной формой антигена (например, складчатостью). Таким образом, аминокислоты, определяющие эпитоп, могут быть сравнительно малочисленны, но широко рассеяны по длине молекулы (или даже разных молекул, в случае димеров и т.п.) и собираться в правильную конформацию эпитопа за счет складчатости. Части антигена между остатками, определяющими эпитоп, могут быть несущественными для конформационной структуры эпитопа. Например, делеция или замена этих промежуточных последовательностей может не влиять на последовательности, создающие конформационный эпитоп, необходимые для сохранения конформации эпитопа (например, цистеин, участвующий в дисульфидной связи; участки гликолизирования и т.д.).
Конформационный эпитоп, находящийся в - области NS3/4a, надежно определяется с использованием способов, обсуждаемых выше. Кроме того, присутствие или отсутствие конформационного эпитопа в данном полипептиде можно легко определить с помощью скрининга интересующего антигена с антителом (поликлональным сывороточным или моноклональным к конформационному эпитопу), и сравнения его реакционной способности с денатурированной версией антигена, который сохраняет только линейные - эпигоны (если есть). В подобном скрининге с использованием поликлональных антител можно вначале абсорбировать поликлональную сыворотку денатурированным антигеном и посмотреть, остались ли антитела к интересующему антигену. Кроме того, в случае NS3/4a, молекула, которая сохраняет природную конформацию, будет также обладать ферментативной активностью протеазы и, необязательно, хеликазы. Эти активности можно определить с помощью ферментативных анализов, как будет описано ниже.
Предпочтительно, конформационный эпитоп получают путем рекомбинации, и он выделяется клеткой, из которой он может быть извлечен в условиях, которые сохраняют его желаемые структурные особенности, т.е. без денатурации эпитопа. Эти клетки включают в себя клетки бактерий, дрожжей, насекомых и млекопитающих. Выделение и изоляция рекомбинантных конформационных эпитопов из полипротеина HCV описана, в частности, в Международных публикациях №№ WO 96/04301, WO 94/01778, WO 95/33053, WO 92/08734. В качестве альтернативы, можно выделять антигены и затем ренатурировать белок после выделения. Также понятно, что химический синтез также позволяет получать мимитопы конформационного антигена, которые перекрестно реагируют с конформационным эпитопом «природного» антигена.
Термин «слитый антиген с множественными эпитопами», или "MEFA", используемый здесь, означает полипептид, в котором множественные антигены HCV являются частью единой, непрерывной цепи аминокислот, которая не встречается в природе. HCV-антигены могут быть соединены непосредственно друг с другом пептидными связями или могут быть разделены промежуточными аминокислотными последовательностями. Слитые антигены могут также содержать последовательности, экзогенные по отношению к полипротеину HCV. Более того, присутствующие последовательности HCV могут происходить из разнообразных генотипов и/или изолятов HCV. Примеры конкретных МЕРА для использования в настоящих иммунологических анализах детализированы, например, в Международной публикации № WO 97/44469 и описаны ниже.
«Антитело» означает молекулу, которая по химическим или физическим причинам специфически связывается с представляющим интерес полипептидом. Таким образом, HCV-коровое антитело является молекулой, которая специфически связывается с HCV коровым белком. Термин «антитело», как он использован здесь, включает в себя антитела, полученные как из поликлональных, так и моноклональных препаратов, так же, как следующее: гибридные (химерные) молекулы антител (см., например. Winter et al. (1991) Nature 349: 293-299; Патент США №4816567); F(ab')2- и F(ab)-фрагменты, Fv-молекулы (не-ковалентные гетеродимеры, см., например, Inbar et ai. (1972) Proc Nati Acad Scl USA 69:2659-2662; and Ehrlich et al. (1980) Biochem 19:4091-4096); одноцепочечные Fv молекулы (sFv) (см.,например, Huston et ai. (1988) Proc Nati Acad Sci USA 85:5879-5883); димерные и гримерные конструкции фрагментов антител, минитела (см., например. Pack et al. (1992) Blochem 31:1579-1584; Cumber et al. (1992) J Immunology 1498:120-126); гумманизированные молекулы антител (см., например, Riechmann et al. (1988) Nature 332: 323-327; Verhoeyan et al. (1988) Science 239:1534-1536; и Патентная публикация Англии № GB 2276169, опубликованная 21 сентября 1994 г.); и любые функциональные фрагменты, полученные из таких молекул, которые сохраняют иммунологические связывающие свойства родительской молекулы антитела.
Термин «моноклональное антитело», как он используется здесь, относится к композиции антител, имеющих гомогенную популяцию антител. Этот термин не ограничен ни видом или источником антител, ни способом их получения. Так, этот термин включает в себя антитела, полученные из мышиных гибридом, так же, как и моноклональные антитела, полученные при использовании скорее человеческих, чем мышиных гибридом. Например, см., Cote, et al. Monclonal Antibodies and Cancer Therapy, Alan R. Liss, 1985, p. 77.
«Рекомбинантный» белок -