Производные оксадиазола, обладающие противоопухолевым действием, лекарственное средство, их содержащее, и способ лечения
Иллюстрации
Показать всеИзобретение относится к новым сульфонамидным производным, обладающим противоопухолевой активностью, а именно к соединениям формулы (I′)
(I/)
где R6 означает гидроксил, R7 означает метил, изопропил, изобутил, бензил или индол-3-илметил, R8 означает водород, R9 означает фенилен, R10 означает тиенил, фурил или пиридил, необязательно замещенный низшим алкилом или галогеном; к их производным или фармацевтически приемлемым солям или сольватам. Описаны лекарственные средства для лечения или предупреждения рака и для профилактики метастазирования, а также описан способ лечения рака у млекопитающего. 4 н. и 1 з.п. ф-лы, 17 табл.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции для лечения или профилактики онкологических заболеваний, содержащей в качестве активного ингредиента сульфонамидное производное, включающее оксадиазольный цикл.
Уровень техники
Межклеточный матрикс, включающий коллаген, фибронектин, ламинин, протеогликан и т.п., выполняет опорную функцию для всех видов тканей, а также играет важную роль в миграции, дифференциации, адгезии или в других процессах в клетке. Металлопротеиназы, которые являются протеазами, содержащими в активном центре ион металла, прежде всего, матриксные металлопротеиназы (ММП), принимают участие в деградации межклеточного матрикса. Известно множество ММП, от ММП-1 до ММП-23.
В литературе описан ингибитор ММП, обладающий противоопухолевыми свойствами (см. статьи Chem. Rev., 99, 2735-2776 (1999); Current Pharmaceutical Design, 5, 787-819 (1999) и др.).
Известно также, что у пациентов с онкологическими заболеваниями наблюдается повышенный уровень активности ММП-2 и ММП-9 (см. статьи Cancer Research, 53, 878-883 (1993) и Cancer Research, 53, 5365-5369 (1993)).
Известно, что ММП-9 продуцируется имунными клетками, такими, как макрофаги и лимфоциты, и этот процесс регулируется цитокинами (см. статьи Journal of Immunology, 4159-4165 (1996) и Journal of Immunology, 2327-2333 (1997)). Принято считать, что ММП-9 включается в процесс в тот момент, когда клетка, такая как макрофаг и лимфоцит, разрушает клеточный матрикс для того, чтобы подойти к очагам воспаления или развития опухоли. Соответственно, предполагается, что сильное ингибирование ММП-9 может снизить иммунный ответ.
Как описано в WO 99/04780, сульфонамидное производное, содержащее оксадиазольный цикл, обладает ингибирующим действием в отношении ММП.
Кроме того, известны другие сульфонамидные производные, обладающие ингибирующим действием в отношении ММП.
Описание изобретения
Как описано выше, в настоящее время ведется разработка соединений, обладающих ингибирующим действием в отношении ММП, которые могут найти применение в качестве противоопухолевых агентов. Однако существует необходимость в разработке ингибитора ММП, который в качестве лекарственного средства обладает более высокой эффективностью и оказывает меньшее побочное действие.
Заявители настоящего изобретения показали, что некоторые сульфонамидные производные, содержащие оксадиазольный цикл, могут найти применение в качестве высокоэффективного и безопасного противоопухолевого агента.
Настоящее изобретение относится
1) к фармацевтической композиции для терапии и профилактики онкологического заболевания, содержащей в качестве активного ингредиента соединение общей формулы (I), пролекарство, фармацевтически приемлемую соль или сольват
где
R1 означает NHOH, гидрокси или (низш.)алкилокси,
R2 означает водород, необязательно замещенный (низш.)алкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,
R3 означает водород, необязательно замещенный (низш.)алкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,
R4 означает необязательно замещенный арилен или необязательно замещенный гетероарилен,
R5 означает необязательно замещенный арил, необязательно замещенный гетероарил или необязательно замещенную неароматическую гетероциклическую группу.
Более конкретно, изобретение относится к объекту изобретения, описанному в следующих пунктах 2)-6).
2) Соединение формулы (I')
где
R6 означает NHOH, гидрокси или (низш.)алкилокси,
R7 означает водород, метил, изопропил, изобутил, бензил или индол-3-илметил,
R8 означает водород или необязательно замещенный (низш.)алкил,
R9 означает фенилен или 2,5-тиофендиил,
R10 означает необязательно замещенный тиенил, необязательно замещенный фурил или необязательно замещенный пиридил, его пролекарство или фармацевтически приемлемая соль или сольват.
3) Соединение формулы
или
где
его пролекарство или фармацевтически приемлемая соль или сольват.
4) Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение, описанное в пунктах 2) или 3).
5) Фармацевтическая композиция по пункту 4) в качестве агента для терапии или профилактики онкологического заболевания.
6) Фармацевтическая композиция по пункту 4) в качестве агента для профилактики метастазирования.
7) Применение соединения по пункту 2) или 3) для получения лекарственного средства для терапии опухолевого заболевания.
8) Способ лечения опухолевого заболевания у млекопитающего введением млекопитающему, включая человека, терапевтически эффективного количества соединения по пункту 2) или 3).
Термин (низш.)алкил, используемый в настоящем описании отдельно или в различных сочетаниях, означает прямую или разветвленную одновалентную углеводородную группу, содержащую от 1 до 8 атомов углерода. Примеры алкильной группы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, н-октил, и т.п. Предпочтителен C1-С6алкил, более предпочтителен C1-С3алкил.
Термин (низш.)алкенил, используемый в настоящем описании, означает прямую или разветвленную одновалентную углеводородную группу, содержащую от 2 до 8 атомов углерода и одну или более двойную связь. Примеры алкенильной группы включают винил, аллил, пропенил, кротонил, изопентенил, различные изомеры бутенила и т.п. Предпочтителен С2-С6алкенил, более предпочтителен С2-С4алкенил.
Термин (низш.)алкинил, используемый в настоящем описании, означает прямую или разветвленную одновалентную углеводородную группу, содержащую от 2 до 8 атомов углерода и одну или более тройную связь. Алкинил может содержать одну или несколько двойных связей. Примеры алкинильной группы включают этинил, 2-пропинил, 3-бутинил, 4-пентинил, 5-гексинил, 6-гептинил, 7-октинил и т.п. Предпочтителен С2-С6алкинил, более предпочтителен С2-С4алкинил.
Термин циклоалкил, используемый в настоящем описании, включает циклоалкильную группу, содержащую от 3 до 8 атомов углерода. Примеры циклоалкильной группы включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Предпочтителен С3-С6циклоалкил.
Термин арил, используемый в настоящем описании отдельно или в сочетании в другими терминами, включает моноциклические или конденсированные циклические ароматические углеводороды. Примеры арильной группы включают фенил, 1-нафтил, 2-нафтил, антрил и т.п.
Термин аралкил, используемый в настоящем описании, означает вышеупомянутый (низш.)алкил, замещенный одной или более вышеупомянутыми арильными группами в любом возможном положении. Примеры аралкильной группы включают бензил, фенетил (например, 2-фенетил), фенилпропил (например, 3-фенилпропил), нафтилметил (например, 1-нафтилметил и 2-нафтилметил), антрилметил (например, 9-антрилметил) и т.п. Предпочтительны бензил и фенилэтил.
В случае R2 или R3 предпочтительным арилалкилом является бензил. Термин гетероарил, используемый в настоящем описании отдельно или в сочетании с другими терминами, включает 5-6-членную ароматическую гетероциклическую группу, содержащую в цикле один или более гетероатомов, выбранных из группы, включающей атомы кислорода, серы и азота, которая может быть конденсирована с циклоалкилом, арилом, неароматической гетероциклической группой и другим гетероарилом по любому возможному положению. Примерами гетероарильной группы являются пирролил (например, 1-пирролил, 2-пирролил, 3-пирролил), фурил (например, 2-фурил, 3-фурил), тиенил (например, 2-тиенил, 3-тиенил), имидазолил (например, 2-имидазолил, 4-имидазолил), пиразолил (например, 1-пиразолил, 3-пиразолил), изотиазолил (например, 3-изотиазолил), изоксазолил (например, 3-изоксазолил), оксазолил (например, 2-оксазолил), тиазолил (например, 2-тиазолил), пиридил (например, 2-пиридил, 3-пиридил, 4-пиридил), пиразинил (например, 2-пиразинил), пиримидил (например, 2-пиримидил, 4-пиримидил), пиридазинил (например, 3-пиридазинил), тетразолил (например, 1H-тетразолил), оксадиазолил (например, 1,3,4-оксадиазолил), тиадиазолил (например, 1,3,4-тиадиазолил), индолизинил (например, 2-индолизинил, 6-индолизинил), изоиндолил (2-изоиндолил), индолил (например, 1-индолил, 2-индолил, 3-индолил), индазолил (например, 3-индазолил), пуринил (например, 8-пуринил), хинолизинил (например, 2-хинолизинил), изохинолил (например, 3-изохинолил), хинолил (например, 3-хинолил, 5-хинолил), фталазинил (например, 1-фталазинил), нафтиридинил (например, 2-нафтиридинил), хиноланил (например, 2-хиноланил), хиназолинил (например, 2-хиназолинил), циннолинил (например, 3-циннолинил), птеридинил (например, 2-птеридинил), карбазолил (например, 2-карбазолил, 3-карбазолил), фенантридинил (например, 2-фенантридинил, 3-фенантридинил), акридинил (например, 1-акридинил, 2-акридинил), дибензофуранил (например, 1-дибензофуранил, 2-дибензофуранил), бензимидазолил (например, 2-бензимидазолил), бензизоксазолил (например, 3-бензизоксазолил), бензоксазолил (например, 2-бензоксазолил), бензоксадиазолил (например, 4-бензоксадиазолил), бензизотиазолил (например, 3-бензизотиазолил), бензотиазолил (например, 2-бензотиазолил), бензофурил (например, 3-бензофурил), бензотиенил (например, 2-бензотиенил) и т.п.
В случае R2 предпочтительным гетероарилом являются индолил и имидазолил.
В случае R5 предпочтительным гетероарилом являются тиенил, пиридил, дибензофуранил, изоксазолил, тетразолил и пиролил. Более предпочтительным является 2-тиенил.
Термин гетероарилалкил, используемый в настоящем описании, включает вышеупомянутый (низш.)алкил, замещенный одной или более вышеупомянутыми гетероарильными группами в любом возможном положении. Примерами гетероарилалкила являются тиазолилметил (например, 4-тиазолилметил), тиазолилэтил (например, 5-тиазолил-2-этил), бензотиазолилметил (например, (бензотиазол-2-ил)метил), индолилметил (например, индол-3-илметил), имидазолилметил (например, имидазол-5-илметил), бензотиазолилметил (например, 2-бензотиазолилметил), индазолилметил (например, 1-индазолилметил), бензотриазолилметил (например, 1-бензотриазолилметил), бензохинолилметил (например, 2-бензохинолилметил), бензимидазолилметил (например, 2-бензимидазолилметил), пиридилметил (например, 4-пиридилметил) и т.п.
В случае R2 предпочтительным гетероарилалкилом являются индол-3-илметил и имидазол-5-илметил.
Термин неароматическая гетероциклическая группа, используемый в настоящем описании отдельно или в сочетании с другими терминами, включает 5-7-членное неароматическое кольцо, содержащее в цикле один или более гетероатомов, выбранных из группы, включающей атомы кислорода, серы и азота, и конденсированный цикл, который связан с двумя или более неароматическими кольцами. Примерами неароматической гетероциклической группы являются пирролидинил (например, 1-пирролидинил, 2-пирролидинил), пирролинил (например, 3-пирролинил), имидазолидинил (например, 2-имидазолидинил), имидазолинил (например, имидазолинил), пиразолидинил (например, 1-пиразолидинил, 2-пиразолидинил), пиразолинил (например, пиразолинил), пиперидинил (пиперидино, 2-пиперидинил), пиперазинил (например, 1-пиперазинил), индолинил (например, 1-индолинил), изоиндолинил (например, изоиндолинил), морфолинил (например, морфолино, 3-морфолинил), 4Н-1,2,4-оксазол-5-он, 1,2,3,4-тетрагидро-1,8-нафтиридин и т.п.
В случае R5 предпочтительной неароматической гетроциклической группой являются пиразолидинил, пиперидинил, пирролинил и морфолинил.
Термин арилен, используемый в настоящем описании, означает двухвалентную группу вышеупомянутого арила. Примерами арилена являются фенилен, нафтилен и т.п., прежде всего, 1,2-фенилен, 1,3-фенилен, 1,4-фенилени т.п. Предпочтителен 1,4-фенилен.
Термин гетероарилен, используемый в настоящем описании, означает двухвалентную группу вышеупомянутого гетероарила. Примерами гетероарилена являются тиофендиил, фурандиил, пиридиндиил и т.п., прежде всего, 2,5-тиофендиил, 2,5-фурандиил и т.п. Предпочтителен 2,5-тиофендиил.
Термин (низш.)алкокси, используемый в настоящем описании, означает метилокси, этилокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси и т.п. Предпочтительны метилокси, этилокси, н-пропилокси, изопропилокси и н-бутилокси, более предпочтительны метилокси и этилокси.
Термин ацил, используемый в настоящем описании отдельно или в сочетании в другими терминами, включает алкилкарбонил, в котором алкильная группа означает вышеупомянутый (низш.)алкил, и арилкарбонил, в котором арильная группа означает вышеупомянутый арил. Примерами ацильной группы являются ацетил, пропионил, бензоил и т.п.(Низш.)алкил и арил могут быть соответственно замещены нижеописанными заместителями.
Термин галоген, используемый в настоящем описании, означает фтор, хлор, бром и иод. Предпочтительны фтор, хлор и бром.
Термин (низш.)алкилтио, используемый в настоящем описании, означает метилтио, этилтио и т.п.
Термин (низш.)алкилоксикарбонил, используемый в настоящем описании, означает метилоксикарбонил, этилоксикарбонил, н-пропилоксикарбонил, изопропилоксикарбонил и т.п.
Термин галоген(низш.)алкил, используемый в настоящем описании отдельно или в сочетании в другими терминами, включает вышеупомянутый (низш.)алкил, замещенный вышеупомянутым галогеном в положении 1-8, предпочтительно в положении 1-5. Примерами галоген(низш.)алкильной группы являются трифторметил, трихлорметил, дифторэтил, трифторэтил, дихлорэтил, трихлорэтил и т.п. Предпочтителен трифторметил.
Примерами термина галоген(низш.)алкилокси, используемого в настоящем описании, являются трифторметилокси и т.п.
Примерами термина (низш.)алкилсульфонил, используемого в настоящем описании, являются метилсульфонил, этилсульфонил и т.п. Предпочтителен метилсульфонил.
Примерами термина ацилокси, используемого в настоящем описании, являются ацетилокси, пропионилокси, бензоилокси и т.п.
Термин замещенный амино, используемый в настоящем описании отдельно или в сочетании в другими терминами, включает аминогруппу, замещенную одним или двумя вышеупомянутыми группами: (низш.)алкил, аралкил, гетероарилалкил или ацил. Примерами необязательно замещенной аминогруппы являются метиламино, диметиламино, этилметиламино, диэтиламино, бензиламино, ацетиламино, бензоиламино и т.п. Предпочтительны метиламино, диметиламино, этилметиламино, диэтиламино и ацетиламино.
Примерами термина замещенный аминокарбонил, используемого в настоящем описании, являются метиламинокарбонил, диметиламинокарбонил, этилметиламинокарбонил, диэтиламино карбонил и т.п. Предпочтителен диэтиламинокарбонил.
В настоящем описании заместителями в необязательно замещенной (низш.)алкильной группе являются циклоалкил, гидрокси, (низш.)алкилокси, меркапто, (низш.)алкилтио, галоген, нитро, циано, карбокси, (низш.)алкилоксикарбонил, галоген(низш.)алкил, галоген(низш.)алкилокси, незамещенный или замещенный амино, незамещенный или замещенный аминокарбонил, ацил, ацилокси, необязательно замещенная неароматическая гетероциклическая группа, арилокси (например, фенилокси), аралкилокси (например, бензилокси), (низш.)алкилсульфонил, гуанидино, азогруппа, необязательно замещенный уреид (например, уреид, N'-метилуреид) и т.п. Указанные заместители могут находиться в одном или более любых возможных положений.
В настоящем описании заместителями в необязательно замещенном арилене, необязательно замещенном гетероарилене, необязательно замещенном ариле, необязательно замещенном гетероариле, необязательно замещенной неароматической гетероциклической группе, необязательно замещенном аралкиле, необязательно замещенном гетероарилалкиле, необязательно замещенном тиениле, необязательно замещенном пиридиле и необязательно замещенном фуриле являются необязательно замещенный (низш.)алкил, циклоалкил, (низш.)алкенил, (низш.)алкинил, гидрокси, (низш.)алкилокси, меркапто, (низш.)алкилтио, галоген, нитро, циано, карбокси, (низш.)алкилоксикарбонил, галоген(низш.)алкил, галоген(низш.)алкилокси, незамещенный или замещенный амино, незамещенный или замещенный аминокарбонил, ацил, ацилокси, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенная неароматическая гетероциклическая группа, необязательно замещенный аралкил, (низш.)алкилсульфонил, гуанидиногруппа, азогруппа или необязательно замещенный уреид (например, уреид, N'-метилуреид) и т.п. Указанные заместители могут находиться в одном или более любых возможных положений.
В случае R4 предпочтительными незамещенными группами являются необязательно замещенный арилен и необязательно замещенный гетероарилен. Указанными заместителями являются галоген, нитро, циано, (низш.)алкилокси и т.п.
В случае R5 предпочтительными заместителями в необязательно замещенном ариле, необязательно замещенном гетероариле и необязательно замещенной неароматической гетероциклической группе являются (низш.)алкил, гидрокси(низш.)алкил, гидрокси, (низш.)алкилокси, (низш.)алкилтио, галоген, нитро, карбокси, галоген(низш.)алкил, галоген(низш.)алкилокси, незамещенный или замещенный амино, незамещенный или замещенный аминокарбонил и т.п. Более предпочтительными заместителями являются галоген и (низш.)алкил.
Если R5 означает необязательно замещенный арил, предпочтительными являются незамещенный арил или арил, замещенный галогеном или (низш.)алкилом.
В случае R10 предпочтительными заместителями в необязательно замещенном тиениле, необязательно замещенном пиридиле и необязательно замещенном фуриле являются (низш.)алкил и галоген.
В случае R10 общей формулы (I') предпочтительны 2-тиенил или 2-тиенил, замещенный (низш.)алкилом или галогеном в положении 5.
Предпочтительным является соединение общей формулы (I'), где R6 означает гидрокси, R7 означает метил или изопропил, R8 означает водород, R9 означает 2,5-фенилен, R10 означает гидрокси, незамещенный фенил или фенил, замещенный в положении 4 галогеном или (низш.)алкилом.
Предпочтительные варианты осуществления изобретения
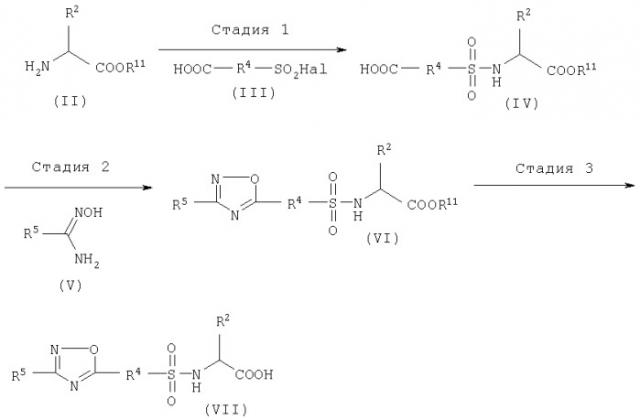
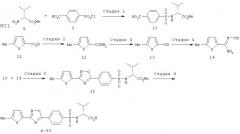
Соединение (I) по изобретению может быть синтезировано по методике, описанной в WO 97/27174, или как показано ниже на схеме.
Схема 1
где R2, R4 и R5 имеют значения, указанные выше, Hal означает галоген, R11 является защитной группой по карбоксильной группе.
Стадия 1
Эта стадия представляет собой способ получения сульфонамидного производного (IV) из исходного соединения (II). Способ можно проводить аналогично тому, как описано в WO 97/27174 (метод А, стадия 1).
Стадия 2
Эта стадия представляет собой способ образования оксадиазольного цикла по реакции соединения (IV) с соединением (V).
Соединение (IV) растворяют в диглиме, толуоле и т.п., а затем к реакционной смеси при температуре от 0°С до 30°С, предпочтительно от 0°С до 20°С, добавляют оксалилхлорид и N,N-диметилформамид, а затем реакционную смесь перемешивают предпочтительно в течение от 60 до 120 мин. К раствору соединения (V) в диглиме и толуоле при охлаждении льдом добавляют раствор ацилхлорида, полученного как описано выше, а затем реакционную смесь перемешивают при температуре от 0°С до 110°С в течение от 2 до 18 ч, предпочтительно в течение от 2 до 3 ч. Соединение (VI) получают после обычной обработки реакционной смеси.
Стадия 3
Эта стадия представляет собой способ получения соединения (VII) из соединения (VI) удалением защитной группы с карбоксильной группы.
Удаление защитной группы проводят известным методом, описанными в монографии "Protective Groups in Organic Chemistry, Theodora W. Green (John Wiley&Sons)" и т.п.
Термин "соединения по настоящему изобретению", используемый настоящем описании, включает фармацевтически приемлемую соль и сольват указанного соединения. Примерами являются соли с щелочным металлом (например, литием, натрием и калием), щелочно-земельным металлом (например, магнием и кальцием), аммонием, органическим основанием, аминокислотой, минеральной кислотой (например, хлористоводородной кислотой, бромистоводородной кислотой, фосфорной кислотой и серной кислотой) или органической кислотой (например, уксусной кислотой, лимонной кислотой, малеиновой кислотой, фумаровой кислотой, бензолсульфоновой кислотой и пара-толуолсульфоновой кислотой) и сольваты указанных солей с растворителем. В качестве сольвата предпочтителен гидрат. Указанные соли и сольваты могут быть получены обычными методами. Гидрат может связывать координационной связью произвольное количество молекул воды.
Настоящее изобретение включает пролекарство соединения по изобретению. Пролекарство является производным соединения по настоящему изобретению, содержащим группу, которая может быть удалена химическим или биохимическим способом, и такое пролекарство благодаря сольволизу или трансформации в физиологических условиях in vivo превращается в фармацевтически активное соединение по настоящему изобретению. Выбор способа и технологии получения соответствующего производного пролекарства описан в литературе, такой, как Design of Prodrugs, Elsevier, Amsterdam (1985). Если соединения по настоящему изобретению содержат карбоксильную группу, примерами пролекарств является производное в виде сложного эфира, полученного при взаимодействи исходного кислотного соединения с соответствующим спиртом, или в виде амида, полученного при взаимодействии исходного кислотного соединения с соответствующим амином. Прежде всего, в качестве пролекарств предпочтительными сложными эфирами являются метиловый эфир, этиловый эфир, н-пропиловый эфир, изопропиловый эфир, н-бутиловый эфир, изобутиловый эфир, трет-бутиловый эфир, морфолинэтиловый эфир, N,N-диэтилгликольамидоэфир и т.п. Если соединения по настоящему изобретению содержат гидроксильную группу, примерами пролекарств являются ацилоксипроизводные, полученные при взаимодействии с соответствующим ацилгалогенидом или ангидридом. Прежде всего, в качестве пролекарств предпочтительными ацилоксипроизводными являются -ОСОС2Н5, -ОСО-трет-Bu, -OCOC15H31, -ОСО(мета-COONa-Ph), -OCOCH2CH2COONa, -OCOCH(NH2)CH3 и -ОСОСН2Н(СН3)2 и т.п. Если соединения по настоящему изобретению содержат аминогруппу, примерами пролекарств является производное в виде амид, полученного при взаимодействии с галоидангидридом или ангидридом соответствующей кислоты. Прежде всего, в качестве пролекарств предпочтительными амидами являются -NHCO(CH2)20CH3, -NHCOCH(NH2)CH3 и т.п.
Соединение по настоящему изобретению не ограничивается какими-либо конкретными изомерами, а включает все возможные изомеры и рацемические смеси.
Соединение по настоящему изобретению обладает селективной ингибирующей активностью в отношении ММП-2 и противоопухолевой активностью, как показано ниже в примерах.
Кроме того, соединение по настоящему изобретению обладает относительно низкой степенью связывания с белком, присутствует в высокой концентрации в крови и не ингибирует фермент Р-450. Следовательно оно обладает удовлетворительными свойствами для применения в качестве лекарственного средства.
При введении соединения по настоящему изобретению пациенту с целью лечения опухолевого заболевания его можно вводить пероральным способом в виде порошка, гранул, таблеток, капсул, пилюль или в жидкой форме, или парентеральным способом в виде инъекций, суппозиториев, средств для чрескожного введения, вдуванием и т.п. Эффективное количество соединения по изобретению перерабатывают, если необходимо, смешиванием с соответствующей лекарственной добавкой, такой, как эксципиент, связывающий агент, смачивающее вещество, дезинтегрирующие вещества, замасливатель и т.п. При изготовлении препаратов для инъекций соединение по изобретению и соответствующий носитель стерилизуют.
Соответствующая дозировка изменяется в зависимости от состояния пациента, способа введения, возраста пациента и массы тела. При пероральном введении взрослым дозировка обычно составляет от 0,01 до 100 мг/кг/сут, предпочтительно от 0,1 до 20 мг/кг/сут.
Настоящее изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
В примерах используют следующие сокращения.
Me - метил
Et - этил.
n-Pr - н-пропил
i-Pr - изопропил
n-Bu - н-бутил
i-Bu - изобутил
t-Bu - трет-бутил
Ph - фенил
Bn - бензил
ДМСО - диметилсульфоксид
ПРИМЕРЫ
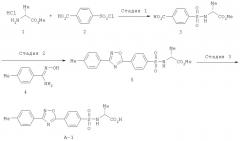
Пример 1
Получение соединения А-1
Схема 2
Стадия 1
К раствору гидрохлорида метилового эфира D-валина (1) (8,2 г, 40,8 ммоля) в воде (100 мл) при охлаждении льдом добавляли карбонат натрия (8,65 г) и ацетон (80 мл). К полученной смеси добавляли воду (50 мл), 4-хлорсульфонилбензойную кислоту (2) (6 г, 27,2 ммоля) и реакционную смесь перемешивали при охлаждении льдом в течение 2 ч. Затем реакционную смесь выливали в охлажденную льдом 2 М соляную кислоту и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из этилацетата (или ацетона)/гексана получали соединение (3) (6,2 г, 79,3%), tпл. 197-199°С.
ИК (KBr, υмакс см-1): 3500-2500, 3296, 3259, 1739, 1718, 1689, 1344, 1171.
1H ЯМР (ДМСО-d6, част./млн): 1,88 (d, J 7,2 Гц, 3Н), 3,42 (s, 3H), 3,94 (m, 1H), 7,88 (d, J 8,4 Гц, 2Н), 8,11 (d, J 8,4 Гц, 2Н), 8,52 (d, J 8,7 Гц, 1Н), 13,35 (ушир.s, 1H).
[α]D+23,1±1,2 (с 0,507, ДМСО, 23°С).
Элементный анализ для С11Н13NO6S:
рассч.: С 45,99, Н 4,56, N 4,88, S 11,16,
найд.: С 45,57, Н 4,40, N 4,87, S 11,10.
Стадия 2
К раствору соединения (3) (23,61 г, 82,2 ммоля) в диглиме (240 мл) добавляли оксалилхлорид (8,60 мл, 98,6 ммоля), N,N-диметилформамид (0,2 мл), и реакционную смесь перемешивали при комнатной температуре в течение 80 мин. К раствору соединения (4) (12,34 г, 82,2 ммоля), пиридина (20 мл, 247 ммолей) и диглима (130 мл) при охлаждении льдом добавляли раствор ацилхлорида, полученный как описано выше, и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч и при 110°С в течение 1 ч. Реакционную смесь охлаждали до 40°С в течение 1 ч, супернатант выливали в ледяную воду (400 мл) и смесь перемешивали в течение 1 ч. Полученные кристаллы отделяли фильтрованием, промывали водой, а затем растворяли в этилацетате. Органический слой последовательно промывали 2 М соляной кислотой (100 мл), насыщенным водным раствором гидрокарбоната натрия (100 мл) и солевым раствором (100 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из этилацетата/гексана получали соединение (5) (22,64 г, 68,6%), tпл. 148-150°C.
ИК (KBr, νмакс.см-1): 3440. 3284, 1743, 1346, 1169, 1133.
1H ЯМР(CDCl3, част./млн): 1,43 (d, J 7,2 Гц, 3Н), 2,44 (s, 3Н), 3,57 (s, 3H), 4,08 (m, 1H), 5,35 (d, J 8,4 Гц, 1Н), 7,33 (d, J 8,1 Гц, 2Н), 8,03 (d, J 9,0 Гц, 2Н), 8,06 (d, J 8,1 Гц, 2Н), 8,36 (d, J 9,0 Гц, 2Н).
[α]D+17,8±1,2 (с 0,505, ДМСО, 24°С).
Элементный анализ для C19H19N3O5S:
рассч.: С 56,84, Н 4,77, N 10,47, S 7,99,
найд.: С 57,21, Н 4,77, N 10,61, S 7,89.
Стадия 3
К раствору соединения (5) (22,64 г, 56,50 ммоля) в диметилсульфоксиде (230 мл) при комнатной температуре добавляли 1 М раствор гидроксида натрия (141 мл) и реакционную смесь перемешивали в течение 18 ч. Полученный раствор натриевой соли фильтровали, промывали этилацетатом (100 мл), выливали в охлажденную льдом 2 М соляную кислоту (100 мл) и дважды экстрагировали этилацетатом/тетрагидрофураном (10:1, 300 мл, 200 мл). Органический слой промывали солевым раствором (2×200 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении.
После перекристаллизации остатка из этанола/воды получали соединение (6) (17,70 г, 81,0%), tпл. 200-203°C. ИК (KBr, νмакс см-1): 3240, 1726, 1346, 1151.
1H ЯМР (ДМСО-d6, част./млн): 1,20 (d, J 7,5 Гц, 3Н), 2,41 (s, 3H), 3.87 (m, 1H), 7,43 (d, J 8,1 Гц, 2Н), 8,01 (d, J 8,1 Гц, 2Н), 8,04 (d, J 8,1 Гц, 2Н), 8,36 (d, J 8,1 Гц, 2Н), 8,48 (m, 1H), 12,80 (ушир.s, 1H).
[α]365-12,2±1,0 (с 0,502, ДМСО, 24°С).
Элементный анализ для C18H17N3O5S:
рассч.: С 55,80, Н 4,42, N 10,85, S 8,28,
найд.: С 55,52, Н 4,46, N 10.81, S 8,23.
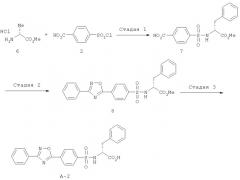
Пример 2
Получение соединения А-2
Схема 3
Стадия 1
К раствору гидрохлорида метилового эфира D-валина (6) (18,12 г, 84 ммоля) в воде (100 мл) при охлаждении льдом добавляли 2 М водный раствор карбоната натрия (61,25 мл), 4-хлорсульфонилбензойную кислоту (2) (16,09 г, 70 ммолей) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь выливали в охлажденную льдом 2 М соляную кислоту и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из ацетона/гексана получали соединение (7) (21,56 г, 84,8%), tпл. 188-189°C.
ИК (KBr, νмакс см-1): 3280, 2956, 1737, 1691, 1428, 1346, 1284, 1166, 723.
1H ЯМР (ДМСО-d6, част./млн): 2,77 (dd, J 9,3, 13,5 Гц, 1Н), 2,94 (dd, J 5,7, 13,5 Гц, 1Н), 3,37 (s, 3Н), 4,01 (dt, J 6,0, 9,0 Гц, 1Н), 7,08-7,23 (m, 5H), 7,66 (d, J 8,4 Гц, 2Н), 7,97 (d, J 8,4 Гц, 2Н), 8,69 (d, J 9,0 Гц, 1H), 13,38 (ушир.s, 1H).
[α]D+3,2±0,9 (с 0,505, ДМСО, 24°С).
Элементный анализ для C17H17NO6S:
рассч.: С 56,19, Н 4,72, N 3,85, S 8,82,
найд.: С 56,06, Н 4,57, N 3,93, S 8,75.
Стадия 2
К раствору соединения (7) (20,0 г, 55 ммоля) в диглиме (200 мл) добавляли оксалилхлорид (5,67 мл, 66 ммолей), N,N-диметилформамид (0,2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. К раствору бензамидоксима (7,49 г, 55 ммолей) и диглима (75 мл), помещенному в другой реакционный сосуд, при охлаждении льдом добавляли пиридин (14,1 мл, 165 ммолей), а затем также при охлаждении льдом раствор ацилхлорида, полученный, как описано выше, и реакционную смесь перемешивали при указанной температуре в течение 1 ч и при 110°С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, супернатант выливали в ледяную воду (400 мл) и смесь перемешивали в течение 20 мин. Полученный осадок отделяли фильтрованием, промывали диэтиловым эфиром и после перекристаллизации из ацетона/гексана получали соединение (8) (16,5 г, 64,9%), tпл. 160-161°C.
ИК (KBr, νмакс см-1): 3338, 1745, 1342, 1169.
1H ЯМР (CDCl3, част./млн): 2,99-3,14 (m, 2Н), 3,56 (s, 3Н), 4,29 (m, 1H), 5,19 (d, J J 9,0 Гц, 1H), 7,05-7,09 (m, 2H), 7,23-7,26 (m, 3H), 7,51-7,56 (m, 3H), 7,89 (d, J 8,7 Гц, 2H), 8,16-8,19 (m, 2H), 8,27 (d, J 8,7 Гц, 2Н).
[α]D-6,8±0,9° (с 0,509, ДМСО, 24°С).
Элементный анализ для C24H21N3O5S:
рассч.: С 62,19, Н 4,57, N 9,07, S 6,92,
найд.: С 62,02, Н 4,52, N 8,95, S 6,96.
Стадия 3
К раствору соединения (7) (4,41 г, 9,51 ммоля) в диметилсульфоксиде (85 мл) при комнатной температуре добавляли 1 М водный раствор гидроксида натрия (28,5 мл) и реакционную смесь перемешивали в течение 24 ч. Полученную натриевую соль фильтровали, выливали в охлажденную льдом 2 М соляную кислоту (100 мл) и экстрагировали этилацетатом/тетрагидрофураном. Органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из этанола/воды получали соединение (8) (3,80 г, 88,8%), tпл. 221-222°C.
ИК (KBr, νмакс см-1): 3286, 1720, 1350, 1167.
1H ЯМР(ДМСО-d6, част./млн): 2,74 (dd, J 9,6, 13,6 Гц, 1Н), 3,00 (dd, J 5,0, 13,8 Гц, 1H), 4,00 (m, 1H), 7,02-7,22 (m, 5H), 7,56-7,72 (m, 2H), 7,79 (d, J 7,8 Гц, 2H), 8,13 (m, 2H), 8,21 (d, J 8,4 Гц, 2H), 8,63 (d, J 8,4 Гц, 1H), 12,86 (ушир.s, 1H).
[α]D+1,6±0,9° (с 0,502, ДМСО, 24,5°С).
Элементный анализ для C23H19N3O5S:
рассч.: С 61,46, Н 4,26, N 9,35, S 7,13,
найд.: С 61,40, Н 4,15, N 9,41, S 7,16.
Пример 93
Получение соединения А-93
Схема 4
Стадия 1
К раствору карбоната натрия (14,4 г, 135,9 ммоля) в ацетоне (100 мл) и воде (100 мл) при комнатной температуре добавляли гидрохлорид метилового эфира D-валина (9) (9,1 г, 54,3 ммоля), 4-хлорсульфонилбензойную кислоту (2) (10,0 г, 45,3 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Затем реакционную смесь выливали в охлажденную льдом 2 М соляную кислоту и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из этилацетата/гексана (1:3) получали соединение (10) (9,84 г, 68,8%), tпл. 213-215°С.
ИК (KBr, νмакс см-1): 3268, 2965, 1737, 1691, 1430, 1344, 1284, 1168.
1H ЯМР (ДМСО-d6, част./млн): 0,80 (t, J 6,6 Гц, 6Н), 1,93 (m, 1H), 3,34 (s, 3Н), 3,60 (dd, J 7,2, 9,3 Гц, 1H), 7,24-7,89 (m, 2H), 8,06-8,11 (m, 2H), 8,47 (d, J 9,3 Гц, 1Н).
[α]D+7,6±1,0 (с 0,502, ДМСО, 25°С).
Элементный анализ для С13Н17NO6S·0,1 H2O:
рассч.: С 49,23, Н 5,47, N 4,42, S 10,11,
найд.: С 49,17, Н 5,36, N 4,39, S 10,30.
Стадия 2
К раствору 5-метилтиофен-2-карбоновой кислоты (11) (20,3 г, 143 ммоля) в тетрагидрофуране (200 мл) при охлаждении льдом добавляли N,N-диметилформамид (0,1 мл), оксалилхлорид (18,4 мл, 211 ммолей) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Затем реакционную смесь выливали в охлажденный льдом 28%-ный водный раствор гидроксида аммония и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из этилацетата/гексана (1:3) получали соединение (12) (19,61 г, 97,3%), tпл. 162-163°С.
ИК (KBr, νмакс см-1): 3374, 3170, 1658, 1608, 1469, 1396, 1376.
1H ЯМР (ДМСО-d6, част./млн): 2,45 (s, 3Н), 6,81 (dd, J 1,2, 3,9 Гц, 1H), 7,27 (ушир.s, 1H), 7,53 (d, J 3,9 Гц, 1H), 7,84 (ушир.s, 1H).
Элементный анализ для С6Н7NOS:
рассч.: С 51,04, Н 5,00, N 9,92, S 22,71,
найд.: С 50,93, Н 4,86, N 9,81, S 22,67.
Стадия 3
К суспензии соединения (12) (19,0 г, 135 ммолей) в толуоле (76 мл) добавляли тионилхлорид (49,0 мл, 675 ммолей) и реакционную смесь перемешивали при 100°С в течение 7 ч. Затем реакционную смесь выливали в охлажденный льдом насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученное маслообразное соединение (13) (22 г) использовали на следующей стадии без очистки.
1H-ЯМР (CDCl3, част./млн): 2.54 (d, J 0,6 Гц, 3Н), 6,78 (m, 1H), 7,44 (d, J 3,3 Гц, 1Н).
Стадия 4
К суспензии соединения (13) (22 г) и хлорида гидроксиламмония (11,3 г, 163 ммолей) в этаноле (160 мл) при комнатной температуре добавляли триэтиламин (22,6 мл, 163 ммолей) и реакционную смесь перемешивали при 100°С в течение 2 ч. Этанол удаляли при пониженном давлении, к остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. После перекристаллизации остатка из этилацетата/гексана (1:3) получали соединение (14) (11,32 г, 53,6% в расчете на две стадии).
ИК (KBr, νмакс см-1): 3390, 3072, 1643, 1585, 1492, 1390, 1371, 931, 808.
1H ЯМР (ДМСО-d6, част./млн): 2,39 (s, 3Н), 5,82 (s, 2H), 6,45 (dt, J 3,3, 0,9 Гц, 1H), 7,24 (d, J 3,3 Гц, 1H), 9,52 (s, 1H).
Элементный анализ для C6H8N2OS:
рассч.: С 46,13, Н 5,16, N 17,93, S 20,53,
найд.: С 46,09, Н 5,05, N 17,87, S 20,69.
Стадия 5
К суспензии соединения (10) (9,80 г, 31,1 ммоля) в диглиме (100 мл) при комнатной температуре добавляли оксалилхлорид (3,30 мл, 98,6 ммоля), N,N-диметилформамид (1,0 мл) и реакционную смесь перемешивали в течение 2 ч. К раствору соединения (14) (4,85 г, 31,1 ммоля), пиридина (7,50 мл, 92,7 ммоля) и диглима (50 мл) при охлаждении льдом добавляли раствор ацилхлорида, полученного, как описано выше, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч и при 110°С в течение 4 ч. Реакционную смесь выдерживали при комнатной температуре в течение ночи. Супернатант выливали в ледяную воду (400 мл), полученный кристалличес