Способы и композиции для ингибирования размножения вич-1
Иллюстрации
Показать всеИзобретение относится к области вирусологии. Предложены различные композиции, способные индуцировать выработку антител против Tat ВИЧ-1, что может ингибировать размножение ВИЧ-1. Также предложены способ индукции антител против Tat ВИЧ-1. in vitro способ определения присутствия и титра антител, способ снижения уровней вируса ВИЧ-1, синтетическая последовательность нуклеиновой кислоты и синтетическая молекула. Предложенная группа изобретений может быть использована для ингибирования размножения ВИЧ-1 у инфицированных пациентов и для ослабления размножения ВИЧ-1 после первичного заражения и у ранее неинфицированных индивидуумов. 19 н. и 20 з.п. ф-лы, 3 ил., 9 табл.
Реферат
Область, к которой относится изобретение
В общих чертах настоящее изобретение относится к композициям и способам, которые могут быть использованы для ингибирования размножения вируса иммунодефицита человека-1 (ВИЧ-1) у инфицированных пациентов с симптомами или без симптомов и для ослабления размножения ВИЧ-1 после первичного заражения у ранее неинфицированных индивидуумов в целях минимизации прогрессирования СПИДа.
Предпосылки создания изобретения
Различные методы лечения инфекций, вызываемых вирусом иммунодефицита человека типа 1 (ВИЧ-1), направлены на трансактивирующий ген (tat) ВИЧ-1, который продуцирует белок (Tat), играющий важную роль в транскрипции этого вируса. Ген tat и его белок были секвенированы и исследованы на предполагаемую возможность их использования для лечения ВИЧ-инфекций [см., например, патенты США №№5158877, 5238882 и 5110802; Международные патентные заявки №№ WO 92/07871, WO 91/10453, WO 91/09958 и WO 87/02989, опубликованные 14 мая 1992, 25 июля 1991, 11 июля 1991 и 21 мая 1987, соответственно]. Белок Tat высвобождается из клетки, что делает возможным его поглощение другими инфицированными клетками с усилением транскрипции ВИЧ-1 в этих клетках и неинфицированными клетками с изменением активации генов клетки-хозяина. Tat сообщает этим клеткам восприимчивость к инфицированию указанным вирусом. Уровень поглощения Tat клетками очень высок и, как сообщалось, опосредуется короткой основной последовательностью указанного белка [S.Fawell et al., Proc. Natl. Acad. Sci., USA, 91:664-668 (1994)].
Ведутся интенсивные исследования по иммунизации с использованием белка Tat ВИЧ-1 в качестве потенциальной вакцины против СПИДа. В опубликованных исследованиях последовательность Tat ВИЧ-1 HXB/LAV была использована в качестве иммуногена или в качестве рекомбинантного белка [A.Cafaro et al., Nat. Med., 5:643-650 (1999)], ДНК-вакцины [S.Calarota et al., Lancet. 351:1320-5 (1998)], инактивированного белка (Tat-токсоида) [S.S. Cohen et al., Proc. Natl. Acad. Sci., USA, 96(19):10842-10847 (1999)], A. Gringeri et al., J. Hum. Virol. 1:293-8 (1998)] или ДНК-вакцины, экспрессирующей неактивный Tat [E.Caselli et al., J.Immunol., 162:5631-5638 (1999)]. Иммуннизация полноразмерной последовательностью Tat индуцировала как клеточный, так и гуморальный иммунитет. См. также M.C. Rhe et al., J. Acquir. Immune. Defic. Syndr. Hum. Virol. 10:408-416 (1995); C.J. Li et al., Proc. Natl. Acad. Sci. USA, 94:8116-8120 (1997) и другие].
Международная патентная заявка № WO 92/14755, опубликованная 3 сентября 1992, относится к белку Tat и к рецептору клеточной поверхности - интегрину, способному связываться с белком Tat. Были идентифицированы две последовательности Tat, связывающиеся с интегрином: -Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg- [SEQ ID NO: 1], а также Gly-Arg-Gly-Asp-Ser-Pro- [SEQ ID NO: 2]. Эти последовательности представляют собой основную область или домен, который является доминантным сайтом связывания с интегрином. В описании указанной заявки продемонстрировано, что ряд пептидов, соответствующих этим последовательностям Tat, и соответствующие интегрины блокируют in vitro-связывание клеток с Tat-сенсибилизированными планшетами так же, как и антитела против соответствующих интегринов. Однако в указанном описании также показано, что эти реагенты не блокируют поглощение функционального Tat клетками (см., пример 9 в WO92/14755), что делает неэффективным предложенный механизм действия для терапевтического лечения ВИЧ-инфекции. Последовательности Tat, описанные в указанной Международной заявке, отличаются от пептидных иммуногенов настоящего изобретения.
Как моноклональные, так и поликлональные антитела против белка Tat, были легко продуцированы у животных и было показано, что они блокируют поглощение белка Tat in vitro [см., например, работы D.Brake et al., J.Virol., 64:962 (1990); D.Mann et al., EMBO J. 10, 1733 (1991); J. Abraham et al.; P.Auron et al.; работу M.Jaye et al.; G.Zauli et al., цитируемые выше]. В более поздних работах было показано, что моноклональные или поликлональные антитела против белка Tat, добавленные в среду с тканевой культурой, ослабляли ВИЧ-1-инфекцию in vitro [работа L.Steinaa et al., Arch. Virol. 139:263 (1994); М.Re et al., цитируемая выше; и G.Zauli et al., J. Acq. Imm. Def. Syndr. Hum. Retrovirol., 10:306 (1995)].
В публикациях авторов настоящей заявки [G. Goldstein, Nature Med. 2:960 (1996) и Международная патентная заявка №WO95/31999, опубликованная 30 ноября 1995] приводятся данные, свидетельствующие о том, что секреция белка Tat ВИЧ-1 из инфицированных клеток и его поглощение как инфицированными, так и неинфицированными клетками играет важную роль в инфекционности ВИЧ-1. Предшествующие исследования также показали, что антитела против белка Tat блокировали in vitro поглощение Tat и ингибировали инфекционность in vitro. Было высказано предположение, что активная иммунизация животных индуцирует образование антител против белка Tat ВИЧ-1, используемого в качестве потенциальной вакцины против СПИДа. См. также G. Goldstein et al., «Minimization of chronic plasma viremia in rhesus macaques immunized with synthetic HIV-1 Tat peptides and infected with a chimeric simian/human immunodeficiency virus (SHIV33)», Vaccine, 18:2789 (2000).
В других публикациях автора настоящего изобретения (Международная патентная заявка №WO99/02185, опубликованная 21 января 1999, и патент США №5891994, выданный 6 апреля 1999 (обе эти работы вводятся в настоящее описание посредством ссылки)) была предложена новая концепция лечения и предупреждения ВИЧ-1-инфекции, предусматривающая использование последовательностей Tat, которые распознавались иммунной системой кроликов как эпитопы. В отличие от предшествующих работ, обсуждаемых выше, эти публикации относятся к терапевтическим и иммуногенным комбинациям, требующим присутствия, по крайней мере, двух, а предпочтительно, всех четырех пептидов или полипептидов Tat, включающих последовательности «эпитопа I», охватывающие следующие аминокислотные остатки 4 (или 5) - 10 Tat: -Asp-Pro-Х7-Leu-Glu-Pro- [SEQ ID NO: 3] или R1-Val-Asp-Pro-Х7-Leu-Glu-Pro-R2 [SEQ ID NO: 4], где Х7 представляет Arg, Lys, Ser или Asn. Такие композиции индуцируют антитела, реагирующие с большинством белков Tat ВИЧ-1, и ингибируют размножение ВИЧ-1. В соответствии с указанной публикацией, в эту композицию могут быть добавлены некоторые другие последовательности Tat, которые включают пептид или полипептид «эпитопа II», охватывающего аминокислотные остатки 41-50 Tat формулы R3-Lys-Х42-Leu-Gly-Ile-Ser-Tyr-Gly-Arg-Lys-R4 [SEQ ID NO: 5], где Х42 выбран из группы, состоящей из Gly или Ala. Альтернативно, в эту композицию могут быть добавлены пептид или полипептид «эпитопа III», охватывающего аминокислотные остатки 56-62 Tat формулы R5-Arg-Arg-Х58-Z59-A60-Y61-Ser-R6 [SEQ ID NO: 6], где Х58 выбран из группы, состоящей из Ala, Pro, Ser и Gln; Y61 выбран из группы, состоящей из Asp, Asn, Gly и Ser; Z59 выбран из группы, состоящей из Pro и His; а A60 выбран из группы, состоящей из Gln и Pro. Кроме того, альтернативно, в эту композицию могут быть добавлены пептид или полипептид «эпитопа IV», охватывающего аминокислотные остатки 62-73 Tat формулы R7-Ser-Gln-Х64-His-Gln-Y67-Ser-Leu-Ser-Lys-Gln-Pro-R8 [SEQ ID NO: 7], где Х64 выбран из группы, состоящей из Asn и Thr; Y67 выбран из группы, состоящей из Ala и Val. Сама эта композиция может быть использована для индуцирования антител против большого числа последовательностей Tat, характеризующих множественные варианты ВИЧ-1. Указанные композиции или генерированные антитела используют в качестве вакцины или для профилактического лечения, направленного против указанных множественных вариантов.
Несмотря на накопленные знания о распространении заболеваний, ассоциированных с ВИЧ-1, необходимость в разработке композиций и способов как для профилактического, так и для терапевтического лечения ВИЧ-1-инфекций, которые позволяли бы снижать уровни вируса ВИЧ-1 в целях лечения и возможного предупреждения последующего, в основном, смертельного заболевания СПИДа, остается актуальной.
Краткое описание изобретения
В одном из своих аспектов настоящее изобретение относится к композиции, включающей, по крайней мере, два варианта пептида или полипептида эпитопа I формулы R1-Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12-R2 [SEQ ID NO: 8], где Y7 выбран из группы, состоящей из Arg, Lys, Ser и Asn; Х9 выбран из группы, состоящей из Glu и Asp; Z12 выбран из группы, состоящей из Lys и Asn; R1 выбран из группы, состоящей из водорода, низшего алкила, низшего алканоила и последовательности примерно из 1-5 аминокислот, необязательно замещенной низшим алкилом или низшим алканоилом; R2 выбран из группы, состоящей из свободного гидроксила, амида и последовательности примерно из 1-5 дополнительных аминокислот, необязательно замещенной амидом. В этой композиции, по крайней мере, один из двух вариантов должен иметь формулу, где Y7 представляет Arg, а Z12 представляет Lys, а, по крайней мере, второй из двух вариантов должен иметь формулу, где Y7 представляет Asn и Z12 представляет Asn. Каждый пептид этой композиции распознается иммунной системой приматов как эпитоп I Tat ВИЧ-1. Эта формула позволяет конструировать и использовать ряд пептидных комбинаций.
В другом аспекте настоящего изобретения вышеописанная композиция, кроме того, содержит один или несколько дополнительных пептидов или полипептидов, которые представляют собой другие аминокислотные последовательности, соответствующие аминокислотным остаткам 5-12 Tat ВИЧ-1. Эти необязательные аминокислотные последовательности подробно описаны ниже. Эти последовательности, предпочтительно, происходят от штамма ВИЧ-1, имеющего вариантный белок Tat в указанной области.
В другом своем аспекте настоящее изобретение относится к описанной выше композиции, содержащей пептиды или полипептиды, которая содержит, по крайней мере, два необходимых пептида эпитопа I, распознаваемых иммунной системой приматов (а предпочтительно, другие пептиды эпитопа I) в комбинации с одним или несколькими эпитопами II, III и/или IV Tat ВИЧ-1. Эпитопы II, III и IV представляют собой пептиды Tat ВИЧ-1, формулы которых представлены в публикации Международной патентной заявки №WO99/02185, которая вводится в настоящее описание посредством ссылки. Такие композиции могут объединять соответствующие пептиды Tat ВИЧ-1, так чтобы эти композиции индуцировали образование антител, реагирующих примерно более чем с 95% всех известных белков Tat ВИЧ-1.
В еще одном своем аспекте настоящее изобретение относится к композиции антител, включающей, по крайней мере, одно антитело, предпочтительно генерированное у примата, которое специфически связывается с пептидом или полипептидом формулы R1-Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12-R2 [SEQ ID NO: 8], где Y7 выбран из группы, состоящей из Arg, Lys, Ser и Asn; Х9 выбран из группы, состоящей из Glu и Asp; Z12 выбран из группы, состоящей из Lys и Asn; R1 выбран из группы, состоящей из водорода, низшего алкила, низшего алканоила и последовательности примерно из 1-5 аминокислот, необязательно замещенной низшим алкилом или низшим алканоилом; R2 выбран из группы, состоящей из свободного гидроксила, амида и последовательности примерно из 1-5 дополнительных аминокислот, необязательно замещенной амидом. Указанная композиция антител предпочтительно содержит, по крайней мере, два антитела, то есть одно антитело, которое связывается с вариантом эпитопа I, где Y7 представляет собой Arg, а Z12 представляет собой Lys, и, по крайней мере, второе антитело, которое связывается со вторым вариантом эпитопа I, где Y7 представляет собой Asn и Z12 представляет собой Asn. В эту композицию могут быть также включены другие антитела, направленные не на указанные два конкретных варианта, а на другие варианты. Такие антитела в указанной композиции связываются с последовательностями эпитопа I, распознаваемыми иммунной системой приматов, где указанный эпитоп присутствует на множестве вариантов белков Tat ВИЧ-1. Эти антитела включают ряд конструкций антител, таких как моноклональные антитела, которые более подробно описаны ниже.
В еще одном своем аспекте настоящее изобретение относится к антителу, в частности к моноклональному антителу, которое специфически связывается с распознаваемым иммунной системой приматов эпитопом белка Tat ВИЧ-1, причем указанный эпитоп включает аминокислотную последовательность -Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12- [SEQ ID NO: 9], где Y7, Х9 и Z12 определены выше.
В еще одном своем аспекте настоящее изобретение относится к композиции антител, содержащей, по крайней мере, одно антитело, распознающее пептидную последовательность эпитопа II -Lys-Х42-Leu-Gly-Ile-Ser-Tyr-Gly-Arg-Lys [SEQ ID NO: 10], где Х42 представляет собой Gly или Ala и где указанный эпитоп отличается от эпитопа -Leu-Gly-Ile-Ser-Tyr-Gly-Arg-Lys [SEQ ID NO: 11], распознаваемого ранее описанными антителами. Предпочтительно, указанные композиции включают одно антитело, которое распознает пептид, где Х42 представляет собой Gly, и пептид, где Х42 представляет собой Ala. Указанные антитела вырабатываются предпочтительно у приматов. Эти антитела в указанной композиции связываются с последовательностями эпитопа II, распознаваемыми иммунной системой приматов, где указанный эпитоп присутствует на множестве вариантов белков Tat ВИЧ-1. Эти антитела включают ряд конструкций антител, которые более подробно описаны ниже.
В еще одном своем аспекте настоящее изобретение относится к антителу, а предпочтительно, к моноклональному антителу, которое распознает пептидную последовательность эпитопа II -Lys-Х42-Leu-Gly-Ile-Ser-Tyr-Gly-Arg-Lys- [SEQ ID NO: 10], где Х42 представляет Gly или Ala и где указанный эпитоп отличается от эпитопа -Leu-Gly-Ile-Ser-Tyr-Gly-Arg-Lys- [SEQ ID NO: 11], распознаваемого ранее описанными антителами.
В еще одном своем аспекте настоящее изобретение относится к рекомбинантному или синтетическому гену, который последовательно кодирует пептид или полипептид, содержащий, по крайней мере, два варианта пептида или полипептида эпитопа I формулы R1-Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12-R2 [SEQ ID NO: 8], определенной выше. В этом синтетическом гене, по крайней мере, один из двух вариантов должен иметь формулу, где Y7 представляет собой Arg и Z12 представляет собой Lys, а, по крайней мере, второй из двух вариантов должен иметь формулу, где Y7 представляет собой Asn и Z12 представляет собой Asn. Этот синтетический ген необязательно содержит карбокси-концевой пептид эпитопа II, распознаваемый иммунной системой приматов. Альтернативно, рекомбинантный или синтетический ген содержит семь или восемь предпочтительных аминокислотных последовательностей эпитопа I, распознаваемых иммунной системой приматов и идентифицированных ниже. Синтетический ген может содержать каждую аминокислотную последовательность, отделенную спейсерной последовательностью, либо он может экспрессировать каждый пептид/полипептид считывания вместе с белком-носителем с сохранением открытой рамки считывания. Указанный синтетический ген может быть отделен от белка-носителя спейсером в том случае, если этот спейсер присоединен к последовательности эпитопа I, распознаваемой иммунной системой приматов, в результате чего последовательность эпитопа II будет находиться у карбокси-конца рекомбинантного белка. Другие варианты осуществления изобретения включают множество пептидов эпитопа I вышеуказанных формул, присоединенных друг к другу и к белку-носителю.
В еще одном своем аспекте настоящее изобретение относится к синтетической молекуле, например к вектору, содержащему вышеописанный синтетический ген, функционально присоединенный к регуляторным последовательностям нуклеиновой кислоты, которые направляют и регулируют экспрессию продукта синтетического гена в клетке-хозяине.
В другом своем аспекте настоящее изобретение относится к рекомбинантному микроорганизму, например к вирусу или бактерии-комменсалу, которые содержат вышеописанный синтетический ген или синтетическую молекулу. Указанный микроорганизм способен экспрессировать в хозяине множество копий продукта указанного гена или указанной молекулы.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции, используемой для индукции выработки антител, которые реагируют с большим числом известных белков Tat ВИЧ-1, например, с более чем 95%, а предпочтительно, с более чем 99% известных белков Tat. Эти индуцированные антитела могут ингибировать размножение ВИЧ-1. Указанная фармацевтическая композиция включает, по крайней мере, одну из композиций, содержащих рекомбинантные или синтетические пептиды/полипептиды, описанные выше; или синтетический ген/синтетическую молекулу, описанные выше; или рекомбинантный микроорганизм, описанный выше, в фармацевтически приемлемом носителе.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции, которая может быть использована для ингибирования размножения ВИЧ-1, где указанная композиция содержит вышеописанную композицию антител или композицию моноклональных антител.
В еще одном своем аспекте настоящее изобретение относится к способу снижения уровней вируса ВИЧ-1, предусматривающему введение человеку или другому примату антитело-индуцирующих фармацевтических композиций, описанных выше и активно индуцирующих выработку антител, которые реагируют с большинством белков Tat ВИЧ-1, и ингибирующих размножения указанного вируса in vivo. Этот способ может быть применен к ВИЧ-1-инфицированному индивидууму с компетентной иммунной системой или к неинфицированному или хронически инфицированному индивидууму, но не имеющему симптомов заболевания. Указанный способ позволяет индуцировать выработку антител, которые реагируют с белками Tat ВИЧ-1 и уменьшают размножение вируса во время любого начального острого заражения вирусом ВИЧ-1 и которые, кроме того, минимизируют хроническую виремию, приводящую к СПИДу.
В другом своем аспекте настоящее изобретение относится к способу снижения уровней вируса ВИЧ-1 путем введения фармацевтической композиции, содержащей вышеописанные композиции антител, человеку, не способному вырабатывать эффективный или быстрый иммунный ответ на ВИЧ-1-инфекцию. Этот способ может предусматривать постоянное введение указанной композиции.
В других своих аспектах настоящее изобретение относится к способам продуцирования композиций, описанных выше, а также к клеткам-хозяевам, трансфецированным указанными композициями.
В еще одном своем аспекте настоящее изобретение относится к набору для измерения и детекции титров и специфичностей антител, индуцированных путем иммунизации композициями, описанными выше. Набор настоящего изобретения, предпочтительно, включает два необходимых пептида эпитопа I, описанных выше, а также дополнительные пептиды эпитопа I, распознаваемые иммунной системой приматов, и возможно дополнительные пептиды эпитопов II-IV, и сенсибилизированные твердые носители, меченый реагент для детекции связывания антител с этими пептидами, разнообразные субстраты и устройство для стимуляции или детекции сигналов, вырабатываемых метками, а также стандартное устройство для взятия проб крови, соответствующие сосуды и другие компоненты диагностического анализа.
В другом своем аспекте настоящее изобретение относится к способу детекции титров и оценки картины реактивности антител у индивидуумов, иммунизованных композициями настоящего изобретения. Указанный способ включает стадии инкубирования разведений биологической жидкости индивидуума, например, сыворотки, с плоскостями или сферами, на которых связываются один или несколько пептидов последовательностей эпитопа I настоящего изобретения, и необязательно эпитопов II-IV, отмывки несвязанных биологических материалов, и измерения уровня связывания любого антитела с пептидами с использованием меченого реагента, например античеловеческого иммуноглобулина, с которым ассоциируется данный фермент. В зависимости от типа используемой метки сигнал, продуцируемый этой меткой, может быть индуцирован путем последующего добавления субстрата, который реагирует с данным ферментом, например может быть индуцировано изменение окраски. В этот аналитический набор могут быть также введены и другие стандартные метки.
Другие аспекты и преимущества настоящего изобретения представлены ниже в более подробном описании предпочтительных вариантов его осуществления.
Краткое описание графического материала
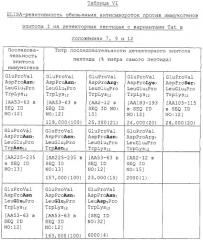
На фиг.1А представлен график ELISA-титров кроличьей антисыворотки против более крупных линейных пептидов эпитопа I на усеченных детекторных пептидах, где указанные титры выражены как процент максимального связывания с более крупными пептидами. N- или С-концевые аминокислоты соответствующих детекторных пептидов указаны ниже каждого столбца однобуквенным кодом.
На фиг.1В представлен график ELISA-титров антисыворотки приматов против более крупных линейных пептидов эпитопа I на усеченных детекторных пептидах, где указанные титры выражены как процент максимального связывания с более крупными пептидами. N- или С-концевые аминокислоты соответствующих детекторных пептидов указаны ниже каждого столбца однобуквенным кодом.
На фиг.2А представлен график ELISA-титров кроличьей антисыворотки против линейных пептидов эпитопа II на усеченных детекторных пептидах, где указанные титры выражены как процент максимального связывания с более крупными пептидами. N- или С-концевые аминокислоты соответствующих детекторных пептидов указаны ниже каждого столбца однобуквенным кодом.
На фиг.2В представлен график ELISA-титров антисыворотки приматов против линейных пептидов эпитопа II на усеченных детекторных пептидах, где указанные титры выражены как процент максимального связывания с более крупными пептидами. N- или С-концевые аминокислоты соответствующих детекторных пептидов указаны ниже каждого столбца однобуквенным кодом.
На фиг.3А проиллюстрировано конструирование пятивалентной иммуногенной конструкции эпитоп I/эпитоп II. Tat ВИЧ-1, где аминокислоты обозначены трехбуквенным кодом [SEQ ID NO: 12].
На фиг.3В проиллюстрировано конструирование восьмивалентного универсального эпитопа I, где аминокислоты обозначены трехбуквенным кодом [SEQ ID NO: 13].
На фиг.3С проиллюстрировано конструирование иммуногенной одновалентной универсальной конструкции эпитопа II, где аминокислоты обозначены трехбуквенным кодом [SEQ ID NO:14].
Подробное описание изобретения
Настоящее изобретение относится к решению вышеуказанной проблемы путем получения дополнительных композиций, которые индуцируют выработку антител у неинфицированных индивидуумов или индивидуумов с ранней стадией ВИЧ-1-инфекции, которые еще способны вырабатывать иммунный ответ на иммуноген, причем указанные антитела реагируют с большим числом (то есть более чем с 95%, а предпочтительно более чем с 99%) известных вариантов белка Tat ВИЧ-1. Термин «вариант последовательности (или белка) Tat» означает полипептид или пептид, содержащий аминокислотные остатки белка Tat или последовательность другого белка Tat штамма ВИЧ-1, которая, в основном, сходна с консенсусной последовательностью, представленной в таблице I [SEQ ID NO: 15]. Каждый вариант может отличаться от консенсусной последовательности и/или от другого варианта, по крайней мере, одной аминокислотной заменой в остатках, которые являются важными для эпитопов I-IV. При введении в данную композицию настоящего изобретения эта замена может давать ту же самую или другую антигенную специфичность для конкретного эпитопа Tat.
Антитела, индуцированные композициями настоящего изобретения, могут ингибировать размножение ВИЧ-1, и, тем самым, предупреждать последующее развитие болезни в СПИД. Антитело-содержащие композиции также предназначены для введения инфицированным или неинфицированным индивидуумам, которые не способны вырабатывать эффективный или быстрый иммунный ответ на ВИЧ-1-инфекцию. Эти композиции обладают способностью реагировать с большим числом белков Tat, что, тем самым, приводит к снижению уровней вируса ВИЧ-1. Эти антитела могут быть использованы как в терапевтических, так и в профилактических целях для предупреждения развития СПИДа у большого числа людей, контактировавших со штаммами ВИЧ-1 или инфицированных штаммами ВИЧ-1, которые после инфицирования клетки продуцируют иммунологически отличающиеся белки Tat.
Композиции настоящего изобретения включают пептиды или белки, состоящие из пептидов, составляющих эпитоп белка Tat ВИЧ-1, против которых у приматов вырабатываются антитела, или последовательности нуклеиновых кислот, которые кодируют пептиды и полипептиды, индуцирующие выработку у приматов антител против Tat. Эти индуцированные антитела, в свою очередь, ингибируют размножение ВИЧ-1.
Белок Tat ВИЧ-1 продуцируется из двух экзонов: экзона 1, кодирующего белок из 72 аминокислот (АА), который может экспрессироваться без сплайсинга или который может быть сплайсирован с приблизительно 15-32 аминокислотами, кодируемыми экзоном 2. Последовательность экзона I Tat ВИЧ-1 показана в таблице I и представляет собой консенсусную последовательность на основе последовательностей белка Tat от 31 известных штаммов ВИЧ-1, объединенных в общий подтип В [база данных NIH Los Alamos]. Положения аминокислот, в которых имеются вариации, обозначены строчными буквами. В таблице I [SEQ ID NO: 15] аминокислотный остаток в положении 73 представляет собой первый Pro экзона 2 Tat ВИЧ-1. Поскольку продукт экзона I из 72 аминокислот сам по себе может поглощаться клеткой и активировать, то важно, чтобы антитела реагировали с указанным пептидом из 72 аминокислот и тем самым предотвращали межклеточный транспорт этого пептида. Tat ВИЧ-1 содержит богатую цистеином область между положениями аминокислот 22 и 37 экзона I [SEQ ID NO: 15] с одной ковалентной связью между Cys21 и Cys37, образуя, тем самым, сложную третичную структуру. В научной литературе указывается, что эта область, очевидно, не является иммуногеннной. Преобладающие антитела против Tat представляют собой антитела к линейной N-концевой Pro-богатой области (АА1-21) и к линейной основной области (АА44-65), при этом сообщалось о дополнительном антителе против области АА62-73.
Авторы настоящего изобретения ранее идентифицировали эпитопы, то есть области связывания, распознаваемые кроличьими антителами (антигенные последовательности) в N-концевой линейной последовательности 1-21 (22 АА) экзона I [SEQ ID NO: 15] вариантов Tat, и определили четыре В-клеточных эпитопа в Tat ВИЧ-1. Как было ранее описано в публикации Международной патентной заявки № WO 99/02185, иммуногенные области этой более крупной последовательности распознавались иммунной системой кроликов. Эти области были идентифицированы в консенсусной последовательности экзона 1 в таблице I, представленной ниже. Эпитоп I был идентифицирован кроличьими антителами как последовательность из девяти аминокислот в положениях 2-10 экзона 1. Эпитоп II был идентифицирован как последовательность из восьми аминокислот в положениях 43-50 экзона 1. Эпитоп III был идентифицирован как последовательность из 7 аминокислот в положениях 56-62 экзона 1. Эпитоп IV был идентифицирован как последовательность из двенадцати аминокислот в положениях 62-73 Tat, включающая первый Pro (АА73) экзона 2 и перекрывающаяся с Ser62 эпитопа III.
Однако автор настоящего изобретения неожиданно обнаружил сдвиг в аминокислотных последовательностях, в частности эпитопа I, распознаваемого В-клетками приматов. В таблице I последовательности эпитопов I и II, распознаваемые клетками приматов, подчеркнуты. Распознаваемый клетками приматов эпитоп I охватывает аминокислотные остатки 5-12 Tat. Последовательность эпитопа II, распознаваемого В-клетками приматов, охватывает аминокислоты 41-50. Эпитопы III и IV являются теми же эпитопами, которые распознаются иммунной системой кроликов и которые описаны в работе WO99/02185, вводимой в настоящее описание посредством ссылки.
А. Иммуногенные композиции, содержащие эпитоп I, распознаваемый иммунной системой приматов
В одном из вариантов своего осуществления настоящее изобретение относится к композиции, содержащей, по крайней мере, два варианта пептида или полипептида, распознаваемых иммунной системой приматов и стимулирующих специфический гуморальный иммунный ответ (соответствующий целям настоящего изобретения) у приматов, подвергнутых воздействию in vivo указанными последовательностями. Эти распознаваемые иммунной системой приматов аминокислотные последовательности эпитопа I соответствуют аминокислотным остаткам 5-12 консенсусной последовательности Tat [SEQ ID NO: 15], указанной в таблице I, происходящей от ряда «вариантов последовательности Tat». Распознаваемый иммунной системой приматов эпитоп I определяет пептиды общей формулы R1-Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12-R2 [SEQ ID NO: 8], где Y7 представляет собой Arg, Lys, Ser или Asn; Х9 представляет собой Glu или Asp, а Z12 представляет собой Lys или Asn. Эта формула позволяет определить множество вариантных пептидов эпитопа I млекопитающих. Композиция настоящего изобретения должна содержать, по крайней мере, один пептидный вариант, где Y7 представляет собой Arg, а Z12 представляет собой Lys, и по крайней мере, второй пептидный вариант, где Y7 представляет собой Asn и Z12 представляет собой Asn.
Конкретно определенные аминокислоты, присутствующие в формуле эпитопа I, распознаваемого иммунной системой приматов и описанного выше, представляют собой минимальную реактивную последовательность эпитопа I, распознаваемого иммунной системой приматов. Каждый иммуноген, определенной указанной формулой и используемый в способах настоящего изобретения для выработки антител против минимальной последовательности эпитопа I, может представлять собой более крупную аминокислотную последовательность. Так, например, минимальная аминокислотная последовательность эпитопа I фланкируется другими аминокислотными последовательностями, так, что вся иммуногенная последовательность эпитопа I имеет длину примерно от 8 до 25 аминокислот. Тип фланкирующих аминокислот не играет важной роли в биологической функции иммуногена эпитопа I. В частности, дополнительные аминокислоты на N-конце последовательностей эпитопа I, распознаваемого иммунной системой приматов, не влияют на иммуногенность. Таким образом, для каждого пептида эпитопа I, распознаваемого иммунной системой приматов, N-концевым R1 может быть свободный водород на немодифицированной N-концевой аминокислоте или низшая алкильная (то есть С1-С10-алкильная) или низшая С1-С10-алканоильная группа, такая как ацетильная группа. R1 может также включать последовательность примерно от 1 до приблизительно 5 аминокислот, необязательно замещенную низшим алкилом или низшим алканоилом. Предпочтительно, R1 представляет собой 2 аминокислоты. В одном из вариантов осуществления изобретения R1 представляет собой Val, в результате чего образуется последовательность Val-Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12 [SEQ ID NO: 37], где Y7, Х9 и Z12 определены выше. В другом варианте осуществления изобретения R1 представляет собой Х2-Pro-Val-, в результате чего образуется последовательность Х2-Pro-Val-Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12 [SEQ ID NO: 38], где Х2 представляет собой Glu или Asp и где Y7, Х9 и Z12 определены выше. Предпочтительно, R1 представляет собой 3 аминокислоты.
Дополнительные аминокислоты на С-конце минимальной последовательности эпитопа I, распознаваемого иммунной системой приматов, могут повышать титр антитела. Хотя С-концевой R2 может представлять собой простую свободную гидроксильную группу на С-концевой аминокислоте, однако, он может также представлять собой С-концевой амид. Однако для повышения титра R2 предпочтительно представляет собой последовательность примерно от 1 до 14, а предпочтительно примерно 4 дополнительные аминокислоты, амидированные у карбокси-конца. В предпочтительном варианте осуществления изобретения R2 представляет His-Pro-Gly-Ser-амид, в результате чего образуется последовательность Asp-Pro-Y7-Leu-Х9-Pro-Trp-Z12-His-Pro-Gly-Ser [SEQ ID NO: 16], где Y7, Х9 и Z12 определены выше.
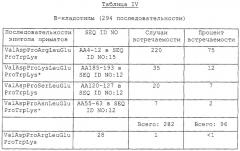
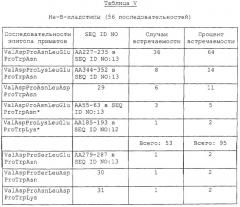
Предпочтительно, композиция настоящего изобретения, помимо двух нужных пептидов, идентифицированных выше, включает, по крайней мере, пять или шесть других аминокислотных последовательностей эпитопа I, распознаваемого иммунной системой приматов. Более предпочтительно, указанная композиция включает семь или восемь вариантных аминокислотных последовательностей, идентифицированных непосредственно ниже. Эта композиция может также содержать другие пептидные или полипептидные последовательности, каждая из которых включает различные комбинации Х9,Y7 и Z12. Как продемонстрировано в нижепривиденных примерах, где описан распознаваемый иммунной системой приматов эпитоп I с тремя сайтами антигенной вариабельности, предпочтительная композиция настоящего изобретения может включать достаточное число пептидов эпитопа I, распознаваемого иммунной системой приматов, так что эта композиция содержит 95% от всех известных вариантов В-кладотипа и не-В-кладотипа Tat ВИЧ-1 благодаря включению двух «необходимых» пептидов:
R1-Asp-Pro-Arg-Leu-Glu-Pro-Trp-Lys-R2 [SEQ ID NO: 17] и
R1-Asp-Pro-Asn-Leu-Glu-Pro-Trp-Asn-R2 [SEQ ID NO: 18],
а также один из пяти следующих дополнительных пептидов эпитопа I:
R1-Asp-Pro-Lys-Leu-Glu-Pro-Trp-Lys-R2 [SEQ ID NO: 19],
R1-Asp-Pro-Ser-Leu-Glu-Pro-Trp-Lys-R2 [SEQ ID NO: 20],
R1-Asp-Pro-Asn-Leu-Glu-Pro-Trp-Lys-R2 [SEQ ID NO: 21],
R1-Asp-Pro-Lys-Leu-Glu-Pro-Trp-Asn-R2 [SEQ ID NO: 22] и
R1-Asp-Pro-Asn-Leu-Asp-Pro-Trp-Asn-R2 [SEQ ID NO:23],
а также необязательно редкий вариант
R1-Asp-Pro-Ser-Leu-Glu-Pro-Trp-Asn-R2 [SEQ ID NO: 24].
Композиция эпитопа I, распознаваемого иммунной системой приматов, может включать ряд дополнительных пептидов или полипептидов, которые содержат другие последовательности, соответствующие аминокислотным остаткам АА5-АА12 SEQ ID NO: 15, но происходящим от других вариантов Tat, которые не способны перекрестно реагировать с антителами против композиций эпитопа I, распознаваемого иммунной системой приматов. Композиции эпитопа I настоящего изобретения могут содержать множество копий пяти или нескольких различных пептидов эпитопа I в любом порядке. В одном из вариантов осуществления изобретения в композиции присутствует, по крайней мере, одна копия семи или всех восьми аминокислотных последовательностей, описанных выше [SEQ ID NO: 17-24].
Указанные пептиды или полипептиды настоящего изобретения продуцируют синтетическими или рекомбинантнымм способами. Для связывания этих пептидов между собой или с носителем в концы этих пептидов могут быть включены необязательные аминокислоты (например, -Gly-Ser-) или другие аминокислоты или химические соединения - спейсеры. Эта композиция может иметь форму, состоящую из одного или нескольких вышеописанных пептидов, экспрессируемых в виде синтетического пептида, присоединенного к белку-носителю. Альтернативно, композиция может содержать множество пептидов эпитопа I, каждый из которых экспрессируется в виде множественного антигенного пептида, необязательно присоединенного к белку-носителю. Альтернативно, отобранные пептиды могут быть последовательно присоединены и экспрессированы в рекомбинантно продуцированном белке. В одном из вариантов осуществления изобретения восемь последовательностей, конкретно идентифицированных выше, последовательно соединены друг с другом непосредственно или через спейсерные аминокислоты с образованием более крупного рекомбинантного белка. Альтернативно, рекомбинантный белок может быть слит с сохранением рамки считывания с белком-носителем. Такие композиции эпитопа I, распознаваемого иммунной системой приматов, предназначены для индукции выработки антител, реагирующих более чем с 95% известных вариантов белка Tat ВИЧ-1, включая белки Tat ВИЧ-1 В- и не-В-кладотипов.
Композиции эпитопа I, распознаваемого иммунной системой приматов, обнаруживают биологическую активность, направленную на индуцирование у иммунизованного иммунокомпетентного примата, то есть неинфицированного человека или у инфицированного человека без симптомов заболевания, активного гуморального иммунного ответа (то есть вырабатывания антител), который направлен против более чем 95%, а предпочтительно более чем 99% известных вариантов белков Tat ВИЧ-1. Конечным результатом такого лечения является ингибирование размножения ВИЧ-1 после острого инфицирования. Такое ингибирование предотвращает высокие уровни ВИЧ-1 в плазме после сероконверсии, ассоциированные с развитием СПИДа. Активное индуцирование выработки антител в асимптотической фазе ВИЧ-инфекции может приводить к снижению размножения вируса, к снижению вирусной нагрузки в плазме и к снижению вероятности развития СПИДа. Композиция, которая содержит, по крайней мере, два необходимых иммуногена эпитопа