Структурированная эмульсия амфотерицина b с низкой токсичностью для парентерального введения и способ ее получения
Иллюстрации
Показать всеОписан парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии, содержащий (а) масляную фазу (до 30 мас./об.% состава), выбранную из группы растительных масел, таких как соевое масло, сезамовое масло, сафлоровое масло; (b) амфотерицин В (0,05-1 мас./об.% состава), диспергированный в масляной фазе; (с) воду водной фазы; (d) модифицирующие тоничность агенты, выбранные из группы соединений, таких как глицерин, маннит, декстроза, растворенные в водной фазе; (е) эмульгатор, такой как натуральные фосфатиды (до 3 мас./об.% состава), диспергированный в водной фазе. Состав позволяет достичь LD50 не менее 400 мг/кг при одном вводе дозы и не менее 40 мг/кг при повторном вводе дозы у мышей. Также описан способ получения этого состава. 2 н. и 12 з.п. ф-лы, 11 ил., 20 табл.
Реферат
Область изобретения
Изобретение относится к композиции амфотерицина В с низкой токсичностью. В частности, изобретение относится к композиции амфотерицина В с низкой токсичностью в структурированной эмульсии типа масло в воде для парентерального введения.
Предпосылки для создания изобретения
Амфотерицин В является макроциклическим полиеновым антибиотиком, продуцируемым Streptomycetes nodosus. Он эффективен по отношению к широкому кругу грибов, дрожжей и некоторым представителям простейших.
Первоначально амфотерицин В был доступен для внутривенного введения в обычной коллоидной форме. Даже в настоящее время, спустя 35 лет после его разработки, он широко используется как жизненно важное противогрибковое средство из-за его надежной терапевтической эффективности. Сообщается о низкой толерантности лекарственного средства ввиду количества неблагоприятных эффектов при клиническом использовании. Почти у всех пациентов, получавших обычный амфотерицин В внутривенно, наблюдалась нефротоксичность. Другие неблагоприятные эффекты включают в себя гипертензию, гипотензию, сердечную аритмию, в том числе фибрилляцию желудочков, остановку сердца, нарушения функции печени. Наблюдали и тубулярное, и гломерулярное повреждения и существование риска постоянного снижения почечной функции. Растворы амфотерицина В раздражают венный эндотелий и могут вызывать боль и тромбофлебит на участке инъекции из-за использования синтетического поверхностно-активное вещества, дезоксихолата, при приготовлении, чтобы солюбилизировать амфотерицин В.
Для снижения токсичных эффектов амфотерицин В приготовляли с использованием различных систем доставки лекарственного средства к участку действия, таких как липидные комплексы, липосомы и эмульсия. Эти композиции имеют более высокую эффективность, более низкую токсичность по сравнению с лекарственным средством, используемым в свободной форме. И липидные комплексы, и липосомальные готовые препаративные формы амфотерицина В в настоящее время доступны на рынке и одобрены в различных странах по всему миру.
Основной недостаток липидных готовых препаративных форм на основе липидных комплексов и липосом - высокая стоимость лечения. Амфотерицин В является липофильным лекарственным средством, которое связывается со стеринами и интеркалирует в липидные двойные слои, и следовательно, амфотерицин В особенно пригоден для использования в липидной системе доставки лекарственного средства.
Была предпринята попытка в этой лаборатории приготовить амфотерицин В в форме эмульсии на основе липида, преимущества которой состоят в низкой токсичности при более низкой стоимости лечения.
Volker Heinemann et al. допускают (Antimicrobial agents and chemotherapy 1997, 41 (4); 728-732), что липидные эмульсии уменьшают количество олигомерного амфотерицина В и тем самым уменьшают взаимодействие амфотерицина В с холестерином клеточных мембран человека. Остаточный мономерный амфотерицин В, однако, сохраняет потенциал связывания с эргостерином грибковых клеточных мембран.
Kirsh R, Goldstein R, Tarloff J, et al. сообщают (J. Infect. Dis. 1988, 158; 1065-1070), что липидная эмульсионная композиция амфотерицина В, полученная смешиванием с жировой эмульсией, проявляет меньшую токсичность без потери противогрибковой активности. Однако найдено, что физическая стабильность такой липидной эмульсии, несущей амфотерицин В, невысока.
Moreau P, et al. сообщают (J. Antimicro. Chemother. 1992, 30, 535-541), что у пациентов, проходящих лечение жировой эмульсией, смешанной с инъекционным раствором амфотерицина В, происходит значительное снижение связанной с инфузией токсичности и почечной дисфункции.
Применение амфотерицина В, смешанного с жировой эмульсией парентерального питания, возрастает и в Европе, и в Соединенных Штатах.
Известные способы получения эмульсии амфотерицина В обсуждаются ниже.
Патент США 5364632 (1994) / Патент Японии JP 2290809 (1990)
Способ получения эмульсии по изобретению описан в типичном примере следующим образом:
Амфотерицин В растворяли в метаноле (0,8 мг/мл) с использованием ультразвука (15 мин). Фосфолипиды Е-80 (содержащие, в основном, 80% фосфатидилхолина и 8% фосфатидилэтаноламина) растворяли в хлороформе. Оба раствора смешивали и фильтровали через комбинированную фильтровальную систему, имеющую предварительный стекловолокнистый фильтр и мембранный фильтр 0,45 мкм из регенерированной целлюлозы (RC 5) (GF92), для удаления пирогенов и агрегаций. Полученный прозрачный липидный раствор осаждали в виде тонкой пленки на стенки круглодонной колбы с использованием роторного испарения при пониженном давлении и 40°С. Водную фазу, содержащую полоксамер (poloxamer), дезоксихолат натрия и глицерин, фильтровали через Millepore фильтр 0,22 мкм, заливали в колбу и подвергали дисперсию воздействию ультразвука до образования гомогенной липосомной смеси.
Масло МСТ (триглицерид со средней длиной цепи), отфильтрованное через Millepore фильтр 0,22 мкм и содержащее α-токоферол, нагревали до 70°С и затем подмешивали в липосомную смесь, нагретую до 45°С, и диспергировали в ней с использованием магнитной мешалки.
Эмульгирование осуществляли, поддерживая такую же температуру, с использованием смесителя с высоким усилием среза, Polytron. Полученную грубую эмульсию быстро охлаждали. Тонкую монодисперсную эмульсию получали в двухступенчатом гомогенизаторе.
Окончательно регулировали рН эмульсии и фильтровали через Millepore фильтр 0,45 мкм, чтобы отделить крупные капли и продукты распада, образующиеся в процессах эмульгирования и гомогенизации.
Все операции обработки проводили в асептических условиях.
Относительные количества различных ингредиентов в конечных эмульсиях в примере и диапазоны, данные в описании, приведены ниже:
Амфотерицин В 0,075% (0,015-0,15%), масло МТС 20% (3-50%), фосфолипид Е80 0,5% (0,5-20%), полоксамер 2% (0,3-10%), дезоксихолат натрия 1% (0,5-5%), глицерин 2,25%, α-токоферол 0,02% и дважды дистиллированная вода 200%.
Недостатки процесса патента США 5364632 (1994)/патента Японии JP 2290809(1990):
i. Так как растворимость амфотерицина В в метаноле невысока, то необходимо использовать большое количество метанола, чтобы растворить требуемое количество амфотерицина В. Это ограничивает уровень лекарственного средства в конечной композиции.
ii. В этом способе сначала необходимо было сформировать тонкую пленку лекарственного средства, амфотерицина В и фосфолипидов и затем гидратировать эту пленку с использованием водной фазы. Водная фаза содержит неионогенный эмульгатор - полоксамер, поверхностно-активное вещество - дезоксихолат натрия и глицерин.
iii. Использованной масляной фазой является масло МСТ с добавленным α-токоферолом. Эмульсию получали добавлением масляной фазы, поддерживаемой при 70°С, в водную фазу, поддерживаемую при 45°С. Это не гарантировало, что амфотерицин В сохраняется в масляной фазе. Способ не использует весь потенциал снижения токсичности амфотерицина В, если он находится в масляной фазе.
iv. Продукт по способу патента США 5364632 (1994) получали в асептических условиях для придания ему стерильности. Предпочтительный способ стерилизации, установленный в фармакопее, - это обработка продукта в конечной емкости в автоклаве. Так как амфотерицин В обычно вводят внутривенно, то конечная стерилизация является предпочтительной единственной альтернативой, которая предлагает более высокую гарантию соблюдения стерильности.
v. Эмульсионный продукт, хотя стоек к механическому напряжению, все же не был исследован на токсичность. Следовательно, токсичность продукта не известна. Однако сравнительные исследования in vivo были осуществлены с мышами Balb/c для сравнения с Fungizone, который является промышленной готовой препаративной формой амфотерицина В, содержащей дезоксихолат натрия. Эти исследования показали, что продукт менее токсичен, чем Fungizone.
vi. Применение масла МСТ и полоксамера увеличивает концентрацию лекарственного средства в плазме из-за снижения поглощения лекарственного средства ретикулоэндотелиальной системой (RES). В случае грибковой инфекции необходимо, чтобы амфотерицин В распределялся в ретикулоэндотелиальной системе, которая является местоположением инфекции.
Патент Японии 11-60491 (1989)
В патенте Японии описана лекарственная препаративная форма, содержащая амфотерицин В в форме эмульсии. Эмульсия содержит:
i) Амфотерицин В (1-10 мг/мл готовой эмульсии)
ii) Масляную фазу - масляная фаза содержит растительные масла, рыбий жир или триглицериды (1-50%, предпочтительно 5-30%). Предпочтительным используемым маслом является соевое масло или сезамовое масло.
iii) Эмульгаторы - использованные эмульгаторы представляют собой фосфолипиды. Дополнительно также применяли нетоксичные эмульгаторы. Используемыми фосфолипидами являлись фосфолипиды яичных желтков, фосфолипиды соевых бобов или гидрогенизированный продукт, полученный из этих материалов. Фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилсерин, фосфатидная кислота, фосфатидилглицерин также можно использовать. Рекомендованное количество 1-50 мас.% масляного компонента, предпочтительно 10-30 мас.% масляного компонента или 1-10 мас./об.%, предпочтительно 4-6 мас./об.% эмульсии.
Применяли также неионогенные эмульгаторы, такие как полиалкиленгликоль (мол. масса 1000-10000, предпочтительно 4000-6000); или полимер - полиоксиэтилен или полиоксипропилен (мол. масса 1000-20000, предпочтительно 2000-10000), полиоксиалкиленовые производные гидрогенизированного касторового масла, такие как полиоксиэтилен-20-эфир, -40-эфир, -100-эфир гидрогенизированного касторового масла, в количестве менее 5 мас./об.%, предпочтительно менее 1 мас./об.%. Также можно использовать сочетания двух неионогенных эмульгаторов.
iv) Жирные кислоты и их соли (фармацевтически приемлемые) - до 1%, предпочтительно 0,5 мас./об.%.
v) стабилизаторы - менее 5 мас./об.%, предпочтительно менее 1 мас./об.%, которые включают в себя
а) высокомолекулярные полимерные вещества, такие как альбумин человеческого происхождения, виниловый сополимер, например поливинилпирролидон, поливиниловый спирт, алифатические амины.
b) желатин, гидроксиэтилированный крахмал, разновидности холестерина.
vi) изотонические агенты - менее 5 мас./об.%, предпочтительно менее 1 мас./об.%;
vii) глицерин или его моноэфиры типа моноолеина, монопальмитина;
viii) сахариды, такие как моно- и дисахариды, сорбит, ксилит, менее 5 мас./об.%, предпочтительно менее 1 мас./об.%;
ix) антиоксиданты, такие как токоферол, менее 5 мас./об.%, предпочтительно менее 1 мас./об.%;
х) агенты регулирования рН, такие как кислоты, щелочи и буферы.
О способе получения, изложенном ниже, уже сообщалось ранее. Способ предусматривает сначала формирование эмульсии типа вода в масле (w/o) и затем превращение ее в эмульсию типа масло в воде (o/w) разбавлением водой. В способе соевое масло, фосфолипид, амфотерицин В и некоторое количество воды, а также другие добавки (если их использовали) смешивали вместе и нагревали при необходимости. Смесь затем гомогенизировали в гомогенизаторе высокого давления. Добавляли еще воды в требуемом количестве, чтобы превратить эмульсию w/o в эмульсию o/w, которую снова гомогенизировали.
В типичном примере 200 г соевого масла, 50 г фосфолипида и 2,5 г амфотерицина В и 750 мл воды обрабатывали, как указано выше.
В другом примере в приведенный выше состав вводили глицерин в количестве 2,2 мас./об.% композиции.
Средний размер капли эмульсии 0,1-0,2 мкм. Эмульсия и размер капель сохраняются вплоть до 10 дней в условиях охлаждения.
Недостатки способа по патенту Японии 11-69491 (1989):
Известно, что амфотерицин В в эмульсионной готовой препаративной форме менее токсичен, чем обычный препарат амфотерицина В. Однако готовые препаративные формы патента Японии 11-69491 (1989) не используют полного потенциала снижения токсичности, обусловленного идеей использования эмульсии, из-за способа получения эмульсии в этом патенте.
i. Из-за того, что средний размер частицы эмульсии, получаемой в патенте Японии 11-69491 (1989), составляет 0,1-0,2 мкм, невозможно использовать хорошо известное преимущество предпочтительного поглощения ретикулоэндотелиальной системой частиц большего размера. Требуется предпочтительное поглощение амфотерицина В ретикулоэндотелиальной системой, так как она является местоположением большинства грибковых инфекций.
ii. Стабильность исследуемой эмульсии до 10 дней в холодильнике.
iii. Для добавления в эмульсионный препарат предложено большое количество добавок, в том числе поддерживающих эмульгирование агентов, таких как алифатические амины, высокомолекулярные полимеры, неионогенные природные поверхностно-активные вещества, разновидности холестерина, сахариды, такие как моно- и дисахариды, антиоксиданты.
iv. Технологическая стадия придания продукту стерильности не оговаривается.
В патенте Японии 4-173736 (1992) описан продукт, содержащий 0,005-5% амфотерицина В, 0,5-25% фосфолипида, предпочтительно яичного лецитина. Композиция имеет средний размер диаметра частиц 100 нм. Композиция не является эмульсией и не содержит масляной фазы.
В патенте США 5389373 (1995) описан способ получения эмульсии слаборастворимых лекарственных средств типа масло в воде (o/w). Способ предусматривает растворение амфотерицина В в водном растворе с высоким или низким рН, добавление полученного раствора с концентрацией не более чем 100 мг/мл к предварительно приготовленной эмульсии, добавление к эмульсии некоторого количества кислоты, основания или буфера, пригодного для нейтрализации и регулирования рН продукта до нужного значения.
Недостатки способа по патенту США 5389373 (1995):
Основной недостаток способа состоит в ограничении низкой концентрации амфотерицина В в эмульсии. В этом способе концентрация амфотерицина В составляет порядка 100 мг/мл. Исходя из этого необходимо инъектировать большие объемы композиции, что является недостатком для лечения.
В патенте США 5534502 (1996) амфотерицин В декристаллизуют с помощью кислоты и этанола и затем гомогенно диспергируют в липиде с последующим эмульгированием. В этом способе необходимо растворять амфотерицин В в этаноле, наиболее предпочтительное количество этанола 400-600 мл/г амфотерицина В. Основной недостаток способа состоит в том, что амфотерицин В не стабилен в кислой области рН.
Европейский патент 0700678 (1996) описывает липидную эмульсию, которая, в основном, содержит лимонную кислоту или ее фармацевтически приемлемую соль и по меньшей мере один элемент, выбранный из группы, включающей в себя метионин, фенилаланин, серин, гистидин и их фармацевтически приемлемые соли, при условии, что эмульсия не содержит одновременно и метионин и фенилаланин.
Существенным требованием является одновременное использование лимонной кислоты и по меньшей мере одной из указанных аминокислот. Способ приготовления эмульсии в соответствии с этим изобретением описан следующим образом.
Фосфолипиды и вспомогательные агенты для эмульгирования, такие как олеиновая кислота, растворяли в подходящем органическом растворителе, таком как гексан, и затем растворитель отгоняли при пониженном давлении, чтобы получить липидную пленку. К полученной липидной пленке добавляли масляный компонент и воду и смесь предварительно эмульгировали энергичным перемешиванием путем встряхивания. Полученную жидкость эмульгировали с использованием применяемых в настоящее время эмульгаторов. По завершении эмульгирования значение рН полученной эмульсии регулировали до заданного уровня добавлением хлористоводородной кислоты или гидроксида натрия. Лимонную кислоту и аминокислоты добавляли к эмульсии, чтобы получить липидную эмульсию. В варианте липидную эмульсию получали таким же образом, добавляя масляный компонент и водный раствор лимонной кислоты и аминокислоты к липидной пленке, полученной согласно указанной выше процедуре, и затем подвергали полученную смесь эмульгированию.
Недостатки способа по европейскому патенту 0700678 (1996):
Способ получения эмульсии амфотерицина В подробно не описан. Амфотерицин В является одним в перечне примерно из 70 лекарственных средств, на которое указывается как на средство, которое «может быть приготовлено в липидной эмульсии».
i) Способ получения липидной эмульсии предусматривает растворение фосфолипидов в подходящем органическом растворителе, таком как гексан.
ii) В примерах патента аминокислоты и лимонную кислоту добавляли к предварительно полученной липидной эмульсии и исследовали стабильность при 60°С на обесцвечивание.
Требуется, чтобы внутривенные эмульсии были стабильны при температурах стерилизации в автоклаве.
iii) Способ стерилизации, представленный в одном из примеров, предусматривает нагревание при 60°С в течение 1 час и повторение процесса стерилизации три раза каждые 24 часа. Этот способ не подходит для получения внутривенных инъекционных растворов.
Главная задача настоящего изобретения -создать способ получения эмульсии амфотерицина В, пригодной для парентерального введения и имеющей очень низкую токсичность, а также преодоление недостатков и пробелов известных способов, приведенных выше.
Таким образом, основная часть главной задачи - разработать способ покрытия маслом твердого порошка амфотерицина В и размещения покрытого маслом твердого порошка амфотерицина В в масляной фазе эмульсии типа масло в воде при условии сохранения амфотерицина В, внедренного в масляную фазу эмульсии, в течение всего способа получения, в том числе при стерилизации обработкой в автоклаве и в течение последующего срока хранения и использования.
Другая часть главной задачи - разработать способ получения такой структурированной эмульсии типа масло в воде со средним размером капель масла в эмульсии, регулируемым в оптимальном диапазоне, чтобы происходило преимущественное распределение в ретикулозндотелиальной системе при низкой концентрации в плазме. Таким образом, для более успешного выполнения инъекций такая эмульсия действует подобно эмульсии с водной внешней фазой, несущей масляные глобулы, содержащие покрытый маслом амфотерицин В.
Следующая часть главной задачи - разработать способ получения такой структурированной эмульсии амфотерицина В, который требует только минимума добавок, необходимых для получения эмульсии типа масло в воде.
Краткое изложение сущности изобретения
Соответственно этому, настоящее изобретение относится к парентеральному составу покрытого маслом амфотерицина В в форме структурированной эмульсии, имеющему LD50 по меньшей мере 400 мг/кг у мышей и содержащему:
а) масляную фазу (вплоть до 30 мас./об.% состава), выбранную из группы растительных масел, таких как соевое масло, сезамовое масло, сафлоровое масло;
b) амфотерицин В (0,05% до 1 мас./об.% состава), диспергированный в масляной фазе;
c) воду водной фазы;
d) модифицирующие тоничность агенты, выбранные из группы соединений, таких как глицерин, маннит, декстроза, растворенные в водной фазе, и;
e) эмульгатор, такой как натуральные фосфатиды (вплоть до 3 мас./об.% состава), диспергированный в водной фазе.
В другом примере осуществления изобретение относится к способу получения парентерального состава покрытого маслом амфотерицина В в форме структурированной эмульсии, имеющего LD50 по меньшей мере 400 мг/кг у мыши, предусматривающему диспергирование амфотерицина В в масляной фазе, получение водной фазы растворением модифицирующего тоничность агента в воде; диспергирование эмульгатора в водной фазе; регулирование рН водной фазы приблизительно до 8-11; добавление масляной фазы в водную фазу при перемешивании, чтобы получить грубо структурированную эмульсию; гомогенизирование грубо структурированной эмульсии до размера частиц менее 2 мкм, фильтрование, заливку гомогенизированной структурированной эмульсии в стеклянные емкости в атмосфере азота; закрывание стеклянных емкостей, герметизацию закрытых стеклянных емкостей и стерилизацию герметизированных заполненных емкостей обработкой в автоклаве. Важно соблюдать порядок выполнения стадий способа. Изменение порядка стадий приводит к изменению структуры эмульсии, как показано исследованиями токсичности.
Характерно для способа настоящего изобретения, что яичный фосфатид диспергируют в водной фазе, в то время как порошок амфотерицина В диспергируют в масляной фазе, и следовательно, продукт обозначается как покрытый маслом амфотерицин В в форме структурированной эмульсии.
В следующем примере осуществления изобретение относится к парентеральному составу покрытого маслом амфотерицина В в форме структурированной эмульсии, полученному приведенным выше способом.
Приготовление амфотерицина В в форме структурированной эмульсии типа масло в воде по способу настоящего изобретения приводит к значительному снижению его токсичности и гарантирует стерильность состава без изменения его противогрибковой активности. Состав настоящего изобретения, будучи менее токсичным, создает возможности для увеличения уровней доз при лечении определенных инфекций.
Парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии настоящего изобретения является менее токсичным и отличается тем, что
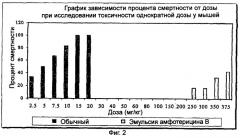
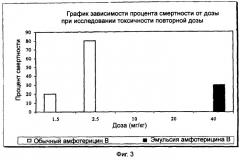
a) имеет LD50 по меньшей мере 400 мг/кг массы тела при исследовании токсичности однократной дозы и по меньшей мере 40 мг/кг массы тела при исследовании токсичности повторной дозы у мышей;
b) имеет LD50 по меньшей мере 150 мг/кг массы тела при исследовании токсичности однократной дозы у крыс;
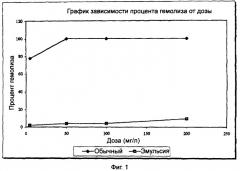
c) проявляет не менее чем в 20 раз меньшее гемолитическое воздействие на эритроциты человека по сравнению с обычным составом, содержащим дезоксихолат натрия;
d) имеет преимущественное распределение в тканях ретикулоэндотелиальной системы и имеет не менее двойного t1/2 в органах ретикулоэндотелиальной системы по сравнению с обычным составом, содержащим дезоксихолат натрия, при исследовании однократной дозы у мышей.
e) не имеет токсических симптомов кардиальной токсичности после инъекции у мышей, таких как тяжелый респираторный дистресс-синдром, местное раздражение, абдоминальный дистресс и возбуждение.
Подробное описание примеров осуществления изобретения
Содержание амфотерицина В в парентеральном составе покрытого маслом амфотерицина В в форме структурированной эмульсии изобретения находится в широком диапазоне от 0,05% до 1 мас./об.% состава. Предпочтительно, от 0,1 до 0,5 мас./об.% и, в частности, приблизительно 0,5% или приблизительно 0,25 мас./об.% состава.
В способе настоящего изобретения амфотерицин В диспергируют в масляной фазе перед эмульгированием. Амфотерицин В используют как таковой или очень тонко размельчают перед диспергированием в масляной фазе. Масляная фаза присутствует в количестве, составляющем вплоть до 30 мас./об.% состава, предпочтительно от 5 до 25 мас./об.% и более предпочтительно 10-20 мас./об.%, в частности, приблизительно 10 мас./об.% или приблизительно 20 мас./об.%. Обычно используемая масляная фаза представляет собой растительное масло и может быть одним из растительных масел, таких как соевое масло, сезамовое масло, хлопковое масло, сафлоровое масло, подсолнечное масло, арахисовое масло, кукурузное масло, касторовое масло или оливковое масло.
Предпочтительным растительным маслом является соевое масло.
В изобретении эмульгатор растворяют в водной фазе. Пригодными эмульгаторами являются натуральные фосфатиды и модифицированные фосфатиды. Предпочтительными эмульгаторами являются фосфатиды натурального происхождения, такие как яичные фосфатиды и соевые фосфатиды. Эмульгатор, используемый в изобретении, может представлять собой смесь двух или более упомянутых выше эмульгаторов. Предпочтительным натуральным фосфатидом является очищенный яичный фосфатид.
Парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии настоящего изобретения приготовляют для диапазона рН 6,0-8,5. В способе настоящего изобретения рН водной фазы регулируют между 8 и 11 щелочью, такой как раствор гидроксида натрия или гидроксида калия в воде, так что рН состава настоящего изобретения после обработки в автоклаве сохраняется в диапазоне 6-8,5.
Парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии настоящего изобретения приготовляют изотоническим относительно крови введением модифицирующего тоничность агента, такого как глицерин, маннит, декстроза или их сочетания. Предпочтительный модифицирующий тоничность агент-глицерин. Глицерин присутствует в количестве от 2-3 мас./об.% состава. Предпочтительно используемое количество глицерина приблизительно 2,25 мас./об.% состава.
Парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии настоящего изобретения содержит, в частности, стерильные эмульсии типа масло в воде, приготовленные согласно процедуре получения в регулируемых условиях и подвергаемые конечной стерилизации в автоклаве. Когда эмульгирование осуществляют при высоких температурах, то водную фазу, или масляную фазу, или обе фазы поддерживают при температуре до 75°С.
Средний размер частиц состава изобретения преднамеренно поддерживают вплоть до 2 мкм, так чтобы создать распределение амфотерицина В, предпочтительно в ретикулоэндотелиальной системе, и тем самым обеспечить низкую концентрацию в плазме.
Настоящее изобретение описывается в типичном примере, где структурированную эмульсию, содержащую амфотерицин В (0,5 мас./об.%), масляную фазу - соевое масло (20 мас./об.%), эмульгатор - очищенный яичный фосфатид (1,2 мас./об.%), модифицирующий тоничность агент-глицерин (2,25 мас./об.%) и воду (сколько понадобиться до 100% по объему), получают способом, предусматривающим диспергирование амфотерицина В в соевом масле; приготовление водной фазы добавлением глицерина к воде; последующее диспергирование очищенного яичного фосфатида в водной фазе; регулирование рН водной фазы до 10,8; добавление соевого масла, содержащего амфотерицин В, к водной фазе при перемешивании с целью получения грубой эмульсии; гомогенизирование полученной эмульсии до размера частиц менее 2 мкм; фильтрование через фильтр 2 мкм, заливку в стеклянные емкости в атмосфере азота; закрывание стеклянных емкостей; герметизацию закрытых стеклянных емкостей и стерилизацию герметизированных заполненных емкостей обработкой в автоклаве.
Структурированная эмульсия парентерального состава покрытого маслом амфотерицина В в форме структурированной типа масло в воде эмульсии настоящего изобретения имеет низкую токсичность и небольшой размер частиц и пригодна для парентерального применения. Стерильность состава изобретения обеспечена благодаря стерилизации продукта конечной обработкой в автоклаве без значительной потери активности амфотерицина В и без дестабилизации эмульсии. Состав настоящего изобретения легко использовать, так как продукт может быть разбавлен инъекционным 5%-ным раствором декстрозы или физиологическим раствором, чтобы получить требуемую концентрацию для парентерального введения. Состав изобретения также имеет длительный срок хранения и, следовательно, пригоден как готовый рыночный продукт.
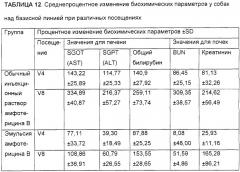
Был исследован профиль токсичности эмульсий, полученных по способам, в которых были сделаны изменения, касающиеся добавления амфотерицина В и очищенного яичного фосфатида. Результаты исследований приведены в примерах в следующей ниже таблице.
| Пример | Амфотерицин В | Яичный лецитин | Токсичность |
| I | В масляной фазе | В водной фазе | Не показывает симптомов кардиальной токсичности |
| IV | В водной фазе | В водной фазе | Показывает симптомы кардиальной токсичности |
| V | В водной фазе | В масляной фазе | Показывает симптомы кардиальной токсичности |
| VI | В масляной фазе | В масляной фазе | Показывает симптомы кардиальной токсичности |
В способе настоящего изобретения наблюдали при суспендировании амфотерицина В в водной фазе образование продукта, который при инъецировании мышей вызывает симптомы кардиальной токсичности, такие как тяжелый респираторный дистресс-синдром, местное раздражение, абдоминальный дистресс и возбуждение. Однако эти токсичные симптомы не наблюдаются, когда амфотерицин В суспендируют в масляной фазе. Это может происходить благодаря резервуарному эффекту как масляных капель эмульсии, так и клеток Купфера. Такое медленное высвобождение может привести к наличию мономерного амфотерицина В в плазме после инъекции эмульсионного состава, тем самым к снижению токсичности [Ref. Antimicrobial agents and chemotherapy, 1997; Vol.41 (4): Pg.728-732].
Найдено, что состав, приготовленный добавлением эмульгатора - яичного лецитина в масляную фазу, также вызывает симптомы кардиальной токсичности, как упоминалось выше. После проведения обширных опытов эта проблема была преодолена добавлением яичного лецитина в водную фазу. Исследования этих процессов описаны в примерах I-VI. Пример II и пример III, которые являются вариантами примера I, все представляют настоящее изобретение, в то время как примеры IV, V и VI не входят в сферу изобретения. В примере VII приведено исследование in-vitro токсичности по отношению к эритроцитам человека. Пример VIII и пример XI описывают исследование токсичности у мышей, крыс и собак. Пример IX описывает фармакокинетическое исследование у кроликов и пример Х описывает исследование распределения в органах у мышей.
Наблюдение, что амфотерицин В, диспергированный в масле, и яичный лецитин, диспергированный в воде, дает эмульсию с очень низкой токсичностью, предполагает сильное взаимодействие между каплями масла и амфотерицином В. Следовательно, эмульсию амфотерицина В можно рассматривать как резервуар мономерной формы амфотерицина В, и вследствие высокой стабильности состава только ограниченное количество свободного амфотерицина В будет постепенно высвобождаться. Мономерная форма амфотерицина В способна связываться с эргостеролом грибковых клеток, но инертна к холестерину клеток хозяина-млекопитающего и, следовательно, вызывает меньшую токсичность. В случае обычного состава амфотерицина В высвобождение высоких уровней свободного амфотерицина В в плазме приводит к наличию самоассоциированных олигомеров в системе кровообращения. Эти олигомерные формы взаимодействуют с содержащими холестерин хозяйскими клеточными мембранами и, следовательно, вызывают большую токсичность. Это объясняет механизм низкой токсичности эмульсии амфотерицина В настоящего изобретения по сравнению с обычным составом. Более низкие пиковая концентрация и значения AUC в сыворотке (пример IX) и соответственно более быстрое отложение амфотерицина В в тканях (пример Х-А) также объясняют причину более низкой токсичности эмульсии амфотерицина В настоящего изобретения. Низкая токсичность подтверждается данными, приведенными в примерах VIII-A, VIII-B и VIII-C.
Эти исследования токсичности показывают, что хотя парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии продукта изобретения, по-видимому, аналогичен продукту, приведенному в патенте Японии 11-60491 (1989), продукт настоящего изобретения имеет характерную биологическую низкую токсичность благодаря способу получения.
Способ настоящего изобретения обеспечивает эмульсионный продукт, который содействует образованию мономеров из-за медленного высвобождения амфотерицина В в плазме при инъекционном применении, что не происходит с продуктом, полученным по способу, приведенному в патенте Японии 11-60491 (1989). Таким образом, структура эмульсии настоящего изобретения отличается от той, которая получена по патенту Японии, как характеризуется исследованиями токсичности. Следовательно, эмульсию настоящего изобретения обозначают как структурированную эмульсию.
В основном примере осуществления изобретения амфотерицин В диспергируют в масляной фазе, так что порошок амфотерицина В покрывается маслом. Яичный лецитин, используемый как эмульгатор, диспергируют в водной фазе.
В другом примере осуществления изобретения гомогенизирование осуществляют в ходе повторяющихся циклов, чтобы достичь распределения частиц по размеру менее 2 мкм.
В следующем примере осуществления изобретения конечный парентеральный состав покрытого маслом амфотерицина В в форме структурированной эмульсии стерилизуют обработкой в автоклаве на конечной стадии процесса получения.
Отличия от известного уровня техники:
Можно увидеть из следующего ниже, что способ настоящего изобретения отличается от указанных патентов.
а) Способ настоящего изобретения отличается от патента США 5364632 (1994) тем, что в нем не используют растворитель для амфотерицина В; не осуществляют процесса приготовления пленки амфотерицина В и фофсолипида с последующей гидратацией; не используют масло МСТ с добавленным α-токоферолом; регулируют рН водной фазы, содержащей яичный фосфатид, до 8-11; осуществляют конечную стадию стерилизации с образованием продукта, который имеет низкую токсичность и хорошее распределение в ретикулоэндотелиальной системе (RES).
Использование такого большого количества растворителя затрудняет промышленное применение способа. Оказалось, что размер частиц в различных примерах менее 100 нм, однако нет сообщений о токсичности состава.
В способе настоящего изобретения низкая токсичность сохраняется даже при 5 мг/мл, что является преимуществом при лечении, так как требуется небольшой инъецируемый объем.
b) Способ настоящего изобретения отличается от патента Японии 11-60491 (1989) тем, что размер глобулы/частицы эмульсии составляет 0,1-0,2 мкм в патенте Японии, а в настоящем изобретении до 2 мкм.
В способе настоящего изобретения яичный фосфатид добавляют в водную фазу и регулируют рН водной фазы до 8-11.
Срок хранения продукта настоящего изобретения свыше 2 лет, а продукта патента Японии - порядка 10 дней или нескольких недель.
Большое число поддерживающих эмульсию агентов необходимо использовать в способе патентов Японии, что не требуется для лекарственной эмульсии настоящего изобретения.
Способ настоящего изобретения создает стерильный продукт, стерилизуемый на конечной стадии процесса в автоклаве, тогда как продукт по патенту Японии не стерилизуется.
c) Продукт, полученный по способу патента Японии 4-173736 (1992), не содержит частиц, имеющих диаметр более 1 мкм, и этот продукт не содержит масляного компонента и, следовательно, отличается от состава настоящего изобретения.
d) В патенте США 5389373 (1995) амфотерицин В добавляли в предварительно полученную эмульсию, тогда как в способе настоящего изобретения амфотерицин В диспергируют в масляной фазе.
e) В европейском патенте ЕР 0700678 (1996) эмульсия амфотерицина В как таковая не описана. Одно лекарственное средство приблизительно из 70 лекарственных средств определено в патенте как средство, которое «может быть приготовлено как липидная эмульсия».
Эмульсия, приведенная в этом патенте, по существу должна содержать аминокислоты и лимонную кислоту или их соли, которые вообще не требуются в способе настоящего изобретения.
Способ получения эмульсии в данном патенте, в основном, начинается с получения фосфолипидной пленки с лекарственным средством или без него. Эта процедура совсем не нужна в способе настоящего изобретения.
В способе получения эмульсии процедура предусматривает различные схемы добавления эмульгатора, тогда как в способе настоящего изобретения процедура устанавливает добавление эмульгатора только в водную фазу.
Целью изобретения, упоминаемой в европейском патенте ЕР 0700678 (1996), является, в основном, преодоление проблемы обесцвечивания липидной эмульсии с использованием лимонной кислоты и аминокислот, тогда как задачей настоящего изобретения является создание структурированной типа масло в воде эмульсии покрытого маслом амфотерицина В, имеющей низкую токсичность, характеризуемую LD50 по меньшей мере 400 мг/кг у мышей.
Хотя настоящее изобретение описано относительно конкретных примеров осуществления, специалистам в данной области техники понятно, что могут быть внесены различные изменения и модификации, не выходящие за пределы с