Способы получения симвастатина высокой степени очистки и полусинтетических статинов
Иллюстрации
Показать всеИзобретение относится к фармацевтике. Получают симвастатин высокой степени очистки из ловастатина, осуществляя следующие стадии: а) размыкание лактонового кольца при введении ловастатина в реакцию с амином для образования амида, b) защита 1,3-диоловой части с помощью защитной группы, с) удаление 2-метилбутириловой группы, присоединенной с помощью сложной эфирной связи через посредство кислорода в позиции 8 гексагидронафталинового кольца, d) присоединение 2,2-диметилбутиратной группы путем образования сложной эфирной связи к гидроксилу в позиции 8, е) удаление защитной группы, f) превращение амида в кислую соль, g) замыкание лактонового кольца с образованием симвастатина. Получают полусинтетический статин из статина, осуществляя следующие стадии: а) размыкание лактонового кольца путем приведения статина в реакцию с амином для получения амида, b) защита 1,3-диоловой части с помощью защитной группы, с) удаление группы R1, присоединенной с помощью сложной эфирной связи через посредство кислорода в позиции 8 гексагидронафталинового кольца, d) присоединение группы R2 путем образования сложной эфирной связи к гидроксилу в позиции 8, е) удаление защитной группы, f) превращение амида в кислую соль и g) замыкание лактонового кольца с образованием полусинтетического статина. Изобретение позволяет повысить чистоту продукта. 2 н. и 15 з.п. ф-лы.
Реферат
Область техники, к которой относится предлагаемое изобретение
Предлагаемое изобретение относится к способу получения полусинтетических статинов, к промежуточным соединениям, образующимся при осуществлении этого способа, и к способу получения симвастатина высокой степени очистки.
Предпосылки создания предлагаемого изобретения
Лекарства на основе статинов в настоящее время являются наиболее эффективными средствами для понижения уровня липопротеинов низкой плотности в крови пациента, предрасположенного к сердечно-сосудистым заболеваниям. К этому классу лекарств относятся ловастатин (lovastatin), симвастатин (simvastatin), правастатин (pravastatin), компактин (compactin), флувастатин (fluvastatin) и атровастатин (atrovastatin).
Симвастатин - это общее медицинское наименование для химического соединения, которое полностью называется бутаноикацид,2,2-диметил-1,2,3,7,8,8а-гексагидро-3,7-диметил1-8-[2-(тетрагидро-4-гидрокси-6-оксо-2Н-пиран-2-ил)-этил]-1-нафталинилэфир, [1S*[1а,3а,7b,8b(2S*,4S),-8аb]] (№79902-63-9 в Реестре CAS). Структурная молекулярная формула симвастатина приведена ниже, при этом атомы помечены номерами.
Ловастатин - это общее медицинское наименование для химического соединения, которое полностью называется [1S-[1α(R*),3α,7β(2S*,4S*),8αβ]]-1,2,3,7,8,8а-гексагидро-3,7-диметил-8-[2-(тетрагидро-4-гидрокси-6-оксо-2H-пиран-2-ил)-этил]-1-нафталинил 2-метилбутаноат (№75330-75-5 в Реестре CAS). Структурная молекулярная формула ловастатина приведена ниже, при этом атомы помечены номерами.
Молекула ловастатина в позиции 8 кольцевой системы гексагидронафталина имеет боковую цепь 2-метилбутирилового эфира. В противоположность этому, молекула симвастатина в позиции 8 кольцевой системы гексагидронафталина имеет боковую цепь 2,2-диметилбутирила. Известно, что симвастатин как средство понижения уровня липопротеинов низкой плотности в крови более эффективен, чем ловастатин.
В предшествующем уровне техники раскрываются способы преобразования ловастатина в симвастатин. В патенте США №4582915, который включен в настоящую заявку по ссылке, раскрываются способы преобразования мевинолина (mevinolin), компактина и их дигидро- и тетрагидропроизводных в более активные ингибиторы редуктазы HMG-CoA путем С-метилирования естественной боковой 2(S)-мелилбутирилокси-цепи с образованием боковой 2,2-димелилбутирилокси-цепи.
В патенте США №5223415, который включен в настоящую заявку по ссылке, раскрывается способ ферментного гидролиза ловастатиновой кислоты путем обработки ловастатиновой кислоты штаммом микроорганизмов Clonostachys compactiuscula ATCC 38009, или АТСС 74178, или же бесклеточным экстрактом из них. Полученный продукт является ингибитором редуктазы HMG-CoA и, следовательно, применим в качестве антигиперхолистеринемического средства. Этот продукт служит также в качестве промежуточного продукта для получения других ингибиторов редуктазы HMG-CoA.
В патенте США №4293496, который включен в настоящую заявку по ссылке, раскрывается способ удаления боковой 2-метилбутириловой цепи путем основного гидролиза сложного эфира ловастатина с помощью гидроокиси щелочного металла, предпочтительно - гидроокиси лития (LiOH). Полученные продукты применимы для синтеза антигиперхолистеринемических средств.
В патенте США №4444784, который включен в настоящую заявку по ссылке, раскрывается способ введения в молекулу гидролизированного ловастатина новой боковой цепи.
В патенте США №5159104, который включен в настоящую заявку по ссылке, раскрывается способ получения симвастатина путем последовательного ацилирования диоллактона (diollactone) с образованием дважды ацилированного промежуточного продукта с последующим выборочным деацилированием и замыканием лактонового кольца с образованием симвастатина.
Краткое описание предлагаемого изобретения
Ближайшим аналогом предлагаемого изобретения является техническое решение по патенту США №5159104.
Способ получения статина, описанный в указанном патенте, не позволяет получать симвастатин высокой степени очистки, практически чистый симвастатин.
Целью предлагаемого изобретения является получение практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) симва-оксолактона (simva-oxolactone).
Еще одной целью предлагаемого изобретения является получение практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) ангидросимвастатина (anhydrosimvastatin).
Еще одной целью предлагаемого изобретения является получение практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) димера симвастатина.
Еще одной целью предлагаемого изобретения является получение практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) дигидросимвастатина (dihydrosimvastatin).
Еще одной целью предлагаемого изобретения является получение практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) по меньшей мере одного из соединений из следующего перечня: симва-оксолактон, ангидросимвастатин, димер симвастатина, дигидросимвастатин.
Предлагаемое изобретение относится к способу получения симвастатина высокой степени очистки из ловастатина, включающему следующие стадии: размыкание лактонового кольца путем приведения ловастатина в реакцию с амином для получения амида; защита 1,3-диоловой части с помощью защитной группы; удаление 2-метилбутириловой группы, присоединенной с помощью сложной эфирной связи через посредство кислорода в позиции 8 гексагидронафталинового кольца; присоединение 2,2-диметилбутиратной группы путем образования сложной эфирной связи к гидроксилу в позиции 8; удаление защитной группы; превращение амида в кислую соль; и замыкание лактонового кольца с образованием симвастатина.
Согласно другому аспекту предлагаемое изобретение относится к способу получения полусинтетического статина, имеющего молекулярную структурную формулу, показанную ниже (Формула I):
из статина, имеющего следующую молекулярную структурную формулу (Формула II):
содержащему следующие стадии: размыкание лактонового кольца путем приведения статина, имеющего структурную молекулярную формулу "Формула II", в реакцию с амином для получения амида; защита 1,3-диоловой части с помощью защитной группы; удаление 2-метилбутириловой группы, присоединенной с помощью сложной эфирной связи через посредство кислорода в позиции 8 гексагидронафталинового кольца; присоединение 2,2-диметилбутиратной группы путем образования сложной эфирной связи к гидроксилу в позиции 8; удаление защитной группы; превращение амида в кислую соль; и замыкание лактонового кольца с образованием полусинтетического статина, имеющего структурную молекулярную формулу "Формула I", где R1 и R2 - ацильные группы, присоединенные к кислороду посредством сложной эфирной связи, а R3 и R4 - группы, независимо выбранные из следующего перечня: -Н, -ОН, -С1-10алкил, -С6-14арил, С6-14арил-С1-3.
Подробное описание предлагаемого изобретения
Предметом предлагаемого изобретения является способ получения практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) симва-оксолактона (simva-oxolactone).
Еще одним предметом предлагаемого изобретения является способ получения практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) ангидросимвастатина (anhydrosimvastatin).
Еще одним предметом предлагаемого изобретения является способ получения практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) димера симвастатина.
Еще одним предметом предлагаемого изобретения является способ получения практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) дигидросимвастатина (dihydrosimvastatin).
Еще одним предметом предлагаемого изобретения является способ получения практически чистого симвастатина, содержащего менее чем приблизительно 0,1% (по массе) по меньшей мере одного из соединений из следующего перечня: симва-оксолактон, ангидросимвастатин, димер симвастатина, дигидросимвастатин.
Способ получения симвастатина высокой степени очистки
Согласно первому аспекту предлагаемое изобретение относится к способу получения симвастатина высокой степени очистки из ловастатина, содержащему следующие стадии: размыкание лактонового кольца путем приведения ловастатина в реакцию с амином для получения амида; защита 1,3-диоловой части с помощью защитной группы; удаление 2-метилбутириловой группы, присоединенной с помощью сложной эфирной связи через посредство кислорода в позиции 8 гексагидронафталинового кольца; присоединение 2,2-диметилбутиратной группы путем образования сложной эфирной связи к гидроксилу в позиции 8; удаление защитной группы; превращение амида в кислую соль; и замыкание лактонового кольца с образованием симвастатина.
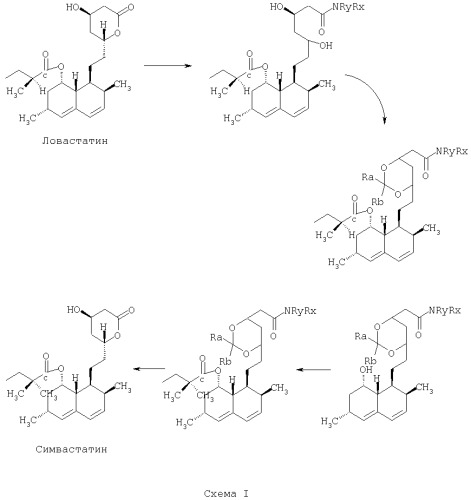
Превращение ловастатина в симвастатин по способу по предлагаемому изобретению показано ниже на Схеме I:
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию размыкания лактонового кольца выполняют путем приведения лактона в реакцию с аммиаком, первичным амином или вторичным амином. При выполнении стадии размыкания лактонового кольца путем приведения лактона в реакцию с амином в предпочтительных вариантах осуществления способа по предлагаемому изобретению амин выбирают из следующего перечня: n-бутиламин, циклогексиламин, пиперидин, пирролидин.
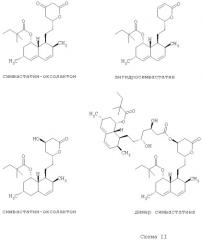
Загрязняющие примеси, которые могут образоваться в процессе синтеза симвастатина, показаны ниже на Схеме II:
В предпочтительных вариантах осуществления предлагаемого изобретения практически чистый симвастатин, полученный по способу по предлагаемому изобретению, содержит менее чем приблизительно 0,1% (по массе) симваоксолактона (simva-oxolactone).
В предпочтительных вариантах осуществления предлагаемого изобретения практически чистый симвастатин, полученный по способу по предлагаемому изобретению, содержит менее чем приблизительно 0,1% (по массе) ангидросимвастатина.
В предпочтительных вариантах осуществления предлагаемого изобретения практически чистый симвастатин, полученный по способу по предлагаемому изобретению, содержит менее чем приблизительно 0,1% (по массе) дигидросимвастатина.
Кроме того, при применении предлагаемого изобретения обеспечивается получение практически чистого симвастатина, который содержит менее чем 0,1% (по массе) димера симвастатина.
При желании по способу по предлагаемому изобретению практически чистый симвастатин может быть синтезирован из загрязненного ловастатина, содержащего до приблизительно 30% примесей.
Способ получения статина высокой степени очистки
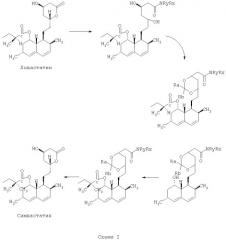
Согласно другому аспекту, предлагаемое изобретение относится к способу получения полусинтетического статина, имеющего молекулярную структурную формулу, показанную ниже (Формула I):
из статина, имеющего следующую молекулярную структурную формулу (Формула II):
содержащему следующие стадии: размыкание лактонового кольца путем приведения статина, имеющего структурную молекулярную формулу "Формула II", в реакцию с амином для получения амида; защита 1,3-диоловой части с помощью защитной группы; удаление 2-метилбутириловой группы, присоединенной с помощью сложной эфирной связи через посредство кислорода в позиции 8 гексагидронафталинового кольца; присоединение 2,2-диметилбутиратной группы путем образования сложной эфирной связи к гидроксилу в позиции 8; удаление защитной группы; превращение амида в кислую соль; и замыкание лактонового кольца с образованием полусинтетического статина, имеющего структурную молекулярную формулу "Формула I", в которой R1 и R2 - ацильные группы, присоединенные к кислороду посредством сложной эфирной связи, а R3 и R4 - группы, независимо выбранные из следующего перечня: -Н, -ОН, -С1-10алкил, -С6-14арил, С6-14арил-С1-3.
Превращение химического соединения, имеющего структурную молекулярную формулу "Формула II", в химическое соединение, имеющее структурную молекулярную формулу "Формула I", по способу согласно предлагаемому изобретению показано ниже на Схеме III:
В предпочтительных вариантах осуществления предлагаемого изобретения полусинтетический статин, имеющий структурную молекулярную формулу "Формула I", синтезированный способом по предлагаемому изобретению, содержит менее чем приблизительно 0,1% примесей.
При желании по способу по предлагаемому изобретению полусинтетический статин, имеющий структурную молекулярную формулу "Формула I", может быть синтезирован из загрязненного статина, имеющего структурную молекулярную формулу "Формула II", содержащего до приблизительно 30% примесей.
В предпочтительных вариантах осуществления предлагаемого изобретения R1 - это ацильная группа следующего вида:
где ОМ - это кислород, который является заместителем гексагидро-нафталинового кольца в позиции 8, R5 - это группа, выбранная из следующего перечня: -С1-15алкил, - -С3-15циклоалкил, -С2-15алкенил, -С2-15алкинил, -фенил, -фенилС1-6алкил, а А - это заместитель R5, выбранный из следующего перечня: водород, галоген, С1-6алкил, С1-6алкокси, С6-14арил.
В предпочтительных вариантах осуществления предлагаемого изобретения R2 - это ацильная группа следующего вида:
где ОМ - это кислород, который является заместителем гексагидро-нафталинового кольца в позиции 8, R6 - это группа, выбранная из следующего перечня: -С1-15алкил, --С3-15циклоалкил, -С2-15алкенил, -С2-15алкинил, -фенил, -фенилС1-6алкил, а В - это заместитель R6, выбранный из следующего перечня: водород, галоген, С1-6алкил, С1-6алкокси, С6-14арил.
Пунктирными линиями, обозначенными в структурных молекулярных формулах "Формула I" и "Формула II" буквами X, Y и Z, показаны возможные двойные связи, эти двойные связи, когда они присутствуют, находятся или в позициях Х и Z одновременно, или только в одной из позиций X, Y, или Z.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию размыкания лактонового кольца выполняют путем приведения лактонового кольца в реакцию с аммиаком, первичным амином или вторичным амином. Стадия размыкания лактонового кольца может выполняться путем приведения лактонового кольца в реакцию с амином, выбранным из следующего перечня: n-бутиламин, циклогексиламин, пиперидин, пирролидин.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению размыкание лактонового кольца выполняют в органическом растворителе. Этот органический растворитель может быть выбран из следующего перечня: толуол, циклогексан, тетрагидрофуран, ацетонитрил.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию размыкания лактонового кольца выполняют при температуре выше температуры окружающей среды. В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадия размыкания лактонового кольца может выполняться при температуре приблизительно 60°С.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадия размыкания лактонового кольца включает удаление непрореагировавшего амина после образования амида. В число способов удаления непрореагировавшего амина входят удаление амина путем испарения и/или промывания органического раствора, содержащего амид, с помощью разбавленной кислоты.
Способ по предлагаемому изобретению включает также стадию защиты 1,3-диоловой части с помощью защитной группы. Способы защиты гидроксильных групп хорошо известны в данной отрасли, они раскрыты, например, в патентах США №№6100407 и 6252091, в Европейском патенте №ЕР 299656 и в Международной патентной заявке WO 95/13283, включенных в настоящую заявку по ссылке. Защитная группа может быть выбрана из следующего перечня: ацетал, кетал, циклический сульфат, циклический фосфат, боратная группа.
В одном из вариантов осуществления предлагаемого изобретения в качестве защитной группы использован кетал. В этом варианте стадия защиты 1,3-диоловой части может выполняться путем получения кетала с помощью кетона. Получение кетала предпочтительно выполняется в органическом растворителе. Этот органический растворитель может быть выбран из следующего перечня: толуол, циклогексан, тетрагидрофуран, ацетонитрил, этилацетат.
В другом варианте осуществления способа по предлагаемому изобретению в качестве защитной группы использован ацетал. В этом варианте стадия защиты 1,3-диоловой части может выполняться путем получения ацетала с помощью альдегида. Получение ацетала предпочтительно выполняется в органическом растворителе. Этот органический растворитель может быть выбран из следующего перечня: толуол, циклогексан, тетрагидрофуран, ацетонитрил, этилацетат.
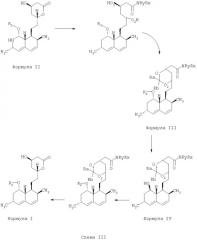
Еще в одном варианте осуществления способа по предлагаемому изобретению защита 1,3-диоловой части может быть осуществлена путем получения диоксиновой части, посредством которой защита 1,3-диоловой части осуществляется, как показано ниже на Схеме IV:
Еще в одном варианте осуществления способа по предлагаемому изобретению защита 1,3-диоловой части может быть осуществлена путем получения ацетала, имеющего следующее строение:
где группа RС может быть выбрана из следующего перечня: водород, галоген, С1-6алкил-, С1-6алкокси, С6-14арил, как, например, фенил или ароматический гетероцикл, a m и n независимо друг от друга могут принимать значения от 0 до 10.
Кроме того, в способе по предлагаемому изобретению предусмотрено также использование других защитных групп, как например:
(1) циклический сульфат
(2) циклический фосфат
(3) циклический борат
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию защиты 1,3-диоловой части выполняют при температуре от приблизительно 5°С до приблизительно 50°С. В еще более предпочтительных вариантах стадию защиты выполняют при температуре от приблизительно 20°С до приблизительно 25°С.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию защиты 1,3-диоловой части выполняют в присутствии каталитического реагента. В качестве такого каталитического реагента предпочтительно использовать кислоту. Эта кислота может быть выбрана из следующего перечня: p-толуоловая сульфокислота, серная кислота.
В одном из вариантов осуществления способа по предлагаемому изобретению стадия удаления R1 включает восстановление статина со структурной молекулярной формулой "Формула III" с помощью восстановителя. Этот восстановитель может быть выбран из следующего перечня: алюмогидрид лития, гидрид алюминия, гидрид диизобутилалюминия. В предпочтительных вариантах стадия восстановления выполняется в инертном растворителе. Этот инертный растворитель может быть выбран из следующего перечня: толуол, тетрагидрофуран. Кроме того, стадия восстановления может дополнительно включать нейтрализацию остаточного восстановителя с помощью воды.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию восстановления выполняют при температуре от приблизительно 0°С до приблизительно 30°С. В еще более предпочтительных вариантах стадию защиты выполняют при температуре от приблизительно 5°С до приблизительно 10°С.
В одном из вариантов осуществления способа по предлагаемому изобретению стадия удаления R1 включает приведение статина со структурной молекулярной формулой "Формула III" в реакцию с металлоорганическим реагентом в среде инертного растворителя.
В качестве металлоорганического реагента может быть использован реактив Гриньяра (магнийгалоидалкил). Температура, при которой статин со структурной молекулярной формулой "Формула III" приводят в реакцию с реактивом Гриньяра, предпочтительно находится в диапазоне от приблизительно -10°С до приблизительно 20°С. Еще более предпочтительный температурный диапазон реакции статина со структурной молекулярной формулой "Формула III" с реактивом Гриньяра составляет от приблизительно -5°С до приблизительно 10°С.
В альтернативном варианте в качестве металлоорганического реагента может быть использовано производное алкиллития. В предпочтительном варианте это производное алкиллития представляет собой n-бутиллитий. Предпочтительный температурный диапазон реакции статина со структурной молекулярной формулой "Формула III" с производным алкиллития составляет от приблизительно -70°С до приблизительно -20°С.
Еще в одном из вариантов осуществления способа по предлагаемому изобретению стадия удаления R1 включает приведение статина со структурной молекулярной формулой "Формула III" в реакцию с амином. В предпочтительных вариантах этот амин представляет собой аммоний или первичный амин. Молярное отношение амина к статину со структурной молекулярной формулой "Формула III" предпочтительно равно 1:1.
Стадия удаления R1 может выполняться в присутствии воды. Кроме того, стадия удаления R1 может выполняться в присутствии органического растворителя.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию удаления R1 выполняют при температуре от приблизительно 100°С до приблизительно 250°С. В еще более предпочтительных вариантах стадию удаления R1 выполняют при температуре от приблизительно 130°С до приблизительно 200°С.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию удаления R1 выполняют при давлении выше атмосферного.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадия присоединения R2 включает ацилирование кислорода, который является заместителем гексагидронафталинового кольца в позиции 8. Стадия ацилирования может включать приведение статина со структурной молекулярной формулой "Формула IV" в реакцию с хлорангидридом кислоты. В альтернативном варианте стадия ацилирования может включать приведение статина со структурной молекулярной формулой "Формула IV" в реакцию со свободной кислотой в присутствии карбодиимида. В качестве такого карбодиимида может быть использован 1,3-дициклогексилкарбодиимид. Еще в одном альтернативном варианте стадия ацилирования может включать приведение статина со структурной молекулярной формулой "Формула IV" в реакцию с симметричным ангидридом в присутствии органического растворителя и катализатора. В предпочтительном варианте в качестве катализатора используется 4-диметиламинопиридин.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию ацилирования выполняют при температуре от приблизительно 20°С до приблизительно 110°С. В еще более предпочтительных вариантах стадию удаления R1 выполняют при температуре от приблизительно 80°С до приблизительно 110°С.
В тех вариантах осуществления способа по предлагаемому изобретению, в которых предусмотрена защита гидроксильных групп -O1H и -O2H, способ по предлагаемому изобретению может дополнительно включать удаление защитных групп после стадии присоединения R2. В предпочтительных вариантах стадия удаления защитных групп включает гидролиз в среде смеси воды и органического растворителя в присутствии катализатора. В предпочтительных вариантах в качестве этого органического растворителя используется тетрагидрофуран. В качестве катализатора может быть использован кислотный катализатор. В предпочтительных вариантах в качестве этого кислотного катализатора используется одно из соединений из следующего перечня: хлористый водород, серная кислота, p-толуоловая сульфокислота.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадию удаления защитных групп выполняют при температуре от приблизительно 20°С до приблизительно 100°С. В еще более предпочтительных вариантах стадию удаления R1 выполняют при температуре от приблизительно 30°С до приблизительно 70°С.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадия превращения амида в кислую соль включает гидролиз. Этот гидролиз может выполняться в среде раствора, содержащего основание, воду и органический растворитель. В предпочтительных вариантах основание выбрано из следующего перечня: гидроокись натрия, гидроокись калия. В предпочтительных вариантах органический растворитель выбран из следующего перечня: метиловый спирт, этиловый спирт, толуол, тетрагидрофуран.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадия превращения амида в кислую соль включает образование соли с фармацевтически приемлемым противоионом. Соль с фармацевтически приемлемым противоионом - это предпочтительно соль аммония.
В предпочтительных вариантах осуществления способа по предлагаемому изобретению стадия замыкания лактонового кольца включает образование лактона в среде органического растворителя. В предпочтительных вариантах органический растворитель выбран из следующего перечня: толуол, этилацетат, циклогексан. В предпочтительных вариантах стадию замыкания лактонного кольца выполняют при повышенной температуре. Эта температура находится в диапазоне от приблизительно 60°С до приблизительно 110°С. Еще более предпочтительный температурный диапазон составляет от приблизительно 80°C до приблизительно 110°С.
В одном из альтернативных вариантов осуществления способа по предлагаемому изобретению предусмотрена стадия изолирования статина со структурной молекулярной формулой "Формула I" путем кристаллизации.
Симвастатин высокой степени очистки, получаемый способом по предлагаемому изобретению, в сочетании с по меньшей мере одним фармацевтически приемлемым инертным наполнителем, может найти применение для производства фармацевтических композиций. Такие фармацевтические композиции пригодны для приема млекопитающими пациентами в виде лекарственных форм.
Эти лекарственные формы могут содержать практически чистый симвастатин, или же, в качестве альтернативного варианта, они могут содержать практически чистый симвастатин как часть фармацевтической композиции. Как в чистом виде, так и в составе фармацевтической композиции, практически чистый симвастатин может приниматься в форме порошка, гранул, агрегаций, или в любой другой твердотельной форме. Такие фармацевтические композиции могут включить композиции для таблетирования. В зависимости от примененного способа таблетирования, требуемого выхода продукта и других факторов, эти таблетируемые фармацевтические композиции могут иметь большее или меньшее количество компонентов. Такие фармацевтические композиции могут содержать разбавители, в качестве каковых могут быть использованы, например, такие производные целлюлозы, как порошкообразная целлюлоза, микрокристаллическая целлюлоза, сверхтонкая целлюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, соли карбоксиметилцеллюлозы и другие замещенные и незамещенные производные целлюлозы; крахмал; предварительно желатинизированный крахмал; неорганические разбавители, такие как карбонат кальция и дифосфат кальция, а также другие разбавители, хорошо известные среднему специалисту соответствующего профиля. В число разбавителей, пригодных для использования в фармацевтических композициях по предлагаемому изобретению, входят также такие вещества, как воски, сахара (например, лактоза) и "сахарные" (шестиатомные алифатические) спирты (такие как маннит и сорбит), полимеры и сополимеры акрилатов, а также пектиновые вещества, декстрины и желатин.
В число других инертных наполнителей входят связующие вещества, такие как аравийская камедь, предварительно желатинизированный крахмал, альгинат натрия, глюкоза и другие связующие вещества, используемые при мокрой и сухой грануляции и при таблетировании мутем непосредственного сжатия; разрыхлители, такие как крахмалгликолат натрия, кросповидон, низкозамещенная гидроксипропилцеллюлоза и другие; смазывающие агенты, такие как стеарат магния и кальция и стеарилфумарат натрия; ароматизаторы; подсластители; консерванты; фармацевтически приемлемые красители, а также агенты, придающие таблетке скольжение, например двуокись кремния.
Лекарственные формы могут быть приспособлены для перорального, трансбуккального, парентерального, офтальмического, ректального или чрескожного введения. К лекарственным формам для перорального введения относятся таблетки, пилюли, капсулы, лепешки, саше, суспензии, порошки, пастилки, эликсиры и т.п. Симвастатин высокой степени очистки, раскрываемый в настоящем изобретении, может приниматься также в виде суппозиториев, глазных мазей и суспензий, а также в виде парентеральных суспензий, вводимых иными способами. Наиболее предпочтительным способом введения симвастатина, полученного по предлагаемому изобретению, является пероральный.
Капсулированные дозы могут содержать твердую фармацевтическую композицию, заключенную в капсулу, которая может иметь покрытие из желатина. Таблетки и порошки тоже могут быть покрыты энтеросолюбильной оболочкой. Порошковые формы с энтеросолюбильной оболочкой могут иметь в составе этой оболочки такие вещества, как фталевокислая ацетилцеллюлоза, фталат гидроксипропилметилцеллюлозы, фталат поливинилового спирта, карбоксиметилэтилцеллюлоза, сополимер стирола и малеиновой кислоты, сополимер метакриловой кислоты и метилметакрилата и тому подобные вещества, которые, при желании, могут применяться совместно с подходящими пластификаторами и/или наполнителями. Покрытие таблетки может представлять собой поверхностную оболочку, или же таблетка может состоять из частиц порошка или гранул, снабженных энтеросолюбильной оболочкой.
В настоящее время симвастатин присутствует в продаже в виде таблеток 5 мг, 10 мг, 20 мг, 40 мг и 80 мг, в состав которых входят также следующие инертные наполнители: стеарат магния, крахмал, тальк, двуокись титана и другие ингредиенты. В качестве консерванта использован бутилгидроксианизол.
Ловастатин поставляется на рынок в виде таблеток 10 мг, 20 мг и 40 мг для перорального приема. В дополнение к активному ингредиенту, каковым является ловастатин, эти таблетки содержат следующие инертные наполнители: целлюлоза, лактоза, стеарат магния, крахмал. В качестве консерванта использован бутилгидроксианизол.
Функции и преимущества этих и других вариантов осуществления предлагаемого изобретения будут поняты более полно после изучения примеров, рассматриваемых ниже. Следует заметить, что цель этих примеров состоит в том, чтобы проиллюстрировать преимущества предлагаемого изобретения, а не в том, чтобы охватить весь объем предлагаемого изобретения.
Примеры
Условия эксперимента
Анализ по методике жидкостной хроматографии высокого разрешения проводился как описано в источнике А.Хаук и др. (A.Houck et al.), Talanta, том 40(4), 491-494 (1993), "Жидкостно-хроматографическое пределение известных примесей, присутствующих в нерасфасованном ловастатине в малом количестве: применение хроматографии высокого и низкого уровней" ("Liquid Chromatographic determination of the known low level impurities in lovastatin bulk drug: an application of high-low chromatography").
Оборудование для жидкостной хроматографии высокого разрешения:
- Насос/инжектор Alliance Waters;
- Диодная матрица М996 Waters;
- Система обработки данных Millennium Waters;
- Колонка: Prodigy 5 С8 250×4,6 мм (phenomenex).
Условия:
наносимый объем: 10 μл;
градиентный профиль течения (линейный);
А=ацетонитрил;
В=0,1% ортофосфорная кислота (Н3PO4).
| время (минут) | Поток (мл/мин) | %А | %В |
| 0 | 1,5 | 60 | 40 |
| 1 | 1,5 | 60 | 40 |
| 5 | 1,5 | 80 | 20 |
| 8 | 1,5 | 90 | 10 |
| 16 | 1,5 | 90 | 10 |
| 20 | 1.5 | 60 | 40 |
Температура колонки: 30°С.
Определение при длинах волн 200 нм и 237 нм.
Образцы подмешивались к ацетонитрилу в концентрации 1,5 мг/мг.
Время удерживания:
| дигидросимвастатин | 8,10 мин (200 нм); |
| симвастатиновая кислота | 5,77 мин (237 нм); |
| ловастатин | 6,34; |
| симвастатин | 7,11; |
| ангидросимвастатин | 8,90; |
| димер симвастатина | 15,36. |
Пример 1
Получение пиперидинамида ловастатина:
Смесь, содержащая 1 г (2,5 ммоль) ловастатина, 10 мл (0,1 моль) пиперидина, 100 мг (0,82 ммоль) N,N-диметиламинопиридина и 30 мл толуола была подвергнута дефлегмации в течение 36 часов. Затем смесь была охлаждена до комнатной температуры и дважды промыта 2 N раствором соляной кислоты (HCl), взятого оба раза в объеме 30 мл, и дважды промыта водой, взятой оба раза в объеме 20 мл. Органический слой был высушен с помощью сернокислого натрия, отфильтрован и выпарен. Остаток был перемешан с гексаном, и полученный осадок был отфильтрован, в результате чего было получено 0,87 г пиперидинамида ловастатина в виде твердого вещества белого цвета.
Пример 2
Реакция бутиламида ловастатина с тионилхлоридом
К раствору, содержащему 1,2 г (2,5 ммоль) бутиламида ловастатина в 20 мл толуола, было добавлено 0,76 г (7,5 ммоль) триэтиламина. Затем по каплям было добавлено 0,45 г (3,7 ммоль) тионилхлорида. После выдержки в течение 1 часа при комнатной температуре реакционная смесь была промыта водой, высушена (с помощью сернокислого натрия), профильтрована и выпарена, в результате чего было получено маслянистое вещество коричневого цвета.
Пример 3
Реакция бутиламида ловастатина с фосфорилхлоридом
К раствору, содержащему 1,2 г (2,5 ммоль) бутиламида ловастатина в 20 мл толуола, было добавлено 0,76 г (7,5 ммоль) триэтиламина. Затем по каплям было добавлено 0,58 г (3,8 ммоль) фосфорилхлорида. После выдержки в течение 1 часа при комнатной температуре реакционная смесь была промыта водой, высушена (с помощью сернокислого натрия), профильтрована и выпарена, в результате чего было получено маслянистое вещество коричневого цвета.
Пример 4
А. Получение ацетонида бутиламида ловастатина
Смесь, содержащая 40 г (98 ммоль) ловастатина и 60 мл n-бутиламина была подвергнута дефлегмированию в течение 1 часа, выпарена, а затем дважды выпарена с толуолом, взятым в количестве 100 мл. Полученный неочищенный амид был растворен в 500 мл ацетона, после чего к раствору было добавлено 3 г p-TsOH. Прозрачный раствор был подвергнут перемешиванию при комнатной температуре в течение двух часов, причем за это время произошло образование твердой фазы. Затем смесь была охлаждена до температуры -10°С, при которой была выдержана в течение трех часов, после чего твердая фаза была выделена и высушена до получения 45 г (88%) амида/ацетонида в виде твердого вещества белого цвета. Еще 5 г было получено из маточного раствора частичным выпариванием раствора.
В. Алкилирование амида/ацетонида, полученного на стадии А в качестве промежуточного продукта:
Амид/ацетонид в количестве 19,5 г (37,6 ммоль) в среде смеси тетрагидрофурана и циклогексана (в отношении 4:1), взятой в объеме 280 мл, был охлажден до температуры -40°С, после чего было добавлено 113 мл 1 М литийпирролидина (полученного из пир