Конъюгаты и способ их получения, а также их применение для транспорта молекул через биологические мембраны
Иллюстрации
Показать всеИзобретение относится к области медицины и касается конъюгатов, состоящих из транспортируемой через биологические мембраны молекулы, представляющей собой биополимер, пептид-нуклеиновую кислоту или полиамид, и арильного остатка, используемых для лечения заболеваний, обусловленных сверхпродуцированием определенных генов, способа их получения, способа транспорта молекулы через биологическую мембрану, лекарственного средства, способа получения лекарственного средства, диагностического средства и тест-набора на основе указанного конъюгата. 9 н. и 12 з.п. ф-лы, 9 ил., 6 табл.
Реферат
Объектами настоящего изобретения являются конъюгаты, способ их получения и применение этих конъюгатов для транспорта низкомолекулярных соединений и макромолекул через биологические мембраны, в особенности для транспорта молекул в клетки. Объектами настоящего изобретения являются также лекарственное и диагностическое средства, а также тест-наборы, в которых находятся или, соответственно, используются, эти конъюгаты.
Лимитирующим фактором для терапевтического использования молекул, место воздействия которых находится внутри клетки, часто является их недостаточное проникновение в клетку и неблагоприятное внутриклеточное распределение. Типичными примерами являются макромолекулы, как нуклеиновые кислоты, которые специфическим к последовательности образом связываются с клеточными ДНК или РНК и благодаря этому вызывают ингибирование экспрессии генов. Антисмысловые олигонуклеотиды представляют собой короткие одноцепочечные нуклеиновые кислоты, которые через пары оснований, согласно модели Уотсона-Крика, связываются с комплементарной мРНК, трансляцию которой в соответствующем протеине нужно ингибировать. Триплексобразующие олигонуклеотиды за счет так называемого "спаривания оснований по Hoogsteen" связываются в большую "борозду" двойной спирали ДНК с образованием тройной спирали, благодаря чему специфически к последовательности ингибируется транскрипция генов. Другими внутриклеточно действующими олигонуклеотидами являются, например, так называемые "Decoy"-олигонуклеотиды, которые имитируют места связывания факторов транскрипции. Путем обработки с помощью Decoy-олигонуклеотидов специфически к последовательности можно улавливать определенные факторы транскрипции и благодаря этому можно предотвращать активацию транскрипции. Другую группу внутриклеточно действующих олигонуклеотидов, химерапластов, используют для направленной коррекции генов (Cole-Strauss и др., Science, 273, 1386-1389 (1996)). Также для этой коррекции генов существенным является проникновение химерапласт-олигонуклеотида в клетку. Примерами других внутриклеточно действующих нуклеиновых кислот являются такие, которые взаимодействуют с клеточными ферментами, в особенности с теломеразами (Norton и др., Biotechn., 14, 615 (1996)). Следующим классом нуклеиновых кислот являются нуклеиновые кислоты, предпочтительно двухцепочечные ДНК, которые могут кодировать определенные протеины, внутриклеточно экспрессирующиеся с точки зрения генной терапии.
Например, проникновение олигонуклеотида in vitro в клетку, например, путем простого добавления олигонуклеотида в среду клеточной культуры, представляет собой относительно неэффективный процесс, так как фактически только небольшая часть добавленного олигонуклеотида проникает в клетку. Процесс проникновения длится многие часы и чаще всего лишь спустя 8-16 часов достигается "плато"-фаза. Считают, что проникновение олигонуклеотидов подобно процессу эндоцитоза. Общая проблема проникновения через эндоцитоз заключается, однако, в том, что большая часть олигонуклеотидов присутствует не в свободном состоянии в цитоплазме, а находится включенной в определенные клеточные структуры, лизосомы и эндосомы. Это распределение в виде точки в случае флуоресцентномаркированных олигонуклеотидов также можно в самом деле наблюдать флуоресцентномикроскопически. За счет этой везикулярной локализации концентрация свободного олигонуклеотида, который фактически доступен для гибридизации с мРНК, сильно снижена. Кроме того, в зависимости от типа клетки и имеющихся условий, вообще только определенная доля клеток "захватывает" олигонуклеотид. Поэтому для эффективного использования антисмысловых олигонуклеотидов их применяют в общих смесях с усилителями пенетрации, как, например, катионные липиды (Bennet и др., Mol. Pharmacol., 41, 1023 (1992)).
Задача настоящего изобретения состоит в увеличении проникновения в клетки молекул, в особенности макромолекул, как, например, олигонуклеотида.
Исследование проникновения в клетки олигонуклеотидов осуществляют, в общем, либо с помощью радиоактивномеченых, либо флуоресцентномаркированных олигонуклеотидов. Флуоресцентную маркировку олигонуклеотида осуществляют, например, путем введения во взаимодействие аминогруппы олигонуклеотида с флуоресцеинизотиоцианатом (FITC). Флуоресцеин можно вводить, например, в 3'-конец олигонуклеотида с помощью коммерчески доступного, дериватизированного флуоресцеином твердофазного носителя или в 5'-конец с помощью коммерчески доступного реагента флуоресцеинфосфитилирования. Во всех случаях связанный с олигонуклеотидом флуоресцеин благодаря карбоксильной группе находится в виде отрицательно заряженного структурного элемента, который является сильно флуоресцирующим.
В противоположность флуоресцеину флуоресцеиндиацетат (FDA) представляет собой нейтральный витальный краситель, который только после расщепления обеих сложноэфирных групп и раскрытия лактонового кольца превращается в флуоресцирующий флуоресцеин, который, однако, в форме лактона еще не обладает никакой флуоресценцией.
Известно, что FDA (ниже называемый также как "F3") в виде нейтральной нефлуоресцирующей молекулы проникает в живые клетки за счет пассивной диффузии и внутриклеточно расщепляется эстеразами с образованием флуоресцирующего флуоресцеина (Breeuwer и др., Appl. Environ. Microbiol., 61, 1614 (1995); Maeda и др., Cell Struct. Funct., 7, 111 (1982)). До сих пор описаны только FDA-производные, которые содержат реакционноспособную аминогруппу, как, например, изотиоцианатную группу; эти FDA-производные используют для окрашивания внутриклеточных протеинов или клеточных компонентов. Сверх того, до сих пор не описаны никакие конъюгаты FDA с другими молекулами, соответственно, до сих пор также не описаны маркированные с помощью FDA олигонуклеотиды (конъюгаты из FDA и олигонуклеотида).
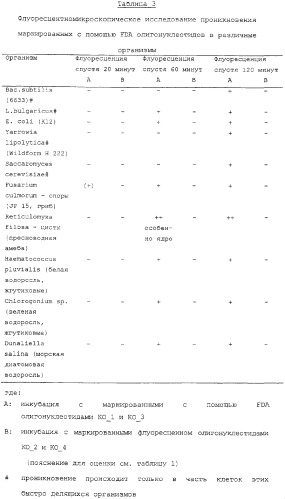
В цитоплазме FDA расщепляется эстеразами за счет маркировки с помощью FDA олигонуклеотида, поэтому можно определять долю "свободного" олигонуклеотида, то есть, сколько олигонуклеотида находится в цитоплазме и сколько доступно для гибридизации, по отношению к доле олигонуклеотида, который находится в везикулах ("включенный" олигонуклеотид) и поэтому недоступен для гибридизации. Вследствие, в целом, большого количества отрицательных зарядов в олигонуклеотиде и того факта, что маркированные с помощью FDA и маркированные флуоресцеином олигонуклеотиды (в случае, когда олигонуклеотид является одним и тем же) различаются только нетто-зарядом, можно было ожидать, что маркированные с помощью FDA и маркированные флуоресцеином олигонуклеотиды обладают очень похожим проникновением в клетку и распределением.
Однако, неожиданно показано, что маркированные с помощью FDA и маркированные флуоресцеином олигонуклеотиды отчетливо различаются в отношении их проникновения в клетки, а именно как в отношении продолжительности, так и в отношении эффективности проникновения олигонуклеотидов, и, сверх того, также в отношении локализации проникших олигонуклеотидов в клетке. Маркированный с помощью FDA олигонуклеотид проникает в клетки намного быстрее, чем соответствующий, маркированный флуоресцеином олигонуклеотид. В то время как проникновение радиоактивномеченых и маркированных флуоресцеином олигонуклеотидов требует нескольких часов, маркированные с помощью FDA олигонуклеотиды после ординарной инкубации, например, с человеческими клетками, уже спустя пять минут обнаруживают внутри клеток. Неожиданным также оказалось то, что маркированные с помощью FDA олигонуклеотиды проникают почти во все клетки (>90% клеток), в то время как в случае до сих пор описанных методов введения олигонуклеотидов или полинуклеотидов в клетки скорость проникновения, в общем, значительно ниже; часто там только примерно 30-60% клеток нагружаются олигонуклеотидами. Предпочтительным также является внутриклеточное распределение маркированных с помощью FDA олигонуклеотидов, которое намного равномернее. Это более равномерное распределение указывает на то, что олигонуклеотиды не находятся, как описано выше, большей частью в везикулах (например, в эндосомах, лизосомах), а распределены по всей клетке, то есть, находятся в цитозоли и в ядре; это является косвенным доказательством того, что большая часть находится в виде "свободного" олигонуклеотида. Только эти "свободные" олигонуклеотиды доступны для связывания с мишенью (молекула-мишень, нуклеиновая кислота-мишень) или в виде биологически активного вещества. Преимуществом также является то, что при использовании маркированных с помощью FDA олигонуклеогидов не наблюдают никакого повреждения клеток; в противоположность этому использование липокатионных усилителей пенетрации часто приводит к повреждениям клеточных мембран. Вследствие этих неожиданных свойств маркированные с помощью FDA олигонуклеотиды, по сравнению с до сих пор описанными методами введения в клетки олигонуклеотидов, соответственно, полинуклеотидов, обладают основным преимуществом, заключающимся в том, что они эффективнее могут проникать в клетки и там также лучше доступны. Благодаря этому маркированные с помощью FDA олигонуклеотиды обладают отчетливо повышенной биологической активностью. Благодаря повышенной биологической активности нужно использовать меньше олигонуклеотида. Благодаря этому и на основании того факта, что маркированный с помощью FDA олигонуклеотид эффективнее как в количественном отношении, так и по времени проникновения в клетку, снижаются (токсичные) побочные действия.
Неожиданно показано, что полезные свойства не ограничены маркированными с помощью FDA олигонуклеотидами, а практически каждая молекула за счет маркировки с помощью FDA, то есть благодаря тому, что транспортируемая молекула связана или конъюгирована с FDA ("FDA-конъюгат"), может эффективно проникать в клетку или транспортироваться через биологическую мембрану. Далее показано, что этот принцип не ограничен FDA-конъюгатами, а распространяется на все конъюгаты сложных ариловых эфиров, которые обладают определенной химической структурой. Настоящее изобретение, таким образом, относится к новому принципу транспорта молекул через биологические мембраны. Так как эти соединения до сих пор в уровне техники практически не описаны, объектом настоящего изобретения также являются соответствующие конъюгаты - транспортируемая молекула, связанная или, соответственно, конъюгированная со сложным ариловым эфиром определенной химической структуры. Эти конъюгаты нельзя получать известными способами; объектом настоящего изобретения поэтому является также способ получения конъюгатов.
Известны биообратимые O-ациларил-конъюгаты, которые предложены в качестве пролекарств на основе олигонуклеотидов (lyer и др., Bioorganic and Med. Chem. Lett., 7, 871-876 (1997)). Эти соединения - в случае, когда арильный остаток представляет собой шестичленное ароматическое кольцо - по своей химической структуре подобны предлагаемым согласно изобретению конъюгатам. В случае биообратимых O-ациларил-конъюгатов, гидролиз сложного эфира, однако, вызывает дестабилизацию связи между арильным остатком и фосфотриэфиром олигонуклеотида, так что биообратимый O-ациларил-конъюгат расщепляется на свои составные части, то есть на свободный олигонуклеотид и O-ациларильный остаток. Эта пролекарственная концепция служит для того, чтобы маскировать отрицательный заряд межнуклеотидфосфатного мостика и благодаря этому облегчать проникновение олигонуклеотида в клетку. В противоположность предлагаемым согласно изобретению конъюгатам, в случае этих пролекарств, однако, не установлено никакого ускоренного проникновения олигонуклеотидов в клетки и также никакого измененного внутриклеточного распределения олигонуклеотидов. Далее не сообщается о проникновении олигонуклеотидов в другие организмы. В противоположность этому в случае предлагаемых согласно изобретению конъюгатов сохраняется ковалентная связь между арильным остатком и олигонуклеотидом при проникновении в клетку; образование ковалентной связи между арильным остатком и олигонуклеотидом можно легко установить флуоресцентномикроскопически, а ароматическое звено, как, например, в случае FDA, лишь после расщепления сложного эфира обладает флуоресценцией.
Объектом настоящего изобретения является конъюгат, который состоит по меньшей мере из одной транспортируемой молекулы и по меньшей мере одного арильного остатка формулы (I):
причем
арил означает группу, которая содержит по меньшей мере один ароматический цикл;
Х означает О или N; предпочтительно Х=О;
Y означает O, S или NH-R2; предпочтительно Y=О;
R1 означает замещенный или незамещенный (С1-С23)-алкильный остаток, который может быть линейным или разветвленным и может содержать двойные и/или тройные связи, например арилалкил;
R2 означает замещенный или незамещенный (C1-C18)-алкильный остаток, который может быть линейным или разветвленным и может содержать двойные и/или тройные связи; и
n означает целое число, больше или равное 1,
причем арильный остаток связан с транспортируемой молекулой либо непосредственно через химическую связь, либо опосредованно через химическую группу; причем химическая группа не является СН2-S-группой, когда связывание транспортируемой молекулы происходит через межнуклеотидфосфодиэфирную связь.
Транспортируемой молекулой может быть любая молекула. Транспортируемая молекула предпочтительно имеет молекулярную массу = 350 Дальтон. Одна форма осуществления изобретения относится к конъюгатам, в случае которых транспортируемой молекулой является макромолекула, например, с молекулярной массой = 500 Дальтон, предпочтительно >1000 Дальтон, особенно предпочтительно >2000 Дальтон или больше. Транспортируемая молекула может представлять собой также низкомолекулярное соединение, например, с молекулярной массой <500 Дальтон, предпочтительно с молекулярной массой от 350 до 500 Дальтон. Низкомолекулярное соединение может представлять собой мононуклеотид.
Транспортируемая молекула может относиться к различным химическим классам веществ, например, она может представлять собой биополимер, например полинуклеотид, предпочтительно олигонуклеотид, полипептид, предпочтительно пептид или протеин, пептид-нуклеиновую кислоту (PNA) или полиамид, который содержит три ароматических цикла: имидазол, пиррол и гидроксипиррол (Kielkopf и др., Science, 282, 111-115 (1998)), или полисахарид, предпочтительно олигосахарид, или одно из производных указанных выше соединений. Транспортируемая молекула может быть пептидным миметиком.
Полинуклеотиды, олигонуклеотиды и мононуклеотиды являются либо встречающимися в природе нуклеиновыми кислотами, либо их известными производными. Под производными понимают, в частности, производимые от транспортируемой молекулы, или конъюгата, соли, в особенности их физиологически приемлемые соли, и также, например, модифицированные, или соответственно, стабилизированные нуклеиновые кислоты.
Транспортируемая молекула может представлять собой ингибитор факторов транскрипции, как, например, NF-KВ, c-fos или c-jun; протеинов клеточного цикла, как, например, циклин D; киназ, как c-Src, тирозин- или МАР-киназы; внутриклеточных ионных каналов; иммунофилинов, как, например, протеины связывания FK506, пролил-4-гидроксилаза; топоизомераз, вирусных протеаз, протеинов устойчивости к многочисленным лекарственным средствам, фосфатаз, как, например, протеин-тирозин-фосфатаза.
Транспортируемая молекула может быть конъюгирована с одним или несколькими арильными остатками, например с двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью, пятнадцатью, двадцатью или более арильными остатками.
Арильный остаток ("арильный остаток" означает в особенности арильный остаток формулы (I) и/или арильный остаток формулы (II)) может быть однократно или многократно связан с транспортируемой молекулой, причем связи могут быть локализованы в разных положениях арильного остатка. Если с транспортируемой молекулой связаны несколько арильных остатков, то они могут быть одинаковыми или различными.
Арильный остаток содержит арильную группу (в формулах (I) и (II) обозначается как "арил"); арильная группа может состоять из одного или нескольких циклов, причем, однако, по меньшей мере один из циклов имеет ароматическую природу. Арильная группа также может содержать гетероциклы, которые могут быть ароматическими. Арильная группа содержит, например, 1-8 или более циклов ("циклическая система"), предпочтительно 1, 2, 3, 4, 5, 6, 7 или 8 циклов. Отдельные циклы являются 3-7-членными, предпочтительно 5-6-членными. Примерами циклических систем являются фенильные, пиридинильные, пиримидинильные, пирролильные, фуранильные, тиофенильные циклы, 5-членные лактоны, 6-членные лактоны, спиролактоны, бензохиноны, циклогексадиенилы и циклогексенилы. Эти циклические системы, арильная группа или, соответственно, отдельные циклы арильной группы могут быть однократно или многократно замещены. По меньшей мере один из циклов арильной группы предпочтительно связан с ацильным остатком.
Арильная группа может отвечать, например, одной из формул: F1', F2', F3', F4', F6', F7', F8', F9', F10', F11'. Эти формулы представлены на фиг.1.
Арильный остаток может быть связан с транспортируемыми молекулами непосредственно или через химическую группу. Объектом изобретения является конъюгат, причем химическая группа вместе с арильным остатком отвечает формуле (II):
причем арил, X, Y и R1 имеют указанное выше значение и
R3 означает химическую группу, причем R3 предпочтительно означает группу -С(=O) или группу -NH-C(=S).
Примерами арильных остатков формулы (II) являются арильные остатки формул F1, F2, F3, F4, F5, F6, F7, F8, F9, F10 и F11; эти формулы представлены на фиг.2а и на фиг.2b.
Согласно особой форме выполнения транспортируемой молекулой является олигонуклеотид. Олигонуклеотид может быть сконструирован, например, полностью из нуклеотидов, как аденозинфосфат, гуанозинфосфат, инозинфосфат, цитидинфосфат, уридинфосфат и тимидинфосфат. Согласно другим формам осуществления изобретения олигонуклеотид, в случае необходимости, может содержать одну или несколько модификаций, например химические модификации. Олигонуклеотид может обладать несколькими одинаковыми и/или разными модификациями.
Примеры химических модификаций известны специалисту и описаны, например, в работах: Е.Uhlmann и A.Peyman, Chemical Reviews, 90, 543 (1990); "Protocols for Oligonukleotides and Analogs" Synthesis and Properties and Synthesis and Analytical Techniques, ред. S. Agrawal, изд. Humana Press, Totowa, США, 1993 г., и Hunziker и С. Leumann "Nucleic Acid Analogs: Synthesis and Properties" в книге "Современные методы синтеза" (ред. Beat Ernst и С. Leumann), изд. Helvetica Chimica Acta, Базель, с.331-417.
Химическая модификация олигонуклеотида, например, может включать:
а) полную или частичную замену диэфирных мостиков фосфорной кислоты, например, фосфортиоатными, фосфордитиоатными, NR1R'-фосфорамидатными, боранофосфатными, фосфат-(C1-C21)-O-алкилэфирными, фосфат-[(C6-C12)-арил-(C1-C21)-O-алкил]эфирными, (С1-С8)-алкилфосфонатными и/или (C6-C12)-арилфосфонатными мостиками, причем
R1 и R', независимо друг от друга, означают атом водорода, (C1-C18)-алкил, (С6-С20)-арил, (C6-C20)-арил-(C1-C8)-алкил, предпочтительно атом водорода, (C1-C8)-алкил и/или метоксиэтил, особенно предпочтительно атом водорода, (C1-C4)-алкил и/или метоксиэтил;
или
R1 и R' вместе с соединенным с ними атомом азота образуют 5-6-членный гетероцикл, который дополнительно может содержать другой гетероатом из ряда О, S, N;
b) полную или частичную замену 3'- и/или 5'-диэфирных мостиков фосфорной кислоты "дефосфо"-мостиками (описано, например, Е.Uhlmann и A.Peyman в книге " Methods in Molecular Biology", том 20, "Protocols for Oligonukleotides and Analogs", ред S. Agrawal, изд. Humana Press, Totowa, 1993, глава 16, с.355 и последующие), например, формацетальными, 3'-тиоформацетальными, метилгидроксиламиновыми, оксимными, метилендиметилгидразо-, диметиленсульфоновыми и/или силильными группами;
c) полное или частичное восстановление группы (Rückgrat) фосфата сахара, например, "морфолино"-олигомерами (описано, например, Е.Р. Stirchak и др., Nucleic Acids Res., 17, 6129 (1989); и J.Summerton и D. Weller, Antisence and Nucleic Acid Drug Dev., 1, 187-195 (1997)) и/или полиамиднуклеиновыми кислотами ("PNA") (описано, например, Р.Е. Nielson и др., Bioconj. Chem., 5, 3 (1994)) и/или фосфомоноэфирами нуклеиновых кислот ("PHONA") (описано, например, Peyman и др., Angew. Chem. Int. Ed. Engl., 35, 2632-2638 (1996));
d) полную и/или частичную замену β-D-2'-дезоксирибозных единиц, например, α-D-2'-дезоксирибозой, L-2'-дезоксирибозой, 2'-F-2'-дезоксирибозой, 2'-О-(С1-С6)-алкилрибозой, 2'-O-(C2-С6)-алкенилрибозой, 2'-[О-(C1-C6)-алкил-O-(C1-C6)-алкил]рибозой, 2'-NH2-2'-дезоксирибозой, β-D-ксилофуранозой, α-арабинозой, 2,4-дидезокси-β-D-эритрогексопиранозой, конформационно ограниченными аналогами сахара, как LNA (пространственно затрудненные нуклеиновые кислоты; Singh и др., Chem. Commun., 4, 455 (1998); Singh и др., Chem. Commun., 12, 1247 (1998)) и карбоциклическими (описано, например, Froehler, J. Am. Chem. Soc., 114, 8320 (1992)) и/или аналогами сахара с открытой цепью (описано, например, Vandendriessche и др.. Tetrahedron, 49, 7223 (1993)), и/или бициклическими аналогами сахара (описано, например, М. Tarkov и др., Helv. Chim. Acta, 76, 481 (1993));
е) модификацию или соответственно полную или частичную замену природных нуклеозидных оснований, например, 5-(гидроксиметил)урацилом, 5-аминоурацилом, псевдоурацилом, псевдоизоцитозином, дигидроурацилом, 5-(C1-C6)-алкилурацилом, 5-(С2-С6)-алкенилурацилом, 5-(С2-С6)-алкинилурацилом, 5-(C1-C6)-алкилцитоэином, 5-(С2-С6)-алкенилцитозином, 5-(С2-С6)-алкинилцитозином, 5-фторурацилом, 5-фторцитозином, 5-хлорурацилом, 5-хлорцитозином, 5-бромурацилом, 5-бромцитозином или 7-деаза-7-замещенными пуринами.
Химическая модификация олигонуклеотида включает, далее, связывание олигонуклеотида с одной или несколькими другими молекулами, которые благоприятно влияют на особые свойства олигонуклеотида, как, например, стабильность нуклеазы, сродство к последовательности-мишени и фармакокинетика, например, при гибридизации модифицированного олигонуклеотида с последовательностью-мишенью они действуют путем связывания и/или поперечной сшивки. Примерами таких других молекул являются поли-L-лиэин; интеркаляторы, как пирен, акридин, феназин и фенантридин; флуоресцирующие соединения, как флуоресцеин; кросс-линкеры, как псорален и азидопрофлавин; липофильные молекулы, как (C12-C20)-алкильные группы, предпочтительно (C12-C20)-алкильные группы; липиды, как 1,2-дигексадецил-гас-глицерин; стероиды, как холестерин или тестостерон; витамины, как витамин Е; поли- или олигоэтиленгликоль, (C12-C18)-алкилфосфатные диэфиры, предпочтительно (C14-C18)-алкилфосфатные диэфиры, и -O-CH2-СН (ОН)-О-(C12-C18)-алкильные группы, предпочтительно -O-CH2-СН (ОН)-О-(C12-C18)-алкильные группы. Эти другие молекулы могут быть конъюгированы с 5'- и/или 3'-концом и/или с внутренней частью последовательности, например, с нуклеозидным основанием. Способы получения такого рода модифицированных олигонуклеотидов известны специалистам в данной области и описаны, например, Е.Uhlmann и A.Peyman, Chem. Rev., 90, 543 (1990) и/или М. Manoharan "Antisense Research and Applications", ред. Crooke и Lebleu, CRC Press, Boca Raton, 1993, глава 17, с.303 и последующие; и/или в заявке ЕР-А-0552766.
Далее, согласно особой форме осуществления изобретения, олигонуклетид на 3'- и/или 5'-конце может обладать 3'-3'- и/или 5'-5'-инверсиями. Этот тип химической модификации известен специалистам в данной области и описан, например, М. Кода и др., J. Org. Chem., 56, 3757 (1991).
В случае конъюгата, который состоит из одного или нескольких олигонуклеотидов и одного или нескольких арильных остатков, предпочтительно формулы (I) или формулы [II), связывание (конъюгацию) арильных остатков с олигонуклеотидом можно осуществлять, например, по 5'-концу (А), по 3'-концу (F), по гетероциклическому основанию (Е и G), по сахару (С) или по межнуклеозидному мостику (В) олигонуклеотида. Связывание, например можно, однако, также осуществлять через ненуклеотидные структурные элементы, например случай (D). Эти примеры представлены на фиг.3.
Указанные модификации, соответственно, можно также конечно использовать в случае более длинных полинуклеотидов и, в общем и целом, в случае пригодных моно-, или соответственно, динуклеотидов, или соответственно, -нуклеозидов.
Олигонуклеотиды имеют длину, например, от 8 до 50 нуклеотидов, предпочтительно 10-20 нуклеотидов. Однако, также пригодны более длинные олигонуклеотиды, или соответственно, полинуклеотиды, например, длиной 50-10000 нуклеотидов, предпочтительно 100-1000 нуклеотидов, которые, в случае необходимости, могут быть также двухцепочечными.
Олигонуклеотиды могут иметь любую последовательность. Последовательность олигонуклеотида выбирают, или соответственно, обозначают, в зависимости от выбранной мишени, то есть, в случае, если мишенью является нуклеиновая кислота, то в зависимости от ее последовательности, или в случае, если мишенью является протеин, то в зависимости от нуклеотидной последовательности, которая кодирует этот протеин-мишень. Если, например, мишенью является вирус, например вирус цитомегалий (CMV), ВИЧ, вирус гепреса человека 1 (HSV-1), вирус герпеса человека 2 (HSV-2), вирус гриппа, VSV, вирус гепатита В или вирус папилломы, тогда олигонуклеотид может иметь, например, одну из следующих последовательностей:
a) против вируса цитомегалии:
последовательность №12: 5'-GCGTTTGCTCTTCTTCTTGCG-3'
b) против ВИЧ, например:
последовательность №13: 5'-ACACCCAATTCTGAAAATGG-3' или
последовательность №14: 5'-AGGTCCCTGTTCGGGCGCCA-3' или
c) против вируса герпеса человека 1, например, последовательность №15: 5'-GCGGGGCTCCATGGGGGTCG-3'
Мишенью может быть, например, протеин, который принимает участие в возникновении рака, или является ответственным за рост раковой опухоли. Примерами таких мишеней являются:
1) нуклеарные онкопротеины, как, например, c-myc, N-myc, c-myb, c-fos, c-fos/jun, PCNA, p120;
2) цитоплазматические/ассоциированные с мембраной онкопротеины, как, например, EJ-ras, c-Ha-ras, N-ras, rrg, bcl-2, cdc-2, c-raf-1, c-mos, c-src, c-abl, c-ets;
3) клеточные рецепторы, как, например, EGF-рецептор, Her-2, с-erbA, VEGF-рецептор (KDR-1), ретиноидные рецепторы, протеинкиназная регуляторная субъединица, c-fms, Tie-2, c-raf-1-киназа, РКС-альфа, протеинкиназа А (R1-альфа);
4) цитокины, факторы роста, внеклеточные матрицы, как, например, CSF-1, IL-6, IL-1a, IL-1b, IL-2, IL-4, IL-6, IL-8, bFGF, VEGF, миелобластин, фибронектин.
Олигонуклеотиды, которые направлены против таких мишеней, могут иметь, например, следующую последовательность оснований:
a) против c-Ha-ras, например:
последовательность №16: 5'-CAGCTGCAACCCAGC-3' или
последовательность №17: 5'-TATTCCGTCAT-S' или
последовательность №18: 5'-TTCCGTCATCGCTCCTCAGGGG-3'
b) против bFGF, например:
последовательность №19: 5'-GGCTGCCATGGTCCC-3'
c) против с-myc, например:
последовательность №20: 5'-GGCTGCTGGAGCGGGGCACAC-3'
последовательность №21: 5'-AACGTTGAGGGGCAT-3'
d) против c-myb, например:
последовательность №22: 5'-GTGCCGGGGTCTTCGGGC-3'
e) против c-fos, например:
последовательность №23: 5'-CGAGAACATCATCGTGG-3'
последовательность №24: 5'-GGAGAACATCATGGTCGAAAG-3'
последовательность №25: 5'-CCCGAGAACATCATGGTCGAAG-3'
последовательность №26: 5'-GGGGAAAGCCCGGCAAGGGG-3'
f) против р120, например:
последовательность №27: 5f-CACCCGCCTTGGCCTCCCAC-3'
g) против EGF-рецептора, например:
последовательность №28: 5'-GGGACTCCGGCGCAGCGC-3'
последовательность №29: 5'-GGCAAACTTTCTTTTCCTCC-3'
h) против супрессора опухоли р53, например:
последовательность №30: 5'-GGGAAGGAGGAGGATGAGG-3'
последовательность №31: 5'-GGCAGTCATCCAGCTTCGGAG-3'
i) против bcl-2
последовательность №32: 5'-TCTCCCAGCGTGCGCCAT-3'
k) против VEGF
последовательность №33: 5'-GCGCTGATAGACATCCATG
последовательность №34: 3'-CCAGCCCGGAGG-5',5'-GGAGGCCCGACC-3'
последовательность №35: 3'-CGGAGGCTTTGG-5',5'-GGTTTCGGAGGC-3'
последовательность №36: 3'-GATGGAGGTGGT-5',5'-TGGTGGAGGTAG-3'
последовательность №37: 3'-GGAGGTGGTACG-5',5'-GCATGGTGGAGG-3'
последовательность №38: 3'-GGTGGTACGGTT-5',5'-TTGGCATGGTGG-3'
последовательность №39: 3'-CACCAGGGTCCG-5',5'-GCCTGGGACCAC-3'
последовательность №40: 3'-CCAGGGTCCGAC-5',5'-CAGCCTGGGACC-3'
последовательность №41; 3'-AGGGTCCGACGT-5',5'-TGCAGCCTGGGA-3'
последовательность №42; 3'-GGGTCCGACGTG-5',5'-GTGCAGCCTGGG-3'
последовательность №43: 3'-GGTCCGACGTGG-5',5'-GGTGCAGCCTGG-3'
последовательность №44: 3'-CCGACGTGGGTA-5',5'-ATGGGTGCAGCC-3'
последовательность №45; 3'-GTAGAAGTTCGG-5',5'-GGCTTGAAGATG-3'
последовательность №46: 3'-ACGCCCCCGACG-5',5'-CCAGCCCCCGCA-3'
или
последовательность №47: 3'-CCCCCGACGACG-5',5'-GCAGCAGCCCCC-3'
l) против c-raf-киназы
последовательность №48: 5'-TCCCGCCTGTGACATGCATT
m) против РКС-альфа
последовательность №49: 5'-GTTCTCGCTGGTGAGTTTCA
n) против протеинкиназы А
последовательность №50: 5'-GCGTGCCTCCTCACTGGC
Если мишенью является интегрин или рецептор адгезии клетка-клетка, как, например, VLA-4, VLA-2, ICAM, VCAM или ELAM, то олигонуклеотид может иметь, например, одну из следующих последовательностей:
a) VLA-4, например:
последовательность №51: 5'-GCAGTAAGCATCCATATC-3'
b) ICAM-1, например:
последовательность №52: 5'-GCCCAAGCTGGCATCCGTCA
последовательность №53: 5'-СССССАССАСТТССССТСТС-3'
последовательность №54: 5'-СТСССССАССАСТТССССТС-3'
последовательность №55: 5'-GCTGGGAGCCATAGCGAGG-3'
c) ELAM-1, например:
последовательность №56: 5'-ACTGCTGCCTCTTGTCTCAGG-3'
последовательность №57: 5'-CAATCAATGACTTCAAGAGTTC-3'
d) альфа-интегрин (V)
последовательность №58: 5'-GCGGCGGAAAAGCCATCG
Если мишень представляет собой протеин, который является ответственным за пролиферацию или миграцию, или соответственно, принимает участие в этих процессах или этом процессе, как, например:
1) нуклеарные трансактиваторные протеины и циклины, как, например, c-myc, c-myb, c-fos, c-fos/jun, циклины и cdc-2-киназа;
2) митогены или факторы роста, как, например, PDGF, bFGF, VEGF, EGF, HB-EGF и TGF-β;
3) клеточные рецепторы, как, например, bFGF-рецептор, EGF-рецептор и PDGF-рецептор,
тогда олигонуклеотид может иметь, например, одну из следующих последовательностей оснований:
a) c-myb
последовательность №59: 5'-GTGTCGGGGTCTCCGGGC-3'
b) c-myc
последовательность №60: S'-CACGTTGAGGGGCAT-3'
c) cdc-2-киназа
последовательность №61: 5'-GTCTTCCATAGTTACTCA-3'
d) PCNA (нуклеарный антиген пролиферирующей клетки крысы)
последовательность №62: S'-GATCAGGCGTGCCTCAAA-3'
Если мишенью является, например, аденозин-А1-рецептор, аденозин-А3-рецептор, брадикинин-рецептор или IL-13, то возможна, например, последовательность оснований:
последовательность №63: 5'-GATGGAGGGCGGCATGGCGGG.
Были получены следующие олигонуклеотиды (5'→3'):
ON1: 5'-d(G*CGAC*GC*CAT*GAC*G*G) последовательность №1
ON2: 5'-d(C*GAC*GC*CAT*G*A*C) последовательность №2
ON3: 5'-d(A*T*GAC*GGAA*T*T*C) последовательность №3
ON4: 5'-d(TATTCCGTCAT) последовательность №4
ON5: 5'-(dA)20 последовательность №5
ON6: 5'-(dA)50 последовательность №6
ON7: 5'-(dA)80 последовательность №7
ON8: 5'-T*T*CC*AT*GG*TG*G*C последовательность №8
ON9: 5'-T*T*CA*CT*GT*GG*G*C последовательность №9
ON10: 5'-T*G*GC*GC*CG*GG*C*C последовательность №10
ON11: 5'-T*G*CC*GG*CC*GG*G*C последовательность №11
причем знак * указывает положения, в которых фосфодиэфирный мостик заменен фосфортиоатным межнуклеозидным мостиком.
Эти последовательности были превращены в следующие конъюгаты (КО):
KO_1: FS-Li1-ON1
KO_2: F0-Li1-ON1
KO_3: F3-Li1-ON2
KO_4: F0-Li1-ON2
KO_5: F3-Li1-ON3
KO_6: F9-Li1-ON3
KO_7: F2-Li1-ON3
KO_8: F0-Li1-ON3
KO_9: F3-Li1-ON3-родамин
KO_10: F9-Li1-ОN3-родамин
KO_11: F6-Li1-ОN3-родамин
KO_12: F0-Li1-ОN3-родамин
KO_13: F3-Li1-ON4
KO_14: F3-Li1-ON5
KO_15: F3-Li1-ON6
KO_16: F3-Li1-ON7
KO_17: F3-Li1-ON8
KO_18: F3-Li1-ON9
KO_19: F3-Li1-ON10
KO_20: F3-Li1-ON11
KO_21: F7-Li1-ON3
причем
"F1-F1" означают арильные остатки формул F1-F11 (см., например, фиг.2);
"Li1" означает 6-аминогексилфосфатный остаток, который связан с 5'-концом олигонуклеотида (см., например, Приложение 4);
"ON1-ON11" означают описанные олигонуклеотиды с последовательностями от последовательности №1 до последовательности №11;
и "родамин" означает обнаруживаемую наряду с флуоресцеином родаминовую маркировку на 3'-конце олигонуклеотида.
Объектом изобретения также является способ получения предлагаемых согласно изобретению конъюгатов. Изобретение относится к способу получения конъюгата, который содержит транспортируемую молекулу и по меньшей мере один арильный остаток, предпочтительно формул (I) или (II), причем:
a) получают транспортируемую молекулу, которая содержит реакционноспособную функциональную группу в положении, с которым должен быть связан арильный остаток;
b) получают арильный остаток и
c) транспортируемую молекулу вводят во взаимодействие с арильным остатком до получения конъюгата.
Реакционноспособной функциональной группой предпочтительно является аминогруппа, меркаптогруппа, хлорацетильная группа, изоцианатная группа, изотиоцианатная группа, карбоксильная группа, N-гидроксисукцинимидная группа или хлорангидридная группа карбоновой кислоты. Взаимодействие транспортируемой молекулы с арильным остатком осуществляют при значении рН≤7,5, особенно предпочтительно при значении рН≤7,3, более предпочтительно при значении рН около 7 или при более низком значении рН, например, при значении рН≤7, предпочтительно при значении рН≤6,5. В случае этих реакций сочетания все другие реакционноспособные группы перед реакцией нужно защищать с помощью известных специалистам в данной области защитных групп.
Согласно особой форме осуществления способа транспортируемой молекулой является полинуклеотид, олиногуклеотид или мононуклеотид.
Способ получения включает на первой стадии получение транспортируемой молекулы. В этой связи изобретение относится также к способу получения олигонуклеотидов. Олигонуклеотиды можно получать с помощью различных известных химических способов, как, например, описано F.Eckstein "Oligonucleotides and Analogues, A Practical Approach", изд. IRL Press, Оксфорд. Олигонуклеотиды можно также получать способами, которые включают, в случае необходимости, одну или несколько ферментативных стадий. Получение олигонуклеотидных конъюгатов в принципе описано в литературе (J.Goodchild, Bioconjugate Chem., 1, 165 (1990); S. Beaucage и R. lyer, Tetrahedron, 49, 1925 (1993); S. Agrawal "Methods in Molecular Biology", том 26: "Protocols for oligonucleotide Conjugates", (1994), Humana Press).
При синтезе олигонуклеотидных конъюгатов согласно формуле (I), однако, нужно обращать внимание на то, что они могут разлагаться в щелочной среде. Поэтому, например, при использовании общепринятых методов невозможен синтез маркированных с помощью FDA олигонуклеотидов в синтезаторе олигонуклеотидов, так как сложноэфирные группы FDA-группы уже гидролизовались бы при обработке аммиаком, которая необходима для отщепления олигонуклеотида от носителя и отщепления аминозащитных групп гетероциклических оснований. Поэтому олигонуклеотид сначала получают в незащищенной форме в виде предшественника и на последней стадии конденсируют с группой согласно формуле (I) (фиг.5). Предшественник олигонуклеотида обладает реакционноспособной или активируемой функциональной группой, которую затем дериватизируют известными специалисту способами с помощью реагента, который содержит предлагаемую согласно изобретению группу согласно формуле (I). В качестве реакционноспособных или, соответственно, активируемых функциональных групп используют, например, аминогруппы, меркаптогруппы, хлорацетильные группы, изо(тио)цианатные группы и карбоксильные группы.
Особенно легко можно вводить в олигонуклеотиды так называемые аминолинкеры с помощью коммерчески доступных реагентов. Аминолинкер-олигонуклеотиды затем, например, вводят во взаимодействие с реакционноспособными реагентами, которые содержат группу согласно формуле (I). Такими реакционноспособными реагентами являются, например, соответствующие изотиоцианаты. Группа согласно формуле (I) в этом случае связана через тиомочевинную группу (Приложение 4). Другими реакционноспособными реагентами являются, например, хлорангидриды карбоновых кислот. Мягкими реакционноспособными реагентами являются, например, N-гидроксисукцинимиды соответствующих карбоновых кислот. Активируемыми реагентами являются, например, соответствующие карбоновые кислоты, которые могут связывать с пептидными реагентами сочетания, как HBTU, TBTU или TOTU. В этом случае группа согласно формуле (I) связана через амидную функциональную группу. В принципе предлагаемые согласно изобретению группы формулы (I) можно вводить в любые положения олигонуклеотида. Предпочтительны указанные на фиг.3 п