Способ хирургического лечения гастрошизиса и омфалоцеле у новорожденных
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к хирургии, и может использоваться для лечения гастрошизиса и омфалоцеле. Для этого производят расширение дефекта передней брюшной стенки, удаление пупка. После удаления пупка проводят отсепаровку кожи и подкожной клетчатки от мышц передней брюшной стенки посредством введения в подкожную клетчатку 10-20 мл 0,25% раствора новокаина. Выполняют тоническое растяжение мышц передней брюшной стенки в течение 2-3 минут. Затем эвентрированные органы погружают во вновь сформированную брюшную полость. Проводят аллопластику, в качестве аллотрансплантата используют твердую мозговую оболочку, подвергшуюся консервации в 0,5% раствор формалина при температуре +4°С в течение одного месяца. Причем твердую мозговую оболочку подшивают к апоневрозу узловыми капроновыми швами в количестве 10-20. Кожу над дефектом ушивают наглухо и затем по обе стороны раны выполняют в шахматном порядке насечки длиной 0,7-0,8 см в количестве 10-15 штук. Способ позволяет повысить выживаемость новорожденных до 90%, снизить частоту послеоперационных осложнений, сформировать наиболее физиологическую форму брюшной стенки, избежать на 90% в постоперационном периоде "синдром нижней полой вены". 2 ил.
Реферат
Предлагаемое изобретение относится к медицине, а именно к хирургии, и может использоваться для лечения гастрошизиса и омфалоцеле.
Актуальность поисков нового метода пластики передней брюшной стенки в настоящий момент очевидна. В последние годы по данным литературы и собственных наблюдений (5) отмечается увеличение количества новорожденных с пороками развития передней брюшной стенки. В качестве аналогов можно выделить пластику передней брюшной стенки по Гроссу (1, 4), закрытие дефекта по методу Шустера (2, 4) (применение силастикового мешка).
Сущность пластики по Гроссу при омфалоцеле заключается в следующем. На первом этапе острым и тупым путем удаляют амниотическую оболочку вместе с кожным ободком, избегая ее травмирования. Лигируют пупочные сосуды. Мобилизуют мышцы и апоневроз от кожи. Формируют вентральную грыжу, ушивая края кожи над грыжевым выпячиванием узловыми швами, с нанесением насечек по обеим сторонам от раны в шахматном порядке. На втором этапе производят пластику передней брюшной стенки у детей старше одного года.
Недостатками первого метода являются:
1. Высокая частота развития спаечного процесса при травмировании интимной брюшины (сращение внутренних органов с кожей в 100% случаев).
2. Нанесенные насечки при отсутствии брюшины могут служить входными воротами инфекции.
Сущность пластики по Шустеру заключается в подшивании вдоль края дефекта к прямым мышцам силастикового мешка для создания искусственной брюшной полости с постепенным погружением в нее внутренних органов посредством наложения стягивающих швов на синтетический материал. Вторым этапом удаляют аллопластический материал и производят ушивание брюшной стенки.
Недостатками метода Шустера являются:
1. Необходимость проведения как минимум двух анестезиологических пособий в короткий промежуток времени, что ухудшает дальнейший прогноз.
2. Возможность развития аллергической реакции на синтетический материал силастик.
3. Высокая стоимость метода.
4. Длительность лечения в связи с многодневным погружением внутренних органов в брюшную полость (второй этап пластики выполняется на 5-10 сутки).
За прототип предлагаемого метода выбран предложенный в 1993 г. В.Г.Баировым способ отсроченной радикальной операции с использованием заплаты (3), суть которого заключается в следующем.
Первым этапом после расширения дефекта передней брюшной стенки вверх и вниз, удаления пуповинного остатка и погружения эвентрированных органов в брюшную полость к мышечно-апоневротическому краю дефекта передней брюшной стенки, образовавшегося при растяжении краев раны (без отсепаровки кожи), подшивается с помощью непрерывного обвивного шва заплата из медицинской перчаточной резины. Последняя выкраивается таких размеров, чтобы при ее подшивании создавалось некоторое натяжение. Кожную рану не ушивают. В течение 6-8 суток послеоперационного периода проводится активная декомпрессия желудочно-кишечного тракта: высокое промывание кишечника и желудка, в т.ч. муколитическими ферментами, стимуляция перистальтики кишечника (ФТЛ, прозерин с третьих суток послеоперационного периода). К концу 1-й недели после операции обычно удается настолько опорожнить кишечник и даже отчасти добиться восстановления его функции (появление самостоятельного стула), что создаются благоприятные условия для повторного оперативного вмешательства - удаления заплаты и радикальной операции.
Недостатками прототипа являются:
1. Возможность возникновения аллергической реакции на синтетический материал (перчаточную резину).
2. Увеличение частоты гнойно-септических осложнений и развивающегося спаечного процесса в брюшной полости вследствие контакта петель кишечника с инородным телом.
3. Необходимость повторного вмешательства в ограниченные сроки, что связанно с агрессивностью используемого материала.
Применение твердой мозговой оболочки (ТМО) по описанной ниже методике позволяет снизить вдвое частоту возникновения подобных осложнений, чему способствуют: гипоаллергенность, прочность, пластичность, наличие гладкой поверхности аллотрансплантата, простота и дешевизна консервирования.
В задачу предлагаемого изобретения положено:
1. Повышение выживаемости новорожденных за счет снижения послеоперационных осложнений гнойно-септического, аллергического и спаечного характера вследствие отсутствия необходимости повторного вмешательства в ранние сроки и свойств используемого аллотрансплантата.
2. Формирование наиболее физиологичной формы передней брюшной стенки.
3. Осуществление профилактики "синдрома нижней полой вены" у детей с выраженной висцероабдоминальной диспропорцией (омфалоцеле больших размеров).
Поставленная задача в способе лечения гастрошизиса и омфалоцеле, включающем расширение дефекта передней брюшной стенки, удаление пупка, погружение эвентрированных органов во вновь сформированную брюшную полость с последующей аллопластикой дефекта, достигается тем, что после удаления пупка проводят отсепаровку кожи и подкожной клетчатки от мышц передней брюшной стенки посредством введения в подкожную клетчатку 10-20 мл 0,25% раствора новокаина, выполняют тоническое растяжение мышц передней брюшной стенки в течение 2-3 минут и затем эвентрированные органы погружают во вновь сформированную брюшную полость; при аллопластике в качестве аллотрансплантата используют твердую мозговую оболочку, подвергшуюся консервации в 0,5% растворе формалина при температуре +4°С в течение одного месяца, причем твердую мозговую оболочку подшивают к апоневрозу узловыми капроновыми швами в количестве 10-20, кожу над дефектом ушивают наглухо и затем по обе стороны раны выполняют в шахматном порядке насечки длиной 0,7-0,8 см в количестве 10-15 штук.
Новый технический результат заключается в следующем
1. Применение данной методики пластики передней брюшной стенки у новорожденных с гастрошизисом и омфалоцеле в совокупности с качественной предоперационной подготовкой и адекватным послеоперационным ведением позволило добиться 90% выживаемости детей с данной патологией в серии наблюдений, что напрямую связано со снижением частоты послеоперационных осложнений.
По данным нашей клиники применение указанного метода пластики передней брюшной стенки позволило снизить летальность 71, 43% в 1995 г, когда применялись радикальная пластика и пластика по Гроссу до 22,22% в 2003 г.
2. При использовании данной методики удалось сформировать наиболее физиологичную форму брюшной стенки вследствие использования биологического материала в качестве аллотрансплантата.
3. Создание адекватной по размеру брюшной полости позволило избежать развитие у больных в послеоперационном периоде "синдрома нижней полой вены" в 90% случаев.
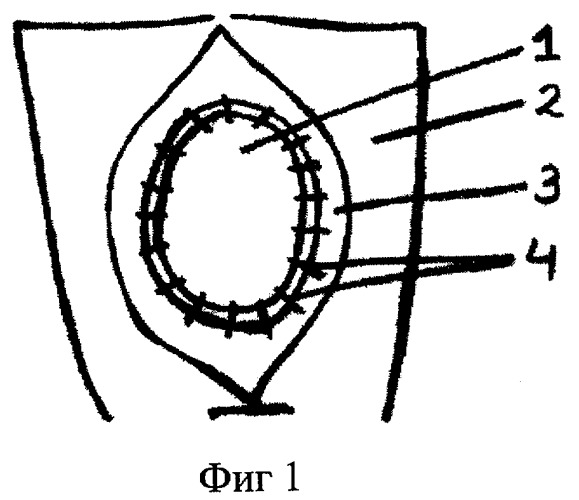
Этапы проведения предлагаемого способа иллюстрируются схемами, представленными на фиг.1, 2.
На фиг.1 показан этап хирургической операции после подшивания твердой мозговой оболочки.
На фиг.2 показан этап операции после ушивания кожи над дефектом и выполняется по обеим сторонам от раны в шахматном порядке насечек длиной 0,7-0,8 см в количестве 10-15 штук.
На фиг.1, 2 обозначено:
1. Твердая мозговая оболочка (ТМО).
2. Передняя брюшная стенка.
3. Апоневроз мышц передней брюшной стенки.
4. Узловые капроновые швы, соединяющие ТМО с апоневрозом мышц передней брюшной стенки.
5. Шов кожи.
6. Кожные насечки, наносимые в шахматном порядке.
Предлагаемый способ осуществляется следующим образом.
Выполняют срединную лапаротомию с отсечением пупка, лигированием пупочных артерий и вены.
Производят ревизию органов брюшной полости. При относительно нормальном тонком и толстом кишечнике (эти пороки всегда сопровождаются незавершенным поворотом кишечника и общей брыжейкой тонкой и толстой кишки) определяют возможность одномоментного погружения эвентрированных органов в брюшную полость и выполнения радикальной пластики передней брюшной стенки местными тканями. Для облегчения этого производят отсепаровку кожи и подкожной клетчатки от мышц передней брюшной стенки до передне-подмышечной линии посредством введения в подкожную клетчатку 10-20 мл 0,25% раствора новокаина. Далее для увеличения объема брюшной полости выполняют тоническое растяжение мышц передней брюшной стенки в течение 2-3 минут. Эвентрированные органы погружают во вновь сформированную брюшную полость, после чего определяют возможность радикальной пластики.
При невозможности ее выполнения производят аллопластику дефекта. В качестве аллотрансплантата используют твердую мозговую оболочку, подвергшуюся консервации в 0,5% растворе формалина при температуре +4°С в течение одного месяца, что необходимо для получения ее эластичности, стерильности и прочности. Твердая мозговая оболочка подшивается к апоневрозу узловыми капроновыми швами (4.0) на расстоянии 0,8-0,9 см друг от друга. Всего накладывается от 10 до 20 швов. Это обеспечивает герметичное закрытие дефекта передней брюшной стенки. С органами брюшной полости контактирует гладкая поверхность ТМО, что исключает возникновение спаек (фиг.1). Кожу над дефектом ушивают наглухо. Для уменьшения ее натяжения и предупреждения некротизирования в шахматном порядке по обе стороны от раны выполняются насечки длиной 0,7-0,8 см в количестве от 10 до 15 на расстоянии не менее 2,5-3 см от краев раны (фиг.2). Это позволяет также избежать инфицирования и сохранить эластичность кожи передней брюшной стенки.
В настоящее время твердую мозговую оболочку используют в хирургической практике. Как правило, в нейрохирургии, офтальмологии, дентальной имплантации, эстетической хирургии (см., например, патенты RU №2001112489, №93002829) при этом используют различным образом подготовленную твердую мозговую оболочку: лиофилизированную (патенты RU №2146899); выдержанную в течение 1-3 суток в 0,5-0,6%-ном растворе нейтрального формалина, а затем в 1%-ном растворе этония в течение 2-3 недель (патент RU №2027407). В ходе разработки предлагаемого способа была исследована возможность применения различных методов подготовки твердой мозговой оболочки и установлено, что наибольший эффект в смысле результатов лечения дает использование твердой мозговой оболочки, подготовленной следующим образом: консервации в 0,5% растворе формалина при температуре +4°С в течение одного месяца.
Попытки использования других методов подготовки не дали положительных результатов (6).
Примеры конкретного выполнения способа представлены в виде выписок из историй болезни:
Пример 1. Ребенок А. (м.) в первые сутки жизни прооперирован по поводу гастрошизиса (2003 г., история болезни №13343). После проведения предоперационной подготовки выполнена пластика дефекта передней брюшной стенки ТМО. Суть метода заключалась в следующем. Выполнена срединная лапаротомия с отсечением пупка, лигированием пупочных артерий и вены.
Произведена ревизия органов брюшной полости. Констатирован незавершенный поворот кишечника и общая брыжейка тонкой и толстой кишки. Вследствие выраженного синдрома висцероабдоминальной диспропорции выполнить радикальную пластику передней брюшной стенки местными тканями не представлялось возможным. Произведена отсепаровка кожи и подкожной клетчатки от мышц передней брюшной стенки до передне-подмышечной линии посредством введения в подкожную клетчатку 20 мл 0,25% раствора новокаина. Далее для увеличения объема брюшной полости выполнено тоническое растяжение мышц передней брюшной стенки в течение 2-3 минут.
Твердая мозговая оболочка подшита к апоневрозу узловыми капроновыми швами (4.0) на расстоянии 0,8-0,9 см друг от друга. Всего наложено от 12 швов. Кожа над дефектом ушита наглухо. Для уменьшения ее натяжения и предупреждения некротизирования в шахматном порядке по обе стороны от раны выполнено 10 насечек длиной 0,7-0,8 см. Послеоперационный период протекал удовлетворительно. Послеоперационная рана зажила первичным натяжением. Ребенок выписан домой в возрасте 1 мес.13 дней в удовлетворительном состоянии.
Пример 2. Ребенок З. (м.) в первые сутки жизни прооперирован по поводу гастрошизиса (2003 г., история болезни №5605). Выполнена пластика дефекта передней брюшной стенки ТМО. Послеоперационный период протекал удовлетворительно. Рана передней брюшной стенки (ПБС) зажила первичным натяжением. Мальчик выписан домой в возрасте 1 мес. 23 дней в удовлетворительном состоянии.
Пример 3. Ребенок К. (м.) в первые сутки жизни прооперирован по поводу гастрошизиса (2003 год, история болезни №3291). Выполнена пластика дефекта передней брюшной стенки ТМО. Послеоперационный период протекал удовлетворительно. Рана (ПБС) зажила первичным натяжением. Пациент выписан домой в возрасте 25 дней в удовлетворительном состоянии.
Всего предлагаемым способом к настоящему времени пролечено 38 человек. Положительные результаты свидетельствуют о достижении положенных в изобретение задач:
1. Применение данной методики пластики передней брюшной стенки у новорожденных с гастрошизисом и омфалоцеле в совокупности с качественной предоперационной подготовкой и адекватным послеоперационным ведением позволило добиться 90% выживаемости детей с данной патологией в серии наблюдений, что напрямую связано со снижением частоты послеоперационных осложнений.
По данным нашей клиники применение указанного метода пластики передней брюшной стенки позволило снизить летальность 71,43% в 1995 г, когда применялись радикальная пластика и пластика по Гроссу до 22,22% в 2003 г.
2. При использовании данной методики удалось сформировать наиболее физиологичную форму брюшной стенки вследствие использования биологического материала в качестве аллотрансплантата.
3. Создание адекватной по размеру брюшной полости позволило избежать развитие у больных в послеоперационном периоде "синдрома нижней полой вены" в 90% случаев.
Список литературы.
1. Долецкий С.Я., Гаврюшов В.В. Хирургия новорожденных. Москва. "Медицина". 1976 г., с.160-161.
2. Баиров Г.А., Дорошевский Ю.Л., Немилова Т.К. Атлас операций у новорожденных. Ленинград. "Медицина". 1984 г., с.158-163.
3. Баиров Г.А. Срочная хирургия детей Санкт-Петербург. 1997 г., с.113-116.
4. Исаков Ю.Ф., Лопухин Ю.М. Оперативная хирургия с топографической анатомией детского возраста. Москва. "Медицина". 1989 г., с.386-387.
5. Шапова Ю.А., Гусева О.И. Вопросы пренатального консультирования при гастрошизисе: Клинические наблюдения и обзор литературы // Ультразвуковая диагностика в акушерстве, гинекологии, педиатрии // том 8 №1, 2000 г., с.30-37.
6. Караваева, Светлана Александровна. Лечение гастрошизиса: Автореф. дис.... канд. мед. наук: 14.00.35. С.-Петерб. гос. педиатр. мед. акад. - СПб., 1997, 1-20 с.
Способ хирургического лечения гастрошизиса и омфалоцеле у новорожденных, включающий расширение дефекта передней брюшной стенки, удаление пупка, погружение эвентрированных органов во вновь сформированную брюшную полость с последующей аллопластикой дефекта, отличающийся тем, что после удаления пупка проводят отсепаровку кожи и подкожной клетчатки от мышц передней брюшной стенки посредством введения в подкожную клетчатку 10-20 мл 0,25%-ного раствора новокаина, выполняют тоническое растяжение мышц передней брюшной стенки в течении 2-3 мин и затем эвентрированные органы погружают во вновь сформированную брюшную полость; при аллопластике в качестве аллотрансплантата используют твердую мозговую оболочку, подвергшуюся консервации в 0,5%-ном растворе формалина при температуре +4°С в течение одного месяца, причем твердую мозговую оболочку подшивают к апоневрозу узловыми капроновыми швами в количестве 10-20, кожу над дефектом ушивают наглухо и затем по обе стороны раны выполняют в шахматном порядке насечки длиной 0,7-0,8 см в количестве 10-15 штук.