Фармацевтическая композиция для лечения и профилактики пролиферативных заболеваний
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и касается фармацевтической композиции для лечения и профилактики пролиферативных заболеваний. Изобретение заключается в том, что композиция фитонуриентов содержит эпигаллокатехин-3-галлат и индол-3 карбинола и дополнительно содержит стабилизатор индол-3-карбинола метионин. Изобретение обеспечивает получение композиции, обладающей синергической антипролиферативной активностью, и может быть использовано для лечения и профилактики доброкачественных и злокачественных опухолей ано-генитальной сферы. 2 з.п. ф-лы, 1 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области фармакологии, медицины, клинической биохимии, ветеринарии и может быть использовано для лечения и профилактики злокачественных и доброкачественных опухолей, папилломавирусных инфекций, хронических воспалительных процессов и других заболеваний, ассоциированных с активацией пролиферативных сигнальных каскадов, а также для изучения последних в научно-исследовательских целях.
Уровень техники
Защитные свойства компонентов зеленого чая, в том числе катехинов, к которым относится эпигаллокатехин-3 галлат (EGCG), в последнее время интенсивно изучаются [1-5]. Выявленные антипролиферативные свойства последнего позволили использовать его в качестве одного из компонентов лекарственных комбинаций (композиций) для лечения и профилактики соответствующих заболеваний (см., например, патенты США 6759064, 6717506, 6680342, 6652840 - прототип, 6538023).
Так, в патенте США 6652840 (прототип) описана композиция EGCG с другими чайными катехинами либо с другими обычно используемыми в этих случаях терапевтическими агентами для лечения первичного или метастазирующего рака.
К недостаткам известных комбинаций (композиций) на основе EGCG, в том числе по прототипу, следует отнести недостаточно полный охват молекулярных мишеней, вовлеченных в развитие и стимуляцию пролиферативных каскадов в клетках, и, как результат - недостаточно высокую целевую активность препаратов.
Раскрытие изобретения
Изобретательской задачей является создание более универсального и эффективного лекарственного средства в отношении пролиферативных заболеваний с минимальными побочными эффектами либо с полным их отсутствием, прежде всего пролиферативных заболеваний ано-генитальной сферы, таких как опухоли простаты или молочной железы.
Изобретательская задача решается тем, что предлагается фармацевтическая композиция для лечения и профилактики пролиферативных заболеваний, включающая эпигаллокатехин-3-галлат и индол-3-карбинол в количестве 30-80% и 20-70%, соответственно в эффективном количестве. Компоненты принимают одновременно или раздельно и могут быть представлены в виде одной таблетки или капсулы. Кроме того, комбинация может дополнительно содержать структурный стабилизатор индол-3 карбинола, в качестве последнего предлагается использовать метионин в количестве 5-10% к основному компоненту. Предлагаемая композиция может быть использована при лечении и профилактике всех заболеваний, при которых присутствуют признаки пролиферации, наблюдаемые при всех гиперпластических процессах - опухолях злокачественных и доброкачественных, преимущественно ано-генитальной сферы, таких как опухоли простаты и молочной железы.
Антипролиферативная активность индол-3 карбинола, источником которого являются овощи семейства крестоцветных (белокочанная, краснокочанная, цветная капуста, и др.) достаточно хорошо изучена на модельных системах (в условиях научных экспериментов), в частности, в отношении эстроген-зависимых и эстроген-независимых опухолей [6, 7].
Однако в качестве противоопухолевых средств нашли применение замещенные производные индол-3 карбинола, обладающее большей избирательной цитотоксичностью, однако имеющие и большую общую токсичность, чем природный аналог (см. патенты США 6656963, 6369095, 61503395, 6001868, 59488080).
Заявители разработали способы профилактики и лечения папилломатоза гортани и рака шейки матки, обусловленные инфицированном вируса папилломатоза человека HPV16 и HPV18, фармацевтическими композициями на основе индол-3 карбинола (Патент России 2196568).
Несмотря на то что компоненты комбинации известны, их сочетание в качестве антипролиферативного средства предложено впервые, для которого в рамках заявленных соотношений заявителем установлен синергизм целевого действия, не вытекающего из уровня техники.
Можно отметить, что теоретическая возможность такой комбинации описана в патентной публикации США №2001003744, однако ее назначение другое - диабет и его осложнения.
Краткое описание чертежей.
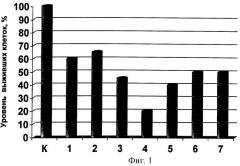
Фиг.1. Апоптотическая активность смесей I3C и EGCG в различных концентрациях. Условные обозначения: К - контроль, 1 - EGCG (100%), 2 - I3C (100%), 3 - EGCG+I3C (80:20), 4 - EGCG+I3C (70:30), 5- EGCG+I3C (50:50), 6 - EGCG+I3C (30:70), 7 - EGCG+I3C (20:80).
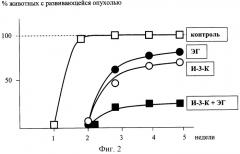
Фиг.2. Ингибирующая активность смеси I3C и EGCG по отношению опухоли простаты в сравнительном аспекте в отношении отдельного приема I3C и EGCG.
Осуществление изобретения
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение композиций и состав инкапсулированной лекарственной формы. Приготовление композиций, в том числе для наполнения капсул.
Эпигаллокатехин смешивают с аэросилом до однородного распределения компонентов. К полученной смеси добавляют половину молочного сахара. Перемешивают 2 мин. Затем добавляют индол-3-карбинол. Перемешивают 1 мин. Вносят остаток молочного сахара. Перемешивают 1 мин. Добавляют стеарат магния и перемешивают 1 мин. Смесь передают на капсулирование. Масса содержимого капсулы - 0,4 г.
Содержание эпигалокатехингаллата может колебаться в пределах 0,05-0,25 г на одну капсулу, а соотношение EGCG и I3C - от 80:20 до 30:70; смесь может содержать 5-10% метионина от общего веса действующего начала, который преимущественно вводится в композицию вместе с I3C. Ниже представлены составы капсул в г, когда соотношение EGCG:I3С˜33:67 и при содержании метионина 7,5% от общего веса композиции.
| (I) | (II) | ||
| Индол-3 -карбинол | 0,1 | Индол-3-карбинол | 0,1 |
| Эпигаллокатехин | 0,05 | Эпигаллокатехин | 0,05 |
| Молочный сахар 80меш (лактозы моногидрат 80 меш) | 0,248 | Молочный сахар (лактозы моногидрат 80 меш) | 0,248 |
| Кремния диоксид коллоидный (аэросил) | 0,001 | Кремния диоксид коллоидный (аэросил) | 0,001 |
| Стеарат магния | 0,001 | Стериат магния | 0,001 |
| Масса содержимого капсулы | 0,4 | Метионин | 0,06 |
| Масса содержимого капсулы | 0,4 |
Пример 2. Исследования апоптотической активности смеси EGCG+I3C исследовались на крысах Sprague-Dawley. Индукция опухолевого роста стимулировалась канцерогеном диметилбензантраценом (ДМБА). Через 1 месяц после воздействия ДМБА на протяжении 2 месяцев в питание крысам добавлялась композиция EGCG+I3C в различных концентрационных сочетаниях: 80:20, 70:30, 50:50, 30:70, 20:80 соответственно. Смеси давлись крысам ab libitium, в количестве 0,5 мл ежедневно три раза в день. Кроме того, использовались EGCG №1 (100%) и I3C №2 (100%) по отдельности (из расчета 1 г/мл). В контрольной группе крысы получали дистиллированную воду. В каждой группе было по 8 крыс. После окончания эксперимента проводились экстирпация опухолей и уровень апоптоза оценивался иммуногистохимически в соответствии со стандартным протоколом TUNEL [8]. Результаты представлены на Фиг.1. Показано, что наибольший процент гибели клеток вызывает композиция EGCG+I3C в соотношении 70:30, в то время как поптотический индекс, вызванный остальными смесями, был ниже. Полученные данные свидетельствуют о наличии биологического синергизма между указанными веществами, об усилении противоопухолевого эффекта в случае совместной дачи препарата.
Пример 3. Индукция апоптоза на клетках MCF-7, - эстроген-зависимой опухоли молочной железы оценивались в следующем эксперименте. Маркерами апоптоза являются каспазы - ферменты, вовлеченные в последние стадии апоптотичеких клеточных каскадов. Оценка каспазной активности оценивается, в часности, по расщеплению поли(АДФ)-рибозы-полимеразы (PARP). Результатом активации каспазы-3 является детекция 85-кДа фрагмента PARP, что можно оценить визуально при постановке Ветерн-блотта. Для детекции использовались коммерческие анти-PARP-антитела. Контрольный образец обрабатывался дистиллированной водой. Остальные культуры MCF-7 клеток подвергались обработке в соответствии с дозировкой, приведенной в предыдущем примере. В эксперименте оценивались только каспаза-3, поскольку остальные каспазы (-8 и -9), вовлеченные в развитие апоптотических каскадов, являются ее регуляторами и активаторами. Оценка каспазной активности проводилась по поглощению на 405 нм на планшетном ридере. Результаты активации каспазы-3 под влиянием смеси приведены в таблице.
| Таблица 1.Эффект смеси EGCG+I3C на активацию каспазы 3. | |
| Комбинация препаратов | Каспаза-3 |
| Контроль | 0 |
| EGCG | 0,06 |
| I3C | 0,1 |
| EGCG+I3C (80:20) | 0,19 |
| EGCG+I3C (70:30) | 0,195 |
| EGCG+I3C (50:50) | 0,18 |
| EGCG+I3C (30:70) | 0,175 |
| EGCG+I3C (20:80) | 0,17 |
Из таблицы видно, что стимуляция каспазной активности наиболее выражена при дозировке смеси компонентов EGCG+I3C в соотношении 70:30.
Пример 4. Проводилось лечение диффузных мастопатий на ограниченном контингенте больных различными комбинациями EGCG и I3C. Исследования проводились в соответствии с нормами и правилами, принятыми для проведения клинических испытаний, согласно национальным требованиям GCP [9]. В исследовании участвовали пациенты с разной степенью и формами мастопатий, контрольные значения были получены на этих же больных до приема препарата. Больные были разделены на группы в соответствии с тем, какой тип смеси компонентов им был предложен. Оценка пролиферативной активности смеси компонентов мониторировалась визуально (сцинтиография) с применением радиоактивных изотопов, разрешенных для использования с диагностическими целями, а также количественно (% накопления радиоизотопов в ткани). Статистическая обработка данных проводилась с применением t-критерия, уровень значимости был выбран р<0,05. Оценивались антипролиферативная активность следующих смесей: 1 - EGCG (700 мг в день), 2 - I3C (300 мг в день), 3 - EGCG+I3C (8:2), 4 - EGCG+I3C (7:3), 5 - EGCG+I3C (1:1), 6 - EGCG+I3C (3:7), 7 - EGCG+I3C (2:8). В ходе исследований были получены достоверные данные о наличии синергизма между компонентами, и наиболее оптимальным выбрано соотношение EGCG+I3C (7:3), в котором ежедневная дозировка составляла 600 мг и 300 мг соответственно. При этом соотношении оптимальным способом приема препарата является 200 мг EGCG и 100 мг I3C трижды в день.
Пример 5. Механизм малигнизации клеток простаты во многом напоминает развитие рака молочной железы. Пусковым механизмом является нарушение гормональной регуляции клеток простаты (C.A.Heinlein and С.Chang Androgen Receptor in Prostate Cancer, Endocrine Reviews 25(2):276-308-2004).
В качестве экспериментальной модели использованы крысы породы "Копенгаген" клеточная линия рака простаты крысы (MLL) выращивалась на среде РПМИ 1640 и вводилась подкожно в количестве 20 тыс. клеток на 1 животное. Когда опухоль достигла видимых размеров, животным вводили внутрибрюшинно исследуемые препараты 2 раза в неделю. В эксперименте участвовали 4 группы животных (см. Фиг.2).
1 - получали 300 мкг индол-3-карбинола,
2 - получали 300 мкг эпигалокатехингаллата,
3 - 100 мкг индол-3-карбинола и 200 мкг эпигалокатехингаллата (по примеру 1)
4 - контрольная группа.
Как следует из результатов исследования, представленных на графике, совмесное применение индол-3-карбинола и эпигалокатехингаллата обладает существенно большей ингибирующей активностью по отношению к опухоли простаты в экспериментах на крысах.
1. Фармацевтическая композиция для лечения и профилактики пролиферативных заболеваний, включающая эпигаллокатехин-3-галлат, отличающаяся тем, что она дополнительно содержит индол-3-карбинол при следующем содержании компонентов, мас.%:
| Эпигаллокатехин-3 галлат | 30-80,0 |
| Индол-3-карбинол | 20-70,0 |
2. Композиция по п.1, отличающаяся тем, что она дополнительно содержит структурный стабилизатор индол-3-карбинола метионин в количестве 5-10% от общего веса действующего начала.
3. Композиция по п.1, отличающаяся тем, что пролиферативное заболевание представляет собой доброкачественные и злокачественные опухоли аногенитальной сферы.