Молекулы, подобные фактору vii или viia
Иллюстрации
Показать всеНастоящее изобретение касается новых конъюгатов полипептида фактора VII (FVII) или фактора VIIa (FVIIa), их получения и применения в медицине, в частности, при лечении ряда заболеваний, связанных со свертыванием крови. Предложен конъюгат, содержащий, по меньшей мере, одну молекулу сахарида, ковалентно присоединенную к введенному сайту N-гликозилирования in vivo, в котором полипептидная часть конъюгата имеет аминокислотную последовательность, которая отличается от приведенной в SEQ ID NO:1 последовательности FVII или FVIIa дикого типа по 1-15 аминокислотным остаткам. Конъюгаты настоящего изобретения обладают как минимум одним из улучшенных свойств по сравнению с коммерчески доступным rFVIIa, включая увеличение функционального периода полужизни in vivo, и/или повышение периода полужизни в плазме, и/или уменьшение чувствительности к протеолитической деградации. 15 з.п. ф-лы, 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается новых конъюгатов полипептида фактора VII (FVII) или фактора VIIa (FVIIa), их получения и применения в медицине, в частности, при лечении ряда заболеваний, связанных со свертыванием крови.
Уровень техники
Свертывание крови - это процесс, состоящий из сложных взаимодействий между различными компонентами (или факторами) крови, который приводит в конечном счете к образованию фибринового сгустка. Как правило, компоненты крови, участвующие в том, что было названо коагуляционным "каскадом", являются проферментами или зимогенами, то есть ферментативно неактивными белками, которые превращаются в активные формы под действием активатора. Одним из таких коагуляционных факторов является FVII.
FVII - зависимый от витамина К белок плазмы, который синтезируется в печени и секретируется в кровь в виде одноцепочечного гликопротеина с молекулярным весом 53 кД (Broze & Majerus. J.Biol. Chem., 1980; 255: 1242-12247). Зимоген FVII обращается в активную форму (FVIIa) при ферментативном расщеплении в единственном сайте, R152-I153, что приводит к образованию двух цепей, связанных одним дисульфидным мостиком. FVIIa в комплексе с тканевым фактором (комплекс FVIIa) способен превращать факторы IX и Х в активные формы, что вызывает реакции, приводящие к быстрому образованию тромбина и фибрина (Osterud & Rapaport, Proc Natl Acad Sci USA 1977; 74: 5260-5264).
FVII подвергается посттрансляционным модификациям, включая витамин К-зависимое карбоксилирование, приводящее к образованию десяти остатков γ-карбоксиглутаминовой кислоты в N-концевом участке молекулы. Так, остатки под номерами 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35, приведенные в SEQ ID NO: 1, являются остатками γ-карбоксиглутаминовой кислоты в домене Gla, важном для активности FVII. Другие посттрансляционные модификации включают присоединение углеводной части в двух природных сайтах N-гликозилирования в положении 145 и 322, соответственно, и в двух природных сайтах O-гликозилирования в положении 52 и 60, соответственно.
Ген, кодирующий FVII человека (hFVII), был картирован в области q34-qter9 хромосомы 13 (de Grouchy et al., Hum. Genet. 1984; 66: 230-233). Он содержит девять экзонов и имеет протяженность в 12,8 Kb (O'Hara et al., Proc Natl Acad Sci USA 1987; 84: 5158-5162). Организация гена и структура белка FVII близки таковым у других витамин К-зависимых прокоагулянтных белков, при этом экзоны 1а и 1b кодируют сигнальную последовательность, экзон 2 кодирует пропептид и домен Gla, экзон 3 - короткий гидрофобный участок, экзоны 4 и 5 - домены, подобные фактору роста эпидермиса, а экзоны 6-8 кодируют каталитический домен сериновой протеазы (Yoshitake et al., Biochemistry 1985; 24: 3736-3750).
Существуют экспериментальные работы по трехмерной структуре hFVIIa (Pike et al., PNAS, USA, 1999; 96: 8925-30 и Kemball-Cook et al., J.Struct. Biol., 1999; 127: 213-223), по комплексу hFVIIa с растворимым тканевым фактором с применением методов рентгеноструктурного анализа (Banner et al., Nature, 1996; 380: 41 и Zhang et al., J.Mol. Biol., 1999, 285: 2089), а также по мелким фрагментам hFVII (Muranyi et al., Biochemistry, 1998; 37: 10605 и Као et al., Biochemistry, 1999; 38: 7097).
Известно лишь сравнительно небольшое число искусственно сконструированных вариантов FVII (Dickinson & Ruf, J. Biol. Chem., 1997; 272:19875-19879, Kemball-Cook et al., J. Biol. Chem., 1998; 273: 8516-8521, Bharadwaj et al., J.Biol. Chem., 1996; 271:30685-30691, Ruf et al., Biochemistry, 1999; 38: 1957-1966).
Имеются работы по экспрессии FVII в клетках ВНК или других клетках млекопитающих (WO 92/15686, WO 91/11514 и WO 88/10295) и по экспрессии FVII вместе с эндопротеазой kex2 в эукариотических клетках (WO 00/28065).
Коммерческие препараты рекомбинантного FVIIa человека имеются в продаже под названием NovoSeven®. NovoSeven® показан при лечении кровотечений у больных гемофилией А или В. NovoSeven® является единственным коммерчески доступным препаратом rFVIIa для эффективного и надежного лечения кровотечений.
В патенте WO 91/1154 приводится неактивная форма FVII с модифицированным аргинином 152 и/или изолейцином 153. Эти аминокислоты располагаются в сайте активации. В WO 96/12800 описана инактивация FVIIa ингибитором сериновых протеиназ, а инактивация путем карбамоилирования FVIIa по α-аминокислотной группе I153 была описана Petersen et al., Eur. J.Biochem., 1999; 261: 124-129. Инактивированная форма способна конкурировать с FVII или FVIIa дикого типа за связывание с тканевым фактором и ингибировать свертывающую активность. Было предложено применять инактивированную форму FVIIa при лечении пациентов в состоянии гиперкоагуляции, например, пациентов с сепсисом, с риском инфаркта миокарда или тромботического инсульта.
Как сообщалось в "Summary Basis for Approval for NovoSeven®", PDA №96-0597, период полужизни циркулирующего rFVIIa составляет 2,3 часа. Для достижения и поддержания нужного терапевтического или профилактического эффекта требуются относительно высокие дозы и частое введение препарата. Вследствие этого трудно добиться адекватной регуляции дозы, а необходимость в частом внутривенном введении налагает ограничения на образ жизни пациента.
Другая проблема применяемого в настоящее время лечения с помощью rFVIIa состоит в относительной неустойчивости молекулы к протеолитической деградации. Протеолитическая деградация является основной помехой при получении препарата в растворе по сравнению с лиофилизированным продуктом. Преимущество получения стабильного растворимого препарата заключается в более простом обращении для больного и в случае критических состояний - в более быстром действии, которое может стать критическим для спасения жизни. Попытки предотвращения протеолитической деградации при помощи направленного мутагенеза в основных сайтах протеолиза были описаны в WO 88/10295.
Молекулы с более длительным периодом полужизни при циркуляции могли бы снизить число необходимых введений. Учитывая, что существующие продукты FVIIa требуют частых инъекций и то, что есть возможность получения более оптимальных терапевтических уровней FVIIa с сопутствующим усилением терапевтического действия, очевидно, существует потребность в усовершенствовании молекул, подобных FVII или FVIIa.
Один из путей для увеличения периода полужизни циркулирующего белка состоит в том, чтобы уменьшить почечный клиренс белка. Этого можно достичь путем конъюгации белка с химической группой, способной обеспечить снижение почечного клиренса белка.
Кроме того, присоединение химической группы к белку или замещение подверженных протеолизу аминокислот может эффективно блокировать контакт с протеолитическим ферментом, ведущий к протеолитической деградации белка. Одной из химических групп, применявшихся при получении терапевтических белковых препаратов, является полиэтиленгликоль (ПЭГ).
В WO 98/32466 предполагается, что FVII, как и многие другие белки, может быть ПЭГилирован, но в нем не содержится никакой дополнительной информации об этом.
Сущность изобретения
Настоящая заявка раскрывает усовершенствованные молекулы FVII и FVIIa, в частности, рекомбинантные молекулы hFVII и hFVIIa, обеспечивающие одно или несколько вышеуказанных преимуществ. Так, конъюгат настоящего изобретения обладает одним или более усовершенствованными свойствами по сравнению с существующими коммерческими rFVIIa, включая увеличение функционального периода полужизни in vivo и/или повышение периода полужизни в плазме и/или повышение биодоступности и/или снижение чувствительности к протеолитической деградации. Соответственно, медицинское применение конъюгата изобретения дает ряд преимуществ перед коммерчески доступным соединением rFVIIa, например более длительные промежутки между инъекциями.
Таким образом, первый аспект изобретения касается конъюгата, включающего, по меньшей мере, одну неполипептидную молекулу, ковалентно присоединенную к полипептиду, у которого аминокислотная последовательность отличается от приведенной в SEQ ID NO:1 последовательности FVII или FVIIa дикого типа тем, что в нее был введен или из нее удален, по меньшей мере, один аминокислотный остаток, содержащий группу для связывания указанной неполипептидной молекулы.
Другой аспект изобретения касается полипептида, у которого аминокислотная последовательность отличается от приведенной в SEQ ID NO: 1 последовательности FVII или FVIIa дикого типа тем, что в нее был введен или из нее удален, по меньшей мере, один аминокислотный остаток, содержащий группу для связывания указанной неполипептидной молекулы. Такие новые полипептиды FVII можно считать полезными для лечения, диагностики или других целей как таковые, но они представляют особый интерес в качестве промежуточных соединений для получения конъюгата по изобретению.
Следующие аспекты изобретения касаются нуклеотидной последовательности, кодирующей полипептид изобретения или полипептидную часть конъюгата изобретения; а также экспрессионного вектора, несущего нуклеотидную последовательность изобретения, и клеток хозяина, содержащих нуклеотидную последовательность изобретения или экспрессионный вектор изобретения.
Другие аспекты изобретения касаются фармацевтических композиций, содержащих конъюгат изобретения, а также способов получения и применения таких конъюгатов.
Подробное раскрытие изобретения
Определения
В контексте настоящей заявки и изобретения применяются следующие определения.
Термин "конъюгат" (или эквивалентный ему "конъюгированный полипептид") служит для определения гетерогенной (в смысле составной или химерной) молекулы, которая образуется при ковалентном присоединении к одному или нескольким полипептидам одной или нескольких неполипептидных частей типа молекул полимеров, липофильных соединений, углеводов или органических реагентов. Предпочтительно конъюгат растворим при соответствующих концентрациях и условиях, а именно растворим в таких физиологических жидкостях, как кровь. Примеры конъюгированных полипептидов изобретения включают гликозилированные и/или ПЭГилированные полипептиды.
Термин "ковалентное соединение" означает, что полипептид и неполипептидная молекула ковалентно соединены друг с другом либо непосредственно, либо через промежуточную группу или группы - мостик, спейсер или соединительную группу или группы.
Термин "неконъюгированный полипептид" может применяться к полипептидной части конъюгата.
В настоящем изобретении термин "неполипептидная молекула" означает молекулу, способную конъюгировать с соответствующей группой связывания на полипептиде изобретения. Предпочтительные примеры таких молекул включают молекулы полимеров, углеводы, липофильные соединения или органические реагенты. При использовании в контексте конъюгата изобретения следует иметь в виду, что неполипептидная молекула соединяется с полипептидом конъюгата через соответствующую группу (группу связывания) самого полипептида. Как указано выше, неполипептидная молекула может ковалентно присоединяться к группе связывания либо непосредственно, либо через промежуточную группу или группы - мостик, спейсер или соединительную группу или группы.
"Полимерная молекула" - это молекула, которая образуется при ковалентном соединении двух или более мономеров, причем ни один из мономеров не является аминокислотным остатком, за исключением случаев, когда полимер является альбумином человека или другим распространенным белком плазмы. Термин "полимер" может быть заменен термином "молекула полимера". Этот термин также охватывает углеводные молекулы, присоединенные путем гликозилирования in vitro, то есть химического гликозилирования, проводимого in vitro, которое в норме включает ковалентное присоединение молекулы углевода к группе связывания на полипептиде, необязательно с помощью перекрестно-сшивающего агента.
Углеводные молекулы, присоединенные при гликозилировании in vivo типа N- или O-гликозилирования (как будет описано ниже) обозначаются в настоящем изобретении как "углеводная часть". За исключением тех случаев, когда число неполипептидных молекул типа полимеров или углеводных молекул в конъюгате указано прямо, каждое упоминание неполипептидной части" в составе конъюгата или в каком-нибудь другом смысле в настоящем изобретении означает одну или несколько неполипептидных молекул типа полимеров или углеводов.
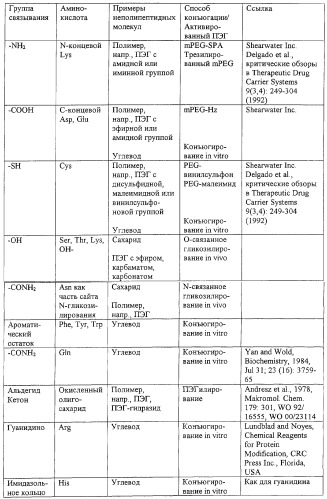
Термин "группа связывания" служит для обозначения функциональной группы полипептида, в частности его аминокислотного остатка или углеводной группы, способной к присоединению неполипептидной молекулы, такой как молекула полимера, липофильная молекула, сахарид или органический реагент. Полезные группы связывания и соответствующие им неполипептидные молекулы приведены ниже в таблице.
Для N-гликозилирования in vivo термин "группа связывания" применяется нестандартным образом для указания аминокислотных остатков, составляющих сайт N-гликозилирования (с последовательностями N-X-S/T/C, где Х - любой аминокислотный остаток, кроме пролина, N - аспарагин и S/T/C - серии, треонин или цистеин, предпочтительно серин или треонин, и наиболее предпочтительно треонин). Хотя именно остаток аспарагина в сайте N-гликозилирования является местом присоединения сахарида в процессе гликозилирования, такое присоединение невозможно, если в сайте N-гликозилирования нет остальных аминокислотных остатков.
Соответственно, в случае, когда неполипептидная молекула представлена сахаридом и конъюгация достигается путем N-гликозилирования, термин "аминокислотный остаток, содержащий группу для связывания неполипептидной молекулы", употребляемый в связи с изменениями аминокислотной последовательности конкретного полипептида, следует понимать в том смысле, что один или несколько аминокислотных остатков, входящих в состав сайта N-гликозилирования, следует изменить таким образом, чтобы в аминокислотную последовательность был введен функциональный сайт N-гликозилирования или же удален из нее.
В настоящей заявке названия аминокислот и атомов (к примеру, СА, СВ, CD, CG, SG, NZ, N, О, С и т.д.) применяются в соответствии с Банком Данных по Белкам (PDB) (www.pdb.org) на основании номенклатуры IUPAC (IUPAC Nomenclature and Symbolism for Amino Acids and Peptides (residue names, atom names etc.), Eur. J.Biochem., 138, 9-37 (1984) с поправками в Eur. J.Biochem., 152, 1 (1985)).
Термин "аминокислотный остаток" служит для обозначения аминокислотных остатков из числа остатков аланина (Ala или А), цистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ile или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gln или Q), аргинина (Arg или R), серина (Ser или S), треонина (Thr или Т), валина (Val или V), триптофана (Тгр или W) и тирозина (Туг или Y).
Терминология, применяемая для определения положения аминокислот, иллюстрируется следующим образом: G124 означает, что положение 124 в аминокислотной последовательности, приведенной в SEQ ID NO:1, занято остатком глицина. G124R означает, что остаток глицина в положении 124 был замещен остатком аргинина. Альтернативные замещения указываются значком "/", например K32D/E обозначает аминокислотную последовательность, в которой лизин в положении 32 замещен аспарагиновой или глутаминовой кислотой. Множественные замены обозначаются значком "+", например K143N+N145S/T означает аминокислотную последовательность, содержащую замену остатка лизина в положении 143 остатком аспарагина и замещение остатка аспарагина в положении 145 остатком серина или треонина. Введение дополнительного аминокислотного остатка, скажем, введение остатка аланина после G124, обозначается как G124GA. Удаление аминокислотного остатка обозначается звездочкой. К примеру, удаление глицина в положении 124 обозначается как G124*. Если не указано иначе, нумерация аминокислотных остатков в настоящем изобретении соответствует аминокислотной последовательности FVII/FVIIa дикого типа, приведенной в SEQ ID NO: 1.
Термин "отличается от" в применении к конкретным мутациям служит для отображения дополнительных отличий, присутствующих отдельно от указанных аминокислотных отличий. Так, наряду с удалением и/или введением аминокислотных остатков, содержащих группу связывания для неполипептидной части, полипептид FVII или FVIIa может содержать другие замены, не связанные с введением и/или удалением этих аминокислотных остатков. Таким образом, наряду с аминокислотными изменениями, раскрытыми в настоящем изобретении с целью удаления и/или введения сайтов для присоединения неполипептидной части, следует иметь в виду, что аминокислотная последовательность полипептида по изобретению может, если потребуется, содержать другие изменения, которые не обязательно связаны с введением или удалением сайтов присоединения, то есть другие замены, вставки или делеции. Например, к ним относятся укорочение N- и/или С-концевых участков на один или несколько аминокислотных остатков или введение одного или нескольких дополнительных остатков в N- и/или С-конец, например добавление остатка метионина в N-конец, а также "консервативные аминокислотные замены", то есть замены, проводимые в пределах группы аминокислот со схожими характеристиками, например небольших аминокислот, кислых аминокислот, полярных аминокислот, основных аминокислот, гидрофобных аминокислот и ароматических аминокислот.
В частности, предпочтительные замены в настоящем изобретении можно выбрать из числа консервативных замен по группам, перечисленным в нижеследующей таблице.
| 1 | Аланин (А) | Глицин (G) | Серин (S) | Треонин (Т) |
| 2 | Аспарагиновая кислота (D) | Глутаминовая кислота(Е) | ||
| 3 | Аспарагин (N) | Глутамин (Q) | ||
| 4 | Аргинин (R) | Гистидин (Н) | Лизин (К) | |
| 5 | Изолейцин (I) | Лейцин (L) | Метионин (М) | Валин (V) |
| 6 | Фенилаланин (F) | Тирозин (Y) | Триптофан (W) |
Термины "мутация" и "замена" в настоящем изобретении могут заменять друг друга.
Термин "нуклеотидная последовательность" служит для обозначения непрерывного отрезка из двух или более молекул нуклеотидов. Нуклеотидная последовательность может происходить из генома, кДНК, РНК, иметь полусинтетическое или синтетическое происхождение или представлять любую их комбинацию.
Термин "полимеразная цепная реакция" или "ПЦР" в общем означает метод амплификации требуемой нуклеотидной последовательности in vitro, как описано, к примеру, в US 4683195. В общем случае метод ПЦР заключается в многократном повторении цикла реакций удлинения праймера с помощью олигонуклеотидных праймеров, способных предпочтительно гибридизироваться с матричной нуклеиновой кислотой.
"Клетка", "клетка-хозяин", "клеточная линия" или "культура клеток" в настоящем изобретении применяются взаимозаменяемо и следует иметь в виду, что все эти термины включают поколения, образующиеся в результате роста или культивирования клетки. "Трансформация" и "трансфекция" могут заменять друг друга и означают процесс введения ДНК в клетку.
"Функционально связанный" обозначает ковалентное соединение двух или более нуклеотидных последовательностей путем ферментативного лигирования или другим способом в такой конфигурации друг относительно друга, чтобы могло осуществляться нормальное функционирование этих последовательностей. Например, нуклеотидная последовательность, кодирующая последовательность предшественника или лидера секреции функционально связана с нуклеотидной последовательностью, кодирующей полипептид, если при этом экспрессируется белок-предшественник, участвующий в секреции этого полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию этой последовательности; сайт связывания с рибосомой функционально связан с кодирующей последовательностью, если он находится в таком положении, что способствует трансляции. Обычно "функционально связанный" означает, что соединенные нуклеотидные последовательности прилегают друг к другу и, в случае лидера секреции, прилегают друг к другу и находятся в одной рамке считывания. Соединение совершается путем лигирования в соответствующих сайтах рестрикции. Если таких сайтов нет, то применяются синтетические олигонуклеотидные адаптеры или линкеры в соответствии со стадартными методами рекомбинантной ДНК.
Термин "ввести" относится к введению аминокислотного остатка, содержащего группу связывания для неполипептидной части, особенно путем замены существующего аминокислотного остатка или же введения дополнительного аминокислотного остатка.
Термин "удалить" относится к удалению аминокислотного остатка, содержащего группу связывания для неполипептидной части, особенно путем замены аминокислотного остатка, который следует удалить, другим аминокислотным остатком, или же путем делеции (без замены) аминокислотного остатка, подлежащего удалению.
Термин "FVII" или "полипептид FVII" относится к молекуле FVII, находящейся в одноцепочечной форме.
Термин "FVIIa" или "полипептид FVIIa" относится к молекуле FVIIa, находящейся в активированной двухцепочечной форме, после расщепления пептидной связи между R152 и I153 в одноцепочечной форме. Когда при описании аминокислотной последовательности FVIIa используется аминокислотная последовательность SEQ ID NO: 1, то следует иметь в виду, что одна цепь содержит аминокислотные остатки 1-152, а другая- 153-406.
Термины "rFVII" и "rFVIIa" обозначают молекулы FVII и FVIIa, полученные методами рекомбинантной ДНК соответственно.
Термины "hFVII" и "hFVIIa" обозначают FVII и FVIIa дикого типа человека соответственно.
Термин "каталитический сайт" применяется для обозначения каталитической триады, состоящей из S344, D242 и H193 полипептида FVII.
Термины "активный FVIIa", "активный полипептид FVIIa", "активный конъюгат FVIIa" или "активный конъюгат" применяются для обозначения полипептида или конъюгата FVIIa, обладающего, по меньшей мере, 10% каталитической активности hFVIIa дикого типа. Каталитическую активность можно соответственно определить методом, описанным в разделе "Методы измерения каталитической активности ", или методом, озаглавленным "Метод измерения низких уровней каталитической активности" (см. раздел Материалы и Методы). Предпочтительно активный конъюгат обладает, по меньшей мере, 15%, например не менее 20% или 25%, более предпочтительно не менее 30% или 40%, наиболее предпочтительно не менее 50% или 60% каталитической активности hFVIIa дикого типа при определении методами, описанными выше.
Предпочтительно активный конъюгат способен связываться с тканевым фактором, а также активировать фактор Х и/или IX плазмы. Так, в предпочтительном варианте воплощения активный полипептид FVIIa или его конъюгат обладает коагуляционной активностью не менее 25% по сравнению с FVIIa дикого типа, например не менее 50% или не менее 75% от коагуляционной активности FVIIa дикого типа. Так, коагуляционная активность активного полипептида FVIIa или его конъюгата предпочтительно составляет от 25% до 200% от активности FVIIa дикого типа. Особенно предпочтительно, чтобы полипептид или конъюгат FVIIa обладал коагуляционной активностью в пределах от 30% до 150% по сравнению с FVIIa дикого типа, например в интервале 30-100% по сравнению с FVIIa дикого типа. Коагуляционную активность можно определять любым методом, известным в этой области, как будет описано далее в разделе Материалы и Методы. Однако особенно предпочтительно, чтобы определение коагуляционной активности проводилось в соответствии с методом, описанным в разделе "Методы измерения коагуляционной активности" (см. раздел Материалы и Методы).
Термин "иммуногенность" в применении к конкретному веществу служит для обозначения способности вещества индуцировать ответ иммунной системы. Иммунный ответ может быть опосредован клетками или антителами (см. подробное определение иммуногенности, к примеру, в Roitt: Essential Immunology (8th Edition, Blackwell)). В норме пониженная реакция антител указывает на снижение иммуногенности. Снижение иммуногенности можно определить любым подходящим методом, известным в этой области, например in vivo или in vitro.
Термины "неактивный FVIIa", "неактивный полипептид FVIIa", "неактивный конъюгат FVIIa" или "неактивный конъюгат" применяются для обозначения полипептида или конъюгата FVIIa, имеющего менее 10% каталитической активности по сравнению с hFVIIa дикого типа. Каталитическую активность можно соответственно определить методом, описанным в разделе "Методы измерения каталитической активности", или методом, озаглавленным "Метод измерения низких уровней каталитической активности" (см. раздел Материалы и Методы). Предпочтительно неактивный конъюгат имеет менее 8%, например менее 6% или 5%, более предпочтительно менее 4% или 3%, наиболее предпочтительно менее 2% или 1% каталитической активности hFVIIa дикого типа при определении методами, описанными выше.
Обычно неактивный конъюгат имеет очень низкую коагуляционную активность in vitro или in vivo по сравнению с hFVIIa дикого типа. Неактивный FVII или полипептид либо конъюгат FVIIa могут конкурировать с FVII или FVIIa дикого типа за связывание с тканевым фактором, ингибируя тем самым коагуляционную активность. Предпочтительно, неактивный FVII или полипептид либо конъюгат FVIIa имеет менее 1% коагуляционной активности hFVII или hFVIIa дикого типа. Более предпочтительно, неактивный FVII или полипептид либо конъюгат FVIIa имеет менее 0,05% коагуляционной активности hFVII или hFVIIa дикого типа. Наиболее предпочтительно, неактивный FVII или полипептид либо конъюгат FVIIa имеет менее 0,01% коагуляционной активности hFVII или hFVIIa дикого типа. Подобно тому, что описано выше, коагуляционную активность можно определять любым методом, известным в этой области, как будет описано далее в разделе Материалы и Методы, но предпочтительно определяют в соответствии с методом, описанным в разделе "Метод определения коагуляционной активности ".
Термин "функциональный период полужизни in vivo" применяется в его обычном значении как время, по прошествии которого в организме/органе-мишени остается 50% биологической активности полипептида или конъюгата, или как время, по прошествии которого активность полипептида или конъюгата составляет 50% от первоначального значения. В качестве альтернативы определению функционального периода полужизни in vivo может определяться "время полужизни в сыворотке", то есть время, по прошествии которого в плазме или кровотоке циркулирует 50% молекул полипептида или конъюгата до их выведения. Определение времени полужизни в сыворотке часто бывает проще, чем определение функционального времени полужизни in vivo, и время полужизни в плазме обычно является хорошим показателем величины функционального времени полужизни in vivo. Альтернативные времени полужизни в сыворотке термины - это "время полужизни в плазме", "полупериод существования в крови", "сывороточный клиренс", "плазменный клиренс" и "период полувыведения". Полипептиды и конъюгаты выводятся при участии ретикулоэндотелиальной системы (RES), почек, селезенки или печени, опосредованной тканевым фактором, SEC-рецептором или другими рецепторами элиминации или путем специфического или неспецифического протеолиза. Обычно выведение зависит от размера (относительно предела исключения для клубочковой фильтрации), заряда, присоединенных углеводных цепей и наличия клеточных рецепторов для данного белка. Функция, о которой идет речь, обычно заключается в прокоагулянтной, протеолитической активности или связывании с рецептором. Функциональное время полужизни in vivo и время полужизни в плазме можно определить любым пригодным методом, известным в этой области, как будет подробно описано ниже в разделе Материалы и Методы.
Термин "повышение" в применении к времени полужизни in vivo или времени полужизни в плазме служит для указания того, что время полужизни данного конъюгата или полипептида статистически достоверно повышается по сравнению с контрольной молекулой типа неконъюгированного rFVIIa (например, NovoSeven®), при определении в сравнимых условиях. К примеру, соответствующее время полужизни может повышаться, по меньшей мере, на 25%, например, по меньшей мере, на 50%, 100%, 150%, 200%, 250%, 300%, 500% или 1000%.
Термин "почечный клиренс" или "выведение через почки" применяется в его обычном значении, обозначая любой способ выведения через почки, например, посредством клубочковой фильтрации, выделения из трубочек или деградации в клетках трубочек. Выведение через почки зависит от физических характеристик конъюгата, включая размер (диаметр), гидродинамический объем, симметрию, форму/упругость и заряд. Обычно молекулярный вес примерно в 67 кД считается предельным для выведения через почки. Почечный клиренс можно установить любым подходящим методом, например, одним из принятых методов in vivo. Обычно почечный клиренс определяют путем введении больному меченного (с помощью радиоактивной или флуоресцентной метки) полипептидного конъюгата и измерения активности метки в собранной у больного моче. Снижение почечного клиренса определяется по сравнению с соответствующим контрольным полипептидом, например соответствующим неконъюгированным полипептидом, неконъюгированным полипептидом соответствующего дикого типа или другим конъюгированным полипептидом (конъюгированным полипептидом, не соответствующим изобретению) в сравнимых условиях. Предпочтительно, скорость выведения конъюгата через почки снижается, по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 75% и наиболее предпочтительно, по меньшей мере, на 90% по сравнению с соответствующим контрольным полипептидом.
Способность конъюгата по изобретению проявлять пониженную чувствительность к протеолитической деградации имеет исключительное значение. Композиции, содержащие продукты деградации, обычно обладают меньшей удельной активностью по сравнению с композициями, не содержащими или содержащими очень незначительную долю деградированного конъюгата. Кроме того, наличие нефизиологических продуктов деградации во вводимой композиции может активировать иммунную систему пациента.
Термин "пониженная чувствительность к протеолитической деградации" главным образом служит для обозначения того, что конъюгат обладает пониженной чувствительностью к протеолитической деградации по сравнению с неконъюгированным FVIIa дикого типа при определении в сравнимых условиях. Предпочтительно протеолитическая деградация снижается, по меньшей мере, на 10%, например, по меньшей мере, на 25% (то есть на 10-25%), более предпочтительно, по меньшей мере, на 35%, например, по меньшей мере, на 50% (то есть на 10-50% например на 25-50%), еще более предпочтительно, по меньшей мере, на 60%, например, по меньшей мере, на 75% или даже 90%. Наиболее предпочтительно снижение протеолитической деградации на 100%. Таким образом, конъюгат по изобретению предпочтительно подвергается протеолитической деградации в меньшей степени, чем FVIIa дикого типа, то есть по сравнению с неконъюгированным FVIIa дикого типа протеолитическая деградация конъюгата изобретения предпочтительно снижена на 10-100%, например на 25-100%, более предпочтительно на 50-100% и наиболее предпочтительно на 75-100%.
Авторы настоящего изобретения разработали подходящий предварительный тест in vitro, который может применяться для оценки того, обладают ли такие конъюгаты пониженной чувствительностью к протеолитическому расщеплению (пониженным автопротеолизом). Так, в предпочтительном воплощении изобретения конъюгат изобретения имеет пониженную чувствительность к протеолитической деградации (как определено выше) по сравнению с FVIIa дикого типа при определении методом, описанным в разделе "Измерение пониженной чувствительности к протеолитической деградации", при определении методом, описанным в разделе "Метод измерения каталитической активности", или при определении методом, описанным в разделе "Метод измерения низких уровней каталитической активности" (см. раздел Материалы и Методы).
Термин "родительский FVII" или "родительский полипептид" служит для обозначения молекулы, подвергаемой модификации в соответствии с настоящим изобретением. Типичным родительским FVII является hFVII или hFVIIa (включая rFVIIa, то есть Novo Seven®) с аминокислотной последовательностью, приведенной в SEQ ID NO: 1.
"Вариант" означает полипептид, отличающийся от родительского полипептида по одному или нескольким аминокислотным остаткам, обычно по 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотным остаткам.
Конъюгаты изобретения
Конъюгаты по изобретению являются результатом по большей части новой стратегии разработки усовершенствованных молекул FVII или FVIIa. Более конкретно, при удалении и/или включении аминокислотного остатка, содержащего группу для связывания неполипептидной части, стало возможным более специфически адаптировать полипептид таким образом, чтобы сделать молекулу более чувствительной к конъюгированию с выбранной неполипептидной молекулой, оптимизировать профиль конъюгации (обеспечить оптимальное распределение и число неполипептидных частей на поверхности молекулы FVII или FVIIa и гарантировать, чтобы в молекуле были только те группы связывания, что предназначены для конъюгации) и таким образом получить новую молекулу конъюгата, обладающую или не обладающую активностью FVII и к тому же одним или более усовершенствованными свойствами по сравнению с молекулами FVII и FVIIa, доступными в настоящее время. Например, когда общее число аминокислотных остатков, содержащих группу для связывания выбранного неполипептида, повышается или сокращается до оптимального уровня, то выведение конъюгата через почки обычно значительно снижается вследствие изменения формы, размера и/или заряда молекулы при конъюгации.
В предпочтительных вариантах воплощения настоящего изобретения изменению подвергается более одного аминокислотного остатка полипептида FVII или FVIIa, например изменения включают как удаление, так и добавление аминокислотных остатков, содержащих группу для связывания выбранной неполипептидной молекулы. Наряду с удалением и/или введением аминокислотных остатков, полипептид может содержать другие замены или гликозилирования, не связанные с удалением и/или включением аминокислотных остатков, содержащих группу для связывания неполипептидной части. Кроме того, полипептид может быть соединен, к примеру, с ингибитором сериновых протеиназ, чтобы заингибировать каталитический сайт полипептида.
Аминокислотный остаток, содержащий группу для связывания неполипептидной части, который подлежит удалению или введению, выбирается на основании природы выбранной неполипептидной части и, в большинстве случаев, на основании метода, с помощью которого достигается конъюгация между полипептидом и неполипептидной молекулой. Например, когда неполипептидная часть представлена молекулой полимера типа молекул, происходящих из полиэтиленгликоля или полиалкиленоксида, аминокислотные остатки, содержащие группу связывания, можно выбрать из числа лизина, цистеина, аспарагиновой кислоты, глутаминовой кислоты, гистидина и тирозина, предпочтительно цистеина и лизина, в особенности лизина.
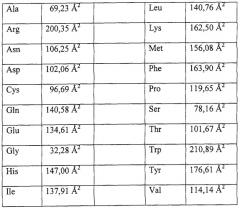
Всякий раз, когда в полипептид FVII или FVIIa надо ввести или удалить группу для связывания неполипептидной части в соответствии с настоящим изобретением, подлежащее модификации положение в полипептиде предпочтительно находится на поверхности полипептида и более предпочтительно занято аминокислотным остатком, у которого более 25% боковой цепи доступно растворителю, предпочтительно более 50% боковой цепи доступно растворителю. Такие положения были определены на основании анализа трехмерной структуры молекулы FVII или FVIIa, как описано далее в разделе Материалы и Методы. Кроме того, эти положения предпочтительно выбирают из той части молекулы FVII, которая находится в стороне от области сайта связывания тканевого фактора и/или активного сайта. Такие области определены далее в разделе Материалы и Методы. Следует подчеркнуть, однако, что в определенных ситуациях, например, когда требуется инактивированный конъюгат, предпочтительно проводят модификации вблизи или прямо в этих участках. Например, предусматривается, что одну или более групп для связывания неполипептидных молекул, скажем, сайтов N-гликозилирования in vivo, можно с пользой ввести в область активного сайта или на гребень связывающего углубления активного сайта молекулы FVII. Область активного сайта и гребень связывающего углубления активного сайта определены далее в разделе Материалы и Методы, они состоят из следующих остатков: I153, Q167, V168, L169, L170, L171, Q176, L177, С178, G179, G1