Композиция слабительного средства
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и касается композиции слабительного средства, включающей бициклическое соединение формулы I, способа, обеспечивающего слабительное действие, и применения соединений формулы I. Композиция обладает повышенной эффективностью. 3 н. и 39 з.п. ф-лы, 4 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новой композиции слабительного средства, которая применяется для облегчения и профилактики запора у пациентов - людей, страдающих запором, а также для очистки кишечника.
Уровень техники
Простагландины (в последующем обозначаются PG) представляют собой группу жирных кислот, которые обладают широким спектром физиологической активности и содержатся в тканях и органах человека и животных. PG содержат каркас простановой кислоты следующей формулы:
причем некоторые синтетические продукты могут содержать указанный выше каркас с некоторыми модификациями. Простагландины классифицируются на несколько типов по структуре и заместителям в пятичленном кольце, например:
Простагландины серии A (PGA),
Простагландины серии В (PGB),
Простагландины серии С (PGC),
Простагландины серии D (PGD),
Простагландины серии Е (PGE),
Простагландины серии F (PGF);
и т.п. Кроме того, они классифицируются на PG1, содержащие 13,14-двойную связь; PG2, содержащие 5,6- и 13,14-двойные связи; и PG3 содержащие 5,6-, 13,14- и 17,18-двойные связи.
Простагландины изображают следующим образом. Атомы углерода, составляющие в PG α-цепочку, ω-цепочку и пятичленное кольцо, нумеруются в соответствии с основным каркасом:
То есть атомы углерода, составляющие основной каркас, нумеруются таким образом, что атом углерода в карбоксильной группе обозначается С-1, а α-цепочка содержит атомы углерода от С-2 до С-7, причем номера возрастают по направлении к кольцу, пятичленное кольцо содержит атомы углерода от С-8 до С-12 и ω-цепочка содержит атомы углерода от С-13 до С-20. В случае меньшего числа атомов углерода в α-цепочке нумерация атомов углерода, последующих С-2, должна быть сдвинута надлежащим образом, а когда число атомов углерода больше 1, это соединение называется при условии, что атом углерода в положении С-2 имеет заместитель, вместо карбоксильной группы (в положении С-1). В случае меньшего числа атомов углерода в ω-цепочке их нумерация должна быть соответственно меньше чем 20, а когда число атомов углерода больше 8, атомы углерода в положении 21 и последующие следует рассматривать как заместитель.
Что касается конфигурации, то она рассматривается в соответствии с конфигурацией указанного выше основного каркаса, если не указано иное. Например, PGD, PGE и PGF означают соединения, в которых имеется гидроксильная группа в положениях С-9 и/или С-11. В настоящем изобретении PG также включает те простагландины, в которых имеется другая группа вместо гидроксильной группы в положениях С-9 и/или С-11, причем они называются 9-дегидрокси-9-замещенными или 11-дегидрокси-11-замещенными простагландиновыми соединениями.
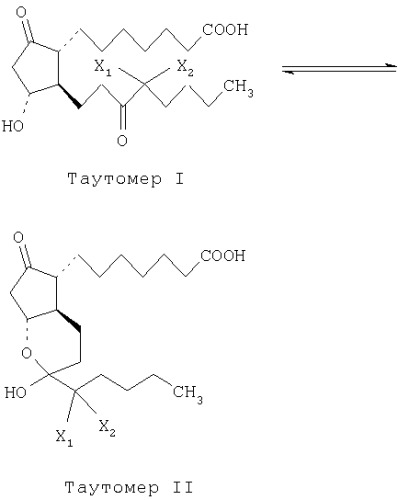
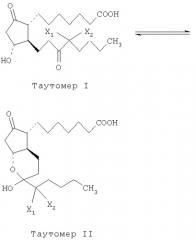
Кроме того, простагландины могут включать изомеры, такие как бициклические таутомеры, оптические изомеры; геометрические изомеры или им подобные.
Известно, что PG имеют различные виды фармакологической и физиологической активности, например расширение сосудов, индуцирование воспаления, индуцирование агрегации тромбоцитов, стимулирование мышцы матки, противоязвенная активность и т.п. Обнаружено, что PGE или PGF обладают высокой способностью к сокращению кишечника, вызванному стимулированием кишечника, в то время как эффект кишечных скоплений является слабым. Соответственно применение PGE или PGF в качестве слабительного средства невозможно вследствие побочных эффектов, таких как боль в области желудка, вызванная сокращением кишечника.
С другой стороны, обнаружено, что PG, имеющие простую 13,14-связь и С-15 карбонильную группу, и те PG, которые имеют двойную 13,14-связь и С-15 карбонильную группу, находятся в продуктах обмена веществ человека или животного. Эти 13,14-дигидро-15-кето-простагландины и 15-кето-простагландины (в последующем называются 15-кето-РС) известны как метаболиты, получаемые естественным путем за счет ферментативного обмена веществ соответствующих PG в живом организме. Сообщалось, что для этих 15-кето-PG едва проявляются различные виды физиологической активности, характерные для PG и что они являются фармакологически и физиологически неактивными метаболитами (см. Acta Physiologica Scandinavica, т.66, с.509-(1966)).
В патенте США 5317032 (Ueno и др.) описаны простагландиновые слабительные средства, включающих их бициклические таутомеры. Однако для бициклических таутомеров до сих пор неизвестна определенная активность в качестве агентов для лечения и профилактики запора.
Сущность изобретения
Тем не менее, при оценке физиологической активности аналогов 15-кето-PG авторы настоящего изобретения обнаружили, что соответствующие бициклические соединения, например бициклические таутомеры, замещенные одним или несколькими атомами галогенов, могут применяться в малых дозах для облегчения запора. Если это желательно, можно использовать увеличенные дозировки, для того чтобы вызвать сильное слабительное действие, хотя главной задачей настоящего изобретения является восстановление нормальной функции кишечника (стул от 3 до 7 раз в неделю).
Задачей настоящего изобретения является обеспечение композиции слабительного средства, лишенного побочных эффектов на кишечник, которая включает в себя эффективное количество бициклического соединения, представленного формулой (I):
где V1 и V2 представляют собой атомы углерода или кислорода;
W1, когда V1 является атомом углерода, и W2, когда V2 является атомом углерода, представляет собой
R3 и R4 представляют собой атом водорода, или один из этих заместителей является группой ОН;
X1 и Х2 представляют собой атом водорода, низший алкил или галоген, причем, по меньшей мере, один из них является галогеном;
Z представляет собой атом углерода, кислорода, серы или азота;
R2 представляют собой атом водорода или алкил;
Y представляет собой насыщенный или ненасыщенный С2-10 углеводород, замещенный или не замещенный оксо-, галогеном, алкильной, гидроксильной, арильной или гетероциклической группой;
А представляет собой -СН2OH, -COCH2OH, -COOH, или их функциональное производное; и
R1 представляет собой насыщенный или ненасыщенный низший углеводородный остаток, имеющий неразветвленную или разветвленную цепь, который не замещен или замещен атомом галогена, оксо-группой, гидрокси-группой, низшей алкокси-группой, низшей алканоилокси-группой, низшей циклоалкильной группой, низшей циклоалкилокси-группой, арильной группой, арилокси-группой, гетероциклической группой или гетероциклической окси-группой; низшую циклоалкильную группу; низшую циклоалкилокси-группу; арильную группу; арилокси-группу; гетероциклическую группу; гетероциклическую окси-группу.
связь между С-13 и С-14 является двойной или простой связью и
С-15 имеет пространственную конфигурацию R, S или их смесь.
Настоящее изобретение также обеспечивает применение соединения формулы (I) для получения композиции слабительного средства.
Настоящее изобретение также предоставляет способ, обеспечивающий слабительное действие для нуждающихся в этом пациентов, который включает в себя введение соединения формулы (I).
Хотя бициклическое галоидированное соединение формулы (I) обеспечивает превосходное слабительное действие, указанное соединение не вызывает существенных побочных эффектов, таких как боль в области желудка, вызванная сокращением кишечника. Следовательно, соединение настоящего изобретения может применяться не только для лечения хронического или перемежающегося запора, но также для лечения или профилактики запора (а также для того, чтобы вызывать опорожнение кишечника, когда это желательно) у пациентов, страдающих от запора, связанного, например, с грыжей или с заболеванием сердечно-сосудистой системы, для того чтобы не напрягаться при стуле и не страдать от проктогенных заболеваний. Более того, эта композиция может применяться для обеспечения нормальной перистальтики кишечника для вымывания вредных веществ из кишечника в случае медикаментозного или пищевого отравления. Кроме того, бициклические галоидированные соединения настоящего изобретения могут использоваться в качестве агента, очищающего кишечник, применяемого для подготовки кишечника к предупредительным, диагностическим или хирургическим процедурам.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает композицию слабительного средства, которая включает в себя эффективное в качестве слабительного количество бициклического соединения формулы (I).
Слабительные средства функционируют путем комбинирования одного или нескольких из четырех механизмов, приведенных ниже, в результате чего возрастает содержание воды в фекалиях и облегчается перемещение содержимого в кишечнике:
i). Вода и электролиты могут сохраняться в кишечнике благодаря гидрофильности или осмотическому воздействию лекарства, в результате чего увеличивается объем содержимого внутри кишечника, что косвенно приводит к более быстрому перемещению содержимого.
ii). Лекарство может воздействовать на слизистую оболочку кишечника, снижая общую величину обычной абсорбции электролитов и воды и увеличивая количество воды, что косвенно приводит к более быстрому перемещению содержимого кишечника.
iii). Лекарство может воздействовать на слизистую оболочку кишечника, увеличивая общую величину обычной секреции электролитов и воды и увеличивая количество воды, что непосредственно и/или косвенно приводит к более быстрому перемещению содержимого кишечника.
iv). Лекарство сначала воздействует на перистальтику кишечника, ускоряя перемещение, что косвенно приводит к уменьшению общего поглощения воды и электролитов, поскольку уменьшается время, в течение которого они могут поглощаться.
Применяемый в настоящем изобретении тест кишечных скоплений предназначается для исследования в основном механизмов ii) и/или iii), которые определяют действие лекарства на скопление воды внутри кишечника путем измерения объема содержимого внутри кишечника. Для бициклических галоидированных соединений настоящего изобретения может наблюдаться очень сильный эффект на эти скопления. Более того, они вызывают слабое или легкое сокращение кишечника, что представляет собой один из индексов для оценки действия механизма iv). В соответствии с этим считается, что бициклические галоидированные соединения формулы (I) настоящего изобретения облегчают запор главным образом путем непосредственного и/или косвенного воздействия на слизистую оболочку кишечника, чтобы повлиять на перемещение электролитов и воды из стенок кишечника в кровеносные сосуды и/или из кровеносных сосудов в кишечник, что приводит к снижению поглощения воды и/или к увеличению секреции воды через кишечник, повышенному скоплению воды внутри кишечника и облегчению перемещения содержимого кишечника.
В определениях формулы (I) термин «ненасыщенный» означает включение как минимум одной или более двойных связей и/или тройных связей, которые изолированно, отдельно или последовательно присутствуют между атомами углерода в главной и/или боковых цепях. Ненасыщенная связь между двумя последовательными положениями указывается путем приведения меньшего числа из двух положений, а ненасыщенная связь между двумя удаленными положениями обозначается с указанием обоих положений. Предпочтительными ненасыщенными связями являются двойная связь в положении 2 и двойная или тройная связь в положении 5.
Термин «низший» включает группу, имеющую от 1 до 8 атомов углерода, если не указано иное.
Термин «атом галогена» включает атомы фтора, хлора, брома или йода. Особенно предпочтительным является атом фтора.
Термин «низшая алкокси» относится к группе низший алкил-O-, в которой низший алкил представляет собой разветвленную или неразветвленную цепь насыщенной углеводородной группы, содержащей от 1 до 6 атомов углерода, и включает, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил.
Термин «низшая гидроксиалкильная группа» относится к низшим алкильным группам, которые определены выше, замещенным как минимум одной гидрокси-группой, такой как гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил и 1-метил-1-гидроксиэтил.
Термин «низшая алканоилокси-группа» относится к группе, представленной формулой RCO-O-, в которой RCO является ацильной группой, образовавшейся при окислении описанной ранее низшей алкильной группы, такой как ацетил.
Термин «низший циклоалкил» относится к циклической группе, образовавшейся при циклизации указанной ранее низшей алкильной группы, но содержащей три и более атома углерода, и включает, например, циклопропил, циклобутил, циклопентил и циклогексил.
Термин «низшая циклоалкилокси» относится к низшей циклоалкил-O-группе, в которой низшая циклоалкильная группа является такой, как определено выше.
Термин «арил» может включать замещенные или незамещенные ароматические карбоциклические группы (предпочтительно моноциклические группы), например фенил, нафтил, толил и ксилил. Примерами заместителей являются атом галогена и низший галоидалкил, в котором атом галогена и низший алкил такие, как определено выше.
Термин «арилокси» относится к группе, представленной формулой ArO-, в которой Ar представляет собой арил, такой как определено выше.
Термин «гетероциклическая группа» может включать моноциклические гетероциклические группы, в цикле которых имеются от 5 до 14 атомов, предпочтительно от 5 до 10 атомов, содержащие в качестве составляющих атомов необязательно замещенные атомы углерода и от 1 до 4, предпочтительно от 1 до 3 гетероатомов одного или двух типов, выбранных из атома кислорода, атома азота и атома серы, и конденсированные гетероциклические группы, содержащие до 3 циклических функциональных групп, по меньшей мере одна из которых представляет собой указанную выше моноциклическую группу. Примеры гетероциклических групп включают фурильную группу, тиенильную группу, пирролил, оксазолил, изоксазолил, тиазолиловую группу, изотиазолиловую группу, имидазолиловую группу, пиразолиловую группу, фуразанильную группу, пиранильную группу, пиридил, пиридазил, пиримидил, пиразильную группу, 2-пирролинил, пирролидинил, 2-имидазолинил, имидазолидиниловую группу, 2-пиразолиниловую группу, пиразолидиниловую группу, пиперидиновую группу, пиперазиниловую группу, морфолиновую группу, индолильную группу, бензотиенильную группу, хинолильную группу, изохинолильную группу, пурил, хиназолиниловую группу, карбазолиловую группу, акридинил, фенантридинил, бензимидазолил, бензимидазолонил, фенотиазинильную группу. Примеры заместителей в этом случае включают атом галогена и галогензамещенный низший алкил, в котором атом галогена и низший алкил являются такими, как описано выше.
Термин «гетероциклическая окси-группа» означает группу, представленную формулой Нс-O-, где Нс является такой гетероциклической группой, как описано выше.
Используемые в настоящем изобретении бициклические-16-галоидированные соединения могут быть солями, или эти соединения включают в себя этерифицированную карбоксильную группу или группу простого эфира. Такие соли включают фармацевтически приемлемые соли, например соли щелочных металлов, таких как натрий и калий; соли щелочноземельных металлов, таких как кальций и магний; фармацевтически приемлемые аммонийные соли, такие как соли аммония, метиламина, диметиламина, циклопентиламина, циклогексиламина, бензиламина, пиперидина, этилендиамина, моноэтаноламина, диэтаноламина, триэтаноламина, монометилмоноэтаноламина, трометамина, лизина, прокаина, кофеина, аргинина, соль тетраалкиламмония и тому подобные. Эти соли могут быть приготовлены традиционным способом, например, из соответствующих кислот и оснований или реакцией замещения солей.
Примеры таких сложных и простых эфиров включают алкиловые сложные и простые эфиры с неразветвленной или разветвленной цепочкой, которые могут содержать одну или несколько ненасыщенных связей, такие как метиловые эфиры, этиловые эфиры, пропиловые эфиры, изопропиловые эфиры, бутиловые эфиры, изобутиловые эфиры, трет-бутиловые эфиры, пентиловые эфиры и 2-этилгексиловые эфиры; эфиры, которые имеют алициклическую группу, такую как циклопропил, циклопентил или циклогексиловую группу; эфиры, содержащие ароматическую группу, такую как фенильную или бензильную группу (в которой ароматическая группа может содержать один или несколько заместителей); низший алкенил, такой как винил и аллил и низший алкинил, такой как этинил и пропинил; гидроксиалкил или алкоксиалкил, такой как гидроксиэтил, гидроксиизопропил, полигидроксиэтил, полигидроксиизопропил, метоксиэтил, этоксиэтиловый или метоксиизопропиловый простой или сложный эфир; необязательно замещенные арилы, такие как фенил, тозил, простой трет-бутилфенил, салицил, 3,4-диметоксифенил и бензамидофенил; алкилсилилы, такие как триметилсилил или триэтилсилил; или простой или сложный тетрагидропираниловый эфир.
Предпочтительно сложные и простые эфиры включают, например, сложные и простые эфиры низших алкилов с неразветвленной или разветвленной цепочкой, такие как метил, этил, пропил, изопропил, н-бутил или трет-бутил; бензил; или гидроксиалкил, такой как гидроксиэтил или гидроксиизопропил.
Предпочтительно А является группой -СООН или ее фармацевтически приемлемая соль или сложный эфир.
Предпочтительно оба X1 и Х2 представляют собой атомы галогена и более предпочтительно атомы фтора.
Предпочтительно W1 представляет собой группу =O.
Предпочтительно W2 представляет собой или когда оба R3 и R4 представляют собой атомы водорода.
Предпочтительно Z представляет собой атом кислорода.
Предпочтительно Y представляет собой незамещенную насыщенную или ненасыщенную углеводородную цепь, содержащую 6-8 атомов углерода.
Предпочтительно R1 представляет собой незамещенную насыщенную или ненасыщенную углеводородную цепь, содержащую 4-8 атомов углерода.
Предпочтительно R2 представляет собой атом водорода.
Композиция настоящего изобретения может включать изомеры указанных выше соединений. Примеры таких изомеров включают моноциклические таутомеры, имеющие кето-группу в положении С-15 и атом галогена в положении С-16; оптические изомеры геометрические изомеры, и т. п.
Таутомеризм между атомом кислорода в положении С-11 и кето-группой в положении С-15, показанный выше, является особенно значительным в случае соединений, имеющих 13,14-простую связь и два атома фтора в положении С-16.
Было установлено, что в отсутствие воды соединения, представленные формулой (I), существуют преимущественно в виде бициклического соединения. Полагают, что в водной среде образуется водородная связь, например, между группой кетона в положении С-15, тем самым затрудняется образование бициклической системы. Кроме того, считается, что атом (атомы) галогена в положении С-16 облегчают образование бициклической системы. Например, моноциклические/бициклические структуры могут присутствовать в соотношении 1:6 в D2O; 1:10 в CD3OD-D2O; и 4:96 в CDCl3. Соответственно предпочтительным вариантом воплощения настоящего изобретения является композиция, в которой бициклическое соединение присутствует в соотношении бициклическое/моноциклическое, равном, по меньшей мере, 1/1 и предпочтительно 20/1 или даже больше, включая практически все бициклическое соединение; 100% бициклическое соединение входит в объем защиты этого изобретения.
Описанные выше бициклические 16-галоидированные соединения формулы (I) могут быть получены в соответствии с общим способом, который изложен ниже.
Получение изопропилового эфира 7-[(1S,3S,6S,7R)-3-гептил-3-гидроксибицикло[4,3,0]-нонан-8-он-7-ил]гепт-5-еновой кислоты и изопропилового эфира 7-[(1S,3R,6S,7R)-3-гептил-3-гидроксибицикло[4,3,0]-нонан-8-он-7-ил]гепт-5-еновой кислоты.
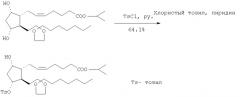
1. Получение изопропилового эфира (Z) 7-[(1R,2R,3R,5S)-2-(3,3-этилендиоксидецил-5-гидрокси-3-(п-толуолсульфонил)циклопентил]гепт-5-еновой кислоты (2)
Добавляют к смеси пиридина (0,77 г) и 4,05 г изопропилового эфира (Z) 7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-(3,3-этилендиоксидецил)циклопентил]гепт-5-еновой кислоты (1) в дихлорметане раствор 1,86 г хлористого тозила в дихлорметане при 0°С, и смесь перемешивают 2 суток при этой температуре. В ходе реакции тремя порциями добавляют раздельно 5,58 г хлористого тозила и 2,31 г пиридина. После обычной обработки неочищенный продукт выделяют хроматографически на силикагеле, получая 3,45 г изопропилового эфира (Z) 7-[(1R,2R,3R,5S)-2-(3,3-этилендиоксидецил)-5-гидрокси-3-(п-толуолсульфокси)циклопентил]гепт-5-еновой кислоты (2) с выходом 64,1%.
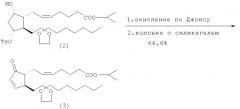
2. Получение изопропилового эфира (Z) 7-[(1R,2S)-2-(3,3-этилендиоксидецил)-5-оксо-циклопент-3-енил]гепт-5-еновой кислоты (3)
Изопропиловый эфир (Z) 7-[(1R,2R,3R,5S)-2-(3,3-этилендиоксидецил)-5-гидрокси-3-(п-толуолсульфонил)циклопентил]-гепт-5-еновой кислоты (2) (1,72 г) окисляют в ацетоне при температуре от -40 до -20°С реагентом Джонса в течение 4 ч. После обычной обработки неочищенный продукт пропускают через слой силикагеля со смесью н-гексан/этилацетат (3,5/1). Затем продукт дополнительно очищают хроматографически на силикагеле со смесью н-гексан/этилацетат (4/1). Получают 0,81 г изопропилового эфира (Z) 7-[(1R,2S)-2-(3,3-этилендиоксидецил)-5-оксо-циклопент-3-енил]гепт-5-еновой кислоты (3) с выходом 64,6%.
3. Получение изопропилового эфира 7-[(1R,2S,3R)-2-(3,3-этилендиоксидецил)-3-гидроксиметил-5-оксоциклопентил]гепт-5-еновой кислоты (4)
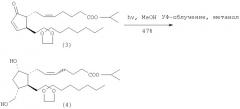
Растворяют в метаноле 0,81 г изопропилового эфира (Z) 7-[(1R,2S)-2-(3,3-этилен-диоксидецил)-5-оксо-циклопент-3-енил]гепт-5-еновой кислоты (3) и бензофенон. В атмосфере аргона этот раствор облучают с помощью ртутной лампы высокого давления (300 Вт) в течение 4 ч и 40 мин. После выпаривания растворителя неочищенный продукт очищают хроматографически на силикагеле смесью н-гексан/этилацетат (3/2). Получают 0,41 г изопропилового эфира 7-[(1R,2S,3R)-2-(3,3-этилендиоксидецил)-3-гидроксиметил-5-оксоциклопентил]гепт-5-еновой кислоты (4) с выходом 47%.
4. Получение изопропилового эфира 7-[(1R,2S,3R)-2-(3,3-этилендиоксидецил)-5-оксо-3-(п-толуолсульфоксиметил) циклопентил]-гепт-5-еновой кислоты (5)
Растворяют 0,21 г изопропилового эфира 7-[(1R,2S,3R)-2-(3,3-этилендиоксидецил)-3-гидроксиметил-5-оксоциклопентил]гепт-5-еновой кислоты (4) и 0,07 г пиридина в дихлорметане. В этот раствор добавляют 0,17 г хлористого тозила при 0°С и смесь перемешивают в течение 72 ч. После обычной обработки неочищенный продукт выделяют хроматографически на силикагеле, получая 0,25 г изопропилового эфира 7-[(1R,2R,3R)-2-(3,3-этилендиоксидецил)-5-оксо-3-(п-толуолсульфокси)метилциклопентил]гепт-5-еновой кислоты (5) с выходом 89%.
5. Получение изопропилового эфира 7-[(1R,2R,3R)-2-(3,3-этилендиоксидецил)-3-иодметил-5-оксоциклопентил]гепт-5-еновой кислоты (6)
Растворяют 0,25 г изопропилового эфира 7-[(1R,2S,3R)-2-(3,3-этилендиоксидецил)-5-оксо-3-(п-толуолсульфокси)метилциклопентил]-гепт-5-еновой кислоты (5) в ацетоне и добавляют 0,12 г йодида натрия. Смесь кипятят с обратным холодильником в течение 3 ч. К смеси добавляют 0,097 г йодида натрия и смесь кипятят с обратным холодильником еще 80 минут. После обычной обработки неочищенный продукт очищают хроматографически на силикагеле смесью н-гексан/этилацетат (5/1). Получают 0,16 г изопропилового эфира 7-[(1R,2R,3R)-2-(3,3-этилендиоксидецил)-3-иодметил-5-оксоциклопентил]гепт-5-еновой кислоты (6) с выходом 68%.
6. Получение изопропилового эфира 7-[(1R,2R,3R)-3-иодметил-5-оксо-2-(3-оксодецил)-циклопентил]гепт-5-еновой кислоты (7)
Растворяют 0,16 г изопропилового эфира 7-[(1R,2R,3R)-2-(3,3-этилендиоксидецил)-3-иодметил-5-оксоциклопентил]гепт-5-еновой кислоты (6) в смешанном растворителе уксусная кислота/вода/тетрагидрофуран (3/1/1). Смесь перемешивают 20 ч при комнатной температуре и 2,5 ч при 50°С. После выпаривания растворителя полученный остаток очищают хроматографически на силикагеле смесью н-гексан/этилацетат (1/1). Получают 0,13 г изопропилового эфира 7-[(1R,2R,3R)-3-иодметил-5-оксо-2-(3-оксодецил)-циклопентил]гепт-5-еновой кислоты (7) с выходом 86%.
7. Получение изопропилового эфира 7-[(1S,3S,6S,7R)-3-гептил-3-гидроксибицикло-[4,3,0]-нонан-8-он-7-ил]гепт-5-еновой кислоты (8а) и изопропилового эфира 7-[(1S,3R,6S,7R)-3-гептил-3-гидроксибицикло[4,3,0]-нонан-8-он-7-ил]гепт-5-еновой кислоты (8b)
Растворяют в тетрагидрофуране 0,0574 г изопропилового эфира 7-[(1R,2R,3R)-3-иодметил-2-(3-оксодецил)-5-оксо-циклопентил]гепт-5-еновой кислоты (7) и дихлорид цирконоцена. Смесь обрабатывают звуком в токе аргона, чтобы выдуть воздух из смеси. В эту смесь по каплям добавляют 0,1 М раствор иодида самария в тетрагидрофуране (2,1 мл). Смесь перемешивают 30 мин при комнатной температуре и затем добавляют 1 мл 0,1 М хлористоводородной кислоты. После обычной обработки неочищенный продукт очищают хроматографически на силикагеле смесью н-гексан/этилацетат (5/1). Получают два бициклических продукта, более полярный (8а) и его менее полярный эпимер (8b) и исходный материал (7) следующим образом:
Изопропиловый эфир 7-[(1S,3S,6S,7R)-3-гептил-3-гидроксибицикло-[4,3,0]-нонан-8-он-7-ил]гепт-5-еновой кислоты (8а) и изопропилового эфира 7-[(1S,3R,6S,7R)-3-гептил-3-гидрокси-бицикло[4,3,0]-нонан-8-он-7-ил]гепт-5-еновой кислоты (8b). Выход (8а) 5,1 мг. Выход (8b) 7,2 мг; выделено 26,7 мг исходного материала (7).
Схема синтеза соединения, представленного формулой (I), в которой Z является атомом серы и W1 представляет собой группу -ОН, приведена ниже:
Схема синтеза соединения, представленного формулой (I), в которой Z является атомом серы и W1 представляет собой кето-группу, приведена ниже:
Схема синтеза соединения, представленного формулой (I), в которой Z является атомом серы, W1 представляет собой кето-группу
Схема синтеза соединения, представленного формулой (I), в которой Z является атомом азота, приведена ниже:
Другая схема синтеза соединения, представленного формулой (I), в которой Z является атомом азота, приведена ниже:
Не следует считать, что препараты настоящего изобретения ограничиваются приведенными выше, причем при их получении могут применяться подходящие средства для защиты, окисления, восстановления и т.п.
В бициклических 16-галоидированных соединениях, применяемых в настоящем изобретении, значительно усилена активность в отношении кишечных скоплений, когда в положении С-16 имеются два атома галогена-заместителя, особенно два атома фтора, независимо от структуры и заместителей в пятичленном кольце или наличия двойных связей или других заместителей. Особенно предпочтительными бициклическими галоидированными соединениями являются те таутомеры, которые образуются из моноциклических соединений, имеющих кето-группу в положении С-9 и гидроксильную группу в положении С-11 в пятичленном кольце. Другой предпочтительной группой являются бициклические галоидированные соединения, содержащие 5,6-простую связь, 5,6-двойную связь, или те, в которых число атомов углерода составляет 20-22, причем R1 содержит от 4 до 6 атомов углерода, предпочтительно в неразветвленной цепи.
Пример моноциклического/бициклического 16-галоидированного соединения, содержащего 5,6-двойную связь, приведен ниже:
Другой вариант воплощения настоящего изобретения включает в себя композицию настоящего изобретения и триглицерид жирной кислоты со средней цепочкой. Кислота триглицерида может быть насыщенной или ненасыщенной, содержащей 6-14 атомов углерода, которые могут образовать разветвленную цепь. Предпочтительной жирной кислотой является насыщенная жирная кислота с неразветвленной цепью, например капроновая кислота, каприловая кислота, лауриновая кислота и миристиновая кислота. Могут использоваться в виде смеси два (или более) триглицерида жирной кислоты с цепочкой средней длины.
Композиция настоящего изобретения может быть получена путем растворения или смешивания бициклического соединения формулы (I) в триглицериде жирной кислоты со средней цепочкой. Количество триглицерида жирной кислоты со средней цепочкой не ограничивается. Однако обычно можно использовать от 1 до 1000000 весовых частей триглицерида жирной кислоты со средней цепочкой в расчете на одну весовую часть бициклического соединения, предпочтительно от 5 до 500000 весовых частей и более предпочтительно от 10 до 200000 весовых частей.
Примеры триглицерида жирной кислоты со средней цепочкой, используемого в настоящем изобретении, включают триглицерид насыщенной или ненасыщенной жирной кислоты, содержащей 6-14 атомов углерода, которые могут образовать разветвленную цепь. Предпочтительной жирной кислотой является насыщенная жирная кислота с неразветвленной цепью, например капроновая кислота (С6), каприловая кислота (С8), лауриновая кислота (С12) и миристиновая кислота (С14). Кроме того, можно использовать смесь из двух или нескольких триглицеридов жирной кислоты со средней цепочкой.
Для увеличения соотношения моноциклического/бициклического соединения можно использовать еще более неполярный растворитель, такой как промышленно доступный Miglyol.
Для иллюстрации рецептуры варианта настоящего изобретения и демонстрации сильного влияния стерических затруднений ниже приведен пример
Пример
Указанные ниже соединения 1 и 2 растворяют в смеси триглицеридов жирной кислоты со средней цепочкой МСТ (МСТ - смесь триглицерида каприловой кислоты и триглицерида капроновой кислоты в соотношении 85:15) в количестве, указанном ниже в таблице
Каждый раствор помещают в емкость, изготовленную из прочного стекла, и хранят при 40°С. Изменение содержания соединений 1 и 2 в растворах во времени определяют методом жидкостной хроматографии высокого давления (ЖХВД). Одновременно каждое из соединений 1 и 2 помещают в емкость отдельно (не разбавляя их растворителем), как указано выше, и хранят при 40°С, для того чтобы обеспечить контрольное исследование.
В отсутствие растворителя содержание соединений определяют методом ЖХВД следующим образом. Сохраняемые соединения 1 и 2 и стандартные соединения 1 и 2 точно взвешивают (навеска около 0,025 г) и добавляют аликвоты (точно 5 мл) раствора внутреннего стандарта к соответствующим навескам соединений. Препараты для испытаний и стандартные препараты получают путем добавления ацетонитрила (для жидкостной хроматографии), для того чтобы получить общий объем каждого препарата точно 10 мл. В жидкостной хроматограф вводят пробы по 10 мкл препарата для испытаний и стандартного препарата и определяют содержание вещества методом внутреннего стандарта по точке на калибровочной кривой:
WS - количество соединения в стандартном препарате, мг
WT - количество соединения 1 и 2 в препарате для испытаний, мг
QS - площадь пика соединения в стандартном препарате относительно площади пика во внутреннем стандарте.
QT - площадь пика соединения в препарате для испытаний относительно площади пика во внутреннем стандарте.
Условия измерений
Детектор: спектрофотометр ультрафиолетового (УФ) поглощения при длине волны 294 нм.
Колонка: нержавеющая трубка, имеющая внутренний диаметр приблизительно 5 мм и длину около 250 мм, заполненная октадецилсилил-силикагелем для жидкостной хроматографии (частицы 5 мкм).
Температура колонки: постоянная, приблизительно 35°С.
Подвижная фаза: смешанный раствор ацетонитрил (для жидкостной хроматографии)/водный раствор ацетата натрия (0,01 моль/л)/ледяная уксусная кислота (800:200:1).
В присутствии растворителя определяют содержание соединения методом ЖХВД следующим образом.
На основе величин, приведенных ниже в таблице, точно взвешивают навеску раствора, соответствующую 36 мкг соединений 1 и 2. Добавляют точно 1,0 мл раствора внутреннего стандарта и затем добавляют этилацетат (для жидкостной хроматографии), получая в каждом случае общий объем 10 мл. Каждую пробу 0,1 мл этого раствора концентрируют в вакууме досуха, получая препарат для испытаний.
Точно взвешивают по 18 мг каждого стандартного соединения и смешивают с этилацетатом (для жидкостной хроматографии), получая в каждом случае общий объем точно 50 мл. Точно отмеривают 1,0 мл этого раствора и 10 мл раствора стандартного соединения и смешивают с этилацетатом (для жидкостной хроматографии), получая в каждом случае общий объем точно 100 мл. Каждую пробу 0,1 мл этого раствора концентрируют в вакууме досуха, получая препарат для испытаний.
Добавляют в испытуемый и стандартный препараты по 0,1 мл реагента - флуоресцентной метки и 0,85 мл катализатора для флуоресцентной метки соответственно, и смесь перемешивают, проводя реакцию при комнатной температуре, в течение более 30 минут. В реакционную смесь добавляют аликвоты (по 0,05 мл) ацетонитрила (для жидкостной хроматографии), содержащие 2% уксусной кислоты, соответственно смесь перемешивают и выдерживают в течение более 30 минут, чтобы получить испытуемый и стандартный растворы.
В жидкостной хроматограф вводят пробы по 10 мкл раствора для испытаний и стандартного раствора и определяют содержание соответствующего вещества методом внутреннего стандарта по точке на калибровочной кривой:
Ws - количество соединения в стандартном препарате, мг
Qs - площадь пика соединения в стандартном препарате относительно площади пика во внутреннем стандарте.
Qт - площадь пика соединения в препарате для испытаний относительно площади пика во внутреннем стандарте.
Условия измерений
Детектор: флуоресцентный спектрометр (длина волны возбуждающего излучения 259 нм; длина волны флуоресценции 394 нм).
Колонка: нержавеющая трубка, имеющая внутренний диаметр приблизительно 5 мм и длину около 250 мм, заполненная фазой - октадецилсилил-силикагель для жидкостной хроматографии (частицы 5 мкм).
Температура колонки: постоянная, приблизительно 35°С.
Подвижная фаза: смешанный раствор ацетонитрил (для жидкостной хроматографии)/метанол (для жидкостной хроматографии)/водный раствор ацетата аммония (0,05 моль/л) (4:11:5).
| Таблица | ||||
| Соединение 1 | Соединение 2 | |||
| Кристаллы | МСТ1 | Кристаллы | МСТ2 | |
| Исходный | 100 | 100 | 100 | 100 |
| 6 суток | 84,5 | |||
| 7 суток | 97,2 | |||
| 14 суток | 94,1 | 101,4 | 75,0 | 99,6 |
| 28 суток | 87,4 | 53,4 | 98,9 | |
| 38 суток | 102,1 | |||
| 90 суток | 100,9 | |||
| 191 сутки | 99,6 | |||
| 1Соединение 1/растворитель: 0,36 мг/г2Соединение 2/растворитель: 0,12 мг/г |
Композиция настоящего изобретения в