Алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина и способ их получения
Иллюстрации
Показать всеОписываются алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина общей формулы где R=СН3, С2Н5, С3Н7, С4Н9; m=2-6; n=1-5, и способ получения. Техническим результатом является использование алкоксисилоксановых производных 3,5-дихлор-2-(4-оксифенокси)пиридина в качестве биологически активных неокрашенных (бесцветных) соединений и применение их как биоцидных препаратов для пропитки и отделки текстильных материалов из различных волокон (природных, искусственных, синтетических) с целью защиты их от биоповреждений. 2 н.п. ф-лы, 3 табл.
Реферат
Изобретение относится к химии элементоорганических соединений, конкретно к химии кремнийорганических соединений - алкоксисилоксановым производным 3,5-дихлор-2-(4-оксифенокси)пиридина, которые могут быть использованы в качестве биоцидных препаратов.
Известны азокрасители, содержащие 3,5-дихлорпиридильный радикал, которые используются для защиты текстильных материалов из волокон различных типов от биоповреждений [Кобраков К.И., Шарипова Э.А., Станкевич Г.С., Дмитриева М.Б., Балабанова Л.В. Оценка эффективности биозащитных свойств азокрасителей, содержащих 3,5-дихлорпиридильный фрагмент. Текстильная химия, 2004, №4, с.10-16]. Перспективность использования таких азокрасителей для колорирования текстильных материалов и их защиты от биоповреждений очевидна. Однако такие азокрасители совершенно не пригодны для защиты от биоповреждений текстильных материалов, которые ранее уже были подвергнуты крашению в другие цвета, а также текстильных материалов, представляющих собой музейные экспонаты, которые подлежат длительному хранению или реставрации и требуют защиты от биоповреждений.
Целью настоящего изобретения является синтез алкоксисилоксановых производных 3,5-дихлор-2-(4-оксифенокси)пиридина, которые могли бы быть использованы в качестве биоцидных препаратов.
Указанный технический результат достигается тем, что предложены алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина общей формулы
где R=СН3, С2Н5, С3Н7, С4Н9;
m=2-6; n=1-5.
3,5-Дихлор-2-(4-оксифенокси)пиридин конденсируют с алкоксисилоксанами при нагревании с одновременной отгонкой алифатического спирта.
Алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина являются биологически активными соединениями. Они могут быть использованы как биоцидные препараты для защиты текстильных материалов от биоповреждений микроорганизмами, бактериями и грибами.
Алкоксисилоксановые производные получают конденсацией 3,5-дихлор-2-(4-оксифенокси)пиридина с алкоксисилоксанами при нагревании с одновременной отгонкой от реакционной смеси алифатического спирта.
Указанные соединения, их свойства и способ получения в литературе не указаны.
В предложенном способе используют следующие алкоксисилоксаны: гексаметоксидисилоксан, октаэтокситрисилоксан, декапропокситетрасилоксан, тетрадекабутоксигексасилоксан, этилсиликат-40.
Указанные алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина являются биологически активными неокрашенными (бесцветными) соединениями и могут применяться как биоцидные препараты в виде растворов в органических растворителях, водных эмульсий и других форм для пропитки и отделки текстильных материалов из различных волокон (природных, искусственных, синтетических) с целью защиты их от биоповреждений.
Для лучшего понимания данного изобретения приводятся следующие примеры получения указанных соединений.
Пример 1. Пентаметокси[3,5-дихлор-2-(4-оксифенокси)пиридил]дисилоксан (I).
Смесь 25,8 г (0,1 моль) гексаметоксидисилоксана с 25,6 г (0,1 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 100 мл толуола нагревают в течение 15-20 мин до начала выделения метанола и кипятят при 67-70°С, отгоняя одновременно от реакционной смеси 3,2 г (0,1 моль) метанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе толуол и получают 45,8 г (95%) соединения (I) в виде смолообразного продукта, d4 20 1,040 г/см3.
Найдено, %: С 39,78; Н 4,35; Si 11,72; N 2,80; Cl 14,58; ОСН3 32,0; М 480.
C16H21Si2N1Cl2O8
Вычислено, %: С 39,83; Н 4,38; Si 11,63; N 2,90; Cl 14,71; ОСН3 32,15; М 482.
Данные ИК-спектров, см-1: νC-Cl 740-800; νSiOC 810; νSiOSi 1050-1080; νPyridyl 1040, 1520-1660.
Пример 2. Гексаэтоксиди[3,5-дихлор-2-(4-оксифенокси)пиридил]трисилоксан (II).
Смесь 47,7 г (0,1 моль) октаэтокситрисилоксана с 51,2 г (0,2 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 200 мл толуола нагревают в течение 25-30 мин до начала выделения этанола и кипятят при 80-83°С, отгоняя одновременно от реационной смеси 9,2 г (0,2 моль) этанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе толуол и получают 86,1 г (96%) соединения (II) в виде смолообразного продукта, d4 20 1,050 г/см3.
Найдено, %: С 45,63; Н 4,83; Si 9,47; N 3,0; Cl 15,68; OC2H5 28,7; М 890.
C34H42Si3N2Cl4O12
Вычислено, %: С 45,52; Н 4,72; Si 9,39; N 3,12; Cl 15,83; OC2H5 30,10; М 897.
Данные ИК-спектров, см-1: νC-Cl 740-800; νSiOC 810; νSiOSi 1050-1080; νPyridyl 1040, 1520-1660.
Пример 3. Гептапропокси-три-[3,5-дихлор-2-(4-оксифенокси)пиридил]тетрасилоксан (III).
Смесь 7,51 г (0,01 моль) декапропокситетрасилоксана с 7,68 (0,03 моль) 3.5-дихлор-2-(4-оксифенокси)пиридина в 30 мл толуола нагревают в течение 30 мин до начала выделения пропанола и кипятят при 98-100°С, одновременно отгоняя от реакционной смеси 1,8 г (0,03 моль) пропанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе толуол и получают 12,8 г (96%) соединения (III) в виде смолообразного продукта, d4 20 1,070 г/см3.
Найдено, %: С 48,57; Н 5,12; Si 8,58; N 3,0; Cl 15,73; ОС3Н7 30,12; М 1330.
C54H67Si4N3Cl6O16
Вычислено, %: С 48,42; Н 5,04; Si 8,38; N 3,13; Cl 15,90; OC3H7 30,84; М 1339.
Пример 4. Нонабутокси-пента-[3,5-дихлор-2-(4-оксифенокси)пиридил]гексасилоксан (IV).
Смесь 12,72 г (0,01 моль) тетрадекабутоксигексасилоксана с 12,8 г (0,05 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 60 мл дибутилового эфира нагревают в течение 30 мин до начала выделения бутанола и кипятят при 118-122°С, одновременно отгоняя от реакционной смеси 3,5 г (0,05 моль) бутанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе дибутиловый эфир и получают 18,1 г (96%) соединения (ГУ) в виде смолообразного продукта, d4 20 1,090 г/см3.
Найдено, %: С 42,0; Н 5,81; Si 8,73; N 3,63; Cl 18,73; OC4H9 34,3; М 1880.
C66H111Si6N5Cl10O24
Вычислено, %: С 42,11; Н 5,94; Si 8,95; N 3,72; Cl 18,86; ОС4Н9 34,90; М 1882.
Пример 5. Гексаэтокси-тетра[3,5-дихлор-2-(4-оксифенокси)пиридил]тетрасилоксан (V).
Аналогично примеру 2 из 6,11 г (0,01 моль) декаэтокситетрасилоксана и 10,24 г (0,04 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 40 мл толуола получают 14,0 г (96%) соединения (V) в виде смолообразного продукта, d4 20 1,055 г/см3.
Найдено, %: С 46,53; Н 3,68; Si 7,63; N 3,47; Cl 19,31; ОС2Н5 18,20; М 1450.
C56H54Si4N4Cl8O17
Вычислено, %: С 46,34; Н 3,75; Si 7,74; N 3,86; Cl 19,56; OC2H5 18,60; М 1451.
Данные ИК-спектров, см-1: νC-Cl 740-800; νSiOC 810; νSiOSi 1050-1080; νPyridyl 1040, 1520-1660.
Синтезированные соединения (I-V) хорошо растворимы в алифатических и ароматических углеводородах, спиртах, эфире, ТГФ, диоксане, ацетоне, алкоксисилоксанах и не растворимы в воде. Они являются биологически активными соединениями.
В табл.1 приведены результаты испытаний добавок соединений (I-V) на рост тест-культур на жидкой среде Чапека, проведенных по ГОСТ 9048-15.
В пробирки с жидкой питательной средой Чапека (2 мл) добавляют растворы соединений (I-V) (0,5 мл) с таким расчетом, чтобы их конечная концентрация была 0,1 и 0,01% от всего объема жидкости в пробирках. (При приготовлении среды Чапека учитывают последующие разведения соединениями (I-V) и суспензией тест-культур). Затем в пробирки вносят 0,5 мл суспензии спор тест-культур двухнедельного возраста. В качестве тест-культур используют следующие плесневые грибы:
Aspergillus niger v.Teigh,
Aspergillus flavus Wink Fr.,
Penicillium chrysogenum Westling,
Ulocladium ilicis Thom (бывшее название Stemphylium).
Пробирки инкубируют при 24°С в течение пяти суток. Контролем служат тест-культуры, выращенные в таких же условиях, но без добавления соединений (I-V). На пятые сутки оценивают характер роста грибов по шестибальной шкале:
5 - воздушный и субстратный мицелий;
4 - спороношение и воздушный мицелий подавлены;
3 - субстратный мицелий хорошо развит, воздушный отсутствует;
2 - субстратный мицелий подавлен;
1 - вместо мицелия взвесь клеток и фрагментов гиф (муть);
0 - рост полностью отсутствует.
Из данных табл.1 видно, что соединения (I-V) являются биоцидными, т.к. уже в количестве 0,01-0,1% масс. полностью подавляют рост указанных плесневых грибов.
Соединения (I-V) могут применяться в качестве биоцидных препаратов в виде растворов в органических растворителях, водных эмульсий и других форм для пропитки и отделки текстильных материалов из различных волокон с целью их защиты от биоповреждений.
Пропитку текстильного материала, в том числе и музейного экспоната из текстиля, проводят методом смачивания материала раствором в органическом растворителе или водной эмульсией соединения (I-V) заданной концентрации - 0,01, 0,1, 1, 5, 10, 15%-ной, сушкой при комнатной температуре, после чего проводят закрепление биоцидного соединения термообработкой при 140°С в течение 5 мин, либо выдерживанием на стеллажах при комнатной температуре в течение 24 суток. Введение в пропиточную ванну препарата АГМ9 (γ-аминопропилтриэтоксисилана) в количестве 0,2-2% от массы силикона позволяет заменить термообработку при 140-150°С сушкой при 100°С.
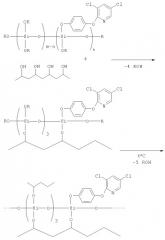
В результате указанной обработки соединения (I-V) ковалентно закрепляются на поверхности волокон текстильного материала вследствие конденсации алкоксигрупп соединения с функциональными группами полимера волокон (схема 1).
Определение устойчивости образцов, обработанных соединениями (I-V), текстильного материала из шерстяного, полиамидного и других волокон к плесневому заражению проводят по методике, разработанной в ИНМИ АН БССР [Дмитриева М.Б. Традиции и современность //сб. Экология и криптоганная ботаника в России, Санкт-Петербург, 2000, с.106-107]. Образцы тканей (2*2 см) стерилизуют в УФ-лучах в течение 20 мин с двух сторон. Помещают в центре чашки Петри на "голодный агар" с 2%-ным содержанием сахарозы. Голодный агар необходим для поддержания достаточно высокого уровня влажности в чашке. На образцы стерильно наносят агаровую сетку со спорами грибов Ulocladium ilicis Thom и Aspergillus niger v.Teigh. Через определенные промежутки времени с каждого образца стерильно снимают одну-две ячейки агара со спорами, под микроскопом подсчитывают количество проросших спор и отмечают характер их ветвления. Данные виды грибов выбирают потому, что представители рода Aspergillus niger среди несовершенных грибов по активности биохимического повреждения текстиля стоят на первом месте. Конидии Aspergillus niger могут вызывать гибель микромицетов - конкурентов за субстрат. Известно также, что зачатки мицелия Aspergillus niger способны выживать в условиях, когда мицелии других видов грибов оказываются уязвимыми и отмирают, кроме того, они очень удобны для микроскопирования. Метод "агаровых сеток" позволяет иммитировать загрязнения материала, находящегося в благоприятных для развития микроскопических грибов условиях и дает возможность быстро (в течение 2-3 суток) определить биостойкость образцов.
Сравнение характера роста на опытных образцах и в контроле - на питательной среде позволяет количественно оценить степень биостойкости материалов
К=Т0/Tк,
где К - коэффициент замедления роста;
Тк - длительность (час) развития спор до момента появления стадии ветвления в контроле (для бактерий Aspergillus niger и Ulocladium ilicis равно 10 и 34 час. соответственно);
Т0 - то же, на опытных образцах.
Коэффициент К показывает во сколько раз замедляется рост бактерий на испытуемых образцах по сравнению с контролем. Чем выше К, тем сильнее выражены биоцидные свойства образцов.
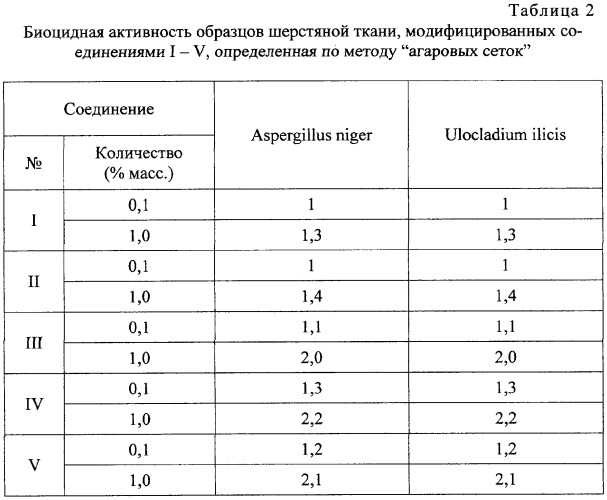
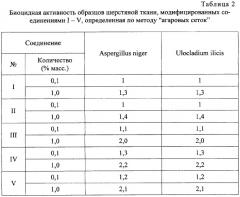
В табл.2 приведены результаты определения биостойкости опытных образцов шерстяной ткани.
Из данных табл.2 видно, что соединения I-V уже в количестве 0,01-0,1% масс. на шерстяной ткани полностью обеспечивают 100%-ное подавление роста испытуемых тест-культур и предохраняют ткани от биоповреждений.
Устойчивость к микробиологическому разрушению с применением почвенного метода (ГОСТ 9.060-75) определяется по показателю коэффициента устойчивости к микробиологическому разрушению П, %.
В табл.3 представлены данные по устойчивости хлопчатобумажной ткани к микробиологическому разрушению, обработанной соединениями I-V.
Из приведенных результатов видно, что хлопчатобумажная ткань не подвергается микробиологическому разрушению. Антимикробные свойства сохраняются после 3-5 стирок.
| Таблица 1Биоцидная активность соединений I-V на тест-культурах по шестибалльной шкале, определенная по ГОСТ 9048-75 | |||||||||
| Соединение | Тест-культуры | ||||||||
| № | Концентрация,% | Aspergillus niger | Aspergillus flavus | Penicillium chrysogenum | Ulocladium ilicis | ||||
| I | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.01 | 1 | 1 | 0 | 0 | 1 | 1 | 2 | 2 | |
| II | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.01 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | |
| III | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.01 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| IV | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.01 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| V | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0.01 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Контроль | 0 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 |
| 0 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 |
| Таблица 3Устойчивость хлопчатобумажной ткани к микробиологическому разрушению, определенная по ГОСТ 9.060-75 | ||||
| Соединение | Коэффициент устойчивости к микробиологическому разрушению, % | |||
| № | Количество (% масс.) | До стирки | После 1-й стирки | После 3-х стирок |
| I | 0,1 | 89,2 | 88,9 | 87,8 |
| 0,2 | 97,9 | 97,3 | 96,7 | |
| II | 0,1 | 88,5 | 88,0 | 87,3 |
| 0,2 | 98,3 | 98,0 | 97,6 | |
| III | 0,1 | 89,4 | 88,5 | 87,7 |
| 0,2 | 99,6 | 99,0 | 98,6 | |
| IV | 0,1 | 87,4 | 87,0 | 86,6 |
| 0,2 | 94,5 | 93,8 | 93,0 | |
| V | 0,1 | 88,7 | 87,6 | 86,3 |
| 0,2 | 95,1 | 94,8 | 94,3 | |
| Контроль | 0 | 50 | - | - |
| 0 | 49 | - | - |
Схема 1
1. Алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина общей формулы
где R - СН3, С2Н5, С3Н7, С4Н10;
m=2-6; n=1-5.
2. Способ получения соединения по п.1, отличающийся тем, что 3,5-дихлор-2-(4-оксифенокси)пиридин конденсирует с алкоксисилоксанами при надевании с одновременной отгонкой алифатического спирта.