Способ получения, выделения, очистки и стабилизации рекомбинантного гранулоцитарного колониестимулирующего фактора человека, пригодного для медицинского применения, и иммунобиологическое средство на его основе
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способа получения, выделения, очистки и стабилизации рекомбинантного гранулоцитарного колониестимулирующего фактора человека (рчГ-КСФ), пригодного для медицинского использования, путем разрушения рекомбинантных бактериальных клеток, выделения тел включения, удаления примесных бактериальных белков, восстановления, ренатурации, хроматографической очистки и стабилизации рчГ-КСФ, а также иммунобиологического средства на его основе. Изобретение обеспечивает высокий выход, качество и стабильность рчГ-КСФ. 2 н. и 2 з.п. ф-лы, 5 ил., 6 табл.
Реферат
Изобретение относится к фармацевтике, а именно к способу получения, выделения, очистки и стабилизации рекомбинантного человеческого гранулоцитного колониестимулирующего фактора (рчГ-КСФ), пригодного для медицинского применения.
Гранулоцит-колониестимулирующий фактор (Г-КСФ) является плейотропным цитокином, стимулирующим пролиферацию, созревание и функцию гранулоцитсодержащих лейкоцитов крови [1, 2, 3]. Г-КСФ является полипептидом с молекулярной массой 18-22 кДа и продуцируется различными типами клеток, включая Т-и В-лимфоциты, макрофаги, тучные клетки, эндотелиальные клетки и фибробласты [4, 5].
Г-КСФ используется для активации кроветворения при многих гематологических нарушениях, для увеличения продукции лейкоцитов и уменьшения частоты инфекционных осложнений при различных нейтропениях, апластической анемии, миелодисплазии, трансплантации костного мозга [6-9]. Отмечена эффективность Г-КСФ при лечении больных с прогрессирующими злокачественными опухолями, получающих химиотерапию [10]. Выявлено, что рчГ-КСФ снижает продолжительность нейтропении при химиотерапии злокачественных опухолей и трансплантации костного мозга [11-12]. Г-КСФ стимулирует пролиферацию и дифференцировку нейтрофильных гранулоцитов и мононуклеарных фагоцитов из общих клеток-предшественников [2, 3, 13], увеличивает выживание нейтрофилов, усиливает фагоцитоз, хемотаксис, продукцию IL-8 нейтрофилами, активирует фагоцитарную и бактерицидную активности нейтрофилов [14-17]. Показано, что Г-КСФ, укорачивает период гранулоцитопении, индуцируемой облучением [18].
Эффективность Г-КСФ в терапии ряда заболеваний иммунной и кроветворной систем делают актуальной задачей разработку методов его получения.
Известны способы получения Г-КСФ человека из культуральной жидкости клеточных линий, полученных из опухолевых клеток человека [19-21]. Недостатками этих способов являются использование опухолевых клеток, низкий выход продукта, вероятность контаминации конечного продукта вирусами человека, невозможность масштабирования процесса выделения и, как следствие, высокая стоимость такого препарата Г-КСФ.
Растущие потребности в Г-КСФ и отсутствие высокопродуктивных природных источников способствовали получению Г-КСФ микробиологическим синтезом на основе технологии рекомбинантных молекул ДНК. Этот метод обеспечивает возможность масштабирования и получения целевого продукта со значительно более высоким выходом из сравнительно недорогого исходного сырья. В процессе роста бактериальных клеток рчГ-КСФ накапливается в цитоплазме в виде нерастворимых дискретных включений, получивших название тел включения. Методология выделения рч Г-КСФ из тел включения заключается в экстракции белка из тел включения денатурирующими агентами (при этом белок денатурируется и теряет биологическую активность), ренатурации целевого продукта и хроматографии ренатурированного белка. Поскольку выход и качество целевого продукта в значительной степени зависят от эффективности проведения ренатурации, возникает необходимость введения контроля за ренатурацией.
Описан способ получения рекомбинантного человеческого Г-КСФ (рчГ-КСФ) из клеток Escherichia coli (E. coli), трансформированных плазмидой p536hG-CSF2 [22, 23]. Клетки суспендируют в воде и суспензию несколько раз продавливают в Френч-прессе. Осадок тел включения после центрифугирования растворяют в 50 мМ трис-HCI буфере, рН 8,5, содержащем 1% лауриловую кислоту и 5% этанол. Нерастворимый материал отделяют центрифугированием, а супернатант, содержащий рчГ-КСФ, подвергают очистке методом ВЭЖХ на колонке с обращенной фазой (С4). Связаный с сорбентом рчГ-КСФ элюируют ацетат-аммонийным буфером, содержащим изопропанол. Чистота препарата по результатам гель-электрофореза в полиакриламидном геле более 95%. Недостатком этого метода является отсутствие этапа отмывки тел включения, использование органических растворителей, в которых белок может частично денатурировать, и низкий выход целевого белка.
Описан и другой способ выделения рчГ-КСФ из клеток E. coli, трансформированных плазмидой p536hG-CSF2, в буферах, не содержащих органических растворителей [23]. Этот метод включает разрушение клеток при помощи Френч-пресса, отмывку тел включения 50 мМ Трис-HCI буфером, содержащим 2% саркозила, растворение тел включения в 6 М гуанидинхлориде, ренатурацию при помощи гель-фильтрации на колонке с сефадексом G-25, ионообменную и гель-фильтрационную хроматографию ренатурированного белка на колонках с КМ-целлюлозой и сефадексом G-75 соответственно. Чистота рчГ-КСФ составляла более 95%. Выход составлял 0,4 мг очищенного белка на грамм сырой биомассы. Недостатками этого способа являются низкий выход целевого белка и отсутствие контроля над процессом ренатурации.
Известен способ получения рекомбинантного Г-КСФ человека из клеток Е. coli, содержащих плазмиду pCfBD28 [24]. Клетки разрушают ультразвуком в трис-HCl буфере. Тела включения отделяют центрифугированием и промывают. Отмытые тела включения растворяют в 20 мМ трис-HCl буфере, рН 8,5, содержащем 8 М мочевину и 0,1 мМ дитиотриэтол, и инкубируют в течение 5 ч при температуре 4°С. Ренатурацию восстановленного белка проводят в присутствии 0,1 мМ окисленного глутатиона в течение ночи при температуре 4°С. Ренатурированный белок подвергают ионообменной и гидрофобной хроматографии на колонках ДЭАЭ-Тойоперл и Бутил-Тойоперл соответственно. Очищенный рчГ-КСФ обессоливают на колонке с сефадексом G-25 в 10 мМ фосфатном буфере, рН 7,2. Электрофоретическая чистота получаемого рчГ-КСФ составила более 99%. Выход очищенного рчГ-КСФ составил 33% по отношению к количеству рчГ-КСФ в телах включения. Недостатками этого способа являются использование для ренатурации дорогостоящего окисленного глютатиона, отсутствие контроля за ренатурацией, в результате происходит потеря части целевого белка при хроматографии.
Прототипом заявляемого способа получения Г-КСФ является способ получения рчГ-КСФ из клеток Е. coli SG20050, трансформированных плазмидой pGGF8 [25]. Клетки разрушали при помощи ультразвука, тела включения отмывали и растворяли при помощи 8М мочевины, ренатурацию рчГ-КСФ проводили разбавлением нейтральным буфером. Хроматографическую очистку рчГ-КСФ осуществляли при помощи одноэталной ионообменной хроматографии на двух последовательно соединенных колонках с ДЭАЭ-целлюлозой и SP-сефадексом при рН 4,4 с последующим элюированием целевого белка с колонки с SP-сефадексом в линейном градиенте хлористого натрия (от 0 до 0,4 М) в 0,02 М натрий ацетатном буфере при рН 4,4-4,5. Выход целевого продукта составил 24-30 мг из 1 л культуры клеток Е. coli SG 20050/pGGF8. Очищенный препарат содержал 200 нг бактериальных белков и 80 пкг ДНК на мг рчГ-КСФ.
Недостатками способа-прототипа являются следующие:
1. Используемая схема отмывки тел включения приводит к потере целевого продукта. В отмытых телах включения, полученных из 10 г биомассы, рчГ-КСФ составляет 151 мг.
2. Отсутствие контроля за ренатурацией приводит к потери части рчГ-КСФ на этапе хроматографии. (Выход очищенного белка составил 24-30 мг на 1 л культуры).
3. Получаемые по заявленному способу препараты рчГ-КСФ содержат значительное количество примесей белков и ДНК штамма-продуцента (около 200 нг и 80 пкг на мг рчГ-КСФ соответственно).
4. Получаемый по заявленному способу препарат рчГ-КСФ содержит 0,1 М NaCI, что приводит к нестабильности белка при хранении при температуре 4±2°С.
Технической задачей данного изобретения является создание более продуктивной технологии получения стабильного препарата очищенного рчГ-КСФ с улучшенным качеством, пригодного для создания лекарственного препарата медицинского назначения.
Увеличение продуктивности достигается за счет применения оптимальной схемы отмывки телец включения, введения контроля над процессом ренатурации и оптимизации условий ренатурации.
Улучшение качества достигается за счет введения дополнительной стадии хроматографической очистки рчГ-КСФ на анионобменнике (ДЭАЭ-сефароза) при рН 7-9, замены катионообменного сорбента (ввели SO3-фрактогель вместо SP-сефадекса) и изменения схемы элюции с катиоонообменного сорбента.
Повышение стабильности достигается за счет диализа очищенного препарата рчГ-КСФ против буфера с рН 4-5, добавления в раствор белка полисахаридов, или многоатомных спиртов, или поливинилпирролидонов, или моносахаридов, или аминосахаров, или белков, или аминокислот и неионных детергентов и его хранения в полимерных или стеклянных емкостях с силиконизированной поверхностью при температуре 4±2°С.
Поставленная задача решается тем, что клетки Е. coli SG20050 или любые производные этого штамма трансформируют плазмидой pGGF8 [26]. Трансформированные клетки Е. coli/pGGF8, выращенные как описано ранее [27], разрушают при помощи Френч-пресса или ультразвука при температуре 6±3°С. Тела включения, содержащие рчГ-КСФ, отделяют от фракции растворимых клеточных белков при помощи центрифугирования. Для удаления примесных бактериальных белков тела включения отмывают буферным раствором с рН 7-9, содержащим детергенты и 2 М мочевину. Отмытый осадок тел включения растворяют в буферном растворе с рН 7-9, содержащем 8 М мочевину и 10-30 мМ 2-меркаптоэтанола или 2-5 мМ дитиотриэтола. Ренатурацию восстановленного рчГ-КСФ проводят разбавлением буферным раствором с рН 7-9, содержащим детергенты, глицерин и этилендиаминтетраацетат натрия (ЭДТА) до концентрации суммарного белка 0,3-0,1 мг/мл при температуре 4-20°С в течение 20-48 часов или при помощи диализа восстановленного рчГ-КСФ против буферного раствора с рН 7-9, содержащего детергенты, глицерин и ЭДТА при температуре 4-20°С в течение 20-48 часов.
После окончания процесса ренатурации полученный раствор окисленного белка пропускают через колонку с анионообменным сорбентом, уравновешенную буферным раствором с рН 7-9. К объединенным фракциям, не связавшимся с сорбентом, добавляют уксусную кислоту до рН 4-5, и полученный раствор наносят на две соединенные последовательно и уравновешенные буферным раствором с рН 4-5 (буфер "А"), колонки с анионообменным и катионообменным сорбентами. Колонку промывают буфером "А", содержащим 0,2 М NaCI, и рчГ-КСФ элюируют с катионообменного сорбента линейным градиентом NaCI от 0,2 до 1,0 М в буфере "А". Фракции, содержащие рчГ-КСФ, объединяют и диализуют против буферного раствора с рН 4-5, добавляют неионные детергенты и полисахариды, или многоатомные спирты, или поливинилпирролидоны, или моносахариды, или аминосахара, или белки, или аминокислоты и хранят в полимерных или стеклянных емкостях с силиконизированной поверхностью при 4±2°С.
В качестве детергентов используют неионные, ионные и амфотерные детергенты. В качестве неионных детергентов используют тритон Х-100, твин-80, твин-20 или их смесь, в качестве ионных детергентов используют дезоксихолат (ДОХ) натрия, цетилтриметил-аммониумбромид (ЦТАВ), или их смесь, в качестве амфотерных детергентов используют 3-[(3-холамидопропил) диметиламино]-1-пропансульфонат (CHAPS), 3-[(3-холамидопропил) диметиламмоний]-2-гидрокси-1 пропансульфонат (CHAPSO) или их смесь.
Выход электрофоретически гомогенного рчГ-КСФ с чистотой ≥98% составляет 36-40 мг из 1 л культуры клеток Е. coli штамма SG20050 или любых производных штамма SG20050, трансформированных плазмидой pGGF8. Специфическая (гемостимулирующая) активность полученного препарата рчГ-КСФ, определенная in vivo на мышах, у которых путем введения цитостатика воспроизводилась гипоплазия кроветворения, составляет 600-1000%. Специфическая активность, определенная in vitro по стимуляции мышиных клеток M-NFS-60, составляет ≥108 МЕ/мг белка. Содержание белков штамма-продуцента составляет менее 30 нг/мг рчГ-КСФ, что в 6 раз меньше, чем в рчГ-КСФ, полученном в способе-прототипе. Содержание ДНК составляет менее 10 пкг/мг рчГ-КСФ, что в 8 раз меньше, чем в способе прототипе.
Предлагаемая схема позволяет получать стабильные препараты рчГ-КСФ с высоким выходом и высокой чистотой, что позволяет использовать их в качестве субстанции в фармацевтической промышленности для создания лекарственных препаратов нового поколения для медицины, а также для косметологии, ветеринарии и научных исследований.
Новым по сравнению со способом-прототипом является:
- введение оптимальной схемы отмывки тел включения буфером, содержащим детергенты и низкие концентрации мочевины (вместо использования отмывки с 1М LiCI с мочевиной в способе-прототипе).
- оптимизация условий ренатурации, в частности:
1. Проведение ренатурации рчГ-КСФ разбавлением восстановленного раствора тел включения буферным раствором с рН 7-9, содержащим детергенты, глицерин и ЭДТА или диализом восстановленного раствора тел включения против 10 объемов буферного раствора с рН 7-9, содержащего детергенты, глицерин, ЭДТА и 0,4-0,8 М мочевину (вместо разбавления нейтральным буфером, содержащим ЭДТА в способе-прототипе).
2. Увеличение времени ренатурации до 48 часов при 4°С или до 24 часов при 20°С (вместо 24 часов при 4°С часов в способе-прототипе. Ренатурация при 20°С в способе-прототипе отсутствует).
- Введение дополнительной хроматографической стадии очистки рчГ-КСФ на анионообменнике при рН 7-9 (Эта стадия очистки рчГ-КСФ в способе-прототипе отсутствует).
- Изменение катионообменного сорбента. Использование SO3-фрактогеля вместо SP-сефарозы в способе-прототипе.
- Изменение схемы элюции с катионнообменного сорбента: введение этапа промывки сорбента буферным раствором с рН 4-5, содержащим 0,2 М NaCI, и последующей элюцией рчГ-КСФ линейным градиентом концентрации NaCI от 0,2 до 1,0 М (В способе-прототипе - этап промывки сорбента 0,02 М натрий ацетатным буфером, содержащим 0,2 М NaCI отсутствует).
- Проведение диализа очищенного белка против буферного раствора с рН 4-5 в отсутствие NaCI и добавления в полученный диализат полисахаридов, или многоатомных спиртов, или поливинилпирролидонов, или моносахаридов, или аминосахаров, или белка, или аминокислот и неионных детергентов (В способе-прототипе диализ очищенного белка проводят против 50 мМ натрий-ацетатного буфера рН 4,4-4,5, содержащего 0,1 М NaCI, без последующего добавления стабилизаторов в раствор белка).
Введенные изменения позволяют повысить выход, качество и стабильность препарата рчГ-КСФ.
Предлагаемый способ осуществлен с использованием штамма-продуцента, полученного трансформацией клеток E.coli штамма SG20050 (или любых производных штамма E.coli SG20050) плазмидой pGGF8 [26].
Биомасса трансформированных клеток получена, как описано ранее [27].
Клетки разрушают при помощи Френч-пресса или ультразвука, центрифугируют и осадок тел включения последовательно отмывают буферным раствором, содержащим детергенты и низкие концентрации мочевины.
Эта схема отмывки тел включения позволяет избирательно удалить из тел включения бактериальные белки и ДНК практически без потерь целевого продукта. Отмытые тела включения растворяют в буферном растворе с рН 7-9, содержащем 6-8 М мочевину или 6 М гуанидинхлорид, и 10-30 мМ 2-меркаптоэтанола или 2-5 мМ дитиотриэтола до концентрации суммарного белка 1-3 мг/мл. Ренатурацию проводят при помощи разбавления полученного раствора восстановленного белка фосфатным буфером, рН 7-9, содержащим детергенты, глицерин и ЭДТА, до концентрации суммарного белка 0,3-0,1 мг/мл. Альтернативно ренатурацию проводят диализом полученного раствора восстановленного белка против 10 объемов фосфатного буфера, рН 7-9, содержащего детергенты, глицерин, ЭДТА и 0,4-0,8 М мочевины. Время ренатурации составляет от 20 до 48 час при температуре 4-20°С. Например, при температуре 6±3°С и 20±3°С время ренатурации составляет 48±3 часа и 24±3 часа соответственно. Снижение концентрации денатурирующих агентов - мочевины и гуанидинхлорида - и окисление восстановленных SH-групп белка растворенным кислородом при диализе или разбавлении раствора денатурированного восстановленного белка приводит к сворачиванию белка в правильную конформацию (ренатурация), в результате чего в рчГ-КСФ происходит образование внутримолекулярных дисульфидных связей. Известно, что молекула Г-КСФ содержит две внутримолекулярные дисульфидные связи Cys36-Sys42 и Sys64-Sys74 и свободную сульфгидрильную группу в Cys17 [28]. Показано, что ренатурация рчГ-КСФ происходит в два этапа, с образованием частично ренатурированного продукта: сначала очень быстро проходит образование дисульфидной связи Cys36-Sys42, и только затем очень медленно формируется вторая дисульфидная связь Sys64 -Sys74 [29-30]. Поскольку денатурированный рчГ-КСФ содержит 5 цистеинов в восстановленной форме, он отличается по ряду свойств от частично ренатурированного рчГ-КСФ, который содержит 2 цистеина с окисленными группами (одна дисульфидная связь) и 3 цистеина в восстановленной форме и полностью ренатурированного рчГ-КСФ (содержит 4 цистеина в окисленной форме (две дисульфидные связи) и 1 цистеин в восстановленной форме, поэтому можно ввести контроль за образованием полностью ренатурированного рчГ-КСФ с помощью метода электрофореза в полиакриламидном геле в невосстанавливающих (в отсутствие 2-меркаптоэтанола) условиях. Окисленные и восстановленные формы рчГ-КСФ, обработанные иодацетамидом, имеют различную электрофоретическую подвижность. Условия, при которых более 90% рчГ-КСФ было представлено полностью окисленной ренатурированной формой, считали оптимальными. Процесс ренатурации проводят при рН 8-9, так как в этих условиях тиоло-дисульфидный обмен может происходить достаточно быстро без добавления экзогенных тиоловых групп [31]. Ренатурацию проводят в присутствии детергентов и глицерина, так как ранее было показано, что введение в ренатурационный буфер детергентов и глицерина повышает эффективность ренатурации некоторых рекомбинантных белков [32-33].
После окончания процесса ренатурации проводят очистку белка при помощи ионообменной хроматографии при разных рН. На первой стадии проводят хроматографию при рН 7-9 на анионообменном сорбенте (ДЭАЭ-сефарозе). В этих условиях с сорбентом связываются высокомолекулярные нуклеиновые кислоты и основная часть бактериальных белков, при этом рчГ-КСФ с сорбентом не связывается. Далее проводят рН-фракционирование раствора, содержащего рчГ-КСФ, снижая рН буфера до 4-5. При этом тиол-дисульфидный обмен замедляется и неправильно свернутые формы и олигомеры рчГ-КСФ выпадают в осадок. Полученную суспензию фильтруют и для окончательной очистки рчГ-КСФ проводят хроматографию полученного фильтрата при рН 4-5 одновременно на двух последовательно соединенных колонках: первая с анионообменным сорбентом (ДЭАЭ-сефарозой), вторая с катионообменным сорбентом (SO3-фрактогелем). Использование анионообменного сорбента при рН 4-5 позволяет сорбировать из раствора липополисахариды, низкомолекулярные нуклеиновые кислоты и оставшиеся бактериальные белки. При рН 4-5 рчГ-КСФ связывается с катиоонообменным сорбентом. Остаточные примеси бактериальных белков, также связавшиеся с катионообменным сорбентом, элюируют буферным раствором, содержащим градиент концентрации NaCI от 0,05 до 0,2 М. Элюцию рчГ-КСФ проводят градиентом концентрации хлористого натрия от 0,2 до 1,0 М в буферном растворе с рН 4-5. Очищенный препарат рчГ-КСФ диализуют против 3-15 мМ буферного раствора с рН 4-5, добавляют полисахариды, или многоатомные спирты, или поливинилпирролидоны, или моносахариды, или аминосахара, или белки, или аминокислоты и неионные детергенты и хранят в пластиковых или стеклянных флаконах с силиконизированной поверхностью при температуре 4±2 °С.
Использование приведенного выше способа позволяет получать высокоочищенные стабильные препараты рчГ-КСФ с выходом 32-40 мг на л культуры клеток (на 30% выше по сравнению со способом-прототипом).
Предлагаемое изобретение иллюстрируется фигурами графического изображения, где представлены:
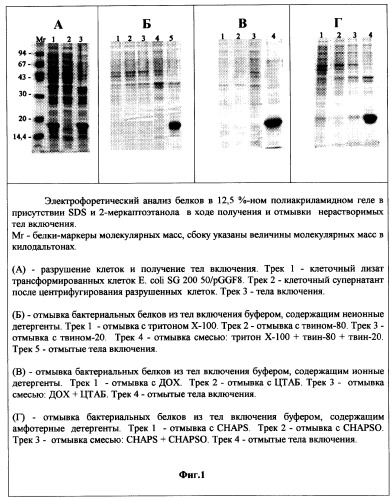
Фиг.1. Электрофоретический анализ белков в 12% полиакриламидном геле в присутствии SDS в ходе получения и отмывки нерастворимых тел включения.
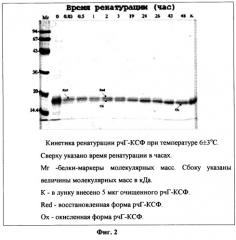
Фиг.2. Кинетика ренатурации рчГ-КСФ при температуре 6±3°С.
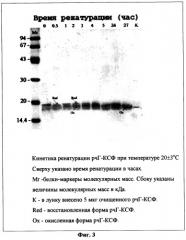
Фиг.3. Кинетика ренатурации рчГ-КСФ при температуре 20±3°С.
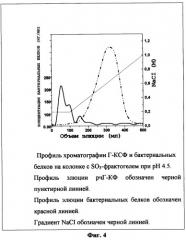
Фиг.4 Хроматография рчГ-КСФ и бактериальных белков при рН 4,5 на колонке с катионообменником (SO3-фрактогель).
Фиг.5. Электрофоретический анализ очищенного рчГ-КСФ.
Примеры конкретного выполнения способа приведены ниже:
Пример 1. Разрушение клеток E.coli SG20050/pGGF8 и получение тел включения. 10 г биомассы штамма-продуцента E.coli SG20050/pGGF8 суспендируют в 100 мл 10 мМ трис-HCl, рН 8, содержащем 0,14 М NaCI, 0,02 М ЭДТА и 1 мМ фенилметилсульфонилфторида (ингибитор протеиназ). Клетки разрушают при помощи Френч-пресса или ультразвука и суспензию центрифугируют 20 мин при температуре 4°С. Осадок тел включения содержит бактериальные белки и рчГ-КСФ (фиг.1А, трек 3). Супернатант, полученный после центрифугирования разрушенных клеток, содержит только бактериальные белки (фиг.1А, трек 2).
Пример 2. Разрушение клеток E.coli SGK25/pGGF8 и получение тел включения. 10 г биомассы штамма-продуцента E.coli SGK25/pGGF8 суспендируют в 100 мл 10 мМ трис-HCl, рН 8, содержащем 0,14 М NaCI, 0,02 М ЭДТА и 1 мМ фенилметилсульфонилфторида. Клетки разрушают при помощи Френч-пресса или ультразвука и суспензию центрифугируют 20 мин при температуре 4°С. Осадок тел включения содержит бактериальные белки и рчГ-КСФ.
Пример 3. Отмывка бактериальных белков из тел включения буфером, содержащим неионные детергенты.
Тела включения, полученные в примерах 1 и 2, отмывают 10 мМ трис-HCl, рН 8, содержащим 2 М мочевину и ионные детергенты: тритон Х-100, или твин-80, или твин-20, или их смесь. Промывочные растворы содержат набор бактериальных белков, но не содержат рчГ-КСФ (фиг.1Б, треки 1, 2, 3, 4). Содержание рчГ-КСФ в отмытых телах включения составляет 74% от суммарного белка (фиг.1Б, трек 5).
Пример 4. Отмывка бактериальных белков из тел включения буфером, содержащим ионные детергенты.
Тела включения, полученные в примерах 1 и 2, отмывают 10 мМ трис-HCl, рН 8, содержащим 2 М мочевину и ионные детергенты: ДОХ, или ЦТАБ, или их смесь. Промывочный раствор содержит набор бактериальных белков, но не содержит рчГ-КСФ (фиг.1В, треки 1, 2 и 3). Содержание рчГ-КСФ в отмытых телах включения составляет 83% от суммарного белка (фиг.1В, трек 4).
Пример 5. Отмывка бактериальных белков из тел включения буфером, содержащим амфотерные детергенты.
Тела включения, полученные в примерах 1 и 2, отмывают 10 мМ трис-HCl, рН 8, содержащим 2 М мочевину и амфотерные детергенты:CHAPS, или CHAPSO, или их смесь. Промывочный раствор содержит набор бактериальных белков, но не содержит рчГ-КСФ (фиг.1Г, треки 1, 2 и 3). Содержание рчГ-КСФ в отмытых телах включения составляет 70% от суммарного белка (фиг.1Г, трек 5).
Пример 6. Определение содержания рчГ-КСФ.
Содержание рчГ-КСФ определяют по отношению к суммарному клеточному белку. Анализируемые образцы с известной концентрацией белка суспендируют в 200 мкл буфера, содержащего 125 мМТрис-HCl, рН 6,8, 20% глицерин, 3% SDS, 3% меркаптоэтанол, 0,005% бромфеноловый синий, нагревают 10 мин на кипящей водяной бане и охлаждают во льду; вносят в лунки по 2, 5 и 10 мкл каждого образца и подвергают электрофорезу в 12,5% SDS-ПААГ. По окончании электрофореза гель окрашивают при помощи кумасси R-250. После отмывки избытка красителя гель сканируют при помощи сканера ScanJet 5300C. В исследуемых пробах определяют концентрацию суммарного клеточного белка, общий белок, содержание рчГ-КСФ, общее количество рчГ-КСФ и выход рчГ-КСФ относительно суммарного белка при помощи программы Gel-Pro 3.1.
Пример 7. Растворение тел включения в мочевине и восстановление белка. Осадок тел включения, полученный в примерах 3 или 4 или 5, суспендируют в 300 мл 10 мМ трис-HCl, рН 8, содержащего 8 М мочевину и интенсивно перемешивают до прозрачности. В растворе определяют концентрацию белка. К раствору добавляют 10 мМ трис-HCl буфер, рН 8, содержащий 8 М мочевину, до концентрации белка 1-3 мг/мл. Для восстановления белка добавляют 2-меркаптоэтанол до концентрации 20 мМ или дитиотриэтол до концентрации 3 мМ и смесь оставляют на 18-20 часов при комнатной температуре 18-20°С
Пример 8. Растворение тел включения в гуанидинхлориде и восстановление белка. Полученный в примерах 3 или 4 или 5 осадок суспендируют в 300 мл 10 мМ трис-HCl, рН 8, содержащего 6 М гуанидинхлорид, и интенсивно перемешивают до прозрачности. В растворе определяют концентрацию белка. К раствору добавляют 10 мМ трис-HCl буфер, рН 8, содержащий 6 М гуанидинхлорид, до концентрации белка 1-3 мг/мл. Для восстановления белка добавляют 2-меркаптоэтанол до концентрации 20 мМ или дитиотриэтол до концентрации 3 мМ и смесь оставляют на 18-20 часов при комнатной температуре 18-20°С.
Пример 9. Ренатурация рчГ-КСФ после растворения тел включения в буферном растворе, содержащем 8М мочевину.
Раствор восстановленного белка, полученный в примере 7, охлаждают до температуры 6±3°С и добавляют 9 объемов 10 мМ натрий фосфатного буфера, рН 8, содержащего неионные детергенты (твин-20 или твин-80), 0,4% глицерина и 10 мМ ЭДТА, охлажденного до указанной температуры. Полученную смесь выдерживают при температуре 6±3°С в течение 48±2 часа или при температуре 20±3°С в течение 24±2 часа.
Пример 10. Ренатурация рчГ-КСФ после растворения тел включения в буферном растворе, содержащем 6М гуанидинхлорид. Раствор восстановленного белка, полученного в примере 8, диализуют 2 раза против 10 объемов 10 мМ натрий фосфатного буфера, рН 8, содержащего детергенты, 0,4% глицерина, 10 мМ ЭДТА и 0,5 М мочевины, при температуре 20±3°С или 6±3°С в течение 24±2 или 48±2 часа соответственно.
Пример 11. Подбор условий ренатурации.
Для контроля за эффективностью ренатурации из раствора, полученного в примере 9, через определенные интервалы времени отбирают аликвоты, добавляют уксусную кислоту до рн 4,5 и центрифугируют. К супернатанту добавляют 1/3 объема буфера, содержащего 125 мМ Трис-НСЕ, рН 6,8, 20% глицерин. 3% SDS 0,005% бромфеноловый синий, и нагревают 3 мин на кипящей водяной бане. К пробам добавляют 1/10 объема 3 М раствора йодацетамида, инкубируют 30 мин при комнатной температуре и вносят в лунки по 50-100 мкл и подвергают электрофорезу в 12,5% SDS-ПААГ. По окончании электрофореза гель окрашивают при помощи Кумасси R-250. После отмывки избытка красителя гель сканируют при помощи сканера ScanJet 5300C. Кинетика ренатурации рчГ-КСФ при температуре 6±3°С и 20±3°С представлена на фиг.2 и 3 соответственно. Исходя из полученных данных видно, что ренатурация заканчивается через 48±2 часа и через 24±2 часа при температуре 6±3°С и 20±3°С соответственно.
Пример 12. Хроматография рчГ-КСФ на анионообменном сорбенте при рН 8. Раствор ренатурированного белка, полученный в примере 9, центрифугируют или фильтруют. Надосадочную жидкость разбавляют в два раза 10 мМ натрий фосфатным буфером, рН 8 и наносят на колонку (20 мл) с анионообменным сорбентом (ДЭАЭ-сефароза), уравновешенную тем же буфером. Фракцию, содержащую белки, не связавшиеся с сорбентом, собирают, колонку промывают 10 мМ натрий фосфатным буфером, рН 8, и белки, связавшиеся с сорбентом, элюируют 1,0 М NaCI. Все фракции анализируют при помощи электрофореза в денатурирующих условиях в 12,5% ПААГ и при помощи иммуноферментного анализа (ИФА) для определения примесных бактериальных белков. Как показали результаты эксперимента (табл.1), при рН 8 рчГ-КСФ не связывается с анионообменным сорбентом в отличие от бактериальных белков, связавшихся с анионообменным сорбентом и элюирующихся с колонки 1 М NaCI. Аналогичные результаты были получены при хроматографии на анионообменном сорбенте при рН 8 раствора ренатурированного белка, полученного в примере 10. К белковому раствору, не связавшемуся с сорбентом, содержащему рчГ-КСФ, добавляют уксусную кислоту до рН 4,5, инкубируют 2 часа при температуре 6±3°С и фильтруют.
| Табл.1. Хроматография рчГ-КСФ на анионообменном сорбенте при рН 8. | |||
| Фракции | Объем (мл) | Состав | |
| Г-КСФ (мг) | Бактериальные белки по данным ИФА (мкг) | ||
| Исходный материал | 3600 | 174 | 200 |
| Несорбированный материал | 3800 | 164 | - |
| Сорбированный материал | 85 | 10 | 180 |
Пример 13. Очистка рчГ-КСФ при помощи ионообменной хроматографии на анионообменном и катионообменном сорбенте при рН 4,5.
Фильтрат, полученный в примере 12, наносят на соединенные последовательно колонки с анионообменным (ДЭАЭ-сефароза, 100 мл) и катиоонообменным (SO3-фрактогель, 20 мл) сорбентами, уравновешенными 20 мМ натрий ацетатным буфером, рН 4,5 (буфер "А"). После нанесения колонку с анионообменным сорбентом отсоединяют, колонку с SO3-фрактогелем промывают последовательно буфером "А" и буфером А, содержащим градиент концентрации NaCI от 0,05 до 0,2 М. Элюцию сорбированного на с SO3-фрактогеле рчГ-КСФ проводят линейным градиентом хлористого натрия от 0,2 до 1,0 М в буфере "А". Фракции анализируют электрофорезом в денатурирующих условиях в 12,5% ПААГ и ИФА для определения примесных бактериальных белков. Для этого из каждой фракции отбирают аликвоты по 100 мкл и проводят ИФА, как описано в работе [34]. Как показали результаты эксперимента (фиг.4), примесные бактериальные белки элюируются при концентрации NaCI, меньшей чем 0,2 М, тогда как рчГ-КСФ начинает элюироваться при концентрации NaCI больше, чем 0,4 М. Фракции, содержащие рчГ-КСФ, объединяют. Выход целевого белка составляет 130 мг. Суммарные данные по очистке и выходу рчГ-КСФ из 10 г биомассы приведены в таблице 2.
| Табл.2. Очистка и выход рчГ-КСФ из 10 г биомассы E.coli /pGGF8 | ||||||
| Стадия | Объем (мл) | Суммарный белок | Г-КСФ | Выход Г-КСФ (%) | ||
| Концентрация (мг/мл) | Количество (мг) | Содержание (%) | Количество (мг) | |||
| Тела включения | 360 | 1,0 | 360 | 60 | 216 | 100 |
| Проба после ренатурации | 3600 | 0,069 | 248 | 70 | 174 | 80 |
| Проба после ионообменной хроматографии при рН 8 | 3800 | 0,054 | 205 | 80 | 164 | 76 |
| Проба после ионообменной хроматографии при рН 4,5 | 200 | 0,65 | 130 | ≥98 | 130 | 60 |
Электрофоретическая чистота полученного белка рчГ-КСФ в редуцирующих и нередуцирующих условиях при нагрузке на лунку 40 мкг составляет более 98% (Фиг.5, треки 2 и 3 соответственно).
Пример 14. Стабилизация очищенного рчГ-КСФ. Объединенные фракции, содержащие очищенный рчГ-КСФ, полученные в примере 13, диализуют против 20 объемов 5 мМ натрий ацетатного буфера, рН 4,5 при температуре 6±3°С. Полученный диализат помещают в пластиковые или стеклянные флаконы с силиконизированной поверхностью, добавляют твин-80 до конечной концентрации 0,002% и добавляют стабилизаторы - полисахариды, или многоатомные спирты, или поливинилпироллидоны, или моносахариды, или аминосахара, или белки, или аминокислоты и хранят при температуре 6±3°С. В качестве полисахарида используют декстран-60 в концентрации 3-6%, в качестве многоатомного спирта используют полиэтиленгликоль 1500 в концентрации 2-5%, в качестве поливинилпиролидона используют поливинилпирролидон-12000 в концентрации 3-6%, в качестве моносахарида используют маннит в концентрации 4-7%, в качестве аминосахаров используют глюкозамин в концентрации 6-10%, в качестве белка используют человеческий сывороточный альбумин (ЧСА) в концентрации 1%, в качестве аминокислоты используют L-аргинин в концентрации 2-6%. Через 12 месяцев отбирают аликвоты и анализируют биологическую активность рчГ-КСФ. В таблице 3 приведены данные по хранению препаратов рчГ-КСФ с тестированием активности методом in vivo на мышах, у которых путем введения циклофосфана была вызвана миелосупрессия. Результаты эксперимента показали, что при хранении в присутствии NaCI активность рчГ-КСФ через 12 месяцев уменьшалась более чем в два раза (табл.3). При добавлении стабилизаторов - полисахариды, или многоатомные спирты, или поливинилпироллидоны, или моносахариды, или аминосахара, или белки, или аминокислоты - активность рчГ-КСФ сохранялась в течение 12 месяцев.
| Таблица 3. Влияние различных веществ на стабильность препарата субстанции рчГ-КСФ в 5 мМ Na-ацетатном буфере, содержащем 0,002% Твина-80 при хранении в течение 12 месяцев при температуре 4±2°С (Специфическая активность в % на мышах линии CBA/CaLac). | |||
| Исходная активность, (%). | Добавляемое вещество | Концентрация (%) (W/V) | Активность после хранения, (%). |
| 968 | NaCI | 0,9 | 430 |
| Декстран 60 | 3-6 | 950 | |
| Полиэтиленгликоль 1500 | 2-5 | 920 | |
| Поливинилпирролидон 12000 | 3-6 | 950 | |
| Маннитол | 4-7 | 890 | |
| Глюкозамин | 6-10 | 910 | |
| Человеческий сывороточный альбумин | 1-2 | 920 | |
| L-аргинин | 2-6 | 930 |
Пример 15. Определение биологической активности препарата рчГ-КСФ in vivo и in vitro.
Гемостимулирующую (гранулоцитопоэзстимулирующую) активность полученного препарата in vivo определяли на мышах, у которых путем введения цитостатика воспроизводилась гипоплазия кроветворения. Биологическую активность in vitro определяли по стимуляции мышиных клеток M-NFS-60. Для тестирования активности препарата in vivo использовали 12 мышей-самцов линии CBA/CaLac массой 18-20 г. Все 12 животных получали однократно внутрибрюшинно циклофосфан в максимально переносимой дозе - 250 мг/кг в 0,2 мл раствора натрия хлорида 0,9% для инъекций (раствор 1). Через 24 ч после инъекции цитостатика шести опытным мышам начинали вводить препарат субстанции рчГ-КСФ в дозе 125 мкг/кг в 0,2 мл раствора 1 подкожно ежедневно в течение четырех дней. Контрольным животным (оставшимся шести мышам) после цитостатика вводили четырехкратно в эквивалентном объеме раствор 1. Специфическая активность полученного препарата рчГ-КСФ in vivo составляла 840-1000% (табл.4). Биологическая активность полученных препаратов рчГКСФ in vitro, определенная по стимуляции мышиных клеток M-NFS60, составляет ≥108 МЕ/мг белка (табл.5).
| Таблица 4. Активность очищенных препаратов рчГ-КСФ in vivo (Специфическая активность в % на мышах линии CBA/CaLac). | ||
| рчГ-КСФ (№образца) | Концентрация белка (мг/мл) | Активность, (%). |
| 1 | 1,01 | 968 |
| 2 | 0,59 | 840 |
| 3 | 0,8 | 1000 |
| Таблица 5. Активность очищенных препаратов рчГ-КСФ in vitro на клетках M-NFS60 (Специфическая активность в МЕ/мг белка). | ||
| рчГ-КСФ (№образца) | Концентрация белка (мг/мл) | Активность, (МЕ/мг белка). |
| 1 | 1,01 | ≥108 |
| 2 | 0,59 | ≥108 |
Пример 16. Определение неспецифических примесей (ДНК и бактериальных белков) в препарате очищенного рчГ-КСФ.
Примеси белков штамма-реципиента E.coli SG20050 или любых производных этого штамма определяли иммуноферментным анализом с использованием поликлональных антител к белкам Е. coli SG20050 [34].
Примеси ДНК определяли гибридизацией [35]. Результаты определения содержания ДНК и бактериальных белков представлены в таблице 6. Полученные данные указывают на то, что содержание ДНК и бактериальных белков в препарате очищенного рчГ-КСФ снизилось примерно в 6-8 раз по сравнению с препаратом, полученным в способе-прототипе.
| Табл.6. Определение неспецифических примесей в препарате очищенного рчГ-КСФ. | |||
| рчГ-КСФ (№образца) | Концентрация белкамг/мл | Примеси бактериальных белков, нг/мг Г-КСФ | Примеси ДНК пкг/мг Г-КСФ |
| 1 | 0,65 | ≤25 | 0 |
| 2 | 0,7 | 30 | 10 |
| 3 | 0,8 | 30 | 10 |
| 4 | 0,56 | ≤25 | 0 |
Таким образом, полученные результаты свидетельствуют о том, что использование предлагаемого способа позволяет получать стабильные препараты рчГ-КСФ с более высоким выходом и более высокой чистотой по сравнению со способом-прототипом. Полученный препарат рчГ-КСФ соответствует требованиям, предъявляемым Минздравом к медицинским иммунобиологическим препаратам, полученным методами генетической инженерии [36], что позволяет использовать его в качестве субстанции в фармацевтической промышленности для создания лекарственных препаратов нового поколения для медицины, а также для косметологии, ветеринарии и научных исследований.
Источники информации
1. Metcalf D.//Blood, 1986, v.67, No.2, р.257-267.
2. Basu S., Dunn A., Ward A. // International Journal of Molecular Medicine, 2002, v.10, p.3-10.
3. Platzer E. //. Eur.J.Hematol., 1989, V.42, р.1-15.
4. Morstyn G., Burgess A.W. //Cancer Res., 1988, V