Способ получения изолированных кардиомиоцитов из сердца взрослой крысы
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к физиологии. Способ выделения кардиомиоцитов из сердца взрослой крысы путем перфузии сердца в течение 40 мин смесью ферментов коллагеназа и проназа в концентрации 0.2 мг/мл и 0.1 мг/мл, соответственно, позволяет эффективно разделять миокард на отдельные, нормальные по структуре и жизнеспособные клетки. Изолированные кардиомиоциты крыс применяются в исследованиях, направленных на изучение изменений параметров внутриклеточного гомеостаза при сердечно-сосудистых патологиях. Изобретение обеспечивает снижение повреждающего воздействия на кардиомиоциты за счет упрощения способа. 4 ил.
Реферат
Изобретение относится к физиологии, а именно к физиологии сердца, и может быть использовано для проведения длительных исследований на большом числе изолированных кардиомиоцитов половозрелых крыс.
Известен способ разделения ткани сердца на отдельные кардиомиоциты путем ферментативной обработки миокарда по Yang B.C., Zander D.S., Mehta J.L. // J.Pharmacol. Exp. Ther. 1999. Vol.291. P.733-738 [1]. При этом сердце длительно обрабатывают раствором, содержащим 1 мг/мл коллагеназы; применяют процедуры встряхивания и многократного центрифугирования.
Данный способ является наиболее близким к заявляемому и выбран в качестве прототипа.
Недостатком способа прототипа является: сложность процедуры выделения кардиомиоцитов, а также химическое и механическое повреждение клеток при разделении, что снижает конечное число жизнеспособных кардиомиоцитов и ограничивает время их использования в исследованиях.
Цель изобретения: снижение повреждающего воздействия на кардиомиоциты за счет упрощения процедуры выделения.
Поставленная цель достигается техническим решением, представляющим собой способ выделения кардиомиоцитов из сердца взрослой крысы путем перфузии сердца в течение 40 мин смесью ферментов коллагеназа и проназа в концентрации 0.2 мг/мл и 0.1 мг/мл, соответственно.
Среды выделения и хранения клеток, используемые в заявляемом способе, не содержат компонентов, способных привести к повреждению клеток или ограничить возможность использования полученных кардиомиоцитов.
Новым в предлагаемом способе является то, что для получения изолированных клеток, сердце в течение 40 мин перфузируют смесью ферментов коллагеназа и проназа в концентрации 0.2 мг/мл и 0.1 мг/мл, соответственно.
В настоящее время получение изолированных кардиомиоцитов остается достаточно сложной и дорогой методикой [1-4]. Это обстоятельство является серьезным препятствием, сдерживающим проведение исследований с использованием изолированных кардиомиоцитов.
Хорошо известно, что чем сложнее и длительнее процедура выделения кардиомиоцитов, тем более высока вероятность получения поврежденных клеток с искаженными свойствами, что может повлиять на данные, получаемые в исследованиях с использованием этих клеток. Так, обработка сердца высокими концентрациями ферментов приводит к уменьшению и повреждению мембраносвязанных частиц (каналы, транспортеры, рецепторы). Любые механические процедуры приводят к нарушению целостности клеточной мембраны. Попытки обойти эти проблемы приводили к снижению количества полученных клеток и их жизнеспособности. Поэтому при различных способах получения изолированных кардиомиоцитов исследователи чаще жертвуют количеством выделенных клеток. Мы постарались подобрать такие условия, при которых можно было бы получить максимальное количество жизнеспособных кардиомиоцитов. Минимальные концентрации ферментов, при которых удается получить наиболее благоприятные результаты, были подобраны в ходе многочисленных экспериментов. Время обработки сердца ферментами мы подбирали с учетом используемых концентраций ферментов. Сочетание выбранных нами ферментов, их концентрации и времени ферментативной перфузии позволило свести к минимуму механическое воздействие на кардиомиоциты.
Совокупность собственных экспериментов и литературных данных позволяет считать, что предлагаемый способ дает возможность получать изолированные кардиомиоциты из сердца взрослой крысы достаточно быстро и с минимальным повреждением.
Изобретение будет понятно из следующего описания и приложенных чертежей.
Фиг.1. Изолированный кардиомиоцит в среде хранения, содержащим 0.4% трипановый синий, ×1000.
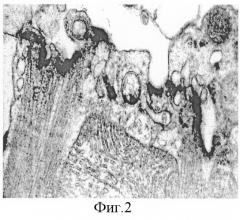
Фиг.2. Продольный срез изолированного кардиомиоцита: участок миофибриллы с прилегающим СПР и митохондриями, ×36000.
Фиг.3. Продольный срез изолированного кардиомиоцита: участок ядра с ядерными порами, ×36000.
Фиг.4. Продольный срез изолированного кардиомиоцита: область вставочных дисков, ×19000.
Способ осуществляется следующим образом:
Кардиомиоциты выделяют из сердца взрослой крысы линии Вистар весом 250-400 г. Для выделения применяют реактивы фирмы Sigma (растворы готовятся на деионизованной воде). После декапитации крысы сердце немедленно извлекается и помещается в ледяную среду выделения (Кребс-Хенселайт буфер, рН 7.4). Затем сердце помещают в перфузионную камеру и канюлируют его через аорту. Последующие 5-10 мин сердце отмывают от крови Кребс-Хенселайт буфером, содержащим (в мМ) 118 NaCl, 4.7 KCl, 1.25 KH2PO4, 1.3 MgSO4, 10 глюкозу, 1.2 CaCl2, 10 HEPES, рН 7.4. В течение всей процедуры выделения буфер насыщают чистым кислородом, и поддерживается температура 35°С. Через сердце буфер прокачивают перистальтическим насосом со скоростью 4 мл/мин. После отмывания от крови сердце 5 минут перфузируют Кребс-Хенселайт буфером, не содержащим ионы кальция. Затем, в течение 20 минут, сердце перфузируют Кребс-Хенселайт буфером с низким содержанием кальция (не более 0.25 мМ), рН 7.4, а также ферментов коллагеназы (0.2 мг/мл) и проназы (0.1 мг/мл). Еще 20 минут сердце обрабатывают буфером, содержащим только проназу (0.1 мг/мл), рН 7.4. Далее сердце отмывают от ферментов, продолжая перфузию низкокальциевым буфером (рН 7.4) в течение 10 мин. Отмытое сердце снимают с канюли и помещают в 10 мл Кребс-Хенселайт буфера с концентрацией кальция 0.25-1 мМ. Удалив крупные сосуды, сердце разрезают на кусочки 1-2 мм3 и осторожно ресуспендируют с помощью большой автоматической пипетки в течение 1 мин. В случае неполного разделения, для удаления оставшихся кусочков, суспензию процеживали через двойной слой марли. После этой процедуры клетки готовы для использования в исследованиях и хранения.
Для хранения клеток используется Кребс-Хенселайт буфер с концентрацией кальция 1 мМ, рН 7.4, при комнатной температуре. При необходимости, клетки однократно осаждают (50 g, 3-5 мин) и разводят свежим буфером до нужной концентрации.
Для увеличения продолжительности жизни клеток, суспензию с кардиомиоцитами желательно хранить при температуре +4 - +8°С.
Пример.
Крысу линии Вистар, весом 350 грамм, находящуюся под легким эфирным наркозом, декапитировали, немедленно извлекали сердце и помещали его в ледяную среду выделения (Кребс-Хенселайт буфер, рН 7.4). Затем сердце, канюлируя через аорту, закрепляли в перфузионной камере. Последующие 5-10 минут сердце отмывали от крови Кребс-Хенселайт буфером, содержащим 1.2 мМ CaCl2, при 35°С. Через сердце буфер прокачивали перистальтическим насосом со скоростью 4 мл/мин. После отмывания от крови сердце 5 минут перфузировали Кребс-Хенселайт буфером, не содержащим ионы кальция. Затем, в течение 20 минут, сердце перфузировали Кребс-Хенселайт буфером с низким содержанием кальция (не более 0.25 мМ), а также ферментом коллагеназы (0.2 мг/мл) и проназы (0.1 мг/мл). Еще 20 минут сердце обрабатывали буфером, содержащим только проназу (0.1 мг/мл). Далее сердце отмывали от ферментов, продолжая перфузию низкокальциевым буфером, в течение 10 минут при 35°С. Отмытое сердце снимали с канюли и помещали в 10 мл Кребс-Хенселайт буфера с концентрацией кальция 1 мМ. Удалив крупные сосуды, сердце разрезали на кусочки 1-2 мм3 и осторожно ресуспендировали с помощью большой автоматической пипетки в течение 1 минуты. Для удаления оставшихся кусочков суспензию процеживали через двойной слой марли. Клетки однократно осаждали (50 g, 3-5 мин) и разводили свежим буфером до нужной концентрации. Кардиомиоциты хранили в Кребс-Хенселайт буфере с концентрацией кальция 1 мМ, рН 7.4, при комнатной температуре.
Результаты применения предлагаемого метода выделения кардиомиоцитов из сердца взрослой крысы контролировали методом световой (фиг.1) и трансмиссионной электронной микроскопии (фиг.2-4), а также оценивая жизнеспособность кардиомиоцитов по окраске погибших клеток трипановым синим в течение 8 часов после выделения.
Использование предлагаемого способа позволяет получать 10-12 млн. изолированных кардиомиоцитов из одного сердца. Процент жизнеспособных клеток составлял 70-80%. В течение 4 часов процент жизнеспособных клеток значительно не менялся, а в последующие 2 часа уменьшался до 50%. Клетки имели классическую цилиндрическую форму с хорошо выраженной поперечно-полосатой исчерченностью и неровными концами в области вставочных дисков. Размеры клеток варьировались от 10 до 25 мкМ в ширину и от 50 до 120 мкМ в длину.
На электронных микрофотографиях хорошо просматривалась типичная структурная организация кардиомиоцита. Сарколемма, митохондрии, саркоплазматический ретикулум (СПР) и миофибриллы имели характерный вид; наблюдались упорядоченная организация саркомеров и хорошо выраженные Z-полоски, четкое расположение актиновых миофиламентов относительно миозина (фиг.2). Кардиомиоциты имели ядро овальной формы, расположенное почти по центру клетки, на его мембране легко различаются нормально расположенные ядерные поры (фиг.3). В области вставочных дисков мембрана имеет неоднородную структуру (фиг.4). Миофибриллы разделены СПР и митохондриями, достаточно плотно упакованы и занимают практически все внутриклеточное пространство.
Полученные результаты свидетельствуют о нормальной структуре выделенных клеток и позволяют использовать предложенный метод для мягкого разделения ткани сердца на отдельные кардиомиоциты.
ЛИТЕРАТУРА.
1. Yang B.C., Zander D.S., Mehta J.L. // J. Pharmacol. Exp. Ther. 1999. Vol.291. P.733-738.
2. Satoh H., Blatter L.A., Bers D.M. // Am. J. Physiol. 1997. Vol.272. P.H657-H668.
3. Ichikava H., Hearse D.J., Coetzee W.A. // Am. J. Physiol. 1994. Vol.266. P.H511-H520.
4. Kharpko K., Bodyak N. et al. // Nucleic Acid Res. 1999. Vol.27. P.2434-2441.
Способ получения изолированных кардиомиоцитов из сердца взрослой крысы путем ферментативной обработки целого сердца, отличающийся тем, что сердце в течение 40 мин перфузируют смесью ферментов коллагеназа и проназа в концентрации 0,2 и 0,1 мг/мл соответственно, отмывают от ферментов, ресуспендируют, осаждают клетки и проводят контроль их жизнеспособности.