Сульфат нитрат аммония и способ его получения (варианты)
Иллюстрации
Показать всеИзобретение относится к сульфатно-нитратным композициям, используемым в качестве удобрений. Композиция сульфат нитрат аммония имеет в качестве существенных составляющих сульфат аммония и (NH4)2SO4·2(NH4NO3) двойную соль с менее чем 5 мас.% в сумме более опасной (NH4)2SO4·3(NH4NO3) двойной соли и нитрата аммония. Композиции по настоящему изобретению получают с помощью реакции сульфата аммония с нитратом аммония, взятых в мольном соотношении примерно от 0.9:1 до около 1.1:1 в присутствии небольшого количества воды в ограниченных пределах температуры, а затем при достаточно быстрой степени охлаждения для затвердевания, чтобы предотвратить макроскопическое выделение продуктов реакции. Композиционный продукт сульфат нитрат аммония, применяемый в качестве удобрений, имеет желательные уровни нитратных ионов, очень высокую стабильность против детонации, более высокую плотность, большую устойчивость к влаге. 4 н. и 18 з.п. ф-лы, 9 табл., 7 ил.
Реферат
1. Область изобретения
Настоящее изобретение относится к сульфатно-нитратным композиционным материалам, используемым в качестве удобрений, имеющих желательные уровни нитратных ионов, очень высокую стабильность против детонации, более высокую плотность, большую устойчивость к влаге. Изобретение относится также к способу получения указанных удобрений.
2. Описание уровня техники
Сульфат нитрат аммония (ASN) является одним из первых синтетических удобрений, который находится в непрерывном использовании в течение почти 100 лет, обеспечивая растения важными первичными и вторичными питательными веществами, азотом и серой. Обеспечение азотом частично происходит через нитратный ион, что является желательным, поскольку он легко адсорбируется многими растениями, промотируя их рост на ранней стадии. Исторически сложилось, что термин "сульфат нитрат аммония" не относится к конкретному химическому соединению, содержащему элементы в закрепленных соотношениях. Скорее его использовали для того, чтобы описать различные смеси сульфата аммония и нитрата аммония. Ассоциация американских производителей пищевых продуктов растительного происхождения (AAPFCO), осуществляющая контроль за удобрениями, попыталась ввести уточнения в соответствии с номенклатурой. AAPFCO определила ASN как двойную соль сульфата аммония и нитрата аммония в равных мольных соотношениях, имеющих содержание азота не менее чем 26%. Смесь сульфата аммония и нитрата аммония, взятых в равных молях, имеет содержание азота 26.4%.
Несмотря на определение AAPFCO, название сульфат нитрат аммония используют для определения многих комбинаций сульфата аммония и нитрата аммония. См., например, R.S.Meline, J.Aqric. Food Chem., 16(2), 235-240 (1968), где один продукт имеет 30%-ное содержание азота. US 2 795 495 описывает сульфат нитрат аммония как имеющий мольное соотношение смеси сульфат аммония/нитрат аммония, равное 1:2, а не 1:1. GB 798 690 определяет, что пропорция сульфата аммония не является критической, и он может использоваться в любой пропорции, необходимой, чтобы получить желательный уровень азота. Использование такой терминологии привело к путанице между чистыми двойными солями и смесями. Кроме того, в уровне техники порядок слов сульфат и нитрат иногда изменяют.
Двойная соль является определенным соединением. Определение AAPFCO подразумевает существование соединения, состоящего из одного моля сульфата аммония и одного моля нитрата аммония. Было сообщено о таком соединении, однако, двойной соли 1:1 не было выделено и окончательно не доказано ее существование. Nikonova et al., Zhurnal Prikaladnoi Khimii 15(6). 437-446(1942) дает критический анализ и корректирует ранние работы.
Простое смешивание сульфата аммония и нитрата аммония не приводит к реакции или к завершению реакции между ними. Достаточные условия, включая время, должны быть выполнены, чтобы вызвать полную химическую реакцию между двумя исходными солями. Однако даже в идеальных условиях реакция взятых в равных мольных соотношениях сульфата аммония и нитрата аммония не заканчивается образованием соединения, содержащего равные моли. Вместо этого продуктами реакции являются двойные соли с другими пропорциями, смешанные с непрореагировавшим сульфатом аммония и/или нитратом аммония.
Двойные соли, состоящие из NH4SO4·2(NH4NO3) и NH4SO4•3(NH4NO3) (в дальнейшем двойная соль 1:2 и двойная соль 1:3 соответственно), были выделены и охарактеризованы. Продукт 1:3 выделен из водного раствора и об этом было сообщено уже в 1909 г. (Reicher et al., Chemish Weekblad. 3 (Jan.). 51-56 (1909)). Scheinemakers et al. сообщил в 1910 г. в той же самой публикации (Volume 6, 1910, pages 51-56) о выделении двойной соли 1:2, так же как о двойной соли 1:3, из водных растворов.
Существование двойных солей 1:2 и 1:3 было подтверждено Nikonova (loc. cit.}; Itoh, Koqyo Kaqaku Zasshi. 63 (11), 1913-1916 (1960); Emons et al., Wissenschaftliche. Zeitschrift Techn. Hocksch, Chem. Leuna-Merseburg, 14(3). 295-299 (1972); и Smith et al., J. Agr. Food Chem., 10, 77-78 (1962), среди других публикаций.
Способы получения, о которых сообщают, описывают получение однородных гранул удобрения из сульфата нитрата аммония. Большинство продуктов являются просто смесями сульфата аммония и нитрата аммония, а не специфическими кристаллическими структурами, так как химические композиции, о которых сообщают, не отражают никаких специфических соединений. Исключением является патент US 2762699, выданный на процесс производства двойной соли 1:2.
Были описаны процессы кристаллизации, гранулирования и приллинга (образование гранул отверждением капель при распылении расплавленных солей). GB 798690 описывает способ кристаллизации из водного раствора сульфата аммония и нитрата аммония. Обычно в процессах грануляции используют температуры ниже точки плавления нитрата аммония (170°С), которые гарантируют, что продукт полностью вступил в реакцию. Примеры процессов грануляции приведены в US 3635691, GB 893389, DE 1039498, GB 1259778 и в ранее упомянутой журнальной статье R. S. Meline, et. а1. В процессах приллинга используют температуры, которые находятся выше точки плавления нитрата аммония (170°С). Примеры приведены в Polish Patent PL86.766 и в Przem. Chem., 55 (12). 611-614 (1976). Было добавлено небольшое количество воды, чтобы облегчить плавление нитрата. Патент Швеции 70 119 описывает процесс использования вплоть до 10%-ной воды в загрузке, состоящей из сульфата аммония и нитрата аммония при их мольном соотношении 0.6:1 и приллинга.
Было сообщено несколько деталей относительно композиции продуктов, полученных в этих процессах. Большинство из них, если не все, являются смесями, состоящими из двойных солей, сульфата аммония и нитрата аммония.
Из уровня техники становится ясным, что продукты указанных процессов характеризуются низкой устойчивостью к разрушению, склонностью к адсорбции влаги и спеканию. Например, в FP 1368035 утверждают, что удобрение - сульфат нитрат аммония не устойчив при хранении. Бельгийский патент 388046 перечисляет несколько способов, которые используют добавки, для ликвидации этих проблем. Склонность к спеканию из-за поглощения влаги снижается при добавлении амфотерных оксидов металлов. US 2795495 описывает процесс повышения стабильности сульфата нитрата аммония путем добавления солей железа после воздействия аммиака. GB 1259778 описывает композицию, включающую гидрокисид алюминия или соли алюминия, чтобы получить улучшенные антиспекающие свойства. GB 372388 повышает стабильность добавлением мочевины и солей магния.
J.Turlej, Prz. Chem, 55(12), 611-614 (1976) описывает попытки различных изготовителей повысить устойчивость нитрата сульфата аммония. BASF, в настоящее время крупнейший производитель, по сообщениям добавляет алюминий, магний, и/или соединения кальция. Ruhrchemie добавляет сульфат железа; Victor-Chemische добавляет сульфат железа; Uhde Hebemia добавляет сульфат железа и минерал фанолит. SBA(Бельгия) добавляет некоторые другие соединения. Собственная работа Терледжа (Turlej's), о которой сообщают в той же самой журнальной статье, демонстрирует добавление доломита, алюминия и/или соединений магния, для того чтобы повысить стабильность и устранить спекание.
В некоторых ссылках указывается, что сульфат нитрат аммония всегда содержит непрореагировавшие исходные продукты. I.G. Farbenindustries сообщает в DE; 555581 и DE 555902, что всегда присутствует свободный нитрат аммония. Srinivasa и другие сообщают в Technology, 6(1). 21-23 (1969), что продукт всегда содержит свободный нитрат аммония. Нитрат аммония, как известно, является очень гигроскопичным и это, вероятно, вносит вклад в рождение проблемы спекания и слабости частиц.
Нитрат аммония, смешанный с органическими материалами, такими как мазут, является важным индустриальным взрывчатым веществом. Его также связывают с террористическими инцидентами, такими как взрыв в Нью-Йоркском Центре международной торговли и бомбардировки в Оклахома-Сити. Является желательным изменять состояние нитрата аммония для изменения чувствительности к детонации. Один из способов сделать это заключается в разбавлении нитрата аммония относительно инертным материалом. Согласно US 3366468, 1968, патентует, что от 5 до 10% добавок, таких как фосфаты аммония или сульфат аммония могут, десенсибилизировать и изменить устойчивость нитрата аммония к воспламенению и детонации. Однако чистые двойные соли сульфата аммония - нитрата аммония должны также быть рассмотрены как потенциальные взрывчатые материалы, потому что соотношение кислорода к азоту благоприятно для реакций окисления.
Naoum et al., Zeit. fur das Gesamte_Sceiss. Und Sprangstoff. 19, 35-38(1924) определили теплоту вспышки (реакции) нитрата аммония и смесей нитрата аммония с сульфатом аммония как функции от композиции. Скрытые энергии в 64.5 мас.% и 54.8 мас.% смесях нитрата аммония соответствуют двойным солям 1:3 и 1:2, в то время как смеси 81% и 76% соответственно обладают взрывчатой энергией чистого нитрата аммония. Данные, полученные независимой лабораторией по испытаниям фирмы Honeywell International, показали, что двойная соль 1:3 освобождает больше энергии при разрушении, чем соль 1:2. Однако Naoun et al. указывает, что полностью гомогенная смесь, содержащая менее чем 40 мас.% нитрата аммония, вероятно, больше не является взрывчатой. Скрытая взрывчатая энергия была нулевой при мольном соотношении смеси сульфат аммония/нитрат аммония 1:1 (37.7% по массе нитрата аммония). Naoun et al., WO 9961395 A1 также показал, что чем более гомогенна смесь нитрата аммония и сульфата аммония, тем сильнее затрудненность к детонации. Однако смеси нитрата аммония и крупногранулированного сульфата аммония могут произвести большее расширение газа при достижении детонации, чем один нитрат аммония. Поэтому тщательно перемешанная смесь нитрата аммония и сульфата аммония, состоящая из очень маленьких частиц, наиболее желательна. Двойные соли обеспечивают гомогенность на молекулярном уровне и дисперсию в масштабе нескольких ангстрем. Условия, достаточные для реакции сульфата аммония с нитратом аммония, поддерживаемые в течение достаточного периода, переводят нитрат аммония почти полностью в двойные соли. Такая реакция, если она проведена с достаточным молярным избытком сульфата аммония, приводит к полному или почти полному преобразованию в более надежную двойную соль 1:2.
Удобрение сульфат нитрат аммония в настоящее время производят и продают фирмы BASF и Fertiberia. Рентгеноструктурный анализ продукта, полученного фирмой BASF, показывает, что он представляет собой композицию, состоящую в среднем из 27 мас.% сульфата аммония, 1 мас.% двойной соли 1:2 и 72 мас.% двойной соли 1:3. Продукт фирмы Fertiberia состоит из 29 мас.% сульфата аммония, 35 мас.% двойной соли 1:2 и 36 мас.% двойной соли 1:3. Эти продукты, по-видимому, сделаны с помощью процесса грануляции. Гранулы имеют неоднородную поверхность ядра.
Питательная ценность, безопасность и стабильность композиций сульфата нитрата аммония являются конкурентоспособными свойствами. Питательная ценность увеличивается при увеличении содержания нитрата, но также повышается чувствительность к детонации и чувствительность к влаге. Ввиду высокого штрафа за детонацию замечено, что баланс между этими свойствами должен находиться там, где необходима уверенность в безопасности. Предшествующие заключения приводят к точке зрения, что необходимым является продукт сульфат нитрат аммония, содержащий максимальное количество нитрата, совместимое с безопасными свойствами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является невзрывчатый композиционный материал сульфат нитрат аммония, содержащий, как показывает дифракция рентгеновских лучей от около 14 мас.% до около 35 мас.% сульфата аммония ((NH4)2SO4); от около 60 мас.% до около 85 мас.% (NH4)2SO4·2(NH4NO3) двойной соли; и от 0 до около 5 мас.% в сумме (NH4)2SO4·3(NH4NO3) двойной соли и нитрата аммония (NH4NO3). Композиции, полезные как удобрения, обладают пониженной чувствительностью к влаге, не рассматриваются как опасные материалы под номером 49 в Code of Federal Regulations, "Transportation", Part 172, "Hazardous Materials Table", октябрь 1, 2000 и не классифицируются как окислители согласно United Nations Recommendations on the Transport of Dangerous Goods, Manual of Tests и Criteria, 1995 ", "Section 34, Classification Procedures, Test Methods и Criteria Relating to Oxidizing Substances of Division 5.1".
Изобретением также является способ получения композиционных материалов, представляющих собой сульфат нитрат аммония, включающий загрузку частиц сульфата аммония, нитрата аммония и воды в устройство для плавления, в котором мольное соотношение сульфата аммония к нитрату аммонию составляет от около 0.9:1 до около 1.1:1 и вода составляет от более чем 2 мас.% до около 10 мас.% от загруженных материалов; (b) плавление нитрата аммония и растворение, по крайней мере, части частиц сульфата аммония при температуре от около 180°С до около 210°С; (с) взаимодействие загруженных продуктов при температуре от около 180°С до около 210°С; и (d) затвердевание продукта при скорости охлаждения, по крайней мере, около 100°С/мин.
Изобретение также включает композиционный материал сульфат нитрат аммония, полученный способом, включающим стадии: (а) загрузку частиц, включающих сульфат аммония, нитрат аммония и воду в устройство для плавления, в котором мольное соотношение сульфата аммония к нитрату аммония составляет от около 0.9:1 до около 1.1:1 и вода составляет от более чем 2 мас.% до около 10 мас.% от загруженных материалов; (b) плавление нитрата аммония и растворение, по крайней мере, части частиц сульфата аммония при температуре от около 180°С до около 210°С; (с) взаимодействие загруженных продуктов при температуре от около 180°С до около 210°С; и (d) затвердевание продукта при скорости охлаждения, по крайней мере, около 100°С/мин.
КРАТКОЕ ОПИСАНИЕ фиг.1-7
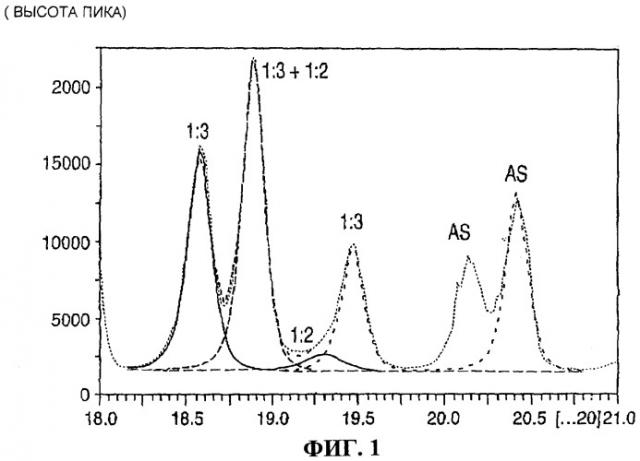
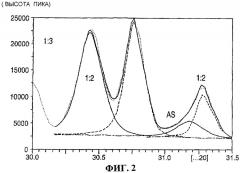
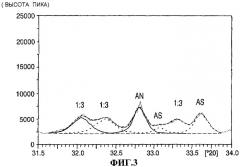
На фигурах 1-3 приведены спектры рентгеновской дифракциии Cu Kα1 для композиционного материала сульфат нитрат аммония, содержащего, как показывает рентгеновская дифракция, 7.6 мас.% сульфата аммония, 42.4 мас.% (NH4)2SO4·2(NH4NO3), 45.7 мас.% (NH4)2SO4·3(NH4NO3) и 4.3 мас. нитрата аммония.
На фигуре 1 приведена развертка спектра рентгеновской дифракции для указанного композиционного материала сульфат нитрат аммония в угловом интервале от 18.2° до 21°
На фигуре 2 приведена развертка Cu Kα1 спектра рентгеновской дифракции для указанного композиционного материала сульфат нитрат аммония в угловом интервале от 30.4° к 31.8°
На фигуре 3 приведена развертка Cu Kα1 спектра рентгеновской дифракции для указанного композиционного материала сульфат нитрат аммония в угловом интервале от 31.8° до 33.8°
На фигуре 4 представлен график, иллюстрирующий связь между количеством воды в загрузке и процентным содержанием двойной соли 1:2 в продукте.
На фигуре 5 приведен график, иллюстрирующий связь между количеством воды в загрузке и процентным содержанием двойной соли 1:3 в продукте.
На фигуре 6 приведен график, иллюстрирующий связь между количеством воды в загрузке и процентным содержанием нитрата аммония в продукте.
На фигуре 7 приведен график, иллюстрирующий связь между количеством воды в загрузке, как сформировано в продукте, и процентным содержанием двойной соли 1:2 в продукте.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является композиционный материал сульфат нитрат аммония, характеризующийся рентгеновской дифракцией, как содержащий от около 14 мас.% до около 35 мас.% сульфата аммония ((NH4)2SO4); от около 60 мас.% до около 85 мас.% (NH4)2SO4·2(NH4NO3) двойной соли; и от 0 до около 5 мас.% в сумме (NH4)2SO4·3(NH4NO3) двойной соли и нитрата аммония (NH4NO3). Предпочтительно, что композиционный материал сульфат нитрат аммония характеризуется рентгеновской дифракцией, как состоящий по существу из около 14 мас.% до около 35 мас.% сульфата аммония ((NH4)2SO4); от около 60 мас.% до около 85 мас.% веса (NH4)2SO4·3(NH4NO3) двойной соли; и 0 до около 5 мас.% в сумме (NH4)2SO4·3(NH4NO3) двойной соли и нитрата аммония (NH4NO3).
Предпочтительно, что в сумме (NH4)2SO4·3(NH4NO3) двойная соль и нитрат аммония (NH4NO3) в композиционном материале сульфат нитрат аммония по настоящему изобретению составляет от 0 до около 3 мас.% Более предпочтительно нитрат аммония ((NH4NO3) составляет от около 0 до 1 мас.%
Термин "двойная соль" как используется в настоящем изобретении, означает химическое соединение, составленное из ионов двух предшествующих соединений, чья кристаллическая структура отличается от структуры предшествующих соединений. Мольное соотношение соединений предшественников в двойной соли находится в соотношении малых целых чисел, например 1:2, и не является непрерывно изменяемым как в твердом растворе.
Композиционный продукт по изобретению состоит из небольших кристаллов сульфата аммония, внедренных в состав (матрицу) из других компонентов. Композиционный материал по изобретению необходими отличать от смеси свободных частиц. Объем кристаллов сульфата аммония приблизительно имеет ту же самую величину, что и частицы исходного сульфата аммония, но при затвердевании около 5 мас.% осадка в виде кристаллов имеет размер менее чем около 2 мкм. Кристаллы сульфата аммония диспергированы в составе равномерно. Небольшой размер и равномерная дисперсия кристаллов сульфата аммония в двойной соли 1:2 значительно повышает стабильность продукта в отношении опасности детонации.
Менее чем около 5 мас.% продукта состоит из опасного нитрата аммония или частиц двойной соли 1:3. Композиции по изобретению полезны в качестве удобрений, они 1 снижают чувствительность к влаге, не считаются опасными материалами, включенными в список Title 49 of the Code of Federal Regulations, "Transportation", Part 172, "Hazardous Materials Table", October 1,2000 и не классифицируются как окислители согласно United Nations Recommendations on the Transport of Dangerous Goods, Manual of Tests и Criteria, 1995", "Section 34, Classification Procedures, Test Methods и Criteria Relating to Oxidizing Substances of Division 5.1".
Сульфат аммония и нитрат аммония, которые используют, чтобы сформировать композиции по изобретению, являются очищенными удобрениями, по крайней мере, примерно 90%-ной чистоты. Предпочтительно сульфат аммония и нитрат аммония имеют, по крайней мере, примерно 95%-ную чистоту. Более предпочтительно сульфат аммония и нитрат аммония имеют, по крайней мере, 97%-ную степень чистоты. Из-за опасности смешивания органических материалов с нитратом аммония очень желательно, чтобы ни сульфат аммония, ни нитрат аммония не содержали больше чем от около 0.2 мас.% органических загрязнений. Одним из примеров сульфата аммония, примененного в изобретении, является коммерчески доступный продукт от фирмы Honeywell International Inc.
Размер частиц нитрата аммония не является критическим, но предпочтительно он составляет около 95 мас.% частиц нитрата аммония, прошедших через сито Tyier No. 6 (отверстие в 3.36 мм).
Размер частиц сульфата аммония важен для достижения целей по изобретению. Как правило, чем меньше частица, тем более высока скорость реакции между сульфатом аммония и нитратом аммония и более высокой будет степень их дисперсии. Предпочтительно, чтобы, по крайней мере, около 85 мас.% сульфата аммония было проходимым сквозь сито Tyler No 48 (отверстие в 0.030 мм). Сульфат аммония, подвергнутый размолу на шаровой мельнице, обычно соответствует этому критерию без дополнительного просеивания. Более предпочтительно, чтобы около 99 мас.% сульфата аммония были проходимыми сквозь сито Tyler No 48. Наиболее предпочтительно, чтобы около 99 мас.% сульфата аммония были проходимыми сквозь сито Tyler No 48 и около 50 мас.% были проходимыми сквозь сито Tyler No 200 (отверстие в 0.074 мм).
Композиции по изобретению формируют при взаимодействии сульфата аммония с нитратом аммония при их мольном соотношении от около 0.9:1 до около 1.1:1 в присутствии небольшого количества воды в узких пределах колебания температур, а затем охлаждение для застывания с достаточно быстрой скоростью, чтобы предотвратить макроскопическую сегрегацию продуктов реакции. Найдено, что при скорости охлаждения менее чем около 100°С/мин наблюдается тенденция к разделению фазы. Способ по изобретению включает стадии: (а) загрузку продуктов, включающих частицы сульфата аммония, нитрат аммония и воды, в устройство для плавления, в котором мольное соотношение сульфата аммония к нитрату аммония составляет от около 0.9:1 до около 1.1:1 и вода составляет более чем от 2 мас.% до около 10 мас.% от загруженных продуктов; (b) плавление нитрата аммония и растворение, по крайней мере, части частиц сульфата аммония при температуре от около 180°С до около 210°С; (с) взаимодействие загруженных продуктов при температуре от около 180°С до около 210°С; и (d) затвердевание продукта при скорости охлаждения, по крайней мере, около 100°С/мин.
Предпочтительно способ по изобретению проводится как непрерывный процесс.
В другом воплощении изобретение включает получение сульфата нитрата аммония с помощью процесса, включающего стадии: (а) загрузку продуктов, состоящих по существу из частиц сульфата аммония, нитрата аммония и воды, в устройство для плавления, в котором мольное соотношение сульфата аммония к нитрату аммония составляет от около 0.9:1 до около 1.1:1 и вода составляет от более чем 2 мас.% до около 10 мас.% от загруженных материалов; (b) плавление нитрата аммония и растворение, по крайней мере, части частиц сульфата аммония при температуре от около 180°С до около 210°С; (с) взаимодействие загруженных продуктов при температуре от около 180°С до около 210°С; и (d) затвердевание продукта при скорости охлаждения, по крайней мере, около 100°С/мин.
Интервалы температур плавления и реакции взаимодействия ограничены потребностью в плавлении нитрата аммония, а также потребностью снизить его разложение. Предпочтительно температуры плавления и реакции имеют значение от около 190°С до около 205°С. Более предпочтительно температуры плавления и реакции взаимодействия имеют значение от около 190°С до около 200°С.
Время, предусмотренное для реакции между сульфатом аммония и нитратом аммония, не является критическим при условии, что существенное время предусматривается для растворения сульфата аммония. Снижающей скорость стадией, как полагают, является растворение сульфата аммония в расплаве нитрата аммония. Необходимое время растворения будет ниже с более мелкими частицами сульфата аммония, при энергичном перемешивании расплава и с температурами в более высоком конце допустимого диапазона.
Для целей сельского хозяйства предпочтительно, чтобы продукты по изобретению находились в форме свободно-сыпучих гранул. Предпочтительно, чтобы стадия d) способа по изобретению: затвердевание продукта при скорости охлаждения, по крайней мере, от около 100°С/мин проводилась в колонке гранулирования. Скорость охлаждения будет больше при меньших величинах капель и более низких температурах воздуха в колонке образования гранул.
Вода является существенным компонентом реакционной смеси. Удивительно, но происходит резкое изменение в соотношениях 1:2 и 1:3 двойных солей в продукте, когда содержание воды в загрузке превышает около 2 мас.% Когда воды становится меньше, чем около 2 мас.% от загруженных продуктов, формируется более опасная двойная соль 1:3, в предпочтении более желательной двойной соли 1:2 и остается большее количество непрореагировавших остатков нитрата аммония. Предпочтительно, чтобы содержание воды было больше, чем 2 мас.% до около 5 мас.% от объема загруженных продуктов. Более предпочтительно содержание воды должно составлять около 2.5 мас.% до около 4 мас.% от загруженных продуктов.
Способ, при котором вода загружается в реакционную смесь, не является критическим. Вода может быть загружена в виде жидкости или она может быть включена в сульфат аммония, нитрат аммония или в них обоих в виде адсорбированной влаги.
Также удивительно то, что остаточная вода в продукте после расплавления и охлаждения пропорциональна исходному количеству воды даже притом, что в некоторых примерах расплавление было проведено при температуре 200°С в течение более часа с перемешиванием. Концентрация остаточной воды также была удивительно высока, учитывая высокое давление водяного пара при температуре 200°С. Большая часть добавленной воды, вероятно, быстро испаряется, однако конечные соотношения двойных солей сильно связаны с концентрацией воды, оставшейся в продукте.
Также был обнаружен другой удивительный эффект воды. При температурах, используемых при расплавлении, вода, возможно, создает пузырьки (пустоты), приводящие к более низкой плотности. Вопреки ожиданиям плотность продукта увеличилась при увеличении количества остаточной воды.
Не будучи связанным с конкретной теорией, раскрывающей суть изобретения, является гипотезой то, что сульфат аммония, находящийся в равномолярной смеси сульфата аммония и нитрата аммония, является не полностью растворимым в расплавленном нитрате аммония в отсутствии воды. Это ограничивает реакцию сульфата аммония с нитратом аммония, приводит к тенденции образования остатка нитрата аммония и поэтому способствует формированию более высокого содержания нитрата двойной соли 1:3. Когда воду добавляют в загрузку, предполагается, что растворимость сульфата аммония в расплавленном нитрате аммония увеличивается, таким образом способствуя завершению реакции нитрата аммония с сульфатом аммония и формированию двойной соли 1:2.
Композиции по изобретению анализируют с помощью порошковой рентгеновской дифракции (XRD), чтобы определить соотношения сульфата аммония, нитрата аммония, двойных солей 1:2 и 1:3. Данные в примерах были собраны на системном рентгеновском дифрактометре 1700 Phillips APD со следующими характеристиками.
XRD Аппаратура
- Герметизированный трубчатый XRG 3100 генератор с Cu мишенью, использующий мощность в 50 кВт, силу тока 40 мА.
- Вертикальный дифрактометр в геометрии парафокуса.
- Переменный падающий, продольная разрез (компенсация θ).
- Искривленный графитовый монохроматор в наборе дифрактированного луча для Cu Кα.
- 0.2°, полученный продольный разрез.
- Герметизированный пропорциональный счетчик ксенона.
- Автоматическое приспособление для замены образца.
- Программное обеспечение ПК-APD.
Образцы и стандарты для XRD анализа были измельчены до величин частиц менее чем 40 мкм, используя 8000 SPEX Mill, Wig-L-Bug измельчитель или ступку и пестик, а затем были загружены в типовые штативы. Небольшая величина частиц и повторная загрузка были использованы, чтобы снизить любые эффекты, связанные с предпочтительной ориентацией или микроадсорбцией.
Идентификация соединений и их дифракционных максимумов была сделана, используя обычный порядок исследования и порошковую базу данных дифракции International Centre For Diffraction Data (ICDD), Newton Square, PA. Начальная развертка спектров продуктов сравнения и их смесей со стандартом - оксидом алюминия - была собрана в угловом интервале от 5° до 85° 2θ, используя 0.02° 2θ размеров шага с 1 с системой подсчета.
Развертки дифракционных спектров были приспособлены к профилю, используя программное обеспечение Philips. Программа посадки профилей использовала Marquardt нелинейный алгоритм наименьших квадратов, профиль пика Voigt и линейный фон. Пригодные результаты для каждого дифракционного максимума состояли из его 2θ пиковых положений для Cu Kα1, использующих λ=1.54056 Å, полная ширина в полумаксимуме (FWHM) Kα1 пикового компонента, высота пика Kα1 компонента пика, площадь Kα1 компонента пика и общая площадь пика, которая включает вклад из обоих Cu Kα1 и Кα2 длин волны. FWHM не были исправлены для аппаратурного расширения.
Количественные исследования выполняли, используя приспособленную профильную высоту пика и площадь отобранных дифракционных максимумов для каждого соединения и коэффициенты эталонной интенсивности Reference Intensity Ratios (RIR). RIR соединений были определены, измеряя отношение их интенсивности к таковой внутренней смеси эталонного стандарта оксида алюминия. NBS 674а, из MIST, используя оба переменных разреза в длину и расчетную установленную интенсивность продольного разреза, содержащего известные соотношения фазы и оксида алюминия. Смеси сульфата аммония, нитрата аммония и двойных солей с оксидом алюминия были препарированы в весовых соотношениях 25/75, 50/50 и 75/25.
Рентгеновская развертка для RIR определения была сделана от 5° до 45° 2θ с 0.02° 2 размерами шага.
RIR для нитрата аммония был получен, используя нитрат аммония марки ACS Grade как сертифицировано Fisher Scientific. Сульфат аммония, использованный для RIR определения, был коммерчески приобретенным от фирмы Honeyweli International Inc. Hopewell VA растение имеет чистоту около 98 мас.% Стандарты, использованные для того, чтобы определять значения RIR для двойных солей 1:2 и 1:3, были сделаны путем кристаллизации и корреляции для примесей в образцах. 1:2 Стандарт содержал 16.7% сульфата аммония. 1:3 Стандарт содержал около 1-2% сульфата аммония и около 3% нитрата аммония.
Большинство пиков на развертках из этих смесей было установлено между 15° и 45° 2θ. Для каждой фазы относительные интенсивности (в %) их дифракционных максимумов были определены экспериментально против его самого интенсивного пика. Относительные интенсивности для каждой фазы были рассчитаны для трех параметров интенсивности: Kα1 высота пика, Kα1 площадь пика и общая площадь пика, используя среднее число интенсивностей от чистого аналитического стандарта и его смесей с оксидом алюминия. Относительные интенсивности пиков оксида алюминия были определены для каждой фазы, используя усредненные интенсивности от чистого оксида алюминия и его смесей с этой фазой.
В уровне техники относительные интенсивности XRD образцов и их RIR приведены, основываясь на фиксированных интенсивностях продольного разреза. Поскольку экспериментально полученные данные по интенсивности были собраны, используя переменный продольный разрез, фиксированные интенсивности продольного разреза были рассчитаны, используя следующее уравнение:
I (фиксированная)=I(переменная)/sinθ
В общем, три самых интенсивных пика для каждой фазы использовали для того, чтобы определить RIR. Для каждой смеси интенсивности от пиков были нормализованы, используя их относительную интенсивность. Среднее число их нормализованных интенсивностей для аналитической фазы и оксида алюминия 1 (а) и 1 (s) соответственно затем использовались в RIR вычислении:
где X(s) = массовая доля оксида алюминия
Х(а) = массовая доля аналитической фазы.
RIRs из набора смесей были затем усреднены и было определено допустимое отклонение. RIRs были определены и для переменного продольного разреза и для фиксированного продольного разреза и для всех 3 параметров интенсивности: Kα1 высоты пика, Kα1 площадь пика и общей площади пика.
Таблица I показывает дифракционные максимумы, использованные для определения RIRs и их относительных интенсивностей. Таблица II показывает среднее значение RIR, как определенных, так и их допустимые отклонения.
Поскольку продукты по примерам были на 100% кристаллическими, и все фазы известны наряду с их RIR, не было необходимым смешивать образцы со стандартом. Вместо этого продукты по примерам были непосредственно измерены и массовые доли расчитаны, используя "Matrix Flushing" ("Normalized RIR") способ (R.L.Snyder, Powder Diffraction. 7(4) 186-193(1992)). В матричном способе разработки с мокрой закладкой (Matrix flushing method) процент массы α фазы в смеси n фаз, используя нормализованную интенсивность, рассчитывают, исходя из следующей зависимости
где суммирование выше j=1 к n фазам.
| Таблица I | ||||||||||||||
| Оксид алюминия | Сульфат аммония | Нитрат аммония | (NH4)2SO4•2(NH)4NO3) | (NH4)2SO4•3(NH)4NO3) | ||||||||||
| NBS 674 | ICDD Карта: 40-660 | ICDD Карта: 47-0867 | ICDD Карта: отсутствует2 | ICDD Карта: 20-100 | ||||||||||
| HkI | 2θ | Относительная интенсивность | hkI | 2θ | Относительная интенсивность | hkI | 2θ | Относительная интенсивность | hkI | 2θ | Относительная интенсивность | hkI1 | 2θ | Относительная интенсивность |
| 120 | 25.58 | 55.4 | 120 | 20.20 | 49 | 011 | 22.47 | 46 | 26.95 | 43 | 27.31 | 55 | ||
| 104 | 35.13 | 87.4 | 100 | 20.47 | 100 | 111 | 28.92 | 100 | 27.18 | 100 | 28.04 | 100 | ||
| 113 | 43.36 | 100 | 200 | 22.83 | 33 | 020 | 32.90 | 64 | 30.50 | 47 | 30.81 | 50 | ||
| 1) Данные карты не индексированы.2) Ни один из существующих файлов карты точно не соответствовал экспериментальным данным. |
| Таблица II | ||||||||
| Параметры интенсивности | Сульфат аммония | Нитрат аммония | (NH4)2SO4•2(NH)4NO3) | (NH4)2SO4•2(NH)4NO3) | ||||
| RIR | Стандартное отклонение | RIR | Стандартное отклонение | RIR | Стандартное отклонение | RIR | Стандартное отклонение | |
| Переменный разрез | ||||||||
| Кα1 Высота пика | 0.866 | 0.027 | 0.912 | 0.056 | 0.534 | 0.023 | 0.368 | 0.033 |
| Кα1 Площадь пика | 0.717 | 0.010 | 0.737 | 0.051 | 0.503 | 0.009 | 0.401 | 0.021 |
| Общая площадь пика | 0.724 | 0,006 | 0.714 | 0.050 | 0.508 | 0.008 | 0.381 | 0.027 |
| Фиксированный разрез | ||||||||
| Кα1 Высота пика | 1.789 | 0.055 | 1.337 | 0.090 | 0.813 | 0.035 | 0.578 | 0.052 |
| Кα1 Площадь пика | 1.481 | 0.021 | 1.090 | 0.075 | 0.767 | 0.013 | 0.630 | 0.033 |
| Общая площадь пика | 1.497 | 0.013 | 1.057 | 0.740 | 0.773 | 0.013 | 0.599 | 0.042 |
Самые высокие по интенсивности пики для нескольких разновидностей не могли
использоваться для количественного анализа, так как было значительное перекрытие между ними. Используют менее интенсивные пики дифракции с небольшим перекрытием или его отсутствием и нормализуют, основываясь на относительных высотах пика. Интенсивности, использованные в описанном выше уравнении, были средними для нормализованных интенсивностей из множества пиков.
Данные дифракции для количественного анализа были собраны, используя две развертки. Первая развертка между 18° и 21° 2θ с 0.02° 2θ размерами шага, 8 с/шаг. Вторая развертка была собрана от 30° до 34° 2θ с 0.02° 2θ размерами шага, 8 с/шаг. Общее время сбора данных было равно 48 мин на образец и собрано в два файла на образец.
Первый файл данных собран в интервале между 18.2° и 21° 2θ и состоял вплоть до 6 пиков, в зависимости от того, какие присутствовали фазы. Второй файл данных собран в двух интервалах: от 30.4° до 31.8° 2θ и от 31.8° до 33.8° 2θ. В интервале от 30.4° до 31.8° 2θ колебании были найдены вплоть до 4 пиков, и в интервале от 31.8° до 33.8° 2θ колебании были возможны вплоть до 6 пиков. Рисунки 1, 2, и 3 иллюстрируют развертки дифракции и установленные пики для образца, приготовленного путем смешивания (неочищенного) 1:2 и 1:3 стандартов, описанных выше в равных соотношениях.
Собранные результаты введены в EXCEL крупноформатную таблицу, созданную для этого анализа. Основываясь на относительной пиковой площади и FWHM, с помощью крупноформатной таблицы определено, был ли пригоден индивидуальный пик и присутствовала ли фаза 1:2 Пики в районе от около 30.5° и до 30.8° 2θ на низкой концентрации, <5%, были затруднены для правильного разрешения и обычно их FWHM становится очень большим. Поэтому отметкой для принятия этих пиков является FWHM, который должен быть <0.25° 2θ. Если FWHM для 1:2 пика от около 30.5° был >0.25, то тогда установление 1:3 пика при 30.8° становится под вопросом и оказывается помеченным как недопустимый.
За