Производные пиридазинохинолина
Иллюстрации
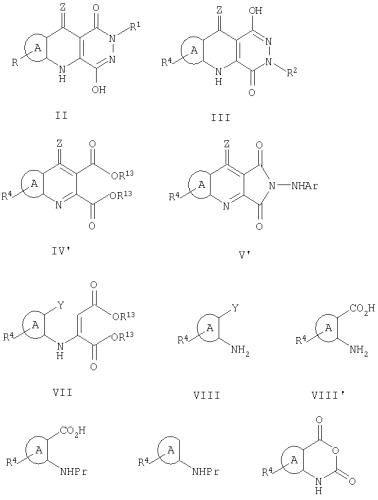
Показать всеНастоящее изобретение относится к производным пиридазинохинолина формулы II или их таутомерам или их фармацевтически приемлемым солям:
где: кольцо А является орто-конденсированным фенилом, монозамещенным R4, где R4 является галогеном; R1 представляет собой (CH2)nL, где n является целым числом, принимающим значение от 1 до 6, и где L выбран из незамещенного фенила или его бензопроиводного, или L выбран из фенила или его бензопроизводного, замещенного 1 или 2 группами, выбранными из галогена, CN, CF3, (С1-С4)алкила, или L выбран из ОН, OCOR', SOmR', где m принимает значения 0, 1 или 2, NR'R'', при условии, что NR'R'' отличен от NH2, NR'COR'', или L выбран из гетероцикла или гетероарила; где в каждом указанном выше случае любая из групп R' или R'' независимо выбраны из водорода, (C1-С4)алкила, (С3-С6)циклоалкила, фенила, фенил(С1-С4)алкила, и где любая из групп R' или R'' является либо незамещенной, либо 1, 2 или 3 замещенной у атомов углерода фенилом, ОН, O-(С1-С4)алкилом, где в любом из вышеуказанных случаев гетероцикл выбран из пяти-, или шестичленного гетероциклического кольца, содержащего 1, 2 или 3 гетероатома, выбранных из О, N или S, или его конденсированного бензопроизводного, указанного гетероцикла, где атом углерода является дизамещенным с образованием С5-С7 спиро-группы, и указанного гетероцикла, где атом С замещен О с образованием карбонильной группы и где в любом из вышеуказанных случаев гетероарил выбран из тиофена, фурана, имидазола, триазола, тетразола, являющихся незамещенными. Соединения формулы II являются антагонистами к глицин рецептору и могут быть для получения фармацевтических средств, предназначенных для лечения или профилактики ишемической болезни. 4 з.п. ф-лы, 8 табл.
Реферат
Данное изобретение относится к производным пиридазиндиона, используемых в лечении неврологических заболеваний, главным образом, у млекопитающих, таких как человек. Более конкретно, соединения используются при лечении припадков и/или других нейродегенеративных нарушений, таких как гипогликемия, корковый паралич, преходящее нарушение коркового мозгового кровообращения, перинатальная асфиксия, эпилепсия, психоз, хорея Хантингтона (Huntington), боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, оливопонтоцеребеллярная атрофия, вызванная вирусом нейродегенерация, такая как приобретенный синдром иммунного дефицита и связанного с ним слабоумия, гипоксия, вызванная утоплением, травмой спинного мозга или головного мозга, и хроническая болезнь, для предупреждения лекарственных алкогольных синдромов отмены, и подавления толерантности и зависимости от наркотических анальгетиков. В частности, изобретение относится к новым производным пиридазиндиона, используемым при восстановлении неврологической дегенерации, такой, которая может быть вызвана ударом, и возникающей в результате ассоциативной функциональной недостаточности. Лечение с использованием соединения по изобретению может быть лечебным или терапевтическим при введении соединения после проявления ишемии для смягчения эффектов этого заболевания. Обработка может также быть профилактической или перспективной при введении соединения в предвидении возможности проявления ишемии, например, пациенту, который склонен к ишемии.
Известно, что случаи ишемии могут стать пусковым механизмом очень сильного увеличения внеклеточных концентраций возбуждающих аминокислот глутамата и аспартата, которые могут, в свою очередь, вызвать длительное нейронное возбуждение, приводящее к массированному притоку кальция из внеклеточных участков к внутриклеточным участкам в невральных клетках головного мозга. Тем самым может быть создана кальциевая перегрузка, которая приводит к каскаду событий, ведущих к катаболизму клеток и в конечном счете выражающихся в смерти клеток. Предполагается, что N-метил-D-аспартат (NMDA) рецепторный комплекс играет существенную роль в потоке событий, приводящих к некрозу клеток, следующему за проявлением ишемии.
Предложенные в данном изобретении соединения могут быть полезны при целом ряде нейродегенеративных нарушений, поскольку они действуют как антагонисты возбуждающих аминокислот. Они могут это делать косвенно, путем аллостерической модуляции места связывания глутамата, в частности, действуя как антагонисты стрихнин-нечувствительного глицин рецептора на NMDA рецепторном комплексе. Они могут также делать это непосредственно, путем связывания самого глутамат участка NMDA рецепторного комплекса.
В ЕРО номер 0516297 А1 описаны некоторые пиридазиндионы. Кроме того, соединения (I) тиено[2',3':5,6]пиридо[2,3-d]пиридазин-5,8,9(4Н,6Н,7Н)-трион и (2) тиено[3',2':5,6]-пиридо[2,3-d]пиридазин-4,5,8(6Н,7Н,9Н)-трион известны, например из J. Heterocyclic Chem., 28, 205, (1991).
Другие производные пиридазиндиона известны, например, из Beilstein's Handbuch der Organischen Chemic; Goodard et al., Bull. Soc. Chim. Fr., 1588, (1972); и Reid et al., Chem. Bet., 85, 204, (1952).
Соединения по настоящему изобретению относятся к новым 2-или 3-замещенным пиридазиндионам или их таутомерам, представленным соединениями, имеющими общую формулу II:
где
кольцо А является орто-конденсированным фенилом или пиридилом или образовано фенилом или пиридилом, моно- или дизамещенным R4, где R4 в каждом случае независимо выбран из группы, включающей галоген, (С1-С4)алкил, NO2, CN, (C1-С3)перфторалкил, ОН, OCF3, (С2-С4)алкенил, (С2-С4)алкинил, O-(С1-С4)алкил, NR'R'', SO2NR'R'', SOmR', гетероцикл, NR'COR'', COR'', NR'СО2R'', CO2R' и CONR'R'';
R1 представляет (CH2)nL, где n является целым числом, принимающим значение от 1 до 6, и где:
L выбран из незамещенного фенила или его бензопроизводного,
или L выбран из фенила или его бензопроизводного, замещенного 1, 2, 3 или 4 группами, выбранными из ОН, галогена, NO2, CN, CF3, (С1-С4)алкила, О-(С1-С4)алкила, (С1-С6алкил)NR'R'', O-(С1-С6алкил)NR'R'', O-фенила, NH(C=O)R', NR'R'', NR'(С1-С6алкил)NR'R'', NR'(С1-С6)алкилокси, NR'(С1-С6алкилгидрокси), C(=O)OR', С(=О)NR'R'', SOmR' (где m принимает значения 0, 1 или 2), SO2NR'R'', (С1-С6)алкилокси (С1-С6)алкилокси, гидрокси(С1-С6)алкилокси, арилокси(С1-С4)алкилокси (С1-С4)алкила, (С1-С6)алкилокси(С1-С6)алкиокси(С1-С6)алкилокси или гидрокси (С1-С6)алкилокси(С1-С6)алкилокси, O-(С2-С4)алкенила, О-(С2-С4)алкинила, О-(С1-С6алкил)фенила, (С1-С4)алкилCF3, окси(С1-С6)алкилокси, который образует циклическое кольцо, присоединенное к фенильному кольцу в орто-положении, (С1-С4)перфторалкила, О-(С1-С4)перфторалкила, (С1-С4алкил)окси(С1-С4алкил), О-(С1-С4алкил)COOR', (С1-С4алкил)OR', NR'(CH2)qCOOR' (где q принимает значения 1, 2, 3 или 4), SOm(С1-С4алкил)окси(С1-С4алкил), SOm(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил), NR'(С1-С4алкил)окси(С1-С4алкил), NR'(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил) или тетразола,
или L выбран из ОН, OR', OCOR', SOmR', SOmNR'R'', галогена, CF3, NR'R'', при условии, что NR'R'' отличен от NH2; COR', NR'COR'', NR'CO2R'', (С3-С6)циклоалкила, NRCONR'R'', CO2R' или CONRR',
или L выбран из гетероцикла или гетероарила;
где в каждом указанном выше случае R' и R'' независимо выбраны из Н, (С1-С4)алкила, (С2-С4)алкенила, (С2-С4)алкинила, (С3-С6)циклоалкила, фенила, фенил(С1-С4)алкила, гетероцикла, гетероцикл(С1-С4)алкила, гетероарила или гетероарил(С1-С4)алкила, или где любая из групп R' или R'' является либо незамещенной либо замещена в положении 1, 2 или 3 атомов углерода галогеном, Н, (С1-С4)алкилом, (С3-С6) циклоалкилом, фенилом, NO2, CN, CF3, ОН, О-(С1-С4)алкилом или где любая из групп NR'R'' образует кольцо N-алкил(С1-С3)оксиалкил(С2-С3);
где в любом из вышеуказанных случаев гетроцикл выбран из пяти-, шести- или семичленного гетероциклического кольца, содержащего 1, 2 или 3 гетероатома, выбранных из О, N или S, или его арильного или гетероарильного бензопроизводного, любого гетероцикла, где атом углерода является дизамещенным с образованием С5-С7 спиро группы, и любого гетероцикла, где атом С или S замещен О с образованием соответственно карбонильной или сульфонильной группы; и
где в любом из вышеуказанных случаев гетероарил выбран из пиридила, тиенила, фуранила, пиразола, имидазола, изоксазола, оксазола, тиазола, изотиазола, пиридазина, пиримидина, пиразина, триазола, оксадиазола, триазина, тетразола, являющихся незамещенными, или любой из вышеуказанных может быть моно- или дизамещенным оксо, гидрокси, алкокси, галогеном или циано
и их фармацевтически приемлемым солям.
Предпочтительными являются соединения формулы II, где R4 является галогеном.
Еще одними предпочтительными соединениями являются соединения формулы II, где А представляет собой 7-хлорфенил или 7,9-дихлорфенил.
Более конкретно предпочтительными являются следующие соединения:
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион или его N-метилглюкаминовая соль;
7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метилтиоэтил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метил-2-гидроксипропионамидоэтил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(фуран-2-илметил)-1,2,5,10-тетрагидропиридазин [4,5-b]хинолин-1,10-дион; и
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
Кроме того, предпочтительными соединениями являются следующие:
7-хлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
4-гидрокси-8-нитро-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-хлорфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-изопропилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7,9-дихлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(1-нафтил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
2-(4-бромфенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-трифторметоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион; и
7-хлор-4-гидрокси-2-(2-метоксипирид-5-ил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
Предпочтительными являются также соединения:
2-(4-бензилоксифенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-дихлорфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-гидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидрокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлорфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метилтиофенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,3-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-этилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-фтор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,5-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-иодфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-бром-2-метоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,5-дифторметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-дифторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-дифторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-нитрофенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-трифторметилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-нитрофенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метилсульфонилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2,5-дигидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-карбоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-карбамоилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-тетразол-5-илфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион; и
7-хлор-4-гидрокси-2-(4-N,N-диэтилкарбамоилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Особенно предпочтительными являются следующие соединения:
7-хлор-2-(4-этоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-изопропилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион; и
7-хлор-4-гидрокси-2-(4-метоксикарбонилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим предпочтительное соединение формулы II, указанное выше, и фармацевтически приемлемый носитель.
Далее, изобретение относится к способу лечения или профилактики ишемической болезни, включающему введение млекопитающему, при необходимости такого лечения, эффективного количества соединения согласно изобретению, как определено выше, или его фармацевтически приемлемой соли, или композиции, как определено выше.
Фармацевтически эффективное количество соединения, как заявлено в формуле изобретения и раскрыто в настоящем изобретении, может вводиться сразу после ишемического приступа для предотвращения разрушения и/или отмирания клеток. Настоящее изобретение относится также к способу профилактики и/или лечения нарушения, вызванного возбуждающими аминокислотами, такими как L-глутамат. Изобретение также относится к способу предупреждения избыточного притока ионов кальция в центральных нейронах. Изобретение относится к способу предупреждения ишемического нейронного повреждения после транзиторной глобальной ишемии и к способу уменьшения размера инфаркта после локального ишемического инсульта.
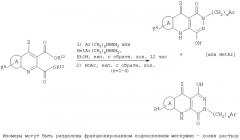
Пиридазиндионы формулы II могут быть получены способами, включающими способы, известные в химической технике для получения структурно аналогичных соединений.
Например, способ получения соединения формулы II включает:
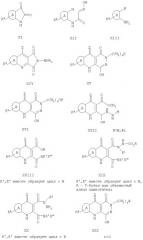
ФОРМУЛЫ
ФОРМУЛЫ (ПРОДОЛЖЕНИЕ)
СХЕМЫ 1 и 2
СХЕМА 1
СХЕМА 2
СХЕМЫ 3 и 4
СХЕМА 3
СХЕМА 4
СХЕМА 5
СХЕМА 6
СХЕМА 7
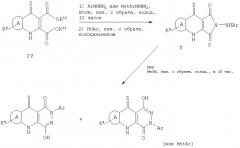
(а) обработку соединения формулы V или XIV кислотой, выбранной из низших алкил(С1-С4)сульфоновой кислоты, в подходящем органическом растворителе, или
(b) обработку соединения формулы IV' алкиларил- или алкилгетероарилгидразином в среде полярного растворителя и слабой кислоты; или
(c) обработку соединения формулы IV', где y выбран из -ОН, -SH или NHR, где R обозначает (С1-С4)алкил, реагентом, выбранным из (i) R2NC(O)Cl; или (ii) RC(O)X или (iii) ROC(O)Cl; или (IV) HBr/NaCN/H2O или ROH; или (v) RNCO, или R'R'NC(O)Cl, или из другой электрофильной группы, перечисленной здесь, с образованием, в частности, соединения формулы XXI; или
(d) обработку соединения формулы XV, где Х обозначает галоген, нуклеофильным реагентом, выбранным из гетероцикла или его бензо-, или гетероарилбензопроизводных; или
(e) обработку соединения формулы XXII замещенным гидразином с образованием соединения формулы XVII в органическом растворителе в подходящих условиях; или
(f) обработку соединения формулы XVIII связывающим реагентом, выбранным из диимида, и дизамещенным гидразином формулы R'-NHNHC(О)O-трет-бутил в органическом растворителе в присутствии соответствующей кислоты, или
(g) последующую обработку соединения формулы II, как указано в п.2, где соединение содержит фенильное кольцо, замещенное метоксигруппой или группами, кислотой с получением фенильного заместителя или заместителей, или дальнейшую обработку соединения формулы II, где соединение не находится в форме соли, фармацевтически приемлемым основанием с получением фармацевтически приемлемой соли, или дальнейшую обработку соединения формулы II, где соединение содержит фенильное кольцо, замещенное цианогруппой или группами, (i) основанием с получением карбокислотного заместителя или заместителей, или (ii) кислотой с получением амидного заместителя, или (iii) азидом с получением тетразольного заместителя, где карбокислотный заместитель может быть затем обработан галогенирующим агентом и замещенным амином формулы HNR'R'', с получением замещенного амидного заместителя, или карбокислотный радикал может быть далее обработан спиртом (С1-С6) в присутствии кислоты с получением сложноэфирного заместителя (С1-С6), или
(h) последующую обработку соединения формулы II, где соединение содержит оксазолидиндион, основанием в водном растворе с получением амидоспиртового заместителя в качестве W, концевого для (СН2)n углеродной цепи при n, равном 1-4; или
(i) последующую обработку соединения формулы II, где соединение содержит сульфидную группу, окислительным агентом в подходящих условиях для образования S(O)1 или S(O)2 группы.
Если они не доступны коммерчески, необходимые исходные продукты для описанных выше превращений могут быть получены способами, которые выбраны из стандартных органических химических методик, способов, аналогичных синтезам известных, структурно подобных соединений, или способов, аналогичных описанным выше, или способов, описанных в примерах.
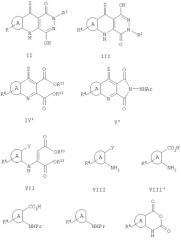
Некоторые сложные диэфиры формулы IV для использования в реакциях с замещенным гидразином с целью получения соединения формулы I, могут быть получены обработкой соединений формулы VII подходящим основанием, таким как алкоголят щелочного металла (например, трет-бутоксид калия) в подходящем растворителе, таком как трет-бутанол, для осуществления замыкания цикла и, тем самым, получения желаемого сложного диэфира. В указанном соединении формулы VII, значение у соответствует следующим, с получением соответствующего значения для Z, как указано:
а. СНО, если желаемое значение Z - водород;
b. COOR15 где R15 обозначает (С1-С3)алкил, если желаемое значение Z - гидрокси (таутомерно эквивалентный оксо). Указывается, что могут использоваться алкилсложные эфиры, но они не дают какого-либо синтетического преимущества.
с. CSOR15 или CSSR15, если для Z желательно значение тиогидрокси (SH); и
d. CN, если желаемое значение Z - амино.
Не требуется выделение соединения формулы VII для получения соответствующего соединения формулы IV'. Лучше получить сложный диэфир формулы IV' в одном реакторе, без выделения соединения формулы VII из реакционной смеси.
Сложный диэтиловый эфир формулы IV', где Z обозначает гидрокси (или оксо), может быть также получен обработкой ангидрида N-карбоксиантраниловой кислоты формулы Х непосредственно натриевой или калиевой солью (С1-С3)алкилового (например, диэтилового) эфира 2-оксоянтарной кислоты в подходящем растворителе, таком как диметилформамид.
Сложный диэфир формулы IV', где Z обозначает тиогидрокси, может быть получен обработкой соответствующего сложного диэфира формулы IV, где R3 обозначает гидрокси, реактивом Лавессона (Lawesson's), 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом в подходящем растворителе, таком как толуол или диметоксиэтан, при температуре 50-110°С.
Замещенный имид формулы V', где В-кольцевой N теряет Н, и Z обозначает, например, NH2, может быть получен обработкой сложного диэфира формулы IV', где значению Z соответствует галоген группа, такая как хлор или бром, аммиаком с образованием фталимида, который взаимодействует затем с арилгидразином, образуя V', который затем реагирует обычным образом (Схема 1), образуя конечный пиридазинохинолин.
Соединение формулы VII, где y обозначает CN, СНО, COOR15, CSOR15 или CSSR15, где R15 обозначает С1-С10алкил, алкенил или алкинил группу, может быть получено обработкой соответствующего VIII диалкилацетилендикарбоксилатом, таким как диметилацетилендикарбоксилат, в подходящем растворителе, таком как (С1-С4)спирт. В качестве растворителя предпочтителен трет-бутанол.
Орто-амин формулы VIII' может быть получен этерификацией соответствующей кислоты формулы VIII' обычными способами. В свою очередь, кислота формулы VIII' может быть получена снятием защиты у соответствующего производного формулы VIII'', где аминогруппа была защищена обычной защитной группой Pr (такой как трет-бутоксикарбонил, t-BOC). Соединение формулы VIII'', в свою очередь, может быть получено последовательным взаимодействием амина формулы IX сначала с двумя эквивалентами литийорганического соединения (например, трет-бутиллития) с образованием дилитиевого производного, которое может быть карбоксилировано путем взаимодействия с двуокисью углерода. Амин формулы IX может быть получен защитой соответствующего (незащищенного) амина обычными способами.
Орто-амин формулы VIII, где y обозначает COOR15, также может быть получен способом, который отличается от только что описанного выше, тем, что стадию этерификации осуществляют, используя основание (например, гидрид натрия) и затем алкилирующий агент R15X с защищенной кислотой формулы VIII'', не кислотой формулы VIII'.
Орто-амин формулы VIII', где у обозначает COOR15, также может быть получен обработкой соответствующего ангидрида N-карбоксиантраниловой кислоты формулы Х основанием (таким как гидрооксись щелочного металла) в спиртовом растворителе формулы R15OH.
Ангидрид N-карбоксиантраниловой кислоты формулы Х может быть получен обработкой изатина формулы XI триоксидом хрома в присутствии уксусного ангидрида, или надоксикарбоновой кислотой, такой как магниевая соль мононадоксифталиевой кислоты, и в подходящем растворителе, таком как уксусная кислота.
Изатин формулы XI может быть получен циклизацией гидроксииминацетамида формулы XII в концентрированной серной кислоте при температуре 60-80°С.
Гидроксииминоацетамид формулы XII может быть получен обработкой амина формулы XIII с хлоральгидратом в присутствии сульфата натрия и гидрохлорида гидроксиламина и в подходящем растворителе, таком как вода. N-трет-бутоксикарбонилгидразины, используемые по настоящему изобретению, могут быть получены согласно способу, приведенному далее в примере 82С. Например, N-трет-бутоксикарбонил-N'-пентафтор-бензилгидразин; N-трет-бутоксикарбонил-N'-2-цианобензилгидразин; N-трет-бутоксикарбонил-N'-3-хлорбензилгидразин; N-трет-бутоксикарбонил-N'-3,5-дитрифторметилбензилгидразин; N-трет-бутоксикарбонил-N'-3-фенилпропилгидразин; N-трет-бутоксикарбонил-N'-4-метилбензилгидразин; N-трет-бутоксикарбонил-N'-4-трифторметилбензилгидразин; N-трет-бутоксикарбонил-N'-4-цианобензилгидразин и N-трет-бутоксикарбонил-N'-2,4-диметилфенилгидразин. Кроме того, настоящее изобретение относится также к этим новым гидразинпроизводным и к способу их получения и применения в качестве промежуточных продуктов для соединения с ключевой промежуточной 2-пирролидинокарбамидхинолин-3-карбоновой кислотой с целью образования соединения формулы II с помощью нового и оригинального способа, как описано здесь, в результате которого селективно образуется N-2-замещенный PQD. Промежуточные гидразины, используемые для получения N-2-арил или N-2-замещенных арил PQD, могут также быть получены согласно не ограничивающему примеру 42а. N'-трет-бутоксикарбонил-N'-арил или замещенные арилпроизводные получают с помощью этого нового способа, дающего возможность селективного получения N-2-замещенных PQD. Этот способ может быть предпочтительным для арилзамещенных производных, перечисленных здесь и в формуле изобретения.
Следует отметить, что многие из исходных веществ для описанных выше способов синтеза являются коммерчески доступными и/или широко известны в научной литературе.
Примерами подходящих фармацевтически приемлемых солей служат соли, образованные основаниями, которые дают физиологически приемлемый катион, такой как щелочной металл (особенно литий, натрий и калий), щелочноземельный металл (особенно кальций и магний), соли алюминия или аммония, а также соли, полученные с подходящими органическими основаниями, такими как холингидроксид, триэтиламин, морфолин, пиперидин, этилендиамин, лизин, этаноламин, диэтаноламин, триэтаноламин, N-метил-D-глюкамин (меглумин), аргинин и трис(гидроксиметил)аминометан. Предпочтительны натриевые и калиевые соли холина и меглумина. Натриевые и калиевые соли холина особенно предпочтительны.
При внутривенном терапевтическом применении, после приступа, пиридазиндион формулы II, обычно вводят в виде подходящей фармацевтической композиции, которая содержит соединение по изобретению, указанное выше, вместе с фармацевтически приемлемым растворителем или носителем, при этом композицию подбирают с учетом конкретного выбранного пути введения. Такие композиции составляют следующий объект изобретения. Они могут быть получены обычными способами с использованием обычных добавок и связующих веществ и могут быть в виде различных дозированных форм. Например, они могут быть в форме таблеток, капсул, растворов или суспензий для перорального введения; в форме суппозиториев для ректального введения; в форме стерильных растворов или суспензий для введения путем внутривенной или внутримышечной инъекции или вливания; и в форме порошков вместе с фармацевтически приемлемыми инертными твердыми разбавителями, такими как лактоза, для введения путем вдувания.
Доза вводимого соединения согласно изобретению обязательно должна варьироваться в соответствии с правилами, хорошо известными в данной области, учитывающими способ введения, степень постишемического поражения, вес и возраст пациента. Обычно, соединение согласно изобретению вводится теплокровным животным (таким как человек) в количестве, требуемом для достижения эффективной дозы, обычно дозы в интервале приблизительно от 0,01 до 100 мг/кг веса тела. Например, если соединение вводится внутривенно, его количество составляет приблизительно в интервале от 0,5 до 100 мг/кг веса тела.
Специалисту в данной области техники понятно, что соединение согласно изобретению может вводиться совместно с другими терапевтическими или профилактическими средствами и/или медикаментами, которые не являются с ними медицински несовместимыми.
Действие соединений согласно изобретению как антагонистов к глицин рецептору NMDA рецепторного комплекса могут быть продемонстрированы одним или более стандартными исследованиями, такими как исследование на связывание [3H]-глицина (испытание А) и исследованиями in vivo, такими как ишемия, индуцируемая каротидной окклюзией, на модели песчанки (испытание В). В дополнение к этим испытаниям, соединения данного изобретения проверяют испытанием на красных ядрах клеток (испытание С) и испытанием на средней церебральной артерии крыс (испытание D). Эти испытания подтверждают, что соединения по изобретению являются NMDA рецепторными антагонистами in vitro и in vivo. Некоторые соединения по изобретению являются сильно действующими NMDA рецепторными антагонистами. Некоторые из перечисленных соединений (то есть, 3-(2-ацетоксиэтил), 3-(п-метоксифенил) или 3-(п-гидроксифенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дионы) имеют значение IC50 в [3H]Gly испытании выше 100 микромоль и, таким образом, менее активны, чем их более сильно действующие аналоги. В частности, соединения по настоящему изобретению с R1, обозначающим алкил, арил или гетероцикл, как определено здесь, и R2 равным Н, являются сильно действующими рецепторными (глицин) антагонистами.
Испытание А
В исследовании на связывание [3Н]-глицина нейрональные синаптические мембраны получают из взрослых (около 250 г) самцов крыс Sprague Dawley. Свежеиссеченные образцы коры головного мозга и гиппокампа гомогенизируются в 0,32 М сахарозы (110 мг/мл). Синаптосомы выделяют центрифугированием (1000 об/мин, 10 мин), супернатант осаждают (20000 об/мин, 20 мин) и вновь суспендируют в дважды дистиллированной воде. Суспензию центрифугируют 20 мин при 8000 об/мин. Полученный супернатант и лейкоцитную пленку дважды промывают (48000 об/мин, 10 мин вновь суспендируют в дважды деионизированной воде). Полученный осадок быстро замораживают (баня из сухого льда/этанола) под слоем дважды деионизированной воды и хранят при -70°С.
В день эксперимента оттаянные синаптические мембраны гомогенизирзуют в тканевом гомогенизаторе Brinkmann Polytron (tm. Brinkmann Instruments, Westbury, N.Y.) в 50 миллимоль трис(гидроксиметил)аминометанцитрате, рН 7,1. Мембраны инкубируют с 0,04% Surfact-AMPS X100 (tm. Pierce, Rockford, IL) в буфере в течение 20 минут при 37°С и промывают шесть раз путем центрифугирования (48000 об/мин, 10 мин) и вновь суспендируют в буфере. Конечный осадок гомогенизируют при 200 мг вес влажного/мл буфера для исследования на связывание.
Для [3Н]-глицин связывания N-метил-D-аспартат рецептору, 20 наномоль [3Н]-глицина (40-60 Ci/ммоль, New England Nuclear, Boston, MA) инкубируют с мембранами, суспендиро-ванными в 50 миллимоль трис(гидроксиметил)аминометанцитрате, рН 7,1, в течение 30 минут при 4°C. Глицин, 1 миллимоль, используют для определения неспецифического связывания. Связанный [3Н]-глицин отделяют от свободного, используя харвестер клеток Brandel (Biomedical Research and Development Laboratories, Gaithersburg, MD) для вакуумной фильтрации через фильтры из стекловолокна (Whatman GF/B from Brandel, Gaithersburg, MD), предварительно пропитанные 0,025% полиэтиленимином. Образцы, оставшиеся на фильтре из стекловолокна, промывают 3 раза в общей сложности 2,5 мл холодного буфера. Радиоактивность измеряют жидкостным сцинтилляционным счетчиком. Значение IC50 получают из регрессии по наименьшим квадратам logit-log (длинные логарифмы) обработки данных. Характерные IC50 значения для соединений по изобретению составляют обычно менее 50 мкМ (микромолей) и иллюстрируются соединением примера 1 (IC50=40 мкМ), примера 2 (IC50=0,50 мкМ), примера 10 (IC50=0,12 мкМ). Другие приведенные здесь примеры описывают глицин антагонисты.
Испытание В
При испытании in vivo, использующим ишемическую модель песчанки, взрослые особи песчанок Mongolian (50-70 г) анестезируют 2-3% галотаном (halothane). Билатеральные общие каротидные артерии шеи раскрывают и накладывают микроаневрические зажимы. Спустя 10 мин (если иного не указано) зажимы удаляют, восстанавливают кровоток через каротидные артерии и кожу сшивают. Исследуемые соединения вводят внутрибрюшинно как до, так и после окклюзии, например, за 45 минут до и через 5 минут после окклюзии каротидных артерий. Животных, которым симулирована операция, обрабатывают аналогичным способом, за исключением того, что артерии не пережимаются. Наблюдения за общим поведением, связанным с моторной активностью, проводятся в течение 2 часов первого (24 часа) дня после окклюзии. Через 4 дня животных забивают (обезглавливание), извлекают головной мозг, фиксируют, разрезают и окрашивают гематоксилин/эозином и крезилвиолетом.
Секции головного мозга оценивают на нейрональные поражения гиппокампуса, используя следующую оценочную шкалу:
0 = непораженные, нормальные
1 = слабое поражение (до 25%) - ограниченные CAI/подлежащая ткань пределами
2 = умеренные поражения (до 50%) - очевидные поражения, ограниченные менее, чем половиной CAI области
3 = заметные поражения (до 75%) - включающие более чем половину CAI области
4 = поражения, выходящие за CAI область
Срезы (7 микрон) каждого мозга, подвергаются оценке. Может быть отмечено случайное, асимметрическое поражение, и за рейтинговое значение принимается среднее показание двух сторон. Регистрируют среднюю рейтинговую величину поражений мозга, и показатели нарушений для обработанных лекарственными средствами групп сравнивают с группой, обработанной растворителем, используя тест Wilcoxon-Rank Sum.
Обычные значения, полученные в этих испытаниях для соединений согласно изобретению, иллюстрируются следующими результатами: 35% нейрозащита (относительно контроля с имитированной операцией) для соединения примера 4, и свыше 80% нейрозащита для соединения примера 10, когда каждое соединение вводится внутрибрюшинно (ip) при уровне 10 мг/кг веса тела в соответствии с вышеприведенным режимом.
Испытание С
Испытание красных ядер клеток
Цель этого испытания состоит в определении воздействия введенных внутривенно глицин антагонистов на индуцированную возбуждающую реакцию клеток, содержащих красные ядра. НА-966 (рацемическая) и CGP 37849 являются стандартными агентами, проявляющими активность в этом испытании (ID50 7,9 и 1,7 мг/кг, внутрибрюшинно, соответственно).
Методика испытания красных ядер клеток приведена далее. Крыс анестезируют хлоральгидратом (400 мг/кг, внутрибрюшинно) и вводят катетер в бедренную вену для внутрибрюшинного введения лекарственного средства. Пятицилиндровые микропипетки размещают стереотаксикально в красных ядрах клеток. Обычно, от трех до четырех из пяти цилиндров заполняются следующим образом: цилиндр для регистрации -2М цитратом калия, цилиндр общепринятого сопоставления 4М NaCl, цилиндр для лекарственных средств - 25 мМ NMDA, а другой цилиндр для лекарственных средств - 2,5 мМ кискалевой (quisqualic) кислоты (QA используют только в исследованиях селективности). NMDA применяют ионофоретически при постоянном токе, который регулируется в зависимости от чувствительности каждой индивидуальной клетки, содержащей красное ядро. NMDA двигается по кругу вперед и назад (обычно 30-60 сек вперед и 60-120 сек назад) и степень возбуждения клетки во время каждого периода регистрируется. Как только нулевая степень возбуждения установлена, начинают внутривенно вводить испытуемое соединение. Воздействие лекарственного средства на NMDA-индуцированную возбуждающую реакцию клетки, содержащей красное ядро, может быть оценено как качественно, так и количественно из регистрируемых и необработанных накопленных данных. Соединения по изобретению проявляют значительную антагонистическую реакцию.
Испытание D
Испытание на средней церебральной артерии крыс
В этом испытании используют самцов крыс SHR, весящих 280-320 г. Способ, использованный для непрерывной окклюзии средней церебральной артерии (МСА), описан Brint и др. (1988). Вкратце: локальную ишемию вызывают путем окклюзии сначала левой общей каротидной артерии и затем левой средней церебральной артерии, расположенной точно над носовым отверстием. После окклюзии, лекарственные средства вводят внутривенно через шейный катетор. Спустя двадцать четыре часа после МСА/общей каротидной артерии окклюзии животных забивают и быстро извлекают головной мозг. Коронарные срезы ткани 1 мм толщиной делают, используя вибратом, и окрашивают 2,3,5-трифенил-2Н-тетразолхлоридным красителем (ТТС). После окрашивания некротическую ткань легко отделяют от интактного мозга и участок инфарктной коры головного мозга исследуют на анализаторе изображения. Размер инфаркта для каждого участка определяют количественно на анализаторе изображения и общий инфарктный объем рассчитывают с помощью программы, суммирующей объем всего интервала. См. S. Brint et al., J. Cerebral Blood Flow 8: 474-485 (1988). Статистический анализ различия между объемом ишемического поражения в контроле с растворителем и обработанных лекарствен