Способ защиты головного мозга в реконструктивной хирургии сонных артерий
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к сосудистой хирургии. Способ характеризуется тем, что за 10 минут до окклюзии сонных артерий в общую сонную артерию на стороне реконструкции вводят раствор никотинамида из расчета дозы никотинамида 2,0 мг/кг больного. Изобретение обеспечивает защиту головного мозга от ишемического повреждения при реконструктивных операциях на сонных артериях под местной анестезией с сохраненным сознанием пациента, в частности, при наличии противопоказаний к общей анестезии и при необходимости словесного контакта врача с оперируемым больным. 1 табл., 4 ил.
Реферат
Предлагаемое изобретение относится к медицине, а именно к сосудистой хирургии.
Каротидная эндартерэктомия (КЭАЭ) является наиболее часто выполняемой реконструктивной сосудистой операцией. По статистике ВОЗ в мире ежегодно выполняется более 1 млн. подобных хирургических вмешательств (Казанчян П.О., Попов В.А., Ларьков Р.Н. и др. / Ангиология и сосудистая хирургия. 1998. т.8. №3. с.81).
Операция может выполняться под общей и местной анестезией.
Важнейшим условием успеха реконструкции каротидного бассейна является адекватная защита головного мозга от ишемии. Пережатие сонной артерии приводит к развитию острой ишемии мозга, а постишемический период характеризуется фазой вторичной гиперперфузии с последующей умеренной гипоперфузией (Покровский А.В., Казанчян П.О., Кунцевич Г.И. и др. Защита мозга при операциях на брахиоцефальных сосудах / Хирургия, 1985, №4, с.17-12).
Снижение перфузии головного мозга запускает ряд каскадных реакций, где особое значение придается процессам свободнорадикального окисления (Halliwell В., Gutteridge J.M.C. Free Radicals in biology and medicine. Oxford. Clarendon Press. 543. 1989; Азизова О.А. Роль свободнорадикальных процессов в патогенезе атеросклероза. / Свободные радикалы, антиоксиданты и болезни человека: Сборник трудов. Смоленск, 2001, с.102-103; Kensler T.W. Inhibition of phorbolester-stimulated chemiluminiscence in human polimorphonuclear leukocyts by retinoic acid and 5.6-epoxiretinoic acid / T.W.Kensler, M.A.Trush / Cancer Res. 1981. Vol.41. N.5. P.1662-1671).
В процессе ишемии вследствие энергодефицита снижается активность ферментов антиоксидантной защиты (Федин А.И., Румянцева С.А. Антиоксидантная терапия нарушений мозгового кровообращения. / Журн. Лечение нервных болезней. 2001, т.2, №4, с.7-12; Molecular Mechanisms of Acidosis-Medicated Damage / B.K.Siesjo, K.Katsura, T.Kristian et al. / In Acta Neurochir. 1996. Vol.66. P.8-14; Watson B.D. Usual and unusual methods for detection of lipid peroxides indicators of tissue injury in cerebral ischemia: what is appropriate and useful? / B.D.Watson/Cell. Mol. Neurobiol. 1998. Vol.18. N 6. P.581-598).
Головной мозг весьма чувствителен к чрезмерному образованию свободных радикалов - "окислительному стрессу" (Smith M.A, Sayer L.M., Monnier V.M., Perry G. TINS. 1995. V.18. №4. Р.172-176). Все факторы, препятствующие оксидативному стрессу, находятся в крови и в условиях ишемии не достигают нейрональных структур, в которых при гипоксии происходит резкое падение количества почти всех водо- и жирорастворимых антиоксидантов (Williams L.R. Oxidative stress, agerelated neurodegeneration and the potential for neurotrophic treatment. Cerebrovasc. Brain Metab. Rev. 7:55-73. 1995). Дополнительными факторами развития свободнорадикального окисления являются фосфолипиды, составляющие до 50% сухого вещества мозга, ненасыщенные связи которых являются главным субстратом перекисного окисления липидов (Гусев Е.И., Скворцова В.И. Ишемия головного мозга. / М. 2001. - 327 с).
Немаловажная роль отводится реперфузионным повреждениям мозга. При ишемии создается парадоксальная ситуация, состоящая в том, что уменьшение концентрации кислорода приводит к увеличению содержания свободных радикалов (Carney J.M., Carney A.M. Life Sci. 1994. V.55. Р.2097; Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при заболеваниях сердечно-сосудистой системы. / М. 2000. 35 с; Watanabe T. Effect of antistroke agent MCI-186 on cerebral arachidonate cascade / T.Watanabe, M. Egawa. / J. Pharmacol. Exp. Ther. 1994. Vol.271. P.1624-1629).
Восстановление кровоснабжения головного мозга после выполнения основного этапа реконструкции сонных артерий (реперфузия, реоксигенация) влечет за собой вторичное реперфузионное повреждение, усугубляющее ишемические изменения и придающее им необратимый характер (Halliwell В. Free Radicals in the Brain / Eds by Packer L., Prilipko L., Christen Y. Berlin, 1992. P.21-40). Активация свободнорадикального перекисного окисления липидов мембран играет решающую роль в патогенезе не только ишемических, но и реперфузионных повреждений мозга (Зозуля Ю.А., Барабой В.А., Сутковой Д.А. Свободнорадикальное окисление и антиоксидантная защита при патологии головного мозга. / M. 2000. 344 с). Даже спустя 10 минут после дебюта ишемии массивное возвращение крови в ишемизированную зону не приводит к полной нормализации кровотока. Чем длительнее дореперфузионный период, тем выше риск дополнительного оксидантного реперфузионного повреждения церебральной ткани, обусловленного включением кислорода в метаболические процессы (Lebel С.Р. Oxygen radicals: Common mediators of neurotoxicity / C.P.Lebel, S.C.Bondy / Neurotoxicol. Teratol. 1991. Vol.13. P.341-346).
Известны различные способы защиты мозга при реконструкции сонных артерий, основными из которых являются:
внутренний шунт; 2) антигипоксанты; 3) гипотермия. Помимо этих основных, используются дополнительные методы защиты головного мозга: гиперкапния, умеренная артериальная гипертензия, системная гепаринизация и гемодилюция, периферическая вазодилятация (Бокерия Л.А., Бухарин В.А., Работников B.C., Алшибая М.Д. Хирургическое лечение больных ишемической болезнью сердца с поражением брахиоцефальных артерий. / М. Издательство НЦССХ им. А.Н.Бакулева РАМН, 1999, - с 76-77).
Методы защиты головного мозга от ишемии направлены либо на увеличение артериального притока (внутренний шунт, вазодилятаторы, гиперкапния, гепаринизация), либо на снижение метаболических потребностей мозга (гипотермия, тиопенталовая защита). Известные в литературе методики защиты головного мозга в основном имеют место при выполнении каротидной эндартерэктомии под наркозом.
Прототипом является способ защиты мозга, принцип которого заключается в интраоперационном парентеральном введении пациенту раствора натрия оксибутирата. Натрия оксибутират является препаратом со снотворными свойствами, потенцирующим эффект наркотических агентов и практически не оказывающим токсического действия ввиду химического сходства с естественным метаболитом мозговой ткани - гамма-аминомасляной кислотой, которая является тормозным медиатором ЦНС. Он обладает свойствами антигипоксанта, способствуя повышению устойчивости мозга к гипоксии и другим вредным воздействиям за счет предупреждения нарушения функции ферментных систем и повышения использования глюкозы (Бунятян А.А. Руководство по анестезиологии. / М.: Медицина, 1994, с.207-210). Это лекарственное средство относится к группе барбитуратов и применяется только при интубационном или внутривенном наркозе, т.е. при выключенном сознании пациента.
Задачей изобретения является повышение эффективности интраоперационной защиты головного мозга.
Технический результат при использовании изобретения - возможность проведения операции под местной анестезией в случаях, когда врачу необходим словесный контакт с оперируемым больным, или тех или иных противопоказаний к проведению общей анестезии.
Указанный технический результат достигается тем, что во время хирургического вмешательства, за 10 минут до окклюзии сонных артерий, в общую сонную артерию на стороне реконструкции вводят раствор никотинамида из расчета дозы никотинамида 2,0 мг/кг.
Предлагаемый способ осуществляется следующим образом: во время хирургического вмешательства на каротидной зоне под местной анестезией или общим обезболиванием за 10 минут до окклюзии общей сонной, наружной сонной и внутренней сонной артерии в общую сонную артерию на стороне реконструкции вводят раствор никотинамида в дозе 2,0 мг/кг. Затем приступают к основному этапу операции, по окончании которого восстанавливают кровоток по сонным артериям
Способ позволяет блокировать процессы свободнорадикального окисления, потенциированные церебральной ишемией. Предлагаемая нами методика интраоперационной защиты головного мозга заключается в парентеральном введении раствора никотинамида, проявляющего антиоксидантные, церебропротекторные свойства (Huang, Т.F. and Chao, С.С. 1960. The effect of niacinamide on cerebral circulation. Proc. Soc. Exp. Biol. Med. 105:551-553; Klaidman, L.K., Kern, S. and Adams, J.D. Neuroprotective effects of nicotinamide toward brain mitochondrial degeneration, Gordon Conference on Oxidative Stress and Disease, 2001; Klaidman, L.K., Mukherjee, S.K. and Adams, J.D. Oxidative changes in brain pyridine nucleotides and neuroprotection using nicotinamide, Biochim. Biophys. Acta, 1525 (2000) 136-148).
Экспериментальные исследования процессов свободнорадикального окисления в головном мозге лабораторных крыс проводились на модели 20-минутной ишемии с последующим восстановлением кровотока в течение 15 минут по общим сонным артериям (Биленко М.В. Ишемические и реперфузионные повреждения органов. / М., 1989). Подобная длительность пережатия сосудов и последующая реперфузия вызывают наибольшее накопление продуктов перекисного окисления липидов, свидетельствуя об усилении процессов свободнорадикального окисления в мозговой ткани.
Все животные были разделены на 5 групп: 1-я группа - ложнооперированные крысы, которым билатерально подводились лигатуры под общие сонные артерии, но не проводилась ишемия головного мозга; остальным группам животных за 10 минут до ишемии головного мозга вводились парентерально следующие препараты: во 2-й группе - оксибутират натрия внутривенно из расчета 50 мг/кг, в 3-й группе - никотинамид внутриартериально в общую сонную артерию из расчета 200 мг/кг, в 4-й группе - никотинамид внутривенно из расчета 200 мг/кг, в 5-й группе - физиологический раствор в соответствующих объемах. Для изучения состояния свободнорадикального окисления в головном мозге использовался метод регистрации хемилюминесценции (Фархутдинов P.P. Хемилюминесценция крови и мочи при типовых патологических процессах: Автореферат д-ра мед. наук. Казань, 1988. 44 с; Loew, L.M. Potentiometric membrane dyes. In: Mattson, W.Т. ed. Fluorescent and luminescent probes for biological activity (vol.11). London: Academic; 1993: 150-160). При этом проводилось хемилюминесценцентное (ХЛ) исследование гомогената головного мозга крыс.
У животных 3-й и 4-й групп, т.е. на фоне введения никотинамида, светосумма ХЛ гомогената мозга была соответственно в 2 и 1,5 раза ниже по сравнению с 5-й группой животных, которым не проводилась интраоперационная защита головного мозга. Эти значения приближались к показателям 1-й группы ложнооперированных крыс и были идентичны показателям 2-й группы животных.
В таблице 1 изображены показатели хемилюминесценции гомогената головного мозга крыс.
Эксперименты на животных подтвердили наличие антиоксидантных свойств никотинамида.
Под наблюдением было 34 пациента, которым были выполнены каротидные эндартерэктомии под местной анестезией. Временный шунт в данных случаях не применялся. Контрольную группу составили 10 пациентов, которым выполнялась стандартная КЭАЭ под местной анестезией.
Основную группу составили 24 пациента, которым также выполнялась стандартная КЭАЭ под местной анестезией, но перед окклюзией в общую сонную артерию вводился раствор никотинамида из расчета 2,0 мг/кг.
Производился трехкратный забор крови по 10 мл из внутренней яремной вены на стороне хирургического вмешательства для исследования свободнорадикального окисления методом регистрации хемилюминесценции:
Первая порция крови из внутренней яремной вены перед окклюзией сонных артерий.
Вторая - на высоте ишемии головного мозга после выполнения реконструкции сонных артерий.
Третья - через 10 минут после снятия окклюзии сонных артерий.
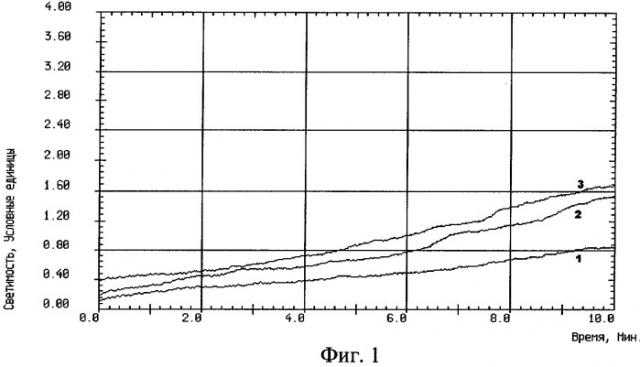
На фиг.1 изображен график записи спонтанной хемилюминесценции крови, взятой из внутренней яремной вены без защиты головного мозга: 1 - до реконструкции на сонных артериях, 2 - на высоте окклюзии сонных артерий, 3 - через 10 минут после снятия окклюзии сонных артерий.
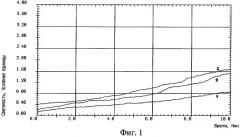
На фиг.2 изображен график записи индуцированной хемилюминесценции крови, взятой из внутренней яремной вены без защиты головного мозга: 1 - до реконструкции на сонных артериях, 2 - на высоте окклюзии сонных артерий, 3 - через 10 минут после снятия окклюзии сонных артерий.
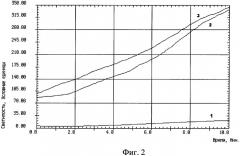
На фиг.3 изображен график записи спонтанной хемилюминесценции крови, взятой из внутренней яремной вены с защитой головного мозга никотинамидом: 1 - до реконструкции на сонных артериях, 2 - на высоте окклюзии сонных артерий, 3 - через 10 минут после снятия окклюзии сонных артерий.
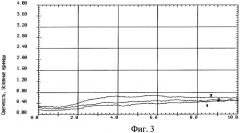
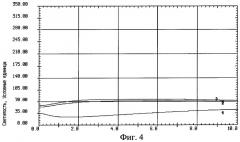
На фиг.4 изображен график записи индуцированной хемилюминесценции крови, взятой из внутренней яремной вены с защитой головного мозга никотинамидом: 1 - до реконструкции на сонных артериях, 2 - на высоте окклюзии сонных артерий, 3 - через 10 минут после снятия окклюзии сонных артерий.
Результаты: У контрольной группы больных было установлено увеличение интенсивности спонтанной ХЛ крови между порцией до окклюзии и порциями крови на высоте окклюзии сонных артерий, а также в фазе реперфузии до 2 раз, а стимулированной ХЛ крови между соответствующими порциями до 5 раз, что является показателем чрезмерного образования свободных радикалов.
Проведенные исследования позволили выявить увеличение процессов СРО в крови, оттекающей от головного мозга, при интраоперационной окклюзии сонных артерий.
В основной группе больных была выявлена незначительная разница в значениях спонтанной и стимулированной ХЛ в крови между первой порцией и порциями крови на высоте окклюзии сонных артерий и в фазе реперфузии (табл.1).
Предлагаемый способ иллюстрируется следующим примером.
Больной А. поступил в отделение сосудистой хирургии с атеросклеротическим поражением брахиоцефальных артерий, стенозирующим просвет правой общей и внутренней сонных артерий до 80%. На операции под местной анестезией выделены правая общая сонная, наружная сонная и внутренняя сонные артерии. За 10 минут до окклюзии сонных артерий в просвет правой внутренней сонной артерии введен раствор никотинамида из расчета 2,0 мг/кг. Для профилактики тромботических осложнений во время пережатия артерий использовался гепарин 5000 ЕД внутривенно. Окклюзированы общая сонная, наружная сонная и внутренняя сонная артерии. Атрериотомия ОСА с переходом на ВСА. Эндартерэктомия из ОСА, ВСА. Ушивание артериотомной раны. Восстановление кровотока по сонным артериям. Время окклюзии сонных артерий 25 минут. Неврологических нарушений на операции и в послеоперационном периоде не было.
| Таблица 1Способ защиты головного мозга в реконструктивной хирургии сонных артерий | ||||
| Показатели | Светосумма, усл.ед | Спонтанная светимость, | Максимальная светимость, | |
| Группы | усл.ед | усл.ед | ||
| Л/оперированные | М | 1,597 | 0,331 | 0,959 |
| (n=11) | М±m | ±0,558 | ±0,426 | ±0,583 |
| ГОМК | М | 2,800 | 0,542 | 1,597 |
| (n=10) | М±m | ±0,539 | ±0,578 | ±0,460 |
| Никотинамид | М | 2,805 | 0,245 | 1,542 |
| внутриартериально | М±m | ±0,433 | ±0,191 | ±0,466 |
| (n=11) | ||||
| Никотинамид | М | 3,606 | 0,532 | 2,007 |
| внутривенно | М±m | ±0,370 | ±0,461 | ±0,356 |
| (n=11) | ||||
| NaCl 0,9% | М | 5,793 | 0,368 | 3,934 |
| (n=10) | М±m | ±1,149 | ±0,397 | ±1,043 |
Способ защиты головного мозга при операциях на сонных артериях путем введения лекарственного препарата, отличающийся тем, что за 10 мин до окклюзии сонных артерий в общую сонную артерию на стороне реконструкции вводят раствор никотинамида из расчета дозы никотинамида 2,0 мг/кг больного.