Способ улучшения функциональной активности сетчатки при ее патологии различного генеза
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к офтальмологии, и касается лечения различных патологических состояний сетчатки. Для этого в полость стекловидного тела или в супрахориоидальное пространство глаза вводят суспензию культивированных эмбриональных нейральных стволовых клеток в дозе 1-2,5 млн клеток в 0,05-0,1 мл физиологического раствора. Такое выполнение способа обеспечивает повышение функциональной активности сетчатки за счет нейропротекторного и регенераторного действия стволовых клеток. 2 з.п. ф-лы, 2 ил., 2 табл.
Реферат
Предлагаемое изобретение относится к офтальмологии и предназначено для повышения функциональной активности сетчатки. Улучшение ретинального электрогенеза и связанных с ним зрительных функций, несомненно, является основной задачей любых реабилитационных мероприятий при заболеваниях сетчатки различной природы (дистрофиях различного генеза, посттравматических изменениях, поражениях сетчатки при общих заболеваниях).
Несмотря на широкий выбор обычно применяемых способов лечения, восстановление ретинальной биоэлектрической активности, а следовательно, и зрительных функций, остается актуальной проблемой. Многочисленные медикаментозные средства, физиотерапевтические методы, лазерные и хирургические вмешательства не обладают достаточной эффективностью (Лысенко B.C. Разработка патогенетически ориентированных комплексных методов лечения инволюционных центральных хориоретинальных дистрофий". Диссерт. канд. мед. наук. С.5-25). Поэтому клиническое улучшение оказывается нестойким, патологический процесс продолжает прогрессировать, приводя к значительному снижению зрения. Отсюда понятна необходимость поиска новых современных способов улучшения функциональной активности сетчатки.
Сообщается об изучении влияния на функциональную активность сетчатки препарата ЭНКАД на модели йодацетатной ретинопатии (Зуева М.В. и др. Экспериментальная йодацетатная ретинопатия" // Вестн. офтальм., 1977, № 3, с.59-60). Однако электрофизиологические данные не обнаружили положительного эффекта препарата.
Известно использование пептидных биорегуляторов в офтальмологии. В 1985 г. в Военно-Медицинской академии (г.Санкт-Петербург) В.Х.Хавинсон и соавторы из сетчатки глаза крупного рогатого скота выделили комплекс пептидов, стимулирующих функцию сетчатки, который получил название ретилин или ретиналамин (RU 2073518, 20.02.97 - ближайший аналог). Лечение с использованием ретилина проводили больным, страдающим центральной хориоретинальной дистрофией сетчатки, диабетической ретинопатией, пигментной абиотрофией сетчатки, а также в комплексе с микрохирургическим лечением при ранениях и контузиях глаза (Трофимова С.В. Применение пептидных биорегуляторов при лечении диабетической ретинопатиии: Автореф. дис. канд. мед. наук. - Спб., 1999; Максимов И.Б. Комплексная пептидная коррекция при микрохирургическом лечении травм глаза и их последствий: Автореф. дис. д-ра мед. наук. - М., 1996). Механизм действия пептидных биорегуляторов основан на восстановлении и сохранении регуляторных механизмов межклеточного взаимодействия, что проявляется, в частности, восстановлением синтеза тканеспецифических белков. Однако биорегулирующая терапия направлена на улучшение трофики вообще и эффективна на ранних стадиях патологического процесса.
В связи с этим нами проявлен интерес к вопросу о целесообразности использования культивированных in vitro нейральных стволовых клеток (НСК) человека для улучшения функциональной активности сетчатки при некоторых видах ее патологии.
Техническим результатом предлагаемого изобретения является длительное и адекватное улучшение функциональной активности сетчатки.
Технический результат достигается за счет введения суспензии НСК в глаз, например в стекловидное тело или супрахориоидальное пространство.
Стволовые клетки обладают рядом существенных достоинств: могут обеспечивать регенерацию поврежденных участков через продукцию различных факторов роста и ключевых метаболитов; способны разворачивать программы эмбриогенеза и дифференцировки, восполняя тем самым недостаток активно работающих клеток. Различные стволовые клетки могут интегрироваться в патологически измененные сетчатки и образовывать клетки с ретинальным фенотипом. В офтальмологии терапевтический потенциал стволовых и прогениторных клеток изучается на животных с наследственной ретинальной патологией, близкой к пигментному ретиниту человека (Lund et al. Subretinal transplantation of genetically modified human cell lines attenuates loss of visual function in dystrophic rats // PNAS. - 2001. - V.98. - N.17. P.9942-9947; Rander et al. Light-driven retinal ganglion cell responses in blind rd mice after neuronal transplantation // Invest. Ophthalmol. Vis. Sci. - 2001. - V.42. - P.1057-1065; Woch et al., 2001; Sagdullaev et al. Retinal transplantation-induced recovery of retinotectal visual function in rodent model of retinitis pigmentosa // Invest. Ophthal. Vis. Sci - 2003. - V.44. - P.1686-1695). Используется также моделирование механического (Nishida et al. Incorporation and differentiation of hippocampus-derived neural stem cells transplanted in injured adult rat retina // Invest. Ophthalmol. Vis. Sci - 2000. - V.41. - P42-68-4274; Tomita et al. Bone marrow-derived stem cells can differentiate into retinal cells in injured rat retina // Stem Cells. - 2002. - V.20. - P.279-283) и ишемического (Kurimoto et al. Transplantation of adult rat hippocampus-derived neural stem cells into retina injured by trancient ischemia // Neurosci. Lett. - 2001. - V.306. - P.57-60) поражения сетчатки. Большинство работ свидетельствует о том, что пересаженные во взрослую сетчатку стволовые клетки всегда достоверно дифференцируются в глиальные элементы (в астроциты и клетки Мюллера). При изучении эффектов стволовых клеток большое значение имеет определение характера их воздействия на структуры и функцию сетчатки, а также объективная оценка функциональной состоятельности регенерируемых нейронов. Однако в многочисленных работах, публикуемых по данной проблеме, малое внимание уделяется анализу функциональных параметров. При трансплантации стволовых и прогениторных клеток оценка их пролиферации, дифференцирования, а также выживания зрелых ретинальных нейронов осуществлялась только в иммуногистохимических исследованиях с помощью нейрональных и глиальных маркеров, но без применения объективных критериев функциональной активности сенсорной ткани. Основываясь на этих данных литературы, предположили, что эти клетки могут оказать положительное воздействие на функциональное состояние поврежденной сетчатки при введении их в глаз различными путями. Для этого были проведены экспериментальные исследования на моделях повреждения сетчатки и введение различных доз НСК различными путями с оценкой функциональной активности сетчатки.
Источником донорского материала является ткань мозга эмбрионов человека 1-го триместра гестации (8-12 недель). Абортивный материал получают из лицензированных учреждений МЗ РФ, действующих в рамках законодательстьва РФ об охране здоровья граждан и в соответствии с утвержденным перечнем медицинских показаний. (Приказ министра здравоохранения № 302 от 28.12.93 "Об утверждении перечня медицинских показаний для искусственного прерывания беременности" и Приложения к этому приказу № 3 от 05.04.94). Культивирование осуществляют в бессывороточной среде, состоящей из DMEM (50%), F12 (50%), основного фактора тоста фибробластов (hFGF-b), эпидермального ростового фактора (hEGF) и фактора выживаемости нейрональных клеток (N2-supplement). (C.N.Svendsen, M.G. ter Borg, R.J.E.Armstrong, A.E.Rosser, S.Chandran, T.Ostenfefeld, M.A.Candwell - A new method for rapid and long-term growth of human neural precursor cells // J.Neirosci. Methods. - 1998.- V.85. - P.141-152).
Непосредственно перед трансплантацией суспензию клеток тщательно отмывают от культуральной среды, подсчитывают количество жизнеспособных клеток с помощью йодида пропидия и трипанового синего и суспензируют в минимальном количестве физиологического раствора. Для трансплантации используют суспензию НСК, содержащую 2-2,5 млн клеток в 0,1 мл физиологического раствора. Доза вводимых нейральных стволовых клеток отработана экспериментально. Время пребывания размороженного материала при положительной температуре не должно превышать 3 часа.
В первой серии эксперимента изучалось влияние НСК на функциональную активность сетчатки в условиях ее экспериментального лазерного повреждения при введении клеток в супрахориоидальное пространство. Повреждение сетчатки при сверхпороговом лазерном воздействии характеризуется, как правило, нарушением ультраструктуры клеток ретины вплоть до изменения архитектоники хориоретинальной области и кровоизлияний в сетчатку. Повреждение сетчатки как результат прямого термического воздействия лазерного воздействия развивается в пигментном эпителии сетчатки, сопровождается некрозом ядер в наружном зернистом слое, некрозом внутренних и наружных сегментов фоторецепторов, а следовательно, и снижением функциональной активности сетчатки (Н.Ф.Гамалея. Лазеры в эксперименте и клинике. М. - 1972. - С.101-108). Лазерное повреждение сетчатки кролика осуществлялось с помощью аргоновой лазерной установки. Коагуляты наносились в нижней половине глазного дна через грань трехзеркальной линзы по 20 коагулятов на каждом экспериментальном глазу. Средняя мощность излучения составляла 400 мВт, длительность экспозиции 0,1 сек, диаметр пятна 20 мкм. Для возможной визуализации клеток при иммуногистохимическом исследовании перед трансплантацией они были окрашены ядерным люминесцентным красителем бизбензимидом (Hoechst 33342, Serva). Перед трансплантацией животных наркотизировали в/м введением смеси реланиума и кетонала. Затем в верхненаружном квадранте делали разрез конъюнктивы и в 6 мм от лимба разрез склеры длиной 2 мм, через который с помощью микрошприца "Hamilton" в супрахориодальное пространство по направлению к заднему полюсу вводили НСК в количестве 1-1,2 млн клеток в 0,05 мл физиологического раствора. Покрытие пигментными клетками участков лазерного повреждения на фоне применения НСК завершалось к 18-20-м суткам, при введении физиологического раствора только к 25-м суткам. При иммуногистохимическом исследовании на 30-й день эксперимента введенные клетки были обнаружены в хориоидее, пигментном эпителии, в наружных и внутренних слоях сетчатки в зоне лазерного повреждения. Положительная окраска этих же гистологических препаратов первичными антителами на Human Nuclei (маркер ядер клеток человека) подтвердила, что трансплантированные НСК выживают в течение указанного срока и мигрируют из зоны введения в зону повреждения.
Функциональную активность сетчатки оценивали по данным электрофизиологического исследования. Электроретинография позволяет документально подтверждать степень и направленность изменений функционального статуса сетчатки, исследовать механизмы влияния изучаемых факторов, локализовать наиболее чувствительные к воздействию ретинальные структуры, определяющие весь спектр дальнейших зрительных функций. При введении НСК в правых опытных глазах через 10 дней после трансплантации и в течение последующего месяца отмечалась лучшая сохранность функции биполярных клеток и мюллеровской глии: в опыте средние значения b-волны составляли 95,0±10,5 мкВ, в контрольной же группе 70,2±8,3 мкВ. Учитывая нахождение трансплантированных клеток в сетчатке в зоне повреждения в течение 1 месяца, можно предположить, что указанное улучшение функционального состояния ретинальных структур связано с заместительной ролью НСК: с их способностью дифференцироваться в незрелый ретинальный фенотип под влиянием среды окружения, а также с высвобождением различных факторов роста, ключевых метаболитов, цитокинов и других активных веществ.
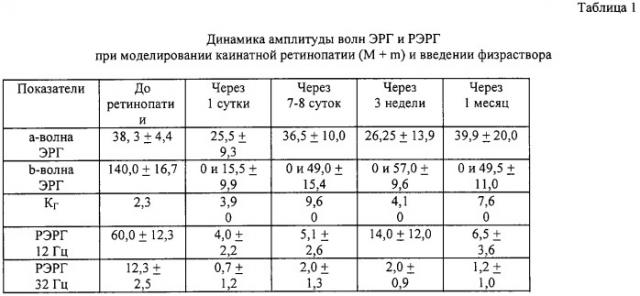
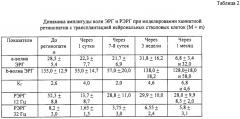
Во второй серии эксперимента изучение влияния трансплантированных НСК на электрогенез сетчатки проводили на модели каинатной ретинопатии, которая характеризуется развитием дегенерации биполярных и ганглиозных клеток сетчатки в ответ на интравитреальное введение яда. В правый опытный глаз кролика в полость стекловидного тела трансплантировали НСКв дозе 2-2,5 млн клеток, в левый контрольный глаз вводили 0,1 физиологического раствора. При клиническом наблюдении с помощью прямой офтальмоскопии к 7-м суткам наблюдения разница между опытными и контрольным глазами незначительная, но в контроле уже появляется легкое облаковидное преретинальное помутнение. На 20-е сутки наблюдения в опыте картина начального фиброза сетчатки, в контроле выраженные фиброзные изменения по типу витреоретинальной решетчатой дистрофии. На 30-е сутки между опытными и контрольными глазами выявляется значительная разница: в глазах с трансплантатами по-прежнему начальные фиброзные изменения, в контроле же отмечается явное прогрессирование пролиферации: выраженный фиброз сетчатки с развитием глиоза.
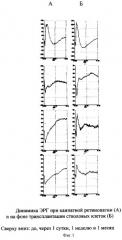
Степень повреждения сетчатки оценивали по показателям функционального состояния, а именно по уровню ее биоэлектрической активности, определяемой методом электроретинографии. При введении стволовых клеток, в правых опытных глазах животных уже через сутки после трансплантации и в течение последующего месяца по данным электроретинограммы (ЭРГ) и низкочастотной ритмической ЭРГ (РЭРГ) наблюдалась значительно лучшая сохранность функции палочковых биполяров, причем амплитуда b-волны прогрессивно возрастала и на 20-й день после моделирования ретинопатии даже превышала свои значения до начала эксперимента. Функция фоторецепторов оставалась практически одинаковой в обоих глазах, что соответствовало механизму действия каиновой кислоты. Результаты электроретинографических исследований суммированы в таблицах 1 и 2. Фиг.1, 2 иллюстрируют динамику ЭРГ и РЭРГ для наиболее типичных случаев.
Способ осуществляют следующим образом: в глаз однократно вводят культивированные НСК в виде суспензии: в стекловидное тело в дозе 2-2,5 млн клеток в 0,1 мл физиологического раствора или в супрахориоидальное пространство в дозе 1-1,2 млн клеток в 0,05 мл физиологического раствора.
Также существуют и другие способы введения, например субретинально.
Пример 1. Лазерное повреждение сетчатки кролика осуществлено вышеуказанным способом. Культивированные НСК в дозе 1 млн клеток введены в супрахориоидальное пространство правого глаза, в левый контрольный глаз введен физиологический раствор. Исходные значения b-волны опытного глаза 138 мкВ, контрольного - 135 мкВ. Через месяц после трансплантации значение b-волны опытного глаза 103 мкВ, контрольного - 68 мкВ, что свидетельствует о лучшей сохранности функции биполярных клеток и мюллеровской глии в глазах с трансплантированными НСК.
Пример 2. Интравитреально в правый и левый глаза кролика введена каиновая кислота в дозе 0,04 мг. В правый глаз в стекловидное тело введены НСК в дозе 2,5 млн клеток в 0,1 мл физиологического раствора, в левый глаз - 0,1 мл физиологического раствора. Исходные значения b-волны опытного глаза 140 мкВ, контрольного - 137 мкВ. На следующие сутки после инъекций b-волна опытного глаза 55 мкВ, контрольного - 0 мкВ, через 1 месяц b-волна опытного глаза 120 мкВ, контрольного - 0 мкВ. Исходные значения амплитуды РЭРГ на 12 Гц опытного глаза - 54 мкВ, контрольного - 53 мкВ. Через сутки после моделирования ретинопатии и введения НСК амплитуда РЭРГ в опытном глазу 14,7 мкВ, в контрольном - 3,9 мкВ. Через 1 месяц в опытном глазу 32,4 мкВ, в контрольном - 6,1 мкВ, что свидетельствует об улучшении функциональной активности сечатки, а именно о достоверно лучшей сохранности нейронов 2-го порядка и клеток Мюллера в опытных глазах.
Таким образом, предложенный способ введения НСК в глаз позволяет добиться длительного и адекватного улучшения функциональной активности сетчатки, предотвращает развитие пролиферативных изменений на глазном дне, снижает проявления каинатной ретинопатии и сохраняет функции тех клеточных типов сетчатки, которые подвергались наибольшему изменению при лазерном повреждении и инъекции каиновой кислоты. Положительное нейропротекторное влияние трансплантированных НСК на выживание биполярных клеток, на глио-нейральные взаимодействия в сетчатке, на функциональную активность Мюллеровской глии говорит о возможном применении данного способа трансплантации в клинике.
1. Способ повышения функциональной активности сетчатки при ее патологии различного генеза, отличающийся тем, что в глаз вводят однократно суспензию культивированных эмбриональных нейральных стволовых клеток в дозе 1-2,5 млн клеток в 0,05-0,1 мл физиологического раствора.
2. Способ по п.1, отличающийся тем, что суспензию вводят в полость стекловидного тела в дозе 2-2,5 млн клеток в 0,1 мл физиологического раствора.
3. Способ по п.1, отличающийся тем, что суспензию вводят в супрахориоидальное пространство в дозе 1-1,2 млн клеток в 0,05 мл физиологического раствора.