Конъюгат, связывающий фибрин/фибриноген
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине. Конъюгат состоит из фибрин/фибриноген-связывающего фрагмента, связанного с фармацевтически активным веществом либо непосредственно, либо через промежуточный захватывающий это вещество фрагмент, например антитело. Такой конъюгат может быть рекомбинантным слитым белком, состоящим из С-концевого домена VEGF165, слитого с веществом для заживления ран, таким, как лептин. Конъюгат позволяет формировать депо для продолжительного высвобождения фармацевтически активного вещества из фибринового сгустка. 7 н. и 8 з.п. ф-лы, 12 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к конъюгатам, имеющим специфическое практическое применение в качестве депо для фармацевтически активных веществ.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Обеспечение депо лекарств для действия при непрерывном высвобождении является существенным для эффективного лечения пациентов, которым необходимо постоянное введение определенных фармацевтически активных веществ, особенно если желательно, чтобы лекарство действовало внутри организма. Предварительным требованием в отношении адекватного депо лекарства является то, чтобы высвобождение фармацевтически активного вещества из такого депо регулировалось процессами специфического задерживания. Это предполагает, что фармацевтически активное вещество должно быть соединено с матриксным депо обратимым или необратимым способом.
Матрикс, с которым связано фармацевтически активное вещество, должен не только иметь сродство к активному веществу, но также и обладать свойствами биосовместимости. Предпочтительно, чтобы такие депонирующие матриксы подвергались биодеградации в организме пациента, чтобы не было необходимости в дополнительном воздействии на пациента для удаления опустошенных депо.
В качестве предпочтительных матриксов для депонирования лекарств были предложены фибриновые гели, в частности, благодаря их подходящим биологическим свойствам (см., например, АТ 369900). Фибриновые гели легко получить, они обладают хорошей биосовместимостью и их биологическую деградацию внутри организма можно регулировать. Однако из-за гидратированной и крупнопористой структуры фибрина диффузия фармацевтически активных веществ происходит со скоростью, слишком большой для большинства целей, даже если фибриновый гель является высокоструктурированным в результате добавления его природного образующего поперечные связи эффектора, фактора XIII.
В предварительных экспериментах, проведенных для данного изобретения, можно было показать, что разные белки, такие как β-галактозидаза, полностью высвобождаются из фибринового геля в течение трех дней или менее.
Поэтому было предложено ковалентно связывать биологически активные факторы с фибриновой сетью с помощью связывания домена трансглутаминазного субстрата с биологически активным фактором, используя действие фактора XIIIa (WО98/43686). Однако ковалентное связывание лекарственного вещества, представляющего интерес, с фибриновой сетью может давать в результате связывание, слишком сильное для того, чтобы обеспечить возможность достаточного высвобождения лекарственного вещества у пациента. Не все лекарственные средства совместимы с ковалентным связыванием. Кроме того, фибриновый сгусток может стать нестабильным, так как трансглутаминазными субстратами используются сайты поперечного связывания, которые существенны для этого взаимодействия.
Поэтому одним из объектов является создание депо лекарства, обладающего удовлетворительной биосовместимостью и имеющего регулируемый полупериод присутствия в организме пациентов.
Другим объектом данного изобретения является получение альтернативного депо лекарства на основе фибрина, в частности, без изменения активного вещества или использования ферментативной активности для его связывания.
Еще одним объектом данного изобретения является получение депо лекарства со способностью к эффективному замедлению диффузии биологически активного вещества по сравнению со временем высвобождения этого лекарственного вещества путем диффузии из стандартного фибринового геля.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Эти проблемы разрешены с помощью конъюгата, связывающего фибрин/фибриноген, состоящего из фрагмента, связывающего фибрин/фибриноген фрагмента, захватывающего вещество, способного к обратимому связыванию с фармацевтически активным веществом, и фармацевтически активного вещества, причем указанный фрагмент, связывающий фибрин/фибриноген, связан с указанным фрагментом, захватывающим вещество.
С помощью конъюгата согласно изобретению партнеры связывания со сродством к фибрину или фибриногену используются для связывания партнеров связывания фармацевтически активных веществ с фибриновым гелем. Благодаря этим фрагментам, связывающим фибрин или фибриноген, конъюгаты в достаточной степени связываются с фибриновым матриксом так, чтобы элюирование фармацевтически активного вещества было невозможным в результате простой диффузии, а чтобы оно главным образом зависело от сродства фибрин/фибриноген-связывающего фрагмента к фибрину и от сродства захватывающего вещество фрагмента к фармацевтически активному веществу.
Связывание фрагмента, связывающего фибрин/фибриноген с захватывающим вещество фрагментом, может быть ковалентным, например, с помощью химических линкеров, таких как 1-этил-3-(3-диметиламинопропил)карбодиимид (ЭДК), известных специалистам, или с помощью электростатических сил.
В другом воплощении данного изобретения конъюгат является слитым протеином, содержащим фрагмент, связывающий фибрин/фибриноген, ковалентно связанный с фармацевтически активным веществом, без промежуточного фрагмента, захватывающего вещество.
Термин "фрагмент, связывающий фибрин/фибриноген" относится к связывающей группе, которая способна связываться либо (1) с фибрином, либо (2) как с фибриногеном, так и с фибрином. Если связывающая способность относится как к фибрину, так и к фибриногену, можно сформировать фибриновый гель с молекулами фибриногена, которые уже "нагружены" присутствующими конъюгатами, что дает возможность получения гомогенного препарата депо лекарства и гомогенного распределения конъюгата и, следовательно, фармацевтического вещества, во всем объеме фибринового депо лекарственного средства.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
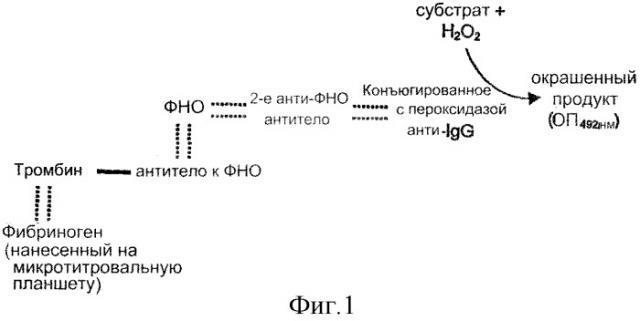
На фиг. 1 представлена система сэндвич-ТИФА (ELISA) для обнаружения ковалентного связывания (-) антител к ФНО и тромбина, а также сродства к связыванию (:::) с фибрином/фибриногеном и ФНО, соответственно.
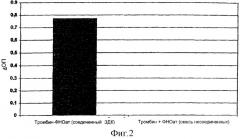
На фиг. 2 показано связывание ФНО с фибриногеновым матриксом с помощью антител к ФНО, соединенных с тромбином.
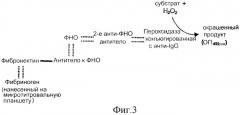
На фиг. 3 приведена система сэндвич-ТИФА для обнаружения ковалентного связывания (-) антител к ФНО и фибронектина и их сродство к связыванию с фибрином/фибриногеном и ФНО, соответственно.
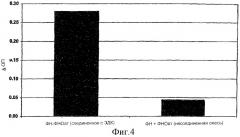
На фиг. 4 показано связывание ФНО с фибриногеновым матриксом посредством антител к ФНО, соединенных с фибронектином.
На фиг. 5 показано удерживание ФНО с использованием конъюгата согласно изобретению по сравнению с удерживанием ФНО в присутствии несвязанных фибронектина и антител к ФНО.
На фиг. 6 представлена стабильность фибриновых сгустков в течение часов с 3000 КИЕ/мл свободного апротинина или с 3000 КИЕ/мл связанного апротинина.
На фиг. 7 представлено специфическое связывание fbe-GST, но не в отдельности GST с фибриногеном.
На фиг. 8а представлено специфическое связывание биотинилированной двухнитевой (дн) и однонитевой (он) ДНК с фибриногеном, но не с БСА.
На фиг. 8b представлено связывание стрептавидин-пероксидазы (СВ-ПОКС), предварительно инкубированной с биотинилированной ДНК, с фибриногеновым матриксом через ДНК в качестве уплотняющего-связывающего фибрин фрагмента.
На фиг. 9 показана скорость высвобождения биотинилированного альбумина, который ковалентно связан с тромбином, по сравнению с высвобождением свободного биотинилированного альбумина из фибринового сгустка.
На фиг. 10 изображена общая схема связывающего фибрин рекомбинантного слитого белка, содержащего С-концевой фибрин-связывающий домен VEGF165, соединенный с фармацевтически активным белком.
На фиг. 11 представлена аминокислотная последовательность слитого белка лептин-VEGF165,имеющего на С-конце His-метку [SEQ ID № 1].
На фиг. 12 изображена плазмида для экспрессии, содержащая кассету, кодирующую слитый белок лептин-VEGF165,имеющий на С-конце His-метку.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение связано с биоматриксом, содержащим конъюгат, который способен связываться с фибриновым гелем и, предпочтительно, также и с фибриногеном. Сродство связывания конъюгата с фибриногеном передается также и фибрину после расщепления фибриногена до фибрина.
Один из конъюгатов согласно изобретению включает в себя связывающий фрагмент, который связывается с фибрином/фибриногеном, фрагмент, захватывающий вещество, способный к обратимому связыванию фармацевтически активного вещества, и фармацевтически активное вещество. В соответствии с данным изобретением фрагмент, связывающий фибрин/фибриноген, связан с фрагментом, захватывающим вещество, предпочтительно ковалентно. Например, белок, связывающий фибрин/фибриноген, или его часть, которая связывается с фибрином/фибриногеном, может быть связана или соединена с фрагментом, захватывающим вещество. Это соединение может быть осуществлено с помощью химических линкеров, технологии рекомбинантной ДНК, пептидного синтеза или комбинации этих методов.
Другой конъюгат согласно изобретению состоит из фрагмента, связывающего фибрин/фибриноген, ковалентно связанного непосредственно с фармацевтически активным веществом без промежуточного фрагмента, захватывающего вещество. Депо, образованное с помощью этого конъюгата, обеспечивает длительное высвобождение фармацевтически активного вещества на основе кинетики высвобождения из фибрина фрагмента, связывающего фибрин/фибриноген, а также естественного растворения фибринового сгустка с течением времени. В этом случае фармацевтически активное вещество сохраняет свою активность, даже когда оно остается ковалентно связанным с фрагментом, связывающим фибрин/фибриноген.
Фрагмент, связывающий фибрин/фибриноген, может быть получен из природно существующих (например, физиологических) связывающих белков, таких как тромбин, фибронектин, бактериальные связывающие фибриноген белки, основной фактор роста фибробластов, интегрины, тканевой активатор плазминогена, VEGF165 и подобные белки, имеющие по меньшей мере один фибрин/фибриноген-связывающий фрагмент.
В другом воплощении в качестве фибрин/фибриноген-связывающего фрагмента может использоваться нуклеиновая кислота, в частности ДНК. Не нужно, чтобы эта ДНК обладала кодирующей функцией, и поэтому она может даже иметь случайную последовательность, а также нужно позаботиться о том, чтобы избежать возможного воспалительного мотива, в частности CpG-мотива, в последовательности. Для целей данного изобретения ДНК используется в любой форме, что означает одно- или двунитевую ДНК, линейную или кольцевую ДНК, в качестве фрагмента, связывающего фибрин/фибриноген.
Для данного конъюгата белки могут использоваться либо в их физиологической форме, либо в обработанной форме. Например, такие физиологические участники связывания могут быть обработаны с помощью известных биохимических методик, чтобы получить по меньшей мере фибрин/фибриноген-связывающие части этих белков. Альтернативно, части, которые, как известно, связывают фибрин/фибриноген, могут быть также получены с помощью технологии рекомбинантной ДНК. Для многих белков, связывающих фибрин/фибриноген, было описано или предложено трехмерное строение, дающее опытному специалисту возможность выбрать те части этих белков, которые значимы для связывания фибрина/фибриногена, для использования в данном изобретении. Другие вещества со сродством связывания к фибрину/фибриногену могут быть проанализированы в отношении их предполагаемых сайтов связывания фибрина/фибриногена на основе известных трехмерных моделей вышеупомянутых белков, например, путем анализа последовательностей, если такие вещества являются белками или производными белков или являются результатом отбора по фаговому фенотипу.
Выбор фрагмента, захватывающего вещество, или непосредственно связанного фармацевтически активного вещества, по существу зависит от фармацевтически активного вещества, которое нужно вводить с помощью фибринового депо. Подходящие пары фрагментов, захватывающих вещество, и фармацевтически активных веществ известны специалистам в данной области.
Например, захватывающий вещество фрагмент может быть антителом, рецептором или их частью, которая специфически распознает и обратимо связывает фармацевтически активное вещество, представляющее интерес (например, в виде антигена или лиганда). Здесь термин "антитело" включает в себя полное антитело любого класса, содержащее константную область, а также вариабельную связывающую антиген область, а также части антител или молекулы, производные от антител, например фрагменты или рекомбинантные конструкции. Разумеется, большинство частей таких "классических" антител может быть опущено, поскольку присутствует существенная часть, а именно вариабельная связывающая область, которая дает возможность связывания фармацевтически активного вещества.
Другим примером фрагмента, захватывающего вещество, может быть группа молекул, связывающих антитела, например бактериальные белки, подобные протеину А или протеину G или Fc-рецептору макрофагов, а также их фрагменты или рекомбинантные конструкции.
В соответствии с предпочтительным воплощением данного изобретения в качестве захватывающих вещество фрагментов используют моноклональные антитела или антиген-связывающие области моноклональных антител. Кроме того, присоединение таких моноклональных антител или их частей к фибрин/фибриноген-связывающему фрагменту, особенно связывающему фибрин белку, может быть основано на классической химии белков.
Данное изобретение может быть адаптировано в отношении всех возможных фармацевтически активных веществ, особенно тех, для которых уже известен подходящий связывающий партнер (например, антиген/антитело, рецептор/лиганд, комплексные партнеры). Партнер связывания, который должен применяться в качестве лекарственного вещества, связывается с конъюгатом только через его конкретный соответствующий партнер связывания, причем последний ковалентно связан с фибрин/фибриноген-связывающим фрагментом.
Здесь термин "обратимое связывание" относится к нековалентному связыванию на основе электростатических сил, которые придают сродство между фрагментом, захватывающим вещество, и фармацевтически активным веществом, на основании чего фармацевтически активное вещество высвобождается с течением времени путем диффузии из фибринового сгустка.
Предпочтительными фармацевтически активными веществами, которые будут использоваться в данном конъюгате, являются антибиотики, факторы роста, рецепторы для тканевых компонентов, тканевые адгезивные вещества, противоопухолевые вещества, клеточные адгезивные вещества, нуклеиновые кислоты, протеины плазмы, антипротеазы, ингибиторы фибринолиза, гормоны, гепариноиды, вещества для лечения ран и их смеси. Когда фармацевтически активное вещество является ингибитором фибринолиза, таким как апротинин, в качестве части конъюгата согласно изобретению сгусток, с которым связан конъюгат, будет сохраняться дольше, чем сгусток, который просто содержит свободный апротинин, который легко диффундировал бы из сгустка.
Эти вещества могут быть либо непосредственно фармацевтически активными, либо давать возможность улучшенного действия другого фармацевтически активного вещества, которое может применяться одновременно с данным депо лекарственного вещества или отдельно от него. Например, могут применяться рецепторы для тканевых компонентов или тканевые адгезивные вещества, которые дают возможность улучшенного действия тканевого клея на основе фибриногена. Другими примерами, которые изменяют адгезивные свойства тканевого клея, являются вещества, которые могут быть представлены с данным конъюгатом. Если они применяются вместе с "классическим" тканевым клеем, наличие таких фармацевтически активных веществ, которые обладают влиянием на адгезивные свойства, могут влиять на адгезивную или неадгезивную способность фибриногенового тканевого клея в отношении конкретных тканей или клеток. Другие вещества, такие как нуклеиновые кислоты или противоопухолевые средства, могут также применяться вместе со специфической фибрин/фибриногеновой основой для образования депо для этих веществ в сайте, необходимом для желаемого эффекта. Также в соответствии с данным изобретением могут использоваться вещества, пригодные для диагностических методов, основанных на получении изображения, например, для рентгенографии или магнитно-резонансной индукции (МРИ), или красители.
В соответствии с предпочтительным воплощением данного изобретения конъюгат или бифункциональная молекула предназначены для включения в "классическую" систему тканевого клея. Такая система обычно состоит из содержащего фибриноген и тромбин препарата, подобного "одно-" или "двухкомпонентному" клею, получаемому в результате образования фибрина в месте нанесения, или предварительно изготовленного фибринового препарата, например фибриновой ваты (салфетки). Сформированный фибриновый сгусток или фибриновая вата дает возможность, например, закрыть рану или склеить ткань. Дополнительными ингредиентами в данной системе являются, например, фактор XIII (в качестве вещества, создающего поперечную связь, "кросс-линкера"), ингибиторы фибринолиза и т.д. (см., например, Fibrin Sealing in Surgical and Non-Surgical Fields, Schlag G., Redl H. editors, Vols. 1-9).
Фибрин/фибриноген-связывающий фрагмент и захватывающий вещество фрагмент, предпочтительно ковалентно связаны с помощью связывающего вещества, в частности, связывающими веществами, которые используются и, как подтверждено, успешно применяются в химии белков. Это предпочтительное воплощение является особенно удовлетворяющим требованиям, если желательна повышенная гибкость групп.
Хотя фармацевтически активная форма конъюгата согласно изобретению состоит из фармацевтически активного вещества, данное изобретение относится также к конъюгату без лекарственного вещества. Такой "голый" ("простой") конъюгат может быть легко трансформирован в фармацевтически активную форму путем "загрузки" конъюгата, состоящего из фрагмента, связывающего фибрин/фибриноген, и захватывающего вещество фрагмента с конкретным лекарственным средством, для которого был создан захватывающий вещество фрагмент.
Конкретное воплощение данного изобретения относится к конъюгату, на который наносится лекарственное вещество, который создан так, что несет в себе содержащий фибрин/фибриноген фрагмент. В соответствии с этим аспектом данного изобретения захватывающий вещество фрагмент может быть опущен. К тому же этот конъюгат может быть создан с помощью белковой химии, пептидного синтеза и/или рекомбинантной технологии путем комбинирования фибрин/фибриноген-связывающего фрагмента с фармацевтически активным веществом, например, путем прямого ковалентного связывания или путем связывания с подходящими соединяющими веществами. Эти конъюгаты, которые не нуждаются в отдельной "нагрузке" фармацевтически активным веществом, могут использоваться также в обычной системе тканевого клея, как описано выше.
Предпочтительный фибрин/фибриноген-связывающий конъюгат имеет в основе открытие того, что С-концевой домен VEGF165 ответственен за способность этой молекулы связываться с фибрином. Здесь термин "С-концевой домен VEGF165" относится к аминокислотным остаткам С104-R165, которые представлены в патенте США 5332671, фигуры 10а и 10b (Ferrata and Leung). VEGF165 дополнительно описан у Tischer et al., J. Biol. Chem. (1991) 266: 11947-11954; Sahni et al., Blood (2000) 96: 3772-3778 и Houck et al., J. Biol. Chem. (1992) 267: 26031-26037). Связывающий фибрин домен данного конъюгата не ограничен аминокислотной последовательностью, кодируемой экзонами 5, 7 и 8, которые изображены на фигуре 10 данного документа. Фибрин-связывающие свойства полученного слитого белка могут быть изменены, чтобы повысить или понизить кинетику высвобождения из фибринового депо путем добавления, делеции или мутирования конкретных аминокислотных остатков в С-концевом домене VEGF165. VEGF165 содержит также природный сайт расщепления плазмина в начале его С-концевого домена. Таким образом, С-концевой домен VEGF165 может быть использован для образования слитого белка с фармацевтически активным веществом, без необходимости в "связывающем вещество фрагменте" между фибрин-связывающим фрагментом и фармацевтически активным веществом. Когда конъюгат включается в фибриновый сгусток в месте ранения, природный плазминоген в плазме пациента, проникая в рану, превращается в плазмин, который, в свою очередь, расщепляет слитый белок с высвобождением фармацевтически активного вещества, дающего возможность его диффузии из сгустка. Другой механизм высвобождения основан на скорости диссоциации С-концевого домена VEGF165 из фибрина; в соответствии с этим механизмом весь конъюгат высвобождается и диффундирует из сгустка, давая возможность фармацевтическому веществу действовать в месте раны, снаружи сгустка. Далее представлены примеры фармацевтически активных веществ, которые могут быть слиты с С-концевым фрагментом VEGF165:
- цитокины, факторы роста и вещества для заживления ран, такие как лептин (Frank et al., J. Clin. Invest. (2000) 106:501-509; Sierra-Honigmann et al., Science (1998) 281:1683-1686), ИЛ-8, БКМ-1 (МСР-1) и ФП-4 (PF-4);
- пептидные антибиотики, такие как магаинины, дефензины и гранулизин;
- ингибиторы фибринолиза, такие как апротинин и домены Кунитца ингибитора коагуляции, ассоциированного с человеческим липопротеином (LACI-D1; Markland et al., Biochemistry (1996) 35:8045-8057).
Фармацевтически активное вещество, высвобожденное таким образом, может служить для управления ростом, миграцией и дифференцировкой специфических типов клеток, ускоряя таким образом заживление ран и неоваскуляризацию в процессе восстановления тканей.
В соответствии с другим аспектом данное изобретение относится к набору для формирования депо для фармацевтически активного вещества, включающего в себя тканевой клей на основе фибриногена и конъюгат согласно изобретению. Конъюгат может быть представлен в отдельной форме, готовой для смешивания перед медицинским использованием. "Готовая для использования" смесь тканевого клея на основе фибриногена и конъюгата согласно изобретению может быть применена с помощью средств и методов, которые уже известны специалистам в отношении "классических" тканевых клеев, в частности, с фибриногеновым компонентом таких клеев. Этот фибриногеновый компонент может быть смешан известным образом с компонентом, содержащим действующее начало для преобразования фибриногена в фибрин, предпочтительно препарат тромбина.
Набор согласно изобретению может поэтому также содержать подходящие устройства для применения тканевого клея и конъюгата и, необязательно, действующее вещество для преобразования фибриногена в фибрин. Примеры для таких устройств описаны в ЕР 0037393 А, ЕР 0315222А, ЕР 0156098А, ЕР 0210160А и ЕР 0292472А, которые включены сюда в виде ссылки.
В соответствии с другим аспектом данное изобретение относится к способу получения депо фармацевтически активного вещества, включающему в себя получение конъюгата согласно изобретению, введение этого конъюгата в сайт депонирования вместе с препаратом фибриногена, что дает возможность преобразования указанного фибриногена в фибрин, посредством чего формируется фибриновый сгусток, и что дает возможность связывания конъюгата с указанным фибриногеном или сформированным фибриновым сгустком.
Преобразование фибриногена в фибрин может быть произведено или тромбином, уже присутствующим в месте введения, или с помощью экзогенно добавленного активного начала преобразования фибриногена. Кроме тромбина или производимых тромбином протеаз для расщепления молекулы фибриногена могут использоваться другие протеазы, такие как стрептилаза, протеаза III и протеазы ядов, подобные, например, баксотропину. Связывание конъюгата с фибрином/фибриногеном может происходить после формирования фибринового сгустка. Однако предпочтительно допустить этот процесс связывания на ранней стадии, например, во время стадии преобразования фибриногена или (наиболее предпочтительно) даже ранее, так, чтобы связывание конъюгата согласно изобретению происходило на уровне фибриногена. Это дает в результате фибриновое депо, которое имеет гомогенное распределение конъюгата по всему депо. С другой стороны, если конъюгат предназначен для размещения главным образом на поверхности фибринового депо, возможность связывания конъюгата должна быть предоставлена после формирования фибринового сгустка.
Еще один аспект данного изобретения относится к депо для фармацевтически активного вещества, состоящего из конъюгата согласно изобретению и фибрина (например, подходящего фибринового матрикса). Такое депо, например, получают путем введения конъюгата согласно изобретению в основу из фибриновой сетки.
Настоящее изобретение может быть использовано при лечении пациентов, страдающих патологическим состоянием, которое излечивается с помощью фармацевтически активного вещества. В этом случае указанному пациенту можно вводить эффективное количество тканевого клея на основе фибриногена и конъюгата согласно изобретению.
Тем самым представлено депо фармацевтически активного вещества с подходящими свойствами высвобождения, которое даст возможность лечить пациентов фармацевтическим веществом и при этом избегать необходимости непрерывного и отдельного введения такого вещества.
Данное изобретение будет далее объяснено более детально с помощью примеров и рисунков, которыми, однако, оно не должно ограничиваться.
ПРИМЕРЫ
В данных примерах фактор некроза опухоли (ФНО) в качестве примера какого-либо фармацевтически активного вещества соединяют через доступное для приобретения антитело к ФНО со связывающим фибрин веществом. Тромбин и фибронектин были выбраны в качестве примеров веществ, имеющих связывающую фибрин/фибриноген часть. Соединение антитела с тромбином и фибронектином достигалось с помощью 1-этил-3-(3-диметиламинопропил)карбодиимида (ЭДК). С помощью реакции этого типа карбоксильные группы соединяющего компонента были активированы ЭДК; эти активированные карбоксильные группы взаимодействуют с аминогруппами другого компонента. Так как свойства групп могут быть разными в зависимости от того, какой компонент активируется первым, всегда исследовали обе возможности или оба варианта. В следующих ниже примерах конъюгат А-В означает, что компонент А является компонентом, который активирован по карбоксигруппам, а компонент В связан через его аминогруппу. Доказательство успешного соединения и обнаружения конкретной связывающей структуры (ФНО-антитело, тромбин/фибронектин-фибрин) устанавливали с помощью сэндвич-ТИФА.
Пример 1:
Соединение антител к ФНО с тромбином
Доступные для приобретения антитела к ФНО соединяли с тромбином через ЭДК. Доказательство соединения и конкретные связывающие структуры в конъюгатах обнаруживали с помощью сэндвич-ТИФА (фиг. 1). В кратком изложении микротитровальный планшет покрывали фибриногеном и затем инкубировали с комплексом (тромбин-антитело к ФНО или антитело к ФНО-тромбин), с ФНО, с вторичным антителом к ФНО и с конъюгатом фермента, распознающим вторичное антитело. Этот фермент превращает бесцветный субстрат в окрашенное соединение, которое затем обнаруживается. Превращение субстрата возможно только в том случае, когда оба компонента (антитело к ФНО и тромбин) ковалентно связаны с помощью реакции ЭДК и обе связывающие структуры были сохранены. Тромбин-антитело к ФНО, а также антитело к ФНО-тромбин дают положительную реакцию в этой системе (фиг. 2). Немодифицированные антитела, использованные в качестве контроля, не могли связывать ФНО с фибриногеновым матриксом.
Пример 2:
Соединение антител к ФНО с фибронектином
Доступные для приобретения антитела к ФНО соединяли с фибронектином, используя ЭДК. Подтверждение соединения и обнаружение конкретных связывающих структур в конъюгатах осуществляли посредством анализа сэндвич-ТИФА (фиг. 3), как в примере 1. Фибронектин-антитело к ФНО, а также антитело к ФНО-фибронектин демонстрировали положительную реакцию в данной системе (фиг. 4). Смесь антител к ФНО и фибронектина в качестве контроля демонстрировала только низкую степень связывания ФНО с фибриногеновым матриксом.
Пример 3:
Замедленное высвобождение ФНО из сгустка тканевого клея
Подтверждение эффективного задерживания ФНО в сгустке тканевого клея на основе фибриногена осуществляли добавлением ФНО и комплекса фибриноген-антитела ФНО, как описано в примере 2, к фибриногеновому компоненту фибринового покрывающего материала. В контрольных экспериментах ФНО и смесь фибронектина и антител к ФНО добавляли к данному фибриногеновому компоненту. Фибриновые сгустки получали с помощью таких модифицированных фибриногеновых компонентов и переносили в PBS (забуференный фосфатом физиологический раствор) через 60 минут после свертывания. Сгустки затем инкубировали при 37°С и супернатанты PBS заменяли свежим PBS в определенные сроки. Определяли содержание ФНО в этих супернатантах (фиг. 5). Через 12 дней сгустки лизировали с помощью урокиназы, и определяли содержание ФНО в лизате.
Добавление комплекса фибронектин-антитело к ФНО к фибриногеновому компоненту тканевого клея приводило к значительному замедлению высвобождения ФНО по сравнению с добавлением смеси фибронектин-антитело к ФНО. Это было показано по сниженному высвобождению ФНО в супернатанты PBS (дни 1-3), а также более высокому содержанию ФНО в лизате сгустка после 12 дней инкубации в PBS (фиг. 5). Так как фибриновые сгустки инкубировали только в PBS и не подвергали протеолитическому расщеплению, высвобождение ФНО определяли главным образом благодаря диффузии из фибринового сгустка. Инкубация с добавлением протеаз (например, урокиназы) приводит к непрерывному высвобождению ФНО в течение более продолжительного периода времени.
Пример 4:
Связывание апротинина через фибронектин
На основе ковалентного связывания активного вещества, в этом случае ингибитора фибринолиза, к связывающему фибрин фиксатору, в этом случае фибронектину, может быть продемонстрировано замедленное высвобождение ингибитора фибринолиза из фибринового сгустка в окружающую среду.
Конъюгат фибронектин-апротинин формировали, как описано ранее. Этот конъюгат растворяли в фибриногеновом компоненте перед смешиванием с тромбином для обеспечения гомогенного распределения конъюгата в фибриновом сгустке. Сгустки инкубировали в забуференном фосфатом физиологическом растворе (PBS) при 37°С. Супернатанты PBS заменяли несколько раз, и постоянство сгустка проверяли или визуально, или определяли путем количественного определения концентрации белка в супернатантах PBS.
Апротинин-фибронектиновый конъюгат повышал устойчивость сгустка по сравнению с фибриновыми сгустками с добавлением того же самого активного неконъюгированного апротинина. Это повышение устойчивости сгустка может быть вызвано сниженным высвобождением конъюгата из сгустка в PBS по сравнению с неконъюгированным апротинином (Фиг. 6).
Пример 5:
Связывание бактериального, связывающего фибрин белка fbe
Другим примером связывающего фибрин фиксатора является бактериальный белок fbe Streptococcus epidermidis. Этот белок экспрессируется в виде слитого белка с глутатион-S-трансферазой (GST) как активной части. Лизаты бактерий, экспрессирующих либо белок слияния fbe-GST, либо один только GST, доводили так, чтобы они содержали одинаковое количество активного GST, и наносили на покрытые фибриногеном или БСА планшеты для ТИФА. Связанный GST обнаруживали с помощью антител к GST. Слитый белок fbe-GST специфически связывается с фибриногеном через его fbe-область. Слитый белок не связывается с бычьим сывороточным альбумином (БСА), который служит в качестве контроля для неспецифического взаимодействия белок-белок. Один GST с отсутствием области fbe не связывается с фибриногеном (фиг. 7).
Пример 6:
ДНК в качестве фиксатора фибрина/фибриногена
ДНК очень сильно связывается с фибрином/фибриногеном. Поэтому определенное количество ДНК вводили в уплотненный фибриновый матрикс, и ее сродство к фибрину/фибриногену приводит к медленному, но постоянному высвобождению ДНК в течение длительного периода времени. Для целей данного изобретения ДНК предпочтительно используется в одной из форм, что означает одно- или двухнитевую ДНК, линейную или циркулярную ДНК, в качестве связывающего фибрин/фибриноген фрагмента. Для данного эксперимента синтезировали биотинилированный однонитевой олигодезоксинуклеотид (20 осн.) и биотинилированную двухнитевую ДНК (700 осн.). Биотинилированные молекулы ДНК смешивали со стрептавидин-пероксидазным конъюгатом для образования комплекса на основе сродства. Комплексы наносили на покрытые фибриногеном или БСА планшеты для ТИФА и количественно определяли активность связанной пероксидазы. Пероксидаза была специфически связанной с покрытыми фибриногеном ячейками через ДНК в качестве связывающегося с фибрин/фибриногеном фрагмента. Не наблюдалось никакого связывания с БСА, и чтобы избежать ложно положительных результатов из-за неспецифического связывания стрептавидин-пероксидазы с ДНК, проводили контрольный эксперимент с небиотинилированной ДНК, не дававшей сигнала (фиг. 8а и 8b).
Пример 7:
Тромбин в качестве фиксатора фибрина/фибриногена
Тромбин обладает расщепляющим фибриноген действием и связывающей фибрин/фибриноген активностью. Эти два действия локализуются в молекуле в разных сайтах.
Для данного эксперимента биотинилированный альбумин смешивали с фибрином сгустка или сам по себе (= свободной форме), или связанный через тромбин-РРАСК (= D-Phe-Pro-Arg-Chlormethylketon) фиксатор (= ковалентно связанной форме). Биотин использовали в качестве маркера для определения высвобождения обеих форм альбумина.
Как показано на фиг. 9, ковалентно связанный альбумин задерживается в уплотненных фибриновых сгустках в течение 4 дней, тогда как свободный альбумин высвобождается в течение 1 дня.
Пример 8:
Связывающий фибрин рекомбинантный слитый белок
На фиг.11 представлен рекомбинантный слитый белок, полученный для этого примера (SEQ ID №:1). С-концевая область VEGF165, которая является связывающей с фибрином частью этого слитого белка, соединяется с лептином, который является одним из примеров фармацевтически активного вещества. Слитый белок содержит природный плазминовый сайт расщепления, происходящий из VEGF165. У С146, концевой остаток в полноразмерном лептине перекрывается с первым Cys в С-концевом домене VEGF165.
Конструкцию ДНК, кодирующую слитый белок лептин-VEGF165, вставляли в плазмиду, показанную на фигуре, используя сайты рестрикции HindIII и Pacl. Эту плазмиду затем трансфицировали в Е.coli и слитый белок экспрессировали с помощью бактерий.
Слитый белок выделяли из бактерий, используя методики, хорошо известные в области генной инженерии. Слитый белок затем включали в фибриновый сгусток, причем С-концевая часть VEGF165 связывается с фибрином в сгустке. Полученный сгусток образует депо для длительного высвобождения лептина, который, как известно, является стимулятором заживления ран. Когда сгусток помещают в место раны, природный плазминоген в плазме пациента, поступающей в рану, превращается в плазмин, который, в свою очередь, расщепляет слитый белок, высвобождая, таким образом, лептиновую часть, которая может диффундировать из сгустка, чтобы воздействовать на заживление. Другой механизм высвобождения основан на скорости диссоциации С-концевого домена VEGF165 из фибрина; в соответствии с этим механизмом, конъюгат в целом высвобождается и диффундирует из сгустка, давая возможность лептиновой части действовать в раневом сайте, снаружи сгустка.
1. Фибрин/фибриногенсвязывающий конъюгат, содержащий
фибрин/фибриногенсвязывающий фрагмент, содержащий С-концсвой домен VEGF165 или его производное, и
фрагмент, захватывающий вещество, способный к обратимому связыванию с фармацевтически активным веществом,
где указанный фибрин/фибриногенсвязывающий фрагмент связан с указанным