Биочип для флуоресцентного и люминесцентного анализа
Иллюстрации
Показать всеИзобретение относится к микротехнологии. Биочип содержит расположенную на основании микрореакционную систему с аналитической камерой, снабженной прозрачной крышкой для прохождения потока анализируемого излучения, на которой сформирован киноформ для фокусирования потока анализируемого излучения в зоне фотоприема. Прозрачная крышка аналитической камеры может быть выполнена из материала с шириной полосы пропускания в анализируемой части спектра. Аналитическая камера может быть дополнительно снабжена элементом светового возбуждения анализируемого излучения, а микрореакционная система оснащена фермент-субстратным или рецепторно-лигандным модулем биолюминесценции. Технический результат - повышение чувствительности измерений люминесценции (флуоресценции) за счет снижения потерь информационного оптического сигнала. 3 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Изобретение относится к микротехнологии и может быть использовано в конструкции аналитических биочипов, предназначенных для исследования жидких химических, биологических и медицинских флуоресцирующих и люминесцирующих проб. Наиболее эффективно его использовать в полевых условиях и в соответствующих телеметрических системах.
Известен биочип для химического и генетического тестирования жидких люминесцирующих и флуоресцирующих проб, содержащий кремниевое основание, проточную реакционную камеру, микрофлюидную систему с подложкой, электронагреватель и термодатчик, подключенные к программному терморегулятору. Основание и боковые стенки реакционной камеры выполнены в подложке микрофлюидной системы; другое основание реакционной камеры выполнено во фторопластовом защитном слое, с помощью которого реакционная камера герметично прикреплена к основанию через изолирующий слой. Соосно с реакционной камерой со стороны, противоположной изолирующему слою, образован полый игольчатый радиатор. Для подачи и отвода реакционной смеси в подложке выполнены капилляры, подключенные к реакционной камере. Электронагреватель сформирован по периметру основания реакционной камеры и изолирован от него с помощью фторопластового защитного слоя. Подложка микрофлюидной системы может быть выполнена из полиметилметакрилата (RU 2171467, G 01 N 27/00, 2001). В целях упрощения конструкции и технологии изготовления биочип содержит стеклянную подложку, покрытую трехслойным пленочным фоторезистом, в среднем слое которого выполнена микрореакционная система с аналитической камерой, снабженной узлом оптического детектирования (RU 2200338, G 03 F 7/00, 7/06, 2002).
Тем не менее, данные устройства продолжают оставаться сложными в изготовлении и эксплуатации. Для приема сигналов флюоресценции или люминесценции требуются внешние фокусирующие элементы.
Известен также биочип для флуоресцентного и люминесцентного анализа, включающий полупроводниковую сэндвич-структуру, расположенную на диэлектрическом основании. В сэндвич-структуре выполнена микрокапиллярная система, подключенная к аналитической камере с возможностью заполнения их жидкой анализируемой пробой. В аналитическую камеру и микрокапилляры интегрированы микросенсоры для считывания химико-биологических характеристик в анализируемых точках реакционной системы. Аналитическая камера снабжена прозрачной стенкой для прохождения потока анализируемого излучения к фотодетектору (WO 99/27140, C 12 Q 1/68).
Наиболее близким к заявляемому является биочип для флуоресцентного и люминесцентного анализа, содержащий расположенную на основании микрореакционную систему с аналитической камерой, снабженной прозрачной крышкой для прохождения потока анализируемого излучения, полосковый световод, расположенный с возможностью освещения аналитической камеры, и токопроводящие ламели для подключения внешних электрических цепей (RU 2229699, G 01 N 21/03, 2004).
Однако чувствительность измерений информационного оптического сигнала при использовании указанных биочипов снижается из-за потерь, связанных с равномерным рассеянием люминесценции (флуоресценции) по всему объему аналитической камеры и обусловленного этим уменьшения светового потока, попадающего на фотодетектор внешней измерительной цепи.
Техническая задача заявляемого устройства заключается в повышении чувствительности измерений люминесценции (флуоресценции) за счет снижения потерь информационного оптического сигнала.
Указанная цель достигается тем, что в биочипе для флуоресцентного и люминесцентного анализа, содержащем расположенную на основании микрореакционную систему с аналитической камерой, снабженной прозрачной крышкой для прохождения потока анализируемого излучения, вносится следующее изменение: на прозрачной стенке аналитической камеры сформирован киноформ.
Киноформ представляет собой зубчатый рельеф, профиль которого выполнен из расчета перенаправления рассеянной части светового потока в требуемую область (Фишман А.И. Фазовые оптические элементы - киноформы // СОЖ, 1999, №12, с.76-84). Известными областями применения киноформов являются голография (Городецкий А.А., Фишман А.И. Синтезированные голографические элементы - киноформы - в курсе общей физики // Журн. Моск. Физ. О-ва. Сер. Б, Физическое образование в вузах, 1995. Т.1, №2, С.71-84) и анемометрия (RU 2144194, G 01 P 3/36, 2000). В микротехнологии, включая конструирование и изготовление биочипа, киноформ используется впервые.
Причинно-следственная связь внесенного изменения в конструкцию с достигаемым техническим результатом заключается в перенаправлении рассеивавшейся ранее части светового потока флуоресценции (люминесценции) в область регистрации ее фотодетектором внешней цепи.
Прозрачная крышка аналитической камеры, на которой сформирован киноформ, может быть выполнена из материала с шириной полосы пропускания в анализируемой части спектра. В таком варианте конструкции прозрачная крышка одновременно выполняет функции киноформа и светофильтра.
Для анализа реакций в пробах, требующих возбуждения флуоресценции или биолюминесценции, аналитическая камера дополнительно снабжена элементом светового возбуждения анализируемого излучения и/или фермент-субстратным или рецепторно-лигандным модулем биолюминесценции. При техническом осуществлении этих вариантов элементом светового возбуждения анализируемого излучения может быть узкоапертурный источник света, например, лазер или светодиод; фермент-субстратным модулем может служить слой пероксидазы хрена, люциферазы светлячков и т.п., имообилизованный на дне аналитической камеры; рецепторно-лигандный модуль может представлять собой, например, слой комплиментарных к фрагменту молекулы мишени анализируемой пробы олигонуклеотидов, иммобилизованных на гидрогеле или фоторезисте, расположенный на дне аналитической камеры. Возможно также внесение компонентов рецепторно-лигандного модуля непосредственно в анализируемую пробу, что удобно при проточной подаче ингредиентов в аналитическую камеру. В этом случае используют биочип в варианте по п.1 формулы.
Техническое осуществление киноформа на прозрачной крышке аналитической камеры может быть выполнено одним из следующих способов:
1. Непосредственным формированием на поверхности прозрачной стенки киноформа с переменным углом наклона рабочей грани зубцов путем фрезерования прозрачной крышки алмазной фрезой; микропрофилированием нанесенного на прозрачную крышку слоя фоторезиста (например, желатины); горячим прессованием заготовки прозрачной крышки и т.д. Эти способы являются оптимальными в отношении полноты фотоприема, но в то же время очень сложными, так как требует предварительного расчета геометрии поверхности киноформа на соответствие закону Снеллиуса с учетом расстояний от поверхности рабочих граней киноформа до области фотоприема, углов наклона этих граней, длины волны анализируемого излучения, показателей преломления анализируемой пробы, прозрачной крышки и других участков прохождения анализируемого излучения. Математические описания киноформов настолько сложны, что их использование возможно только с применением ЭВМ при значительной длине программ расчетов для каждого частного случая (см., например: Воронцов М.А., Корябин А.В., Шмальгаузен В.И. Управляемые оптические системы. - М.: Наука, 1988, 270 с.), что неприемлемо в отношении унификации конструкции. Возможно упрощение и унификация конструкции киноформа путем выполнения наклона граней всех его зубцов под углом 45° к базовой плоскости киноформа, что иллюстрируется ниже. Однако более целесообразно использовать описываемые далее способы оптимизации конфигурации используемых киноформов.
2. Выбором оптимальный по критерию максимума принимаемого светового потока киноформ из набора стандартных или комплекта заранее изготовленных образцов киноформов.
3. Предусмотрением возможности регулировки положения области фотоприема.
Наиболее целесообразно пп.2 и 3 применять совместно.
На фиг.1-3 приведены схемы вариантов биочипа, на фиг.4 представлена схема варианта киноформа для биочипа.
В табл.1 систематизированы сравнительные значения технических характеристик вариантов предлагаемых биочипов и их аналогов.
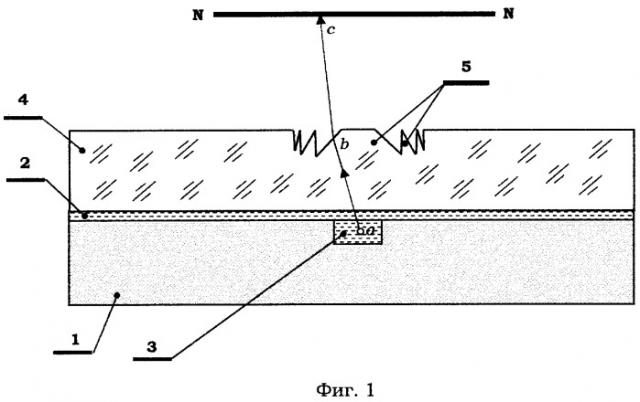
Биочип для флуоресцентного и люминесцентного анализа (фиг.1) содержит ситаловое основание 1 и расположенную на нем микрореакционную систему 2 с аналитической камерой 3, снабженной прозрачной крышкой 4, выполненной из поликарбоната для прохождения потока анализируемого излучения. Микрореакционная система 2 представляет собой блок микрокапилляров, подведенных к аналитической камере 3 с возможностью подачи в нее ингредиентов реакционной смеси и отвода продуктов реакции. Элементы 2 и 3 выполнены микрофрезерованием соответствующих канавок в основании 1 с последующей герметизацией их склеиванием крышки 4 с основанием 1 с помощью бальзамина М. На наружной поверхности прозрачной крышки 4 аналитической камеры 3 с помощью горячего прессования сформирован киноформ с зубцами 5 переменного шага и наклона для фокусирования потока анализируемого излучения в зоне фотоприема NN. Горячее прессование выполнено с помощью микропрофилированного пуансона, изготовленного из нержавеющей стали.
При наступлении флюоресценции (люминесценции) реакционной смеси в аналитической камере 3 часть излучения, не учитывавшаяся в известных биочипах, направляется в зону фотоприема NN по схеме, показанной на фиг.1, где для определенности луч из (·) а направляется в (·) с зоны фотоприема NN, преломляясь в (·) b рабочей грани соответствующего зубца киноформа.
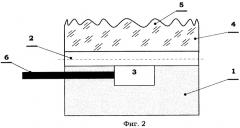
В варианте фиг.2 аналитическая камера 3 биочипа дополнительно снабжена элементом 6 светового возбуждения анализируемого излучения. Элемент 6 представляет собой подведенный к аналитической камере 3 световод, связанный с источником оптического излучения. Здесь первичное излучение от элемента 6 воздействует на флюорофор, образовавшийся из продуктов реакционной смеси в аналитической камере 3, вызывая флюоресценцию пробы, что регистрируется как в варианте фиг.1.
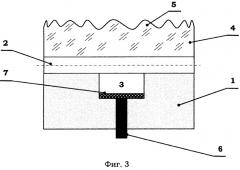
В варианте фиг.3 микрореакционная система 2 дополнительно оснащена фермент-субстратным или рецепторно-лигандным модулем 7 биолюминесценции. В данном варианте для определенности модуль 7 представляет собой слой олигонуклеотидов, иммобилизованных на прозрачном фоторезисте (полиметилметакрилате), нанесенном на дно аналитической камеры 3. При этом элемент 6 светового возбуждения установлен с возможностью просвечивания аналитической камеры 3 через модуль 7. Такое исполнение не является обязательным, но оно удобно в отношении модульности конструкции и равномерности первичного освещения пробы.
В данном варианте световой поток возбуждения, излучаемый с помощью элемента 6, активирует молекулы флюоресцеина, которым помечены продукты положительной реакции. Далее при наступлении световой реакции к свободным связям слоя олигонуклеотидов модуля 7 оказываются присоединенными комплиментарные цепочки фрагментов ДНК, содержащих флюорофоры, что вызывает вторичное (флюоресцентное) свечение, регистрируемое в зоне NN.
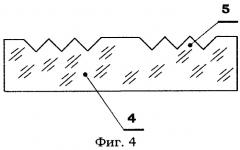
Вариант выполнения киноформа с постоянными шагом и наклоном рабочей грани зубцов (45° к базовой плоскости прозрачной крышки 4) приведен на фиг.4.
ПРИМЕР 1. Испытания вариантов биочипа по фиг.1 проводят на модели хемолюминесценции продуктов реакции люминола с перекисью водорода, катализируемой стандартным раствором гемоглобина лошади известной концентрации. При этом квантовый выход люминесценции пропорционален концентрации гемоглобина. Для проведения испытаний используют биочипы с аналитической камерой объемом 1·10-6 мл, крышка 4 которых изготовлена из полиметилметакрилата, в вариантах с киноформами переменного и постоянного шага и наклона зубцов (фиг.1 и 4 соответственно), а также без формирования киноформа (контроль).
Состав реакционной смеси:
- люминол (3-аминофталевый гидразид) в 0,2 м NaOH в деионизованной воде в концентрации 1,3 мМ - 25 об.%;
- 0,1 об.% раствор перекиси водорода в деионизованной воде - 25 об.%;
- раствор гемоглобина заданной концентрации в 50 мМ трисацетатном буфере рН 8,3 - остальное.
Для проведения реакции ингредиенты смешивают и немедленно вносят в аналитическую камеру 3. Измерение интенсивности хемолюминесценции проводят с помощью фотодетектора, оснащенного фотоэлектроумножителем.
Результаты измерений приведены в табл.1 в процентах от максимального значения тока усилителя-преобразователя фотодетектора. Как видно из таблицы, биочип с киноформом, выполненным с переменными шагом и наклоном рабочей грани зубцов (фиг.1), обладает чувствительностью в диапазоне концентраций гемоглобина от 0,001 до 10 мкМоль/л, а биочип с киноформом при постоянном шаге и наклоне рабочей грани зубцов 45° к базовой плоскости элемента 4 (фиг.4) - в диапазоне от 0,01 до 100 мкМоль/л, тогда как биочип без киноформа обладает чувствительностью в диапазоне концентраций гемоглобина от 0,1 до 1000 мкМоль/л и более. Таким образом, выполнение биочипа с киноформом позволяет повысить чувствительность измерений в 10÷100 раз.
ПРИМЕР 2. Испытания чувствительности вариантов биочипа, выполненных согласно схеме фиг.2 с использованием киноформов, сформированных согласно фиг.2 и 4, а также без киноформа (контроль) проводят на моделях растворов флюорохромов флюоресцеинизотиоцианата (ФИТЦ) и рибофлавина (РФ), концентрации которых установлены в диапазоне от 0,00001 до 1000000 мкМоль/л, при аналитической камере объемом 1·10-6 мл, где в качестве материала крышки 4 использован желто-зеленый светофильтр ЖЗС-9. Длина волны возбуждающего освещения 473 нм; фотодетектор выполнен на базе кремниевого фотодиода.
Результаты приведены в табл.2 в процентах от максимального значения тока усилителя-преобразователя фотодетектора. Как видно из таблицы, на модели ФИТЦ бичип с киноформом, выполненным, как показано на фиг.1 и 2, с переменными шагом и наклоном рабочей грани зубцов, обладает чувствительностью в диапазоне концентраций от 0,0001 до 1 мкМоль/л, а биочип с киноформом при постоянном шаге и наклоне рабочей грани зубцов 45° к базовой плоскости элемента 4 (фиг.4) - в диапазоне от 0,001 до 100 мкМоль/л, тогда как биочип без киноформа чувствителен в диапазоне концентраций ФИТЦ от 0,01 до 1000 мкМоль/л. На модели РФ бичип с киноформом, выполненным по фиг.1, обладает чувствительностью в диапазоне концентраций от 1 до 100000 мкМоль/л, а биочип с киноформом по фиг.4 - в диапазоне от 10 до 1000000 мкМоль/л, тогда как биочип без киноформа чувствителен в диапазоне концентраций ФИТЦ от 1000 до 100000 мкМоль/л. Таким образом, выполнение биочипа с киноформом позволяет повысить чувствительность измерений по ФИТЦ и РФ в 10÷100 раз.
Резюмируя приведенные доказательства и примеры, можно сделать вывод, что предложенное техническое решение позволяет повысить в 10÷100 раз чувствительность измерений люминесценции (флуоресценции).
| Таблица 1Технические характеристики биочипов к примеру 1 при исследовании реакции хемолюминесценции, % от максимума | |||
| Концентрация гемоглобина, мкМоль/л | Киноформ по фиг.1 | Киноформ по фиг.4 | Без киноформа |
| 1000 | 100 | 100 | 62 |
| 100 | 100 | 79 | 39 |
| 10 | 81 | 61 | 27 |
| 1 | 59 | 38 | 19 |
| 0,1 | 39 | 21 | 9 |
| 0,01 | 19 | 11 | 0 |
| 0,001 | 5 | 0 | 0 |
| 0,0001 | 0 | 0 | 0 |
| Таблица 2Технические характеристики биочипов к примеру 2 при исследовании реакции флюоресценции, % от максимума | ||||||
| Концентрация флюорофора, мкМоль/л | Киноформ по фиг.2 | Киноформ по фиг.4 | Без киноформа | |||
| ФИТЦ | Рибофлавин | ФИТЦ | Рибофлавин | ФИТЦ | Рибофлавин | |
| 1000000 | 100 | 100 | 100 | 100 | 100 | 50 |
| 100000 | 100 | 98 | 100 | 75 | 100 | 54 |
| 10000 | 100 | 60 | 100 | 45 | 100 | 29 |
| 1000 | 100 | 25 | 100 | 20 | 98 | 2,5 |
| 100 | 100 | 10 | 95 | 8 | 80 | 0,5 |
| 10 | 100 | 5 | 80 | 3 | 68 | 0,5 |
| 1 | 100 | 2 | 63 | 0,3 | 49 | 0,3 |
| 0,1 | 78 | 0,5 | 47 | 0,3 | 27 | 0,1 |
| 0,01 | 60 | 0,5 | 30 | 0,05 | 9 | 0,05 |
| 0,001 | 30 | 0 | 8 | 0 | 0 | 0 |
| 0,0001 | 8 | 0 | 0 | 0 | 0 | 0 |
| 0,00001 | 0,05 | 0 | 0 | 0 | 0 | 0 |
1. Биочип для флуоресцентного и люминесцентного анализа, содержащий расположенную на основании микрореакционную систему с аналитической камерой, снабженной прозрачной крышкой для прохождения потока анализируемого излучения, отличающийся тем, что на прозрачной крышке аналитической камеры сформирован киноформ для фокусирования потока анализируемого излучения в зоне фотоприема.
2. Биочип по п.1, отличающийся тем, что прозрачная крышка аналитической камеры выполнена из материала с шириной полосы пропускания в анализируемой части спектра.
3. Биочип по п.1, отличающийся тем, что аналитическая камера дополнительно снабжена элементом светового возбуждения анализируемого излучения.
4. Биочип по п.1, отличающийся тем, что микрореакционная система дополнительно оснащена фермент-субстратным или рецепторно-лигандным модулем биолюминесценции.