Модуляция il-2- и il-15-опосредованных т-клеточных ответов
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Сущность его заключается в разработке композиций, включающих в качестве первого активного агента, мишенью которого является рецептор интерлейкина-15 (IL-15), в качестве второго рецептор интерлейкина - 2 (IL-2), а также способы супрессии иммунного ответа. Препараты можно использовать в комбинированной терапии: два или более агентов, каждый из которых способствует гибели Т-клеток или, по меньшей мере один агент, который ингибирует пролиферацию Т-клеток. Технический результат - повышение эффективности иммунотерапии. 6 н. и 28 з.п. ф-лы, 13 ил.
Реферат
Настоящая заявка имеет приоритет в соответствии с заявкой U.S.S.N. 60/232251, поданной 14 сентября 2000 г.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к иммунологии, отторжению трансплантата, и заболеваниям, связанным с иммунной системой.
ИССЛЕДОВАНИЕ, ФИНАНСИРУЕМОЕ ПРАВИТЕЛЬСТВОМ
Описанная здесь работа отчасти субсидировалась National Institute of Health. Поэтому правительство Соединенных Штатов обладает определенными правами на настоящее изобретение.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Два интерлейкина, IL-2 и IL-15, функционально дублируют друг друга при стимулировании Т-клеточной пролиферации in vitro. Вместе с тем, их роль в первичной иммунной активации и иммунном гомеостазе in vivo выяснена в гораздо меньшей степени. In vivo, IL-2 и IL-15 могут обладать разными функциями и регулировать разные аспекты Т-клеточной активации. Например, IL-2 может в основном активировать Т-клетки для апоптоза (Lenardo, Nature 353:858-861, 1991), а IL-15 может содействовать клеточному выживанию (Dooms и соавт., J. Immunol. 161:2141-2150, 1998; Bulfone и соавт. Nature Medicine 3:1124-1128, 1997). IL-15 также, по-видимому, управляет in vivo пролиферацией Т-клеток памяти типа CD8+, тогда как IL-2 ограничивает их непрерывный рост (Ku и соавт., Science 288:675-678, 2000). Кроме того, мыши, фенотипически дефицитные по IL-2, являются лимфопролиферативными и аутоиммунными (Horak и соавт., Immunol. Rev. 148:35-44, 1995), тогда как мыши, дефицитные по IL-15, являются, до некоторой степени, лимфопеничными и неспособны повышать первичный ответ при вирусном заражении (Kennedy и соавт., J. Exp. Med. 191:771-780, 2000; Lodolce и соавт., Immunity 9:669-676, 1998). Молекулярная основа данного резкого расхождения остается неясной.
Функциональные рецепторы для IL-2 и IL-15 состоят из отдельной α-цепи, которая определяет специфичность связывания для IL-2 или IL-15, и из спаренных у рецептора IL-2 β- и γ-цепей. γ-Цепь является также ключевым сигнальным компонентом рецепторов IL-4, IL-7, и IL-9 (Sugamura и соавт., Ann. Rev. Immunol. 14:179-205, 1996). В лимфоидном компартменте эти рецепторные субъединицы могут экспрессироваться индивидуально или в различных сочетаниях, приводя к образованию рецепторов с разным сродством и/или с разными способностями передавать сигнал (Sugamura и соавт., выше). Например, β-цепь может ассоциироваться с α-цепью или с γ-цепью с образованием димерных структур, или с обеими цепями, α- и γ-цепью с образованием тримерных структур. Подобным образом γ-цепь может взаимодействовать с β-цепью и, через β-цепь, с α-цепью рецептора IL-2 либо рецептора IL-15. Сама по себе α-цепь рецептора IL-15, в отличие от α-цепи рецептора IL-2, может связываться с IL-15 с чрезвычайно высоким сродством (Giri и соавт., EMBO J. 14:3654-3663, 1995). Установлено, однако, что подобно α-цепи рецептора IL-2, данное взаимодействие не инициирует событий передачи сигнала. Следовательно, тримеризация цепей α-, β-, и γ-субъединиц, существенна для функциональной целостности IL-2- и IL-15-рецепторов, обладающих высоким сродством.
В исследованиях in vitro показано, что активированные Т-клетки могут экспрессировать и α-цепь рецептора IL-2 и α-цепь рецептора IL-15 (Chae и соавт., J. Immunol. 157:2813-2819, 1996), а β- и γ-цепи экспрессируются конститутивно при активации Т-клеток (Ishii и соавт., Int. Immunol. 6:1273-1277, 1994). Кроме того, IL-2 и IL-15 легко детектируются во время иммунной активации in vivo (Li и соавт., J. Immunol. 161:890-896, 1998). Таким образом, остается неясным как активированные Т-клетки различают in vivo IL-2, IL-15 и другие цитокины, зависимые от γ-цепи.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
Настоящее изобретение частично базируется на изучении экспрессии рецепторных субъединиц IL-2 и IL-15 в циклирующих in vivo Т-клетках. Удивительно, эти субъединицы направляют активированные Т-клеточные ответы на IL-2 или IL-15 селективным образом и, тем самым, регулируют Т-клеточный ответ in vivo. Иными словами (и в противоположность общепринятой точке зрения о том, что IL-2 и IL-15 являются дублерами), IL-2 и IL-15 выступают в разных ролях, контролируя Т-клеточную пролиферацию in vivo. В частности, IL-15 является ключевым в инициации Т-клеточного деления, тогда как IL-2 контролирует Т-клеточный рост с помощью понижения регуляции γс-экспрессии. В соответствии с этим, что касается первого варианта осуществления настоящего изобретения, в данном изобретении охарактеризованы, в основном, новые сочетания антагонистов IL-2 и IL-15 и способы супрессии иммунного ответа путем введения этих антагонистов. В каждом случае супрессию осуществляют путем введения первого агента, который является антагонистом молекулы IL-15 или IL-15-рецептора (IL-15R), и второго агента, который является антагонистом молекулы IL-2 или IL-2-рецептора (IL-2R). В альтернативных вариантах осуществления настоящего изобретения композиции настоящего изобретения могут включать (вместо, или в дополнение вышеописанным агентам), агенты, которые подавляют экспрессию нуклеиновых кислот (напр., ДНК или РНК), которые кодируют интерлейкин (напр., IL-2 или IL-15) или рецептор интерлейкина (напр., рецептор IL-2 или IL-15).
Вообще, настоящее изобретение характеризует новые сочетания агентов, которые при введении пациенту, снижают численность антигенреактивных Т-клеток. Например, в настоящем изобретении охарактеризованы композиции (напр., фармацевтически приемлемые композиции), которые включают два или более агентов, каждый из которых способствует гибели Т-клеток. Альтернативно, данная композиция может содержать, по меньшей мере, один агент, который способствует гибели Т-клеток, а также, по меньшей мере, один агент, который подавляет пролиферацию Т-клеток. Агент, который способствует гибели Т-клеток, может способствовать AICD (индуцированной активацией гибели клеток), пассивной клеточной гибели, ADCC (антитело-зависимой клеточно-опосредованной цитотоксичности) или CDC (цитотоксичности, управляемой комплементом).
Агенты, которые способствуют AICD, включают IL-2 и родственные молекулы (напр., IL-2/Fc или иные молекулы, которое функционируют в качестве агонистов IL-2 или IL-2-рецептора (напр., антитело, которые специфически связывается с данным IL-2-рецептором и имитирует связывание природного лиганда рецептора). Другой агент, который способствует AICD, представляет собой Fas-Лиганд (FasL). Агенты, которые способствуют пассивной клеточной гибели, включают агенты, которые являются антагонистами IL-15 (в результате нацеливания, напр., связывания на IL-15, рецептор IL-15, или компонент внутриклеточного сигнального пути, который активируется после связывания рецептора) или какой-либо иной фактор, необходимый для выживания Т-клеток (напр., IL-4, IL-7, лиганд OX-4, IFN-β, 4-1BB, или IGF-I) и подавляя тем самым их активность. В альтернативных вариантах осуществления настоящего изобретения композиции настоящего изобретения могут включать (вместо, или в дополнение, одного или нескольких вышеописанных агентов) агенты, которые ингибируют экспрессию нуклеиновых кислот (напр., ДНК или РНК), которые кодируют интерлейкин (напр., IL-2 или IL-15) или рецептор интерлейкина (напр., рецептор IL-2 или IL-15).
Способствовать ADCC или CDC можно путем экспонирования Т-клеток с агентом, который связывается с Т-клеточной поверхностью и содержит Fc-часть, которая активирует ADCC или CDC. В частности, агенты, которые способствуют ADCC или CDC, включают слитые белки, которые содержат интерлейкин (напр., IL-2 или мутантный IL-15), и Fc-участок (напр., IL-2/Fc), а также антитела или другие Fc-содержащие белки, которые связываются с рецептором интерлейкина (напр., IL-2- или IL-15-рецептор).
Как установлено выше, композиции настоящего изобретения могут включать не только агент, который способствует гибели Т-клеток, но также и агент, который подавляет пролиферацию Т-клеток. Агенты, которые подавляют пролиферацию Т-клеток, включают рапамицин, микофенолятмофетил (MMF), азатиоприн, и любой другой агент, известный и используемый в данной области техники для предотвращения клеточной пролиферации (включая химиотерапевтические агенты). Применение агента, который подавляет Т-клеточную пролиферацию, оказывается особенно успешным в сочетании с агентами, которые способствуют AICD, а также стимулируют Т-клеточную пролиферацию (такие, как IL-2/Fc). Например, в настоящем изобретении охарактеризована фармацевтически приемлемая композиция, которая включает IL-2/Fc (который, например, способствует AICD и клеточному лизису с помощью ADCC или CDC), антагонист IL-15 (который, например, способствует пассивной клеточной гибели, противодействуя IL-15, фактору, необходимому для выживания Т-клеток), и рапамицин (который подавляет пролиферацию Т-клеток). Композиции, содержащие другие сочетания агентов, описаны ниже.
Примечательно, что при использовании двух или более агентов, необходимость в физическом отделении одного от другого отсутствует. Несмотря на то, что агент может быть представлен одиночным объектом, который исходно обладает одной функциональной активностью (напр., антитело, мишенью которого является IL-2 или IL-15 вследствие специфического связывания IL-2 или IL-15), он может быть также представлен одиночным объектом, который обладает, по меньшей мере, двумя функциональными активностями (напр., IL-2/Fc, mIL-15/Fc, или антитело против IL-2 или антитело против IL-15; в этих молекулах интерлейкин опосредует AICD, а Fc-участок данной молекулы опосредует CDC и ADCC). Следовательно, композиция, которая включает (1) агент, который вызывает AICD, (2) агент, который вызывает CDC, и (3) агент, который подавляет клеточную пролиферацию, может включать только два активных ингредиента (напр., (1) молекулу IL-2/Fc, которая индуцирует AICD и CDC, и (2) рапамицин, который подавляет клеточную пролиферацию).
Описанные здесь композиции пригодны для лечения пациентов, на которых иммунная супрессия оказывает благоприятное воздействие (напр., пациент, который получил или ожидает получить трансплантат; пациент, который страдает от иммунного заболевания, особенно аутоиммунного заболевания; пациент, который является носителем злокачественной опухоли (напр., злокачественная опухоль иммунной системы), или пациент, страдающий реакцией "трансплантат против хозяина" (GVHD)). GVHD характеризуется ответной реакцией донорских лейкоцитов против антигенов реципиента. Этот ответ особенно проблематичен при трансплантации костного мозга, но происходит также и при трансплантации целых органов; донорские лейкоциты, присущие трансплантируемым органам, всегда ко-трансплантируются.
Хотя композиции настоящего изобретения могут содержать более одного агента, способы настоящего изобретения не ограничиваются способами, в которых указанные агенты вводятся одновременно. Например, перед получением композиции, содержащей антагонист IL-2 или антагонист IL-2R, пациент мог бы получить композицию, содержащую антагонист IL-15 или антагонист IL-15R. Подобным же образом, перед получением композиции, содержащей агонист IL-2, пациент мог бы получить композицию, содержащую рапамицин. Более того, композиции настоящего изобретения (применяемые одновременно или последовательно) можно использовать для лечения органа или клеточного трансплантата перед его имплантированием пациенту. Агенты настоящего изобретения и способы их применения описываются ниже.
Многие агенты, используемые в контексте настоящего изобретения, обладают преимущественными терапевтическими характеристиками. Например, агенты, мишенью которых являются IL-15R, могут представлять собой слитые белки, которые включают мутантный полипептид IL-15 (mIL-15). Маловероятно, чтобы эти агенты были иммуногенными, потому что мутантная IL-15-часть данного слитого белка может отличаться от IL-15 дикого типа лишь несколькими замещенными остатками. Кроме того, так как полипептиды mIL-15 могут связывать IL-15Rα c высоким сродством, они могут эффективно конкурировать с природным IL-15 за рецептор. Далее, агенты настоящего изобретения могут активировать компоненты иммунной системы хозяина, такие как комплемент и фагоциты, которые в конечном итоге опосредуют элиминацию (или истощение) клеток, несущих данный рецептор (напр., IL-2-рецептор), с которым связывается данный агент. Например, агенты настоящего изобретения могут опосредовать лизис или фагоцитоз клеток-мишеней. Поскольку альфа-субъединица рецептора IL-15 (IL-15Rα) экспрессируется активированными или злокачественными иммунными клетками, но не покоящимися иммунными клетками, агенты настоящего изобретения можно использовать для специфического нацеливания на те клетки, которые были активированы (напр., антиген-активированные Т-клетки), или те клетки, которые стали злокачественными. Таким образом, хотя Т-клетки представляют предпочтительную мишень для агентов настоящего изобретения, композиции настоящего изобретения могут также использоваться для нацеливания на другие клетки, участвующие в патогенезе иммунологических нарушений, таких, например, как другие клетки иммунной системы или гиперпролиферирующие клетки тканей.
За исключением особо оговоренных случаев все используемые здесь технические и научные термины обладают тем же значением, которое обычно придают им специалисты в данной области техники, к которой относится настоящее изобретение. Все публикации, патентные заявки, патенты и другие упомянутые здесь ссылки, включены путем ссылки во всей полноте.
Другие характеристики и преимущества настоящего изобретения должны быть очевидны из чертежей, подробного описания, и формулы изобретения. Хотя материалы и способы, аналогичные или эквивалентные описанным здесь материалам и способам, могут использоваться при осуществлении или проверке настоящего изобретения, предпочтительные материалы и способы описываются ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлена последовательность нуклеиновой кислоты интерлейкина IL-15 дикого типа (SEQ ID NO:1) и его предсказанная аминокислотная последовательность (SEQ ID NO:2).
На фиг.2 представлена последовательность нуклеиновой кислоты мутантного IL-15 (SEQ ID NO:3) и его предсказанная аминокислотная последовательность (SEQ ID NO:4). Природный кодон, кодирующий глутамин в положении 149, CAG, и природный кодон, кодирующий глутамин в положении 156, САА, оба заменены GAC, который кодирует аспартат. (Эти положения (149 и 156) соответствуют положениям 101 и 108, соответственно, в зрелом полипептиде IL-15, в котором отсутствует сигнальная последовательность из 48 аминокислот).
На фиг.3А представлен ряд графиков, отражающих экспрессию α-, β- и γс-цепей IL-2-рецептора при делении Т-клеток в селезенке хозяина через 3 дня после внутривенной (i.v.) инъекции CFSE-меченных клеток. Показаны данные, соответствующие результатам шести экспериментов.
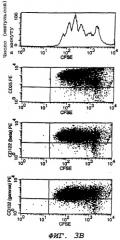
На фиг.3В представлен ряд графиков, отражающих экспрессию α-, β и γ-цепей IL-2-рецептора в делящихся in vitro Т-клетках. Лимфоцитарные клетки, меченные CFSE, стимулировали in vitro с помощью анти-CD3 (2 мкг/мл) в течение 3-х дней. Клеточное деление и экспрессию субъединиц IL-2-рецептора анализировали с помощью анализатора клеток, активированного флуоресценцией (FACS).
На фиг.3С представлен график, отражающий экспрессию L-селектина в делящихся in vivo Т-клетках. Клетки собирали из лимфатических узлов мыши-хозяина через три дня после внутривенной инъекции CFSE-меченных клеток и окрашивали с помощью конъюгированного с РЕ mAb к CD62L. Квадрант представлял собой комплект, основанный на клетках, окрашенных с помощью изотипического контрольного mAb.
На фиг.3D представлен ряд графиков, отражающих разную экспрессию α-цепи IL-2-рецептора в делящихся in vivo Т-клетках. CFSE-меченные клетки стимулировали in vivo в течение трех дней, и клетки второго клеточного деления сортировали. Сортированные клетки повторно стимулировали in vitro с помощью анти-CD3 и анти-CD28 в течение трех дней. Деление клеток и экспрессию α-цепи IL-2-рецептора анализировали с помощью FACS.
На фиг.4А представлен ряд графиков, отражающих экспрессию α-цепи IL-15-рецептора в делящихся in vitro Т-клетках через три дня после внутривенной инъекции CFSE-меченных клеток. Клетки окрашивали с помощью слитого белка IL-15-FLAG с последующим окрашиванием биотинилированным mAb к FLAG и PE-стрептавидином. Клетки, окрашивающиеся в отсутствие IL-15-FLAG, учитывали в качестве контроля.
На фиг.4В представлена гистограмма, отражающая разный ответ делящихся in vivo Т-клеток на действие in vitro IL-2 и IL-15. CFSE-меченные лимфоциты стимулировали in vivo в течение трех дней, а клеточное деление анализировали путем проверки CFSE-профиля. Во втором клеточном делении Т-клеток их сортировали, после чего клетки (1×104) культивировали in vitro в присутствии IL-2 или IL-15 в течение двух дней. Клеточную пролиферацию определяли по поглощению 3Н-TdR. Полученные результаты представлены в виде средней СРМ±CD по трем опытам.
На фиг.4С представлена пара графиков, отражающих эффект обработки антителами и CD25 на деление Т-клеток in vivo. Мыши-хозяева получали внутрибрюшинно (i.p.) mAb к CD25 по 1 мг/день в течение трех дней непосредственно перед внутривенной инъекцией CFSE-меченных клеток. Мышей, обработанных с помощью контрольных изотипических mAb (IgG1 крысы), учитывали в качестве контроля.
На фиг.5А представлен ряд графиков, отражающих картину внутриклеточно окрашенных IL-2 делящихся in vivo Т-клеток. CFSE-меченные клетки стимулировали in vivo в течение трех дней. Клетки, собранные из селезенки хозяина, стимулировали in vitro с помощью PMA и иономицина в течение четырех часов в присутствии GolgiStop™. Затем клетки фиксировали, повышали их проницаемость и окрашивали IL-2-продукцию. Клетки, окрашенные контрольными изотипическими mAb, учитывали в качестве контроля.
На фиг.5В представлена пара графиков, отражающих экспрессию γс в CD4+-Т-клетках мышей, дефицитных по IL-2. Клетки селезенки мышей, дефицитных по IL-2, и контрольных мышей дикого типа окрашивали с помощью конъюгированных с PE mAb против мышиных CD4 и с помощью конъюгированных с FITC mAb против мышиной IL-2-рецепторной γс. Экспрессию γс в CD4+-Т-клетках анализируют с помощью FACS.
На фиг.5С представлен ряд графиков, отражающих эффект обработки антителами против CD25 на экспрессию γс в делящихся in vivo Т-клетках. Мыши-хозяева получают mAb против CD25 по 1 мг/день (i.p.) в течение трех дней непосредственно перед внутривенной инъекцией CFSE-меченных клеток. Экспрессию β- и γ-цепей IL-2-рецептора в делящихся in vivo Т-клетках определяли на третий день (т.е., через три дня после инъекции CFSE-меченных клеток). Мышей, обработанных контрольными изотипическими mAb (IgG1 крысы), учитывали в качестве контроля.
На фиг.5D представлен ряд графиков, отражающих апоптозную гибель делящихся in vivo Т-клеток. CFSE-меченные клетки стимулировали in vivo в течение трех дней. Клетки собирали из селезенки хозяина и окрашивали с помощью PE-аннексина V. Клеточное деление и апоптозную гибель клеток анализировали с помощью FACS.
На фиг. 5Е представлен ряд графиков, отражающих внутриклеточную экспрессию Bcl-2 в делящихся in vivo Т-клетках. CFSE-меченные клетки стимулировали in vivo в течение трех дней. Клетки, собранные из селезенки хозяина, окрашивали с помощью конъюгированных с PE mAb против мышиного Bcl-2 или с помощью контрольных изотипических mAb. Клеточное деление и экспрессию Bcl-2 анализировали с помощью FACS.
На фиг.6 представлена гистограмма, отражающая результаты эксперимента, в котором гибель клеток (оцениваемая по высвобождению из клеток CTLL-2 изотопа 51Cr; смотрите x-ось) оценивали после обработки разными агентами. NP40 представляет собой детергент; IL-2/Fc является химерным белком, который содержит IL-2 и район Fc молекулы IgG (данная молекула является литической); С' представляет собой крысиный комплемент; IL-2/FC-/- представляет собой нелитический химерный белок, содержащий IL-2; а mIg представляет собой мышиный иммуноглобулин. Данное исследование подтверждает вывод о том, что цитолитический IL-2/Fc лизирует клетки CTLL-2, несущие IL-2R-, а нелитический IL-2/Fc не делает этого.
На фиг.7 представлен ряд гистограмм. Интенсивность флуоресценции FcRI в клетках СНО (клетки яичника китайского хомячка) измеряли после экспонирования последних с фосфатно-солевым буферным раствором (PBS; верхняя слева), мышиным иммуноглобулином (mIgG2a; верхняя справа), нелитической молекулой IL-2/Fc (IL-2/Fc-/-; нижняя слева), и литическим слитым белком, содержащим IL-2 (IL-2/Fc; нижняя справа). На каждой гистограмме численность клеток представлена графически против интенсивности флуоресценции FcRI/CHO. Данное исследование подтверждает вывод о том, что цитолитический IL-2/Fc связывается с FcRI, а нелитический IL-2/Fc не связывается.
На фиг.8 представлена группа из восьми графиков, отражающих пролиферативный ответ CD4+- (левая сторона) и CD8+- (правая сторона) Т-клеток in vivo. Данные клетки метили CFSE и стимулировали in vivo в течение трех дней литическими молекулами (IL-2/Fc), клеточным пролиферативным агентом (рапамицин (Rap)), или сочетанием двух агентов. В качестве негативного контроля одну группу животных не обрабатывали. IL-2/Fc анализировали по его CFSE-профилю. Данное исследование подтверждает вывод о том, что рапамицин подавляет пролиферативный сигнал IL-2.
На фиг.9 представлена группа из четырех графиков, относящихся к эксперименту, в котором CFSE-меченные лимфоциты стимулировали in vivo в течение трех дней. Экспрессию α-цепи IL-2R в делящихся Т-клетках оценивали с помощью FACS у животных, не подвергающихся лечению (вверху слева), получающих один лишь рапамицин (Rap; вверху справа), получающих один лишь IL-2/Fc (внизу слева), или получающих сочетание рапамицина и IL-2/Fc (Rap + IL-2/Fc; внизу справа). Данное исследование подтверждает вывод о том, что лечение рапамицином и IL-2/Fc усиливает экспрессию α-субъединицы IL-2R в период ранней пролиферации Т-клеток in vivo.
На фиг.10 представлена пара графиков, полученных в период, когда CSFE-меченные лимфоциты были стимулированы in vivo в течение трех дней, и проанализированы с помощью FACS. Экспрессию Annexin V в делящихся Т-клетках (CD4+) оценивали у животных, не подвергающихся лечению (левая панель), или получающих рапамицин и IL-2/Fc (Rap + IL-2/Fc; правая панель). Данное исследование подтверждает вывод о том, что лечение рапамицином и IL-2/Fc усиливают апоптоз CD4+-клеток в период ранней пролиферации Т-клеток in vivo.
На фиг.11 представлена таблица, показывающая результаты экспериментов, в которых анализируется срок существования аллотрансплантата островков у аутоиммунных, не страдающих ожирением, диабетических (NOD) мышей. Аллотрансплантаты оценивали в терминах первичной функции аллотрансплантата (показанные в данной колонке проценты соответствуют проценту мышей, у которых функционирует аллотрансплантат (функцию оценивали путем мониторинга уровня глюкозы крови)) и среднего времени существования (MST) функционирующих трансплантатов. n = числу протестированных животных. Вид обработки указан под заголовком "Обработка" (смотрите также пояснение, которое сопровождает данную таблицу, и приведенное ниже описание). Представленные здесь результаты подтверждают вывод о том, что обработка сочетанием рапамицина, IL-2/Fc и mIL-15/Fc приводит к длительному сроку существования островковых аллотрансплантатов.
На фиг.12 представлена таблица, демонстрирующая результаты экспериментов, в которых анализировался срок существования кожных аллотранплантатов у NOD-мышей. Состояние трансплантатов оценивали по продолжительности среднего времени существования (MST) функционирующих трансплантатов. n = числу протестированных животных. Виды обработки указаны под заголовком "Обработка" (смотрите также пояснение, которое сопровождает данную таблицу, и приведенное ниже описание). Представленные здесь результаты подтверждают вывод о том, что обработка сочетанием рапамицина, IL-2/Fc и mIL-15/Fc приводит к длительному сроку существования кожных аллотрансплантатов.
На фиг.13 представлена диаграмма в виде ломаной линии, которая схематически отражает % животных, которые не подвержены диабету в период после обработки литической молекулой IL-2/Fc, мышиным иммуноглобулином (mIg), и нелитической молекулой IL-2/Fc. Цитолитические молекулы IL-2/Fc блокируют аутоиммунитет, а литические молекулы IL-2/Fc - не блокируют.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Эффективный иммунный ответ начинает проявляться тогда, когда антиген или митоген запускает активацию Т-клеток. В процессе Т-клеточной активации происходят многочисленные клеточные изменения, которые включают экспрессию цитокинов и цитокиновых рецепторов. Один из цитокинов, участвующий в иммунном ответе, представляет собой интерлейкин-15 (IL-15), который является фактором Т-клеточного роста, стимулирующим пролиферацию и дифференциацию В-клеток, Т-клеток, клеток природных киллеров (NK), и in vitro активированных лимфоцитами киллерных (LAK) клеток. In vivo, пролиферация клеток этих типов усиливает иммунный ответ. Другой цитокин, участвующий в иммунном ответе, и описанный здесь, представляет собой IL-2.
Композиции настоящего изобретения включают агенты, мишенью которых является IL-15 или его рецептор, и IL-2 или его рецептор, а также способы, в которых эти композиции используются для супрессии иммунного ответа (напр., гуморального или клеточного иммунного ответа). В ряде случаев пациенты испытывают благоприятное воздействие от супрессии иммунного ответа, например, при трансплантации органа или при иммунном заболевании, особенно при аутоиммунном заболевании, или в реакции "трансплантат против хозяина". В других случаях, например, когда отдельные иммунные клетки становятся злокачественными или аутоагрессивными, является полезным активное разрушение таких клеток.
Настоящее изобретение основывается на открытие новых путей подавления иммунного ответа. Ингибирование можно осуществить путем введения сочетания агентов, мишенью одого из которых является IL-15 или IL-15R, а мишенью другого является IL-2 или IL-2R (режимы введения, включая ex vivo-обработку трансплантатов, известны в данной области техники и описывается ниже). Вообще, численность антиген-реактивных Т-клеток можно снизить в результате активации сигнальных путей, что ведет к гибели активированных Т-клеток (вследствие, напр., AICD); лишения клеток факторов, которые необходимы для их выживания (говорят, что клетки, которые погибают после такого лишения факторов, погибают пассивной клеточной смертью); или нацеливания активированных клеток на лизис с помощью компонентов иммунной системы (говорят, что клетки, которые погибают таким образом, погибают вследствие ADCC или CDC. В соответствии с этим, композиции настоящего изобретения включают агенты, которые осуществляют один или несколько таких исходов (напр., которые способствуют гибели Т-клеток посредством признанного пути гибели клетки (напр., AICD, пассивная клеточная гибель, ADCC, или CDC). Помимо наличия одного или нескольких агентов, которые способствуют гибели Т-клеток, композиции настоящего изобретения могут включать один или несколько агентов, которые подавляют пролиферацию Т-клеток (возникающую, напр., в ответ на любой антиген). Например, в настоящем изобретении охарактеризована композиция (напр., фармацевтически приемлемая композиция или созданная для применения в органной культуре или в клеточной культуре), которая включает IL-2/Fc (который, например, способствует AICD и клеточному лизису с помощью ADCC или CDC), mIL-15/Fc (который является антагонистом IL-15 (и, тем самым, способствует клеточной гибели) и способствует клеточному лизису с помощью ACDD или CDC), и рапамицин (который подавляет пролиферацию Т-клеток).
Термин "агент" относится, в сущности, к любому типу молекул, которые могут использоваться в качестве терапевтического агента. Белки, такие, например, как антитела, химерные белки, и растворимые лиганды, любой из которых может быть либо идентичен природному белку, либо содержать мутацию (напр., делецию, добавку, или замену одного или нескольких аминокислотных остатков), и молекулы нуклеиновых кислот, которые кодируют их (или которые являются "антисмысловыми" для них; напр., олигонуклеотид, который является антисмысловым для нуклеиновых кислот, которые кодируют IL-2, IL-15, или компонент (напр., субъединицу) их рецепторов), все они являются "агентами". Агенты настоящего изобретения могут быть введены системно, локально, или путем, основанным на клеточной терапии (т.е., агент настоящего изобретения может быть введен пациенту путем введения клеток, которые экспрессируют этот агент. Данные клетки могут представлять собой клетки, вводимые данному пациенту исключительно с целью экспрессии данного терапевтического агента. Эти клетки могут быть также клетками клеточного, тканевого, или органного трансплантата. Например, трансплантируемые клетки (напр., клетки островков) или клетки в пределах тканей или органов (напр., клетки в пределах кусочка кожи или печени, почки или сердца) можно обрабатывать агентом или трансдуцировать молекулой нуклеиновой кислоты, которая кодирует агент ex vivo (напр., перед трансплантацией). При этом трансплантируемые клетки сами продуцируют собственные иммуносупрессивные агенты. Например, клетку с требуемым фенотипом (напр., клетка, продуцирующая инсулин) можно модифицировать включением гена, продуцирующего один или несколько иммуносупрессивных факторов настоящего изобретения. Трансплантируемую клетку, ткань, или орган можно обработать либо перед, либо после трансплантации. Способы введения агентов пациентам (либо в клеточную или в органную культуру) известны, обычно используются специалистами в данной области техники и рассматриваются ниже.
Агенты, мишенью которых являются IL-15 или IL-15R
Композиции настоящего изобретения могут включать один или несколько агентов, мишенью которых являются IL-15 или IL-15-рецептор. Как указано выше, одиночный агент может обладать множеством функциональных доменов. Агенты, мишенью которых являются IL-15 или IL-15R, включают агенты, которые связываются (или иначе взаимодействуют) с IL-15, IL-15R, или с нуклеиновыми кислотами, которые кодируют их, а также агенты, которые связываются, и впоследствие разрушают клетки, несущие IL-15R, такие, как активированные Т-клетки. Таким образом, агенты, пригодные для осуществления иммунной супрессии, могут содержать две функциональные составляющие: нацеливающая составляющую, которая нацеливает данный агент к клетке, несущей IL-15R, и истощающую (напр., лизирующую) клетку-мишень составляющую, что приводит к элиминации клетки, несущей IL-15R. В одном из вариантов осуществления настоящего изобретения нацеливающая составляющая связывает IL-15R без эффективной трансдукции сигнала с помощью этого рецептора. Например, нацеливающая составляющая может включать мутантный полипептид IL-15, а составляющая, истощающая клетки-мишени, может включать Fc-район иммуноглобулиновой молекулы. Fc-район может происходить от IgG, например IgG1, IgG2, IgG3, IgG4 человека, или из аналогичных IgG млекопитающих, или от IgM, таких как IgM человека или из аналогичных IgM млекопитающих. В предпочтительном варианте осуществления настоящего изобретения Fc-район включает шарнир, домены СН2 и СН3 IgG1 человека или мышиного IgG2a. Хотя настоящее изобретение не ограничивается агентами, которые функционируют с помощью какого-нибудь конкретного механизма, полагают, что Fc-район опосредует управляемую комплементом и фагоцитами элиминацию клеток, несущих IL-15R.
Получены мутантные полипептиды IL-15, которые связывают рецепторный комплекс IL-15 с аффинностью, подобной IL-15 дикого типа, но не способны полностью активировать передачу сигнала. Эти мутантные полипептиды эффективно конкурируют с полипептидами IL-15 дикого типа и могут подавлять одно или несколько событий, которые обычно происходят в ответ на IL-15-сигнал, такое, например, как клеточная пролиферация. Используемый здесь полипептид IL-15 дикого типа представляет собой полипептид, который идентичен природно встречаемому IL-15 (напр., полипептид IL-15 дикого типа показан на Фиг.1). Напротив, "мутантный полипептид IL-15" представляет собой полипептид, который обладает, по меньшей мере, одной мутацией, по сравнению с IL-15 дикого типа, и который подавляет, по меньшей мере, одну из активностей in vivo или in vitro, которая, как правило, стимулируется IL-15 дикого типа.
Мутантный полипептид IL-15, который можно использовать в соответствии с настоящим изобретением, будет, как правило, блокировать, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 70%, и наиболее предпочтительно, по меньшей мере, на 90% одну или более активностей молекулы IL-15 дикого типа. Способность мутантного полипептида IL-15 блокировать активность IL-15 дикого типа можно определить с помощью разных анализов, включая описанный здесь анализ пролиферации клеток BAF-BO3 (в котором данные клетки были трансфицированы конструкцией, кодирующей IL-2Rβ). Кроме того, мутантные полипептиды настоящего изобретения можно определить по конкретной процентной идентичности, которую они проявляют в отношении IL-15 дикого типа. При рассмотрении процентной идентичности двух полипептидов, длина сравниваемых последовательностей должна составлять, обычно, по меньшей мере, 16 аминокислот, предпочтительно, по меньшей мере, 20 аминокислот, более предпочтительно, по меньшей мере, 25 аминокислот, и наиболее предпочтительно, по меньшей мере, 35 аминокислот. Термин "идентичность", используемый по отношению к полипептидной или ДНК-вой последовательности, относится к идентичности субъединиц (аминокислотные остатки белков или нуклеотиды молекул ДНК) в двух полипептидных или ДНК-овых последовательностях, которые сравниваются. Если положение субъединицы в обоих молекулах занимает одна и та же мономерная субъединица (т.е., один и тот же аминокислотный остаток или нуклеотид), то рассматриваемые молекулы идентичны по этому положению. Сходство между двумя аминокислотными последовательностями или двумя нуклеотидными последовательностями прямо зависит от числа идентичных позиций. Поэтому, полипептид, который на 50% идентичен стандартному полипептиду, который содержит в длину 100 аминокислот, может представлять собой полипептид, длиной 50 аминокислот, полностью идентичный участку стандартного полипептида длиной в 50 аминокислот. Это может быть также полипептид длиной 100 аминокислот, который на 50% идентичен стандартному полипептиду по всей его длине. Разумеется, и другие многие полипептиды могут удовлетворять этим критериям. Идентичность обычно и наиболее удобно измеряется с использованием программного обеспечения анализа последовательности, такого, например, как Пакет Программ для Анализа Последовательностей с параметрами по умолчанию, разработанный Генетической Компьютерной Группой Биотехнологического Центра Висконсинского Университета (1710 University Avenue, Madison, WI 53705).
Мутантный полипептид IL-15 настоящего изобретения может быть идентичен, по меньшей мере, на 65%, предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 90%, и наиболее предпочтительно, по меньшей мере, на 95% (напр., 96%, 97%, 98% или 99%) IL-15 дикого типа. Данная мутация может заключаться в изменении числа или содержания аминокислотных остатков. Например, мутантный IL-15 может обладать большим или меньшим числом аминокислотных остатков по сравнению с IL-15 данного типа. И наоборот, или в дополнение, этот мутантный полипептид может содержать замену по одному или нескольким аминокислотным остаткам, которые присутствуют в IL-15 дикого типа. Мутантный полипептид IL-15 может отличаться от IL-15 дикого типа добавкой, делецией, или заменой одного аминокислотного остатка, например, добавкой, делецией или заменой остатка в положении 156. Подобным же образом, мутантный полипептид может отличаться от полипептида дикого типа добавкой, делецией, или заменой по двум аминокислотным остаткам, например по остаткам в положении 156 и 149. Например, мутантный полипептид IL-15 может отличаться от IL-15 дикого типа заменой глутамина на аспартат по остаткам 156 и 149 (как показано на Фиг.2). Мутантные полипептиды, пригодные в качестве нацеливающих агентов, подобно IL-15 дикого типа, распознают и связывают компонент IL-15R. В одном из вариантов осуществления настоящего изобретения мутация в IL-15 происходит в карбоксиконцевом домене цитокина, который, как полагают, связывает IL-2Rγ (субъединица IL-2-рецептора). Альтернативно, или в дополнение, мутантные полипептиды IL-15 могут включать одну или несколько мутаций в пределах связывающего домена IL-2Rβ (β-субъединица IL-2-рецептора).
В случае, если мутантный полипептид IL-15 содержит замену одного аминокислотного остатка на другой, данная замена может представлять собой, но не обязательно, консервативную замену, которая включает замену в рамках следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глу