Композиция с антиоксидантными свойствами и способ лечения болезней млекопитающих
Иллюстрации
Показать всеИзобретение относится к области ветеринарии. Фармацевтическая композиция для антиоксидантной защиты клеток, тканей и организма в целом от гиперпродукции свободных радикалов при остром воспалении, химических, термических и радиационных поражениях, содержащая пероксиредоксин Prx VI, содержит дополнительно дигидролипоевую кислоту и фармацевтически приемлемые добавки, причем содержит пероксиредоксин Prx VI и дигидролипоевую кислоту в эффективном количестве, а соотношение между пероксиредоксином Prx VI и дигидролипоевой кислотой находится в интервале (w/w) от 1:1 до 50:1. Причем пероксиредоксин Prx VI может быть рекомбинантным человеческим пероксиредоксином Prx VI. Способ повышения антиоксидантной защиты млекопитающих характеризуется тем, что доставку указанной фармацевтической композиции осуществляют в межклеточное пространство ткани, органа или всего организма млекопитающего, причем доставка может быть осуществлена посредством пассивной или активной диффузии при аппликации или распылении, посредством парентрального или эндолюмбального введения путем инъекции, посредством парентрального введения, путем инфузии, ингаляции, дренажа, посредством сублингвального, вагинального, или ректального введения, посредством капель в нос или глаза, кроме того, доставка может быть осуществлена одновременно с применением иного терапевтического агента, в частности интерферона. Изобретение обеспечивает предупреждение вторичных альтеративных нарушений, восстановление эпителиальной ткани, защиту биомакромолекул от воздействия облучения. 2 н. и 4 з.п. ф-лы, 9 табл., 11 ил.
Реферат
Область техники
Настоящее изобретение относится к способу и фармацевтической композиции, предназначенным для профилактики и/или лечения патологий, которые частично или полностью вызваны нарушением баланса между окислительными и антиоксидантными процессами в клетках и организмах млекопитающих.
Предшествующий уровень техники
Известен широкий спектр заболеваний, для лечения которых антиоксидантные препараты подтвердили свою эффективность (Babish J.G. et al. PCT Appl. WO 0230419, 2002). К таким заболеваниям относятся: а) болезни легких, б) болезни печени, в) болезни почек, г) болезни кишечного тракта, д) болезни иммунной системы, е) болезни нервной системы, ж) болезни глаз, з) воспалительные процессы, и) болезни сердца, к) вирусные инфекции, например СПИД и другие.
В настоящее время открыт новый класс природных антиоксидантов, хорошо растворимых в воде, обладающих широким спектром антиоксидантной активности и исследованных в экспериментах in vitro. К такому классу относятся тиол-специфические антиоксиданты или пероксиредоксины, которые способны нейтрализовать как органические, так и неорганические соединения в широком диапазоне их концентрации (Chae H.Z. et al., 1994; McGonigle S. et al., 1998). Из экспериментов in vitro известно, что многие из пероксиредоксинов участвуют в процессе пролиферации клеток (Prosperi M.T. et al., 1993; Pesenko I.V. et al., 1998; Novoselov S.V. et al., 1999).
Известны публикации, в которых изучалась роль пероксиредоксинов в клетках при дисфункциях вызванных: артеросклерозом (Butterfield L.H., 1999), раком (Chung Y.M. et al., 2001; Kinnula V.L. et al., 2002), нервными заболеваниями (Kirn S.H. et al., 2001), болезнями легких (Das K.C. et al., 2001; Kim H.S. et al., 2002), болезнями почек (Fujii Т., 2001) болезнями кожи (Lee S.C. et al., 2000), ионизирующей радиацией (Park S.H. et al., 2000).
На основании гомологии аминокислотных последовательностей и иммунологического сродства все известные к настоящему времени пероксиредоксины млекопитающих могут быть классифицированы в следующие группы: Prx I-Prx IV, Prx V и Prx VI. Гомология белков, относящихся к одной и той же группе, составляет более 90%. Пероксиредоксины Prx I-Prx V принадлежат к группе 2-Cys тиол-специфических антиоксидантов. Группа Prx VI, самая малочисленная, представлена 1-Cys пероксиредоксинами, сильно отличается от других групп и имеет только 20-40% общих аминокислотных последовательностей с пероксиредоксинами других групп.
Семейство пероксиредоксинов отличается высокой консервативностью, и его представители обнаружены в геномах практически всех живых организмов от бактерий до человека. Согласно данным иммуногистохимических исследований, полученных с помощью световой микроскопии и in situ гибридизации, пероксиредоксин Prx VI обнаруживается практически во всех тканях животного. Однако его максимальная концентрация выявлена преимущественно в тканях, непосредственно контактирующих с атмосферой, а именно: в обонятельном эпителии, трахее, бронхах легких, эпидермисе кожи и волосяных фоликулах (Novoselov S.V et al., 1999). Иммуногистохимические исследования с помощью электронной микроскопии показали, что Prx VI является единственным идентифицированным к настоящему времени секреторным пероксиредоксином. Он синтезируется в специализированных клетках (бокаловидные клетки респираторного эпителия и опорные клетки обонятельного эпителия) и секретируется в слизь, покрывающей клетки этих эпителиальных тканей. Прямыми биохимическими и иммунологическими исследованиями на крысе было показано, что в трахее, бронхах легких и обонятельном эпителии вклад 28-кДа Prx VI в нейтрализацию активных форм кислорода составляет 70-80%. Аналогичные результаты были получены для трахеи и бронхов человека. Например, в составе слизи эпителия трахеи концентрация Prx VI составляет не менее 15 мкг/мг белка.
Известен способ лечения, основанный на повышении уровня пероксиредоксина в клетке с помощью генной терапии. Для этой цели используют вектор, созданный генно-инженерным способом, с помощью которого трансформируют клетки животных. В состав вектора введен ген, кодирующий последовательность пероксиредоксина, выделенного из гельминтов (Chandrashekar R. et al., US Patent 6352836, 2002). Одновременно с применением вектора авторы предлагают дополнительно использовать белок в качестве средства для стимуляции иммунной системы животных. Следует отметить, что применение генотерапии для лечения млекопитающих не получило быстрого развития из-за дороговизны и выявления большого числа побочных эффектов.
Известны исследования по выделению натурального пероксиредоксина (Prx VI) из обонятельных органов крыс и последующего применения выделенного препарата для воздействия на химический ожог органов дыхания крыс (Novoselov V.I. et al., 2000).
Недостатком способа выделения препарата из обонятельных органов является невозможность его применения при получении натурального пероксиредоксина человека в препаративных количествах.
Известен способ для лечения вирусных заболеваний, в том числе СПИДа (HIV-1), в котором в качестве основного компонента лекарственного средства используют натуральные и рекомбинантные пероксиредоксины, имеющие протеазную активность (Walker B.D., Lynn R.G. PCT appl. WO 02077294, 2002). Авторы обнаружили противовирусные свойства пероксиредоксинов по защите клеточных мембран от проникновения вирусов в клетку при введении разовой дозы от 100 до 1000 мг пероксиредоксина в зависимости от веса пациента.
Задачей настоящего изобретения является расширение спектра эффективных фармакологических композиций и повышение их эффективности для лечения и предотвращения болезней, связанных с гиперпродукцией свободных радикалов, вызываемых экзогенными и эндогенными факторами.
Сущность изобретения
Предметом настоящего изобретения является фармацевтическая композиция для антиоксидантной защиты клеток, тканей и организма в целом от гиперпродукции свободных радикалов при остром воспалении, химических, термических и радиационных поражениях, которая в качестве основного действующего вещества содержит эффективное количество пероксиредоксина Prx VI и дигидролипоевой кислоты и фармацевтически приемлемые добавки. При этом соотношение между пероксиредксином Prx VI и дигидролипоевой кислотой находится в интервале (w/w) от 1:1 до 50:1.
Другим объектом изобретения является способ профилактики и лечения, в соответствии с которым доставку композиции в межклеточное пространство ткани, органа или организма в целом осуществляют либо посредством пассивной или активной диффузии при аппликациях или распылении, либо за счет доставки с помощью инъекций в кровь, лимфу, спинно-мозговую жидкость.
Для доставки используют парентральное или эндолюмбальное введение с помощью инъекции или используют парентральное введение с помощью инфузий, ингаляций, введение в дренаж, или используют сублингвальный, вагинальный, ректальный ввод, или используют капли в нос или глаза.
Дополнительно используют терапевтический агент, который применяют одновременно, предварительно или после применения композиции, включающей пероксиредоксин Prx VI и дигидролипоевую кислоту.
Перечень фигур
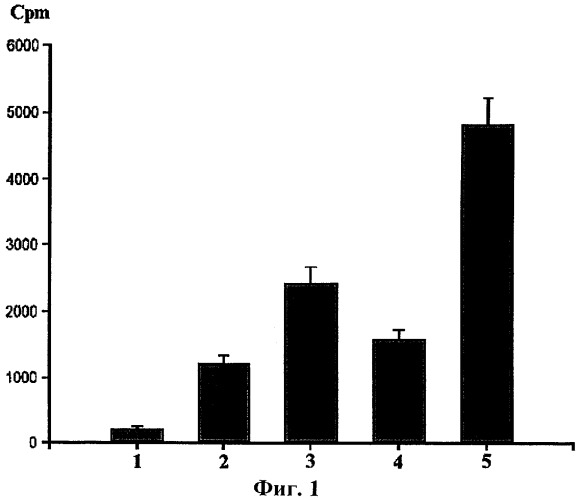
Фиг.1. Включение 3H-тимидина в стимулированные конканавалином А лимфоциты мыши в присутствии Prx VI. Где: 1 - среда, 2 - Т-клетки без стимуляции конканавалином А, 3 - Т-клетки, стимулированные конканавалином А, 4 - Т-клетки в присутствии Prx VI, 5 - Т-клетки, стимулированные конканавалином А в присутствии Prx VI.
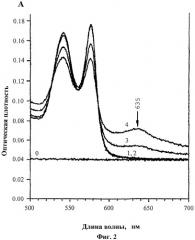
Фиг.2. Влияние Prx VI на спектральные характеристики облученного оксигемоглобина. Где: 1 - оксигемоглобин; 2 - оксигемоглобин после гамма-облучения в присутствии 0,05 мг/мл Prx VI; 3 - оксигемоглобин после гамма-облучения в присутствии 0,01 мг/мл Prx VI; 4 - оксигемоглобин после гамма-облучения. Видно, что при концентрации 0,05 мг/мл Prx VI полностью предотвращает превращение оксигемоглобина в метгемоглобин.
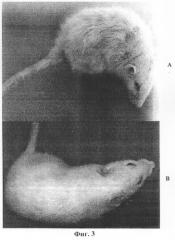
Фиг.3. Внешний вид крыс через 12 месяцев после гамма-облучения (600 рентген). Где: А - контроль; В - крыса с введенным перед облучением Prx VI.
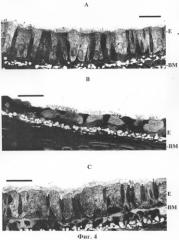
Фиг.4. Эпителий трахеи крысы после ожога парами соляной кислоты и последующей аппликации натурального крысиного или рекомбинантного человеческого Prx VI. Аппликация проводилась через 1 час после ожога. Где: А - контроль; В - эпителий через сутки после химического ожога; С - эпителий через сутки после химического ожога с аппликацией Prx VI через час после ожога; Е - эпителий трахеи; ВМ - базальная мембрана. Наблюдается практически полное сохранение всех клеток эпителия.
Фиг.5. Восстановленный клеточный эпителий трахеи крысы через 14 дней после ожога парами соляной кислоты. Где: А - контроль; В - эпителий через 14 суток после химического ожога; С - эпителий через 14 суток после химического ожога с аппликацией Prx VI, Е - эпителий трахеи; ВМ - базальная мембрана, F - фагоциты. Терапию проводили через сутки после ожога в течение 5 дней. Аппликацию раствора фармацевтической композиции на основе рекомбинантного человеческого Prx VI проводили один раз в сутки.
Фиг.6. Эпителий трахеи крысы после аппликации липополисахарида. Где: А - норма; В - через час после аппликации; С - через 3 часа после аппликации; Е - эпителий трахеи; ВМ - базальная мембрана; F - фагоциты. Наблюдается значительная гибель клеток эпителия и появление большого количества фагоцитирующих клеток.
Фиг.7. Эпителий трахеи крысы после аппликации в нее липополисахарида и последующей аппликации рекомбинантного человеческого Prx VI. Где: Е - эпителий трахеи; ВМ - базальная мембрана; F - фагоциты. Аппликация Prx VI проводилась сразу после аппликации липополисахарида.
Фиг.8. Сравнительные характеристики активации пероксиредоксина Prx VI разными тиолами. Антиоксидантная активность определялясь по степени защиты глутаминсинтетазы против металл-катализируемой окислительной системы. Степень активации пероксиредоксина Prx VI определялась в молярной концентрации, при которой происходила 50% защита глутаминсинтетазы. Типы тиолов: 1 - дитиотрейтол; 2 - дигидролипоевая кислота, 3 - липоевая кислота.
Фиг.9. Эффект аппликации Prx VI на рану, где а) контроль, б), в), г) - концентрация пероксиредоксина составляет соответственно: 1,0; 0,1; 0,2 мг/мл.
Фиг.10. Эффект аппликации дигидролипоевой кислоты на рану, где а) контроль, б), в), г) - концентрация дигидролипоевой кислоты составляет соответственно: 1,0; 0,5; 0,1 мг/мл.
Фиг.11. Эффект аппликации пероксиредоксина Prx VI и дигидролипоевой кислоты, где а) контроль, б), в), г) - варианты, при которых соотношение между постоянной концентрацией пероксиредоксина, (1,0 мг/мл) и изменяемой концентрацией дигидролипоевой кислоты составляет: 20:1; 2:1; 5:1 соответственно.
Описание изобретения
Отмечая важную роль синтеза пероксиредоксинов в клетках в ответ на оксидантный стресс, авторы известных публикаций предлагали повышать содержание разных типов пероксиредоксинов в самой клетке.
В процессе экспериментов по моделированию экзогенных и эндогенных воздействий на организм животных обнаружен неочевидный факт, связанный с тем, что доставка в межклеточное пространство ткани, органа или организма млекопитающего водорастворимого антиоксиданта пероксиредоксина Prx VI и активатора в виде дигидролипоевой кислоты, приводит к высокой эффективности профилактики и/или лечения большой группы заболеваний вызванных гиперпродукцией свободных радикалов.
Этот факт дает возможность осуществить заявленный технический результат, связанный с расширением спектра эффективных фармакологических композиций для лечения и предотвращения болезней, вызываемых экзогенными и эндогенными факторами.
Другой заявленный технический результат изобретения, относящийся к повышению эффективности профилактики и/или лечения, достигается тем, что введение в состав композиции пероксиредоксина PrxVI и дигидролипоевой кислоты приводит не к аддитивному, а к неочевидному, синергетическому эффекту взаимодействия антиоксидантов в межклеточном пространстве. Результаты экспериментов по применению разных вариантов композиций (с разным соотношением концентраций между пероксиредоксином и дигидролипоевой кислотой, в интервале (w/w) от 1:1 до 50:1) для лечения ран, показали, что синергетический эффект от одновременного воздействия на межклеточное пространство пероксиредоксина Prx VI и дигидролипоевой кислоты позволяет повысить эффективность антиоксидантной защиты млекопитающих. При этом дополнительно осуществляется возможность предупреждения развития вторичных альтеративных нарушений при химических и термических ожогах и от воздействия облучения.
Повышение антиоксидантной защиты млекопитающих от гиперпродукции свободных радикалов вызванной экзогенными и/или эндогенными факторами.
Многофункциональность применения пероксиредоксина Prx VI и дигидролипоевой кислоты как компонентов эффективных композиций для профилактики и лечения болезней, связанных с гиперпродукцией свободных радикалов, подтверждена примерами профилактики и лечения заболеваний млекопитающих. Заболевания могут быть вызваны как экзогенными, так и эндогенными факторами, входящими в группу: а) ионизирующей радиации, б) химического ожога, в) острого воспалительного процесса, г) раны. Приведенные примеры включают, но не ограничивают других применений пероксиредоксина Prx VI и дигидролипоевой кислоты для профилактики и/или лечения.
В общем случае способ повышения антиоксидантной защиты млекопитающих от гиперпродукции свободных радикалов в тканях или органах или во всем организме млекопитающих, заключается в доставке активного начала фармацевтической композиции включающей пероксиредоксин Prx VI и дигидролипоевую кислоту, а также фармацевтически приемлемые добавки в межклеточное пространство тканей, органов или в организм млекопитающего в целом.
Предлагаемый способ относится к разным вариантам профилактики или лечения тканей, органов или всего организма млекопитающих в целом, включая:
А) профилактическую защиту организма, отдельных органов и отдельных зон нормальной ткани от гиперпродукции свободных радикалов. Возникновение гиперпродукции радикалов вызывается: а) ионизирующей радиацией, например, при проведении лечения рака, или при полетах на больших высотах и в космическом пространстве, б) действием термического и/или химического ожогов при ликвидации катастроф и пожаров, в) комбинацией факторов по п. а), б).
Б) защиту тканей, органов и организма млекопитающих, в которых за счет эндогенных или экзогенных факторов идет воспалительный и/или иммунный процесс, связанный с гиперпродукцией свободных радикалов. Гиперпродукция радикалов сопутствует или вносит основной вклад в процесс болезней легких, печени, почек, желудочно-кишечного тракта, иммунной системы, нервной системы, болезни глаз, воспалительных процессов, вызванных бактериальной или вирусной инфекциями, или защиту клеток организма при предотвращении последствий химиотерапии при лечении рака, лейкоза, СПИДА, или защиту от действия озона или других экзогенных факторов.
В) защиту органов, предназначенных для трансплантации, или для улучшения возможности криоконсервации.
Д) защиту органов от воспалительных процессов, вызванных механическими повреждениями кожи и ткани в результате травм, инъекций лекарственных препаратов или хирургических операций.
В зависимости от вида терапии или профилактики определяют длительность применения и дозовые характеристики лекарственных препаратов, содержащих состав композиции. Для уточнения значения дозовых характеристик можно измерять концентрацию пероксиредоксина Prx VI в биологических пробах (см. пример 8). Исходя из тяжести воспалительного процесса определяют минимально эффективное количество фармацевтической композиции и проводят лечение. Возможно применение композиции с профилактической целью.
Процедуру лечения выбирают из группы: а) однократной или многократной аппликации или распыления раствора фармацевтической композиции или лекарства на пораженный участок; б) однократных или многократных инъекций раствора фармацевтической композиции; в) однократного или многократного приема таблетированных, порошковых или жидких форм сублингвально, или в виде присыпок, паст, свечей, мазей, гелей для нанесения на поверхность кожи и эпителия, или за счет комбинации указанных способов.
В процессе этиотропной терапии ввод лекарств, содержащих пероксиредоксин Prx VI и дигидролипоевую кислоту, осуществляют через капельницу в течение периода вывода из организма ядов или других экзогенных веществ. Наиболее предпочтительно применение композиций и лекарств, содержащих пероксиредоксин Prx VI и дигидролипоевую кислоту, для проведения комплексных терапий. В последнее время в связи с широким распространением сердечно-сосудистых заболеваний, иммунной системы, лечением СПИД, алкогольной и наркологической зависимости препараты на основе пероксиредоксина Prx VI и дигидролипоевой кислоты можно использовать в поддерживающей терапии наряду с другими препаратами длительного применения.
Доставку композиции в межклеточное пространство ткани, органа или организма можно осуществить различными способами. Поскольку пероксиредоксин подвержен расщеплению и потере биологической активности при прохождении через желудочно-кишечный тракт, основным способом введения является парентральный метод. При парентральном введении используют инъекции, инфузии, ингаляции, введение в дренаж. Раствор для инъекций вводят внутримышечно, внутривенно в кровь, лимфу, спинно-мозговую жидкость, ударными дозами или длительными инфузиями, внутриартериально; интратекально, интравентрикулярно, эндолюмбально. Возможно использовать раствор, порошок или таблетированные формы сублингвально. В ряде случаев требуется вагинальный и ректальный ввод препаратов. Возможно введение композиции с помощью капель в нос или глаз или с помощью промывания или клизм.
Способы доставки композиции к месту воспаления эпителиальных тканей, приведенные в данном описании, не ограничивают применения других известных способов доставки биологически активных полипептидов к месту воспаления или поражения.
Например, при лечении воспалительных процессов верхних дыхательных путей композицию, содержащую пероксиредоксин Prx VI и дигидролипоевую кислоту, вводят в нос, и/или в трахею, и/или в бронхи легкого. Для аппликации используют или раствор композиции, или предварительно раствор распыляют, превращая его в воздушно-капельную смесь. Возможно применение композиции, выполненной в виде сухого мелкодисперсионного порошка, или композиции, которая иммобилизована в мелкодисперсные гранулы или наночастицы диаметром от 0.1 до 7000 нм (например, Esenaliev, 2000), или композиции иммобилизованной в липосомы (например, Thibeault D.W.et al., 1991).
При лечении поражений кожи композицию наносят тонким слоем и/или делают аппликацию на место поражения. Способы доставки композиции к месту воспаления эпителиальных тканей, приведенные в данном описании, не ограничивают применения других известных способов доставки биологически активных полипептидов к месту воспаления или поражения.
Пероксиредоксин Prx VI и дигидролипоевую кислоту как радиопротектор можно использовать в качестве компонента лекарств и фармацевтических композиций для профилактики или лечения широкого спектра заболеваний. Заболевания могут быть вызваны: а) ионизирующей радиацией (в первую очередь при радиотерапии, профилактических исследованиях, при работе персонала с источниками радиации); б) космической радиацией, влияющей в первую очередь на космонавтов и пилотов; в) радионуклеотидным заражением из-за приема зараженной радионуклеотидами пищи, воды или воздуха; г) воздействием неионизирующей радиации, например при томографическом исследовании; д) воздействием на организм источников ультрафиолетового излучения (солнечный свет, сварка, импульсные источники света, дисплеи). Для предотвращения или снижения действия гиперпродукции свободных радикалов возможно применение антидотов, которые содержат пероксиредоксины. Состав антидотов должен быть ориентирован на тот тип экзогенного воздействия, который существует в зоне, в которой необходимо осуществлять работы по ремонту оборудования, или устранения аварий, или устранения последствий катастроф.
При профилактике или лечении заболеваний, связанных с ионизирующим или неионизирующим воздействием на организм млекопитающего, эффективное количество пероксиредоксина Prx VI и дигидролипоевой кислоты выбирают в зависимости от интенсивности ионизирующего или неионизирующего воздействия, учитывая параметры млекопитающего (его вес, возраст, состояние организма). В процессе лечения или профилактики выбранный состав композиции вводят однократно или многократно до воздействия, во время воздействия или после воздействия организма с радиацией или неионизирующим излучением.
Для антиоксидантной защиты клеток, тканей и организма в целом от воздействия нескольких факторов, (например, от действия ионизирующей радиации, и/или термического и/или химического ожога, и/или от заражения организма радионуклеидами через пищу, воду или воздух), используют комбинированный способ применения композиций, который состоит из внутривенных инъекций и дополнительных аппликаций на место поражения, что позволяет снизить токсикацию организма и предотвратить процесс неконтролируемой гибели клеток.
Фармацевтическая композиция
Известны способы получения натурального и рекомбинантного пероксиредоксинов. В рамках настоящего изобретения натуральный Prx VI выделяли из органов млекопитающих (Pesenko I.V. et al., 1998). Рекомбинантный белок можно получить, используя различные экспрессионные системы (Sang W.К. et al., 1998; Chen J.W. et al., 2000; Peshenko I.V. et al., 2001). Варианты получения натурального и рекомбинантного Prx VI с помощью известных способов приведены в разделе материалы и способы (примеры 1-2).
Первичная структура Prx VI крысы (Андреева С.Г. и др., 1998) содержит 223 аминокислоты с рассчитанной молекулярной массой 24630 Да. (EMBL/GenBank, Y17295). Ген, кодирующий Prx VI человека (Nagase Т. et al., 1995), выделен из клеток миелобласта (EMB/GenBank D1 4662). По данным электрофореза в присутствии додецилсульфата натрия молекулярный вес определен как 28 кДа.
Синтезированный рекомбинантный Prx VI (см. пример 2) сравнивали с натуральным Prx VI крысы, который выделяли из обонятельного эпителия крысы линии Вистар (см. пример 1).
Результаты испытаний (см. пример 3) показали, что рекомбинантный Prx VI имеет антиоксидантные характеристики, близкие характеристикам Prx VI, который выделен из обонятельного эпителия крысы.
В фармацевтической композиции возможно использовать другие типы пероксиредоксинов (Prx I-Prx IV) поскольку распределение концентраций разных типов пероксиредоксинов различно в зависимости от типа ткани или органа (Knoops В. et al., 1999). Предпочтительно использовать рекомбинантный человеческий пероксиредоксин типа Prx VI, который обладает более сильными антиоксидантными характеристиками по сравнению с I-V типами пероксиредоксинов.
Для лечения воспалительных процессов минимальную концентрацию пероксиредоксина Prx VI в составе композиции определяют, во-первых, исходя из эффективной концентрации пероксиредоксина Prx VI при защите биомакромолекул от активных форм кислорода in vitro и, во-вторых, исходя из концентрации пероксиредоксина Prx VI в ткани в норме.
В зависимости от тяжести воспалительного процесса и выбранного способа лечения концентрация пероксиредоксина Prx VI в жидкой форме фармацевтической композиции может выбираться от 0.01 до 10.0 мг/мл.
Например, в случае поражения органов дыхания крысы раствором липополисахарида и в случае химического ожога эмпирически полученная концентрация пероксиредоксина Prx VI в составе композиции составила 0.5-1.0 мг/мл при аппликации 20-50 мкл его раствора непосредственно в трахею, что соответствовало от 10 до 50 мкг пероксиредоксина Prx VI на крысу. Учитывая площадь поверхности трахеи крысы, это соответствует аппликации 5-10 мкг пероксиредоксина Prx VI на 1 см2 пораженной ткани. Это количество пероксиредоксина Prx VI может быть использовано при аппликации на пораженную ткань для любого млекопитающего, включая человека.
В случае применения пероксиредоксина Prx VI и дигидролипоевой кислоты в качестве радиопротектора количество пероксиредоксина Prx VI, вводимого в организм перед облучением, может выбираться от 1 до 10 мг/кг веса животного и зависит от мощности излучения. В случае сублетальной дозы гамма-облучения эмпирически полученное количество пероксиредоксина Prx VI составило 2-5 мг/кг веса животного при инъекции 1 мл его раствора в вену. Это количество пероксиредоксина Prx VI может быть использовано при введении для любого млекопитающего, включая человека.
Так как пероксиредоксин Prx VI является хорошо растворимым белком, в качестве растворителей для создания композиций могут быть использованы водные растворы, физ. раствор, раствор Рингера и другие сбалансированные солевые растворы (Dawson R.M., 1986), а также растворы на основе моно- или полисахаридов, например глюкозы, и/или содержащие витамины. Эти же растворители могут быть использованы при создании композиции в воздушно-капельной форме, например в форме спрея.
В процессе экспериментов по моделированию экзогенных и эндогенных воздействий на организм животных исследовались различные типы активаторов. Классическим активатором пероксиредоксинов является дитиотрейтол (Novoselov S.V. et al., 1999). Однако ввиду его токсичности применение его в лекарственных формах исключается. Одним из естественных активаторов пероксиредоксина VI является дигидролипоевая кислота, которая нетоксична и может быть получена восстановлением S-S связи широко используемой в медицине альфа-липоевой кислоты (1,2-дитиолан-3-пентановая кислота) (Sang W.К. et al., 1998). Дигидролипоевая кислота как активатор пероксиредоксина, исследована в работе (Peshenko I.V. Shichi H., 2001) в in vitro экспериментах. Синергетический эффект от применения дигидролипоевой кислоты в качестве активатора пероксиредоксина in vivo продемонстрирован в примере 5.
Концентрацию дигидролипоевой кислоты в жидкой форме композиции выбирают в пределах от 0.01 до 10 мг/мл в зависимости от концентрации пероксиредоксина (см. фиг.9). Отношение пероксиредоксина к дигидролипоевой кислоте (w/w) составляет от 1:1 до 50:1.
Жидкая форма композиции:
а) для внутривенного введения содержит от 0,01 до 0,5% (от 0,1 до 5 мг/мл), предпочтительно от 0,01 до 0,1% (от 0,1 до 1 мг/мл), основного действующего вещества пероксиредоксина и дигидролипоевой кислоты;
б) для обработки раневых поверхностей содержит от 0,1 до 1,0% (от 1 до 10 мг/мл) основного действующего вещества пероксиредоксина и дигидролипоевой кислоты;
в) для глазных капель содержит от 0,1 до 0,3% (от 1 до 3 мг/мл) основного действующего вещества;
При создании жидких сред используют растворитель, выбираемый из группы: а) сбалансированного солевого раствора, б) сбалансированного солевого раствора и активатора пероксиредоксина в концентрации от 0,01% до 1,0% (w/w).
Мазевая форма или форма для суппозитарного введения (свечи для ректального или для интравагинального введения) содержит от 0,1 до 1,0 мас.% основных действующих веществ пероксиредоксина и дигидролипоевой кислоты.
Концентрация пероксиредоксина в составе порошка составляет от 0,1 до 90 мас.%. В таблетированной форме, которую используют сублингвально, концентрация пероксиредоксина может составлять от 0,01 до 1,0 мас.%.
При создании лиофилизированных форм в качестве стабилизаторов используют один или более: моно- или полисахариды или сахарные спирты, аминокислоты, низкомолекулярные белки, которые используют для стабилизации и последующей лиофилизации композиции.
Лиофилизированные формы могут быть использованы для приготовления жидких форм композиции и порошков выбираемых из группы: порошок для приготовления инъекционных, инфузионных растворов, порошок для ингаляций, порошок для применения в мазях, гелях, суспензиях, порошок для приготовления таблетированных форм. Концентрация активного начала пероксиредоксина в лиофилизированных формах может составлять от 10,0 до 90,0 мас.%.
Возможно применение композиции, включающей пероксиредоксин и активатор, совместно с по крайней мере, одним терапевтическим агентом широкого спектра действия.
Терапевтический агент выбирают из группы, состоящей из: а) антибактериальных, антивирусных, антигрибных, антигистаминных препаратов, гормонов, витаминов, цитокинов; б) высокомолекулярных ферментов, которые обеспечивают дополнительную защиту от свободных радикалов (супероксиддисмутаза, каталаза, глутатионпероксидаза);
в) низкомолекулярных соединений, обеспечивающих дополнительное снижение уровня свободных радикалов внутри клетки (токоферол глютатион, убихинон); г) препаратов, используемых для трансплантации или криоконсервации органов; д) биологически активных белков, например инсулина.
Терапевтический агент, применяемый совместно с пероксиредоксином, не должен ингибировать биологическую активность пероксиредоксина как фермента.
При генерализации воспалительного процесса (например, при возникновении сепсиса) с вовлечением нескольких органов и/или систем рекомендуется проводить комбинированную терапию и использовать антибиотики и/или глюкокортикоиды в комбинации с применением пероксиредоксина и активатора.
Представленные формы композиции и способы ее применения не ограничивают других вариантов, которые известны из области медицины или ветеринарии при применении антиоксидантной терапии. Вариации, вытекающие из данного изобретения и очевидные каждому специалисту, имеющему средний уровень знаний в данной области, должны рассматриваться в рамках предлагаемого изобретения.
1. Материалы и способы для получения пероксиредоксина и исследования его свойств.
Известно несколько способов получения пероксиредоксинов, В рамках настоящего изобретения пероксиредоксин выделяли из органов млекопитающих (Pesenko I.V. et al. 1998), или получали рекомбинантный белок, используя различные экспрессионные системы (Sang Won Kang et al. 1998, Chen J.W. et al. 2000).
Пример 1. Получение натурального Prx VI пероксиредоксина крысы
Получение натурального Prx VI пероксиредоксина крысы проводили по следующей процедуре. Натуральный Prx VI пероксиредоксин крысы выделяли из обонятельного эпителия крысы линии Вистар, который содержит максимальное количество этого белка. Изолированный обонятельный эпителий дважды промывали в физиологическом растворе и гомогенизировали в нем же. Гомогенат центрифугировали 5 мин при 500g, супернатант повторно дважды центрифугировали при 20000g и диализовали в течение 12 часов против раствора А, в состав которого входит: 12 мМ Трис/HCl, рН 7.8, 1 мМ MgCl2, 1 мМ дитиотреитола. После диализа экстракт наносили на хроматографическую колонку (305×12.5 мм), заполненную гелем ДЭАЭ-сефарозой (DEAE-Sepharose, Pharmacia) и предварительно уравновешенную раствором А. Белки элюировали при линейном изменении градиента NaCl от 0 мМ до 500 мМ в растворе А при 17°С. Объем раствора составлял 750 мл, скорость элюции 0.7 мл/мин. Фракции анализировали по антиоксидантной активности. Фракции, содержащие Prx VI пероксиредоксин, концентрировали и затем хроматографировали на колонке, заполненной гелем Sephacryl S-200 (820×16 мм). Колонку элюировали буфером Б: 25 мМ Трис/HCl, рН 7.8, 100 мМ NaCl, 1 мМ MgCl2, 1 мМ дитиотреитол. Скорость элюции - 0.6 мл/мин при 4°C. Фракции, содержащие Prx VI пероксиредоксин, собирали, концентрировали, диализовали против физиологического раствора и использовали в дальнейших экспериментах.
Пример 2. Получение человеческого рекомбинантного Prx VI пероксиредоксина
Человеческий рекомбинантный Prx VI пероксиредоксин получали следующим образом. Комплементарная ДНК, кодирующая человеческий Prx VI пероксиредоксин, была выделена из клона НА0683 (Nagase Т. et al., 1995) (GenBank, D 14662) известными методами. Затем ДНК была клонирована в экспрессионную плазмиду рЕТ-23а (+) фирмы Novagen no сайтам рестрикции NdeI и EcoRI, с помощью рестрикционных ферментов фирмы MBI Fermentas. Полученную плазмиду использовали для трансформации клеток E.coli (штамм BL 21 (DE3), из библиотеки штаммов ИБФМ РАН) для получения рекомбинантного человеческого Prx VI пероксиредоксина. Клетки E.coli, экспрессирующие пероксиредоксин, разрушали ультразвуком на генераторе УЗДН-2 при частоте 22 кГц в течение пяти минут при 0°С. Гомогенат центрифугировали 5 мин при 500 g, супернатант повторно дважды центрифугировали при 20000 g и диализовали в течение 12 часов против раствора А (см. пример 2). Рекомбинантный Prx VI пероксиредоксин выделяли по методу выделения натурального крысиного Prx VI пероксиредоксина (см. пример 1).
Пример 3. Сравнительные характеристики крысиного натурального и человеческого рекомбинантного натурального пероксиредоксинов Prx VI.
Рекомбинантный человеческий пероксиредоксин Prx VI (GenBank, D 14662) сравнивают по фактору антиоксидантной активности с натуральным крысиным пероксиредоксином Prx VI (EMBL/GenBank, Y 17295). Для определения активности пероксиредоксина Ргх VI используют его способность защищать глутаминсинтетазу против ДТТ/Fe+3/О2 окислительной системы. Инкубационную смесь объемом 60 мкл, которая содержит 5 мкг глутаминсинтетазы, 3 мМ ДТТ, 3 мкМ Fe3+, 50 мМ HEPES, рН 7.3, инкубируют 10 мин при 37°С. В качестве активатора Prx VI пероксиредоксина используют дигидролипоевую кислоту в концентрации 3 мМ. Остаточную активность глутаминсинтетазы определяют приливанием к пробе 200 мкл реакционной смеси, которая содержит: АДФ - 0.4 мМ, глутамин - 150 мМ, K-AsO4 - 10 мМ, NH2OH - 20 мМ, MnCl2 - 0.4 мМ, HEPES - 100 мМ рН 7.4. После инкубации в течение 10 мин при 37°С, к пробе приливают 100 мкл красителя. В состав красителя входит: 5,5 г FeCl3·6Н2О, 2 г ТХУ, 2.1 мл конц. HCl (38%) на 100 мл Н2О. Степень активности пероксиредоксина определяют по значению концентрации белка, при которой наблюдалось 50% сохранение активности глутаминсинтетазы. Рекомбинантный пероксиредоксин Prx VI имеет антиоксидантные характеристики, близкие к натуральному крысиному пероксиредоксину Prx VI. В дальнейшем человеческий рекомбинантный пероксиредоксин Prx VI используют для отработки способов лечения или в качестве компонента фармацевтических композиций.
Пример 4. Определение цитотоксичности пероксиредоксина Prx VI
Цитотоксичность пероксиредоксинов определяют по влиянию Prx VI пероксиредоксина на уровень пролиферации клеток линии L929 лимфобластомы человека и Т-лимфоцитов из селезенки мышей линии NRRI, стимулированных конканавалином А.
Клетки двух линий с концентрацией 104 клеток/мл среды культивировали в среде RPMI 1640, содержащей 5% бычьей эмбриональной сыворотки. Стимуляцию Т-лимфоцитов проводили при концентрации конканавалина А 0.1 мкг/мл. В случае Т-лимфоцитов уровень пролиферации определяли по включению 3H-тимидина. Количество живых клеток линии L929 определяли в 96-луночной плашке с помощью красителя тренанового с последующим сканированием на многоканальном фотометре Мультискан (LKB, Швеция).
Натуральный крысиный и рекомбинантный человеческий Prx VI пероксиредоксины (в концентрации 0,1-10 мг/мл) не оказали никакого влияния на количество живых клеток линии L929.
В случае Т-лимфоцитов, стимулированных конканавалином А, уровень пролиферации клеток увеличивался примерно в 2 раза в присутствии натурального крысиного или рекомбинантного человеческого Prx VI пероксиредоксина (в концентрации 0.1-1.0 мг/мл) по сравнению с просто стимулированными конканавалином А клетками (см фиг.1). Таким образом, можно сделать вывод о том, что тестированные соединения являются малотоксичными.
Пример 5. Сравнительные характеристики активаторов пероксиредоксина.
Для определения эффективности активации Prx VI дитиотреитолом и дигидролипоевой кислотой (натуральный активатор) использовалась способность пероксиредоксина защищать глутаминсинтетазу от инактивации, вызванной металл-катализируемой окислительной системой. Инкубационная смесь объемом 60 мкл содержала 5 мкг глутаминсинтетазы, 50 мкг Prx VI, 3 мМ аскорбиновой кислоты, 3 мкМ Fe+3, 50 мМ HEPES, рН 7.3 и дитиотреитол или дигидролипоевую кислоту разных концентраций, инкубировалась 10 мин при 37°С. Остаточную активность глутаминсинтетазы определяли приливанием к пробе 200 мкл реакционной смеси (АДФ - 0.4 мМ, глугамин - 150 мМ, K-AsO4 - 10 мМ, NH2OH - 20 мМ, MnCl2 - 0.4 мМ, HEPES - 100 мМ, рН 7.4). После инкубации в течение 10 мин при 37°С, к пробе приливали 100 мкл красителя. В состав красителя входит 5,5 г FeCl3·6Н2О, 2 г ТХУ, 2.1 мл конц. HCl (38%) на 100 мл Н2О. Степень активности п