Комплекс фолиевой кислоты или производного фолиевой кислоты, фармацевтическая композиция и применение комплекса
Иллюстрации
Показать всеОписан комплекс фолиевой кислоты или производного фолиевой кислоты, характеризующийся тем, что он отвечает общей формуле (X)n-Y, в которой Х имеет одинаковые или различные значения и выбирается из группы, состоящей из фолиевой кислоты, фолиновой кислоты, дигидрофолиевой кислоты, тетрагидрофолиевой кислоты, тетрагидроптерина, птероил-полиглютаминовой кислоты, 2-деаминогидроксифолиевой кислоты, 1-денитрофолиевой кислоты, 3-денитрофолиевой кислоты, 8-денитрофолиевой кислоты; Y представляет собой полисахарид, отличный от арабиногалактана, выбранный из группы, состоящей из глюканов, декстранов, полисахароз, фруктозанов, гетерополисахаридов, сульфатов гомо- или гетерополисахаридов, полисахарида пектина женьшеня и других пектиновых полисахаридов, трагакантовой камеди, камеди гхатти (gumghatti), альгината, гомо- или гетерогликуронат-полисахаридов, или Y выбран из полиэтиленоксида, метоксиполиэтиленгликоля и гидрофильных спиртовых полимеров; n≥1, причем указанный комплекс фолиевой кислоты или производного фолиевой кислоты проникает в клетку по пути с участием рецептора фолиевой кислоты на клеточной мембране. Комплекс фолиевой кислоты или производного фолиевой кислоты используют для получения лекарственных средств, обладающих противоопухолевой активностью. 3 н. и 7 з.п. ф-лы, 9 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к комплексам фолиевой кислоты с полисахаридами и способу их получения, главным образом, изобретение относится к декстрановым комплексам фолиевой кислоты, способу их получения, фармацевтическим композициям, содержащим указанные комплексы в качестве активного компонента, и применению указанной композиции в опухолевой терапии.
Уровень техники
После выдвижения концепции о существовании специфического белка, связывающего фолиевую кислоту (FBP) (Johns с сотр.: J.Clin. Invest, 1961; 40:1684), Rothenberg с сотр. впервые обнаружили FBP в клетках человеческого организма (Proc. Soc. Expl.Biol, Med, 1970; 133:428. J.Clin. Invest. 1971; 50:717), а Lesli с сотр. выделили FBP из клеточных мембран (Biochem. 1972; 11:1969). Antony с сотр. после проведения систематических исследований на клетках плаценты высказали определенные соображения о том, что FBP выполняет функции рецептора фолиевой кислоты (FR) на поверхности клеточной мембраны (J. Biol. Chem. 1981; 256(18):9684), и системно и успешно проиллюстрировали биохимические свойства FR (Blood 1992; 79(11):2807. Annu. Rev. Nutr. 1996; 16:501). FR представляет собой определенный тип FBP, якорно-закрепленный на глицерофосфатидинозите (GPI) клеточных мембран, который может отрезаться от клеточной мембраны под воздействием GPI-специфических фосфатидаз С или D (Lee с сотр.: Biochem. 1992; 31: 3236, Verma с сотр.: J. Biol. Chem. 1992; 267(6):4119). FR равномерно размещается на поверхности клеточной мембраны и, после связывания фолиевой кислотой, под воздействием инициатора может сдвигаться в область покрытых углублений или ковеол (coveolae) и вследствие этого образовывать кластеры (Mayor с сотр.: Science 1994; 264:1948), после чего, в результате эндоцитоза, фолиевая кислота переносится в клетки (Anderson с сотр.: Science 1992; 255:410).
В организме человека имеется три основные формы FR: FR-α, FR-β и FR-γ, среди которых FR-γ относится к типу секретируемого белка, экспрессированного в кроветворных клетках (Shen с сотр.: Biochem 1995; 34:5660). FR-α и FR-β также присутствуют на поверхности животных клеток, причем FR-α главным образом экспрессирован на опухолевых клетках и клетках почек, а FR-β экспрессируется на гепатоцитах. Фолиевая кислота, в определенной степени, способна оказывать влияние на сродство и плотность клеток. После предельных дозировок фолиевой кислоты сродство FR-α к фолиевой кислоте понижается, плотность FR-α увеличивается на опухолевых клетках и уменьшается на почечных клетках, тогда как рассматриваемые характеристики FR-β не подвергаются заметным изменениям (Gates с сотр.: Clin. Cancer Res. 1996; 2:1135).
Сообщения о том, что число экспрессии или активности FR на большинстве опухолевых клеток заметно выше соответствующих значений для нормальных клеток (Cambell с сотр.: Cancer Res. 1991; 51:5329. Coney с сотр.: Cancer Res. 1991; 51:6125. Weirman с сотр.: Cancer Res. 1992; 52:3396), привело к быстрому росту числа исследований по применению фолиевой кислоты в качестве среды, нацеленной на опухолевые клетки-мишени.
Результаты экспериментов по диагностике опухолей у животных показали, что комплексы фолиевой кислоты в виде RF лигандов, непосредственно или косвенно связывающие радионуклеиды, оказывают существенное влияние на область развития опухоли (Low с сотр.: WO 96/36367, 21 ноября 1996; патент США 5688488 от 18 ноября 1997 г.).
Результаты культивирования клеток в системе фолиевая кислота-ПЭГ-липосома, полученной в результате непрямого связывания фолиевой кислоты с поверхностью липосомы, показали, что указанная система фолиевая кисота-ПЭГ-липосома оказывает большее воздействие на опухолевые клетки-мишени, чем комбинация ПЭГ-липосома или обычная липосома (Lee с сотр.: J. Biol Chem. 1994; 269(5):3198. Wang с сотр.: Proc. Natl. Acad. Sci. USA, 1995; 92:3318. Lee с сотр.: Biochim. Biophys. Acta 1995; 1233:134. Vogel с сотр.: J. Am. Chem. Soc. 1996; 118(7):1581. Thompson с сотр.: WO 97/31624, 4 сентября 1997г. Lu, Yaowei с сотр.: Transaction of Shanghai University of Medical Science 2000; 27(1):4).
Комплексы фолиевая кислота-полимер способны переносить и полностью выделять указанный полимер в не-лизозомную плазму клеток через FR. Альбумин бычьей сыворотки, бычий иммунный альбумин, пероксидаза хрена, рибонуклеаза, ингибитор бобовой сериназы и олигонуклеотид анти-ДНК, будучи связанными с фолиевой кислотой, способны вводиться в KB клетки (клетки карциномы носоглотки человека), клетки Hela (клетки цервикальной карциномы человека) и ХС клетки (фибробласты, трансфецированные вирусом саркомы Rous), оказывая при этом соответствующее действие (Leamon с сотр.: Proc. Natl. Acad. Sci. USA 1991; 88:5572. Low с сотр.: WO 90/12096 от 18 октября 1990). Моноклональное антитело против рецептора Т-клетки или моноклональное антитело против Fc-рецептора, связанные с фолиевой кислотой, могут прочно связывать опухолевую клетку, Т-клетку или природную клетку-убийцу, моноциты и макрофаги друг с другом, в результате чего может реализоваться рассасывание опухолевой клетки (David с сотр.: WO 96/34630, 7 ноября 1996 г.). Более того, после связывания с фолиевой кислотой токсины (например, момордин, относящийся к классу белковых токсинов, чья цитотоксичность может проявляться лишь после прохождения через рибосому и вхождения в плазму клетки; экзотоксиновые фрагменты псевдомонады (LysPE38 и Суз РЕ35)), обладающие функцией ингибирования синтеза белка, демонстрируют существенное повышение способности к подавлению роста опухолевых клеток (Leamon с сотр.: J. Biol. Chem. 1992; 267(35):249666. 1993; 268(33):24847).
Декстран (dextran) представляет собой полимер D-глюкозы, полученный путем ферментации сахарозы в присутствии leuconastoc mesenteroidas (Gronwall с сотр.: Acta. Physiol. Scand., 1994; 7:97. 1945; 9:1. Патент США 24375518. Патент США 2644815). В различных декстранах, полученных в присутствии различных штаммов, существуют различные виды связывания гликозилов, однако основным видом связывания является связь α-1,6; меньшую роль играют связи α-1,4 и α-1,3 (Van Cleve с сотр.: J. Am. Chem. Soc. 1956; 78:4435. Xu, Danfeng с сотр.: Transactions of Pharmacology 1986; 21(3), 204). Опыты на животных и результаты клинических экспериментов показали, что после инъекции декстрана в органах испытуемых животных не наблюдается патологических изменений и повреждения ткани (Boyd с сотр.: Lancet 1953; 1:59. Gronwall с сотр.: Acta. Physiol. Scand., 1945; 9:1), и не наблюдается аккумуляции декстрана в печени, селезенке, почках, легких и других органах человеческого организма (Wilkinson с сотр.: J. Interal chir., 1951; 11:186). В клинических условиях декстран, главным образом, используют в качестве агента для увеличения объема крови (Gelin с сотр.: Acta Chir. Scand., 1961; 122:309), а также модификатора текучести крови (Gelin: Sock Pathogenesis and Therapy 1962; P332) для лечения геморрагического шока, ожогов и печеночно-почечного синдрома, острого тромбоза, тромботического окклюзивного ангиита, инфаркта миокарда, распространенного склероза и т.п.
Поскольку отличительным биологическим признаком декстрана является наличие множества гидроксильных групп, это вещество используют в качестве носителя многих лекарственных средств с целью усиления их химической стабильности или повышения биодоступности указанных лекарственных средств, либо для диагностики заболеваний лимфатической системы. Эти декстран-медикаментозные комплексы включают: декстран-сурьму (Michail с сотр.: Exptl. Parasitol., 1975; 37:348), декстран-железо (Beresford с сотр.: Brit. J. Pharmacol., 1957; 12:107), декстран-инсулин (Armstrong с сотр.: Biochim. Biophys. Res. Comm., 1972; 47:354), декстран-дауномицин (Bernsten с сотр.: J. Natl. Cancer Inst., 1978; 60(2):379), декстран-митомицин С (Kojima с сотр.: J. Pharmacol., 1980; 32:30), декстран-витамин B12 (Scrollini с сотр.: Eur. J. Med. Chem. 1974; 9:621), декстран-аметоптерин (Hubert с сотр.: ЕР 0383170 А2, декстран-α (или β)-диастаза (или трипсаза) Marshall с сотр.: Arch. Biochem. Biophys., 1975; 167:777), декстран-сульфат (Kozo Yamada с сотр.: Jap. Circul. J., 1961; 25:570, 575, 579), радиоактивный технеций (99mTc)-декстран (Henze с сотр.: J. Nucl. Med., 1982:23:923. Ercan с сотр.: Eur. J. Nucl. Mad., 1985; 11:80. Lu, Weiyao с сотр.: Transaction of Shanghai University of Medical Science 1991; 18(4):246. Liu, Yongchang с сотр.: China J. Nucl. Med., 1993; 13(3):143). Из перечисленных выше декстран-медикаментозных комплексов препараты для инъекций 99mТс-декстран 105 и олово-декстран 105, разработанные авторами изобретения и используемые для локализации пораженных болезнью участков лимфатической системы и для вспомогательной диагностики лимфатической метастазирующей опухоли, были получены и испытаны в клинических условиях.
Суммируя сказанное выше, можно заключить, что FR на поверхности опухолевой клетки является эффективным путем для введения лекарственных компонентов радионуклида, липосомы и полимера в указанную опухоль через фолиевую кислоту; декстран в течение длительного времени изучался как объект, используемый в качестве агента, увеличивающего объем крови, а также носитель радионуклида и другого лекарственного средства, однако сам декстран не проявлял антинеопластического (противоопухолевого) действия. К настоящему времени не имеется документов или патентов, относящихся к исследованию комплексов фолиевой кислоты и полисахаридов, особенно комплексов фолиевой кислоты и декстрана, и их использованию в качестве противоопухолевых агентов.
Сущность изобретения
Настоящее изобретение относится к полисахаридным комплексам фолиевой кислоты формулы X-Y, в которой Х выбирают из группы, состоящей из фолиевой кислоты, ее производных и других веществ, способных проникать в клетку по маршруту с участием рецептора фолиевой кислоты на клеточной мембране, a Y представляет собой полисахариды.
Более конкретно, настоящее изобретение относится к полисахаридному комплексу фолиевой кислоты формулы (X)n-Y, в которой Х может иметь одинаковые или различные значения и его выбирают из фолиевой кислоты, ее производных и других веществ, способных проникать в клетку по маршруту, в котором участвует рецептор фолиевой кислоты, Y представляет собой один из полисахаридов, отличных от арабиногалактана; n≥1.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанный полисахаридный комплекс фолиевой кислоты и фармацевтические адьюванты.
Кроме этого, настоящее изобретение относится к применению указанного полисахаридного комплекса фолиевой кислоты в получении лекарственных противоопухолевых средств.
С другой стороны, настоящее изобретение относится к способу лечения опухоли у пациента с положительной реакций на рецептор фолиевой кислоты, который заключается в применении эффективного количества указанного полисахаридного комплекса фолиевой кислоты на пациенте, нуждающемся в лечении.
Кроме этого, настоящее изобретение относится к полисахаридным комплексам фолиевой кислоты, используемым в качестве лекарственных средств.
Подробное описание изобретения
Настоящее изобретение предусматривает группу полисахаридных комплексов фолиевой кислоты, указанных выше. Неожиданно было установлено, что указанные комплексы не только способны проникать в клетки по маршруту с участием рецептора фолиевой кислоты, расположенного на клеточных мембранах, но также способны уничтожать опухолевые клетки in vivo и подавлять рост опухолевых тканей без повреждения нормальных клеток.
Упоминаемый в настоящем изобретении фрагмент X, относящийся к фолиевой кислоте, производным фолиевой кислоты и другим веществам, способным проникать в клетку по маршруту с участием рецептора фолиевой кислоты, не оказывает заметного токсического или побочного действия на клетки животных или человека, и его выбирают из группы, состоящей из фолиевой кислоты, фолиновой кислоты, дигидрофолиевой кислоты, тетрагидрофолиевой кислоты, тетрагидроптерина, птероилполиглютамовой кислоты, 2-деаминогидроксифолиевой кислоты, 1-денитрофолиевой кислоты, 3-денитрофолиевой кислоты, 8-денитрофолиевой кислоты и т.п., причем используемый термин «денитро» означает, что атом азота в указанном положении в молекуле фолиевой кислоты заменен на атом углерода. Предпочтительно Х представляет собой фолиевую кислоту, дигидрофолиевую кислоту или тетрагидрофолиевую кислоту, наиболее предпочтительно Х представляет собой фолиевую кислоту.
Различные типы полисахаридов Y, на которые ссылаются в настоящем изобретении, не обладают значительной и непосредственной супрессорной активностью в отношении опухолевых клеток животных или людей и не подавляют рост таких клеток, кроме этого, они не обладают свойством лиганда рецептора. Рассматриваемые полисахариды включают: (1) такие декстраны, как декстран, нигеран, пуллюлан, склерогликан, лентинан, крестин (кориолан, полистиктин), пахимаран (пахман), полисахариды гриба Cordyceps (кордицепоза), агаровые полисахариды, шизофиллан, полисахарид гриба Armilariella tabescens, полисахарид Hericium erinaceus (гриб ежовик), грибов Tremella, полисахарид гриба Neurospora crassa, полисахарид гриба-навозника Coprinus, лихенан, гетеролихенан, ламинарин, полисахарид корня Cynanchum paniculatum, полисахарид дудника Angelica, полисахарид Stephania tetrandra, полисахариды астрагала Astragalus, ламинарин, амилоза, декстрин и т.п.; (2) такие полисахарозы, как полисахароза; (3) такой фруктозан, как: полисахарид из корневища купены, полисахарид Lycoris, полисахарид ячменя и полисахарид Scilla maritime, левулозид phlean и полисахарид пырея ползучего; (4) такие гетерополисахариды, как полисахарид Cladospore, гетеропенициллиновый полисахарид, полисахарид гриба Absidia, полисахарид гриба Neurospora crassa, полисахариды гриба Ganoderma, порфиран, полисахарид корня Manyprickle acanthopanax, полисахарид коньяка, полисахарид женьшеня, полисахарид Indicalamus, полисахарид багассы, полисахарид мушмулы, полисахарид брючины глянцевой, полисахарид tabasheer, чайный полисахарид и т.п.; (5) такие сульфаты гомо- или гетерополисахаридов, как полисахарид агара, полисахарид каррагена, полисахарид гингко, водорослей, полисахарид хлореллы, фукоидин, гепарин, хондроитин сульфат и т.п.; (6) такие гомо- или гетерополисахариды альдоновых кислот, как полисахариды пектина женьшеня и другие пектиновые полисахариды, аравийская камедь, трагакантовая камедь, камедь гхатти (gumghatti), трагакант, альгинат и т.п.; а также (7) такие другие гидрофильные полимеры, как полиэтиленоксид, метоксиполиэтиленгликоль и т.п.
Согласно настоящему изобретению, предпочтительные полисахариды имеют молекулярный вес в интервале 4000-2000000.
Согласно предпочтительному воплощению, полисахарид Y представляет собой декстран, и предпочтительный молекулярный вес такого декстрана составляет 10000-2000000, более предпочтительно 10000-150000 и наиболее предпочтительно около 105000.
В приведенной выше формуле (X)n-Y n представляет собой целое число, большее или равное 1. Верхнее значение n не имеет решающего значения и определяется природой используемого полисахарида. Значение n может задаваться путем регулирования соотношения исходных материалов в реакции конденсации, предназначенной для получения рассматриваемого полисахаридного комплекса фолиевой кислоты. Специалист в данной области сумеет выбрать оптимальное значение n для конкретного полисахаридного комплекса фолиевой кислоты с использованием таких традиционных способов, как определение противоопухолевой активности указанного комплекса.
В том случае, когда в указанной выше формуле n имеет значение больше 1, Х может иметь одинаковые или различные значения. В рамках настоящего изобретения предпочтительные Х имеют идентичные значения.
Согласно настоящему изобретению, термин «полисахаридный комплекс фолиевой кислоты» обозначает свободный комплекс и его соответствующие, применимые в медицине соли. Если в молекуле рассматриваемого комплекса присутствует щелочной атом азота, то он способен образовывать соли с такими применимыми в медицине неорганическими или органическими кислотами, как: хлористводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, малеиновая кислота, дигидроксинафтойная кислота, метилсульфокислота, гликолевая кислота, бензолсульфокислота, п-толуолсульфокислота, нафталинсульфокислота и т.п. В случае присутствия в рассматриваемом комплексе карбоксильных групп, он способен образовывать соли с такими используемыми в медицине неорганическими или органическими основаниями, как: гидроксид натрия, гидроксид калия, гидроксид аммония, триэтиламин, этаноламин, диметиламинопиридин и т.п.
В полисахаридном комплексе настоящего изобретения фолиевая кислота (X) и полисахарид соединены посредством ковалентной связи, предпочтительно сложноэфирной связи между карбоксильной группой фолиевой кислоты и гидроксильной группой полисахарида. Соединение указанной фолиевой кислоты с полисахаридом осуществляют известными способами. Так, например, карбоксильную группу указанной фолиевой кислоты вначале активируют с помощью такого дегидратирующего агента, как гидроксидиимидазол, карбодиимид и т.п., которые раскрыты в WO 90/12096 и WO 96/34630, и затем вводят в реакцию с гидроксильной группой полисахарида с образованием сложноэфирной связи, обеспечивающей получение комплекса настоящего изобретения.
Предпочтительно в растворе для получения указанного комплекса происходит конденсация фолиевой кислоты и полисахарида в присутствии щелочного катализатора и дегидратирующего агента, причем в качестве щелочного катализатора можно использовать триэтиламин, пиридин и т.п., предпочтительно пиридин и диметиламинопиридин, а в качестве дегидратирующего агента предпочтительно использовать такой дегидратирующий агент карбодиимидного типа, как дициклогексилкарбодиимид и 1-этил-3-(3-диметиламинопропил)-карбодиимид. Реакцию предпочтительно проводят в среде такого инертного органического растворителя, как ароматический углеводород (бензол, толуол и т.п.), кетон (ацетон), галогенсодержащий углеводород (дихлорметан, трихлорметан и т.п.), амид кислоты (формамид, N,N-диметилформамид), сульфоксид (диметилсульфоксид) и их произвольные смеси, более предпочтительно в среде такого не-протонного полярного растворителя, как N,N-диметилфорамид, диметилсульфоксид и их смеси с другими растворителями.
Описанную выше реакцию конденсации обычно проводят при температуре в интервале от комнатной до температуры дефлегмации реакционной смеси и предпочтительно при умеренной температуре, например при комнатной температуре.
Обычно время такой реакции составляет величину от нескольких минут до нескольких дюжин часов, предпочтительно от 10 минут до 24 часов и более предпочтительно от 20 минут до 20 часов.
После завершения реакции комплекс настоящего изобретения может быть выделен из реакционной смеси и очищен от нее с помощью таких общепринятых методов, как фильтрация, осаждение, кристаллизация, диализ, хроматографическая очистка на кремниевой кислоте, вытеснительная хроматография и т.п., причем предпочтительную очистку осуществляют методом декстран-гель вытеснительной хроматографией с использованием хроматографических колонок Sephadex G-15 и Sephadex G-25 и т.п.
С целью оценки полисахаридного комплекса фолиевой кислоты настоящего изобретения проводили следующие эксперименты.
1. Демонстрация факта вхождения указанного полисахаридного комплекса фолиевой кислоты в опухолевую клетку по маршруту с участием рецептора фолиевой кислоты. Декстрановый комплекс фолиевый кислоты метили флуоресцеином и использовали в качестве модельного лекарственного средства, а опухолевые клетки культивировали in vitro. Вопрос об очевидной тенденции к насыщению при поглощении декстранового комплекса фолиевой кислоты и о более высокой степени поглощения такого комплекса по сравнению с декстраном решался путем тестирования изменения количества декстранового комплекса фолиевой кислоты, поглощенного опухолевыми клетками при различных концентрациях культуры, и определением различия между полученным значением и значением для поглощенного чистого декстрана, а также по изменению поглощения декстранового комплекса фолиевой кислоты при одинаковой концентрации культуры и различном времени культивирования; способность свободной фолиевой кислоты к явному и полному ингибированию поглощения декстранового комплекса фолиевой кислоты оценивали путем тестирования изменения количества декстранового комплекса фолиевой кислоты, поглощенного опухолевыми клетками при одинаковой концентрации и при одинаковом времени культивирования и при различных концентрациях свободной фолиевой кислоты; вопрос о возможном влиянии уменьшения количества рецептора фолиевой кислоты на мембране опухолевой клетки на количество поглощенного декстранового комплекса фолиевой кислоты указанными опухолевыми клетками решался путем определения количества декстранового комплекса фолиевой кислоты, поглощенного опухолевыми клетками, подвергнутыми предварительной обработке различными концентрациями фосфатидазы D. Кроме этого, всесторонне изучался вопрос о способности рассматриваемого декстранового комплекса фолиевой кислоты к проникновению в опухолевую клетку по пути обмена с участием рецептора фолиевой кислоты.
2. Наблюдения, касающиеся поглощения полисахаридного комплекса фолиевой кислоты опухолевыми клетками in vivo. Меченный флуоресцином декстрановый комплекс фолиевой кислоты или декстран вводили вблизи опухоли у голой мыши, через 24 часа мышей умертвляли и исследовали интенсивность флуоресценции и ее распределение в клетках опухолевой ткани с целью определения эффекта селективного поглощения полисахаридного комплекса фолиевой кислоты в опухолевой клетке in vivo.
3. Эффект полисахаридного комплекса фолиевой кислоты в подавлении опухоли in vivo. Голых мышей распределяли на контрольную группу, группу обработки декстраном и группу обработки декстрановым комплексом фолиевой кислоты, после чего животным вблизи опухолей производили инъекции декстрановым комплексом фолиевой кислоты или декстраном, либо инъекции не делали. Наблюдали изменения размера и веса опухолей, изменение морфологии и структуры опухолевой ткани и изменение плоидности ДНК в опухолевых клетках после последовательного применения малых и высоких доз, с целью установления влияния полисахаридного комплекса фолиевой кислоты на подавление опухоли in vivo у голых мышей, имеющих опухоли.
4. Оценка безопасности применения полисахаридного комплекса фолиевой кислоты. Самый большой недостаток хемотерапевтического лечения опухолей заключается в высокой токсичности и побочных эффектах применяемых лекарственных средств. Вопрос о наличии такого недостатка у полисахаридного комплекса фолиевой кислоты решался проведением пробы на острую токсичность системы фолиевая кислота-полисахарид. Уровень двигательной активности, изменение веса и смертность мышей, а также повреждение основных внутренних органов умерщвленных мышей наблюдали после внутривенной инъекции максимальной концентрации декстранового комплекса фолиевой кислоты с целью элементарной оценки безопасности действия системы фолиевая кислота-декстран в качестве противоопухолевого агента.
Согласно настоящему изобретению, проводили реакцию между упомянутыми выше декстраном, полисахарозой, сульфатом гомо- или гетерополисахарида и гомо- или гетерополисахарида альдоновой кислоты с молекулярным весом 4000-2000000, и фолиевой кислотой с образованием полисахаридного комплекса фолиевой кислоты, соединенного посредством ковалентной связи. При выборе в качестве модельного лекарственного средства декстранового комплекса фолиевой кислоты, в котором использовали декстран с молекулярным весом 105000, в упомянутых экспериментах были получены следующие результаты.
1. Культурирование опухолевой клетки in vitro. При культурировании HeLa229 in vitro в присутствии комплекса фолиевая кислота-декстран были получены следующие результаты:
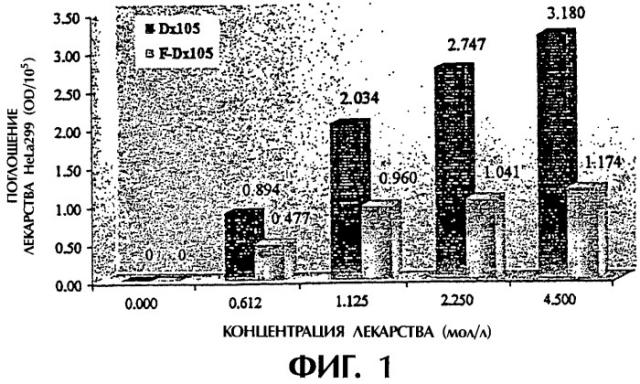
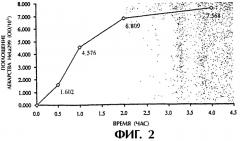
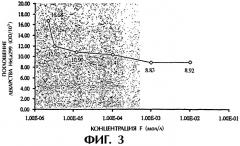
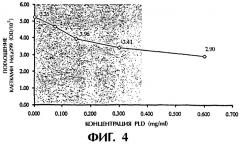
(1) поглощение декстранового комплекса фолиевой кислоты увеличивается с повышением культурирующей концентрации, но степень указанного повышения постепенно снижается (см. фигуру 1), а поглощение системы фолиевая кислота-декстран в 2,7 раза выше поглощения одного декстрана при концентрации декстранового комплекса фолиевой кислоты 4,5 мг/мл; (2) поглощение декстранового комплекса фолиевой кислоты увеличивается с увеличением времени культурирования, но степень повышения медленно убывает (см. фигуру 2); (3) поглощение декстранового комплекса фолиевой кислоты заметно уменьшается с увеличением концентрации фолиевой кислоты в культуральной жидкости (см. фигуру 3); (4) поглощение декстранового комплекса фолиевой кислоты явно уменьшается в присутствии определенной концентрации фосфатидазы D, которая используется для предварительной обработки клеток НеLа229 (см. фигуру 4). Из полученных результатов можно сделать вывод о том, что декстрановый комплекс фолиевой кислоты способен проникать в клетки НеLа229 по маршруту с участием рецептора фолиевой кислоты и что поглощение рассматриваемого комплекса значительно выше поглощения декстрана.
2. Проводились эксперименты по доставке лекарственного препарата к опухолевой клетке-мишени и по подавлению роста опухоли у голых мышей. Результаты эксперимента по доставке лекарства в опухолевую клетку-мишень, проводимого путем инъекции декстранового комплекса фолиевой кислоты вблизи расположения опухоли у голых мышей, которых инокулировали клетками HeLa229, показали, что количество декстранового комплекса фолиевой кислоты, проникающего в опухолевую клетку после диффузии через опухолевую ткань, явно выше количества проникающего декстрана (см. фигуру 5), и нацеленность лекарственного действия на опухоль является вполне очевидной. Результаты эксперимента по подавлению роста опухоли, проводимого с использованием декстранового комплекса фолиевой кислоты на опухоли голых ch-мышей, в которую вводили клетки HeLa229, показали: (1) что рост опухоли замедляется при малых дозировках декстранового комплекса фолиевой кислоты; при этом рост опухоли подавляется при высоких дозировках декстранового комплекса фолиевой кислоты (см. фигуру 6); (2) после применения препарата в течение 33 дней было установлено, что опухоли умерщвленных мышей из группы с обработкой комплексом фолиевая кислота-декстран очевидно меньше по размеру, чем опухоли у мышей из контрольной группы и группы, получившей обработку только декстраном (см. фигуры 7 и 8), причем величина подавления роста опухоли составляет 75%; (3) комплекс фолиевая кислота-декстран оказывает очевидное разрушающее действие на опухолевую ткань (см. фигуры 9а, 9b и 9с); (4) декстрановый комплекс фолиевой кислоты способен значительно снижать индекс ДНК (т.е. отношение массы ДНК в опухолевых клетках к массе ДНК в нормальных клетках, обозначаемое далее как DI) в опухолевых клетках опухолевой ткани, причем DI для контрольной группы имеет значение 3,5, для группы, обработанной декстраном, - 3,1, а для группы, обработанной комплексом фолиевая кислота-декстран, - 2,3.
3. Испытание на острую токсичность. Результаты теста на острую токсичность показали, что испытуемые мыши сохраняют нормальную двигательную активность, их вес повышается, и не наблюдается смертельных случаев и аномалии основных внутренних органов после внутривенной инъекции 1,5 г/кг декстранового комплекса фолиевой кислоты (в связи с низкой растворимостью препарата, указанное значение представляет собой максимальную концентрацию для проведения эксперимента по определению максимальной толерантной дозы) самцам и самкам мышей и наблюдения в течение 7 дней.
Результаты проведенных выше экспериментов доказывают, что настоящее изобретение обладает следующими преимуществами: (1) декстран per se не проявляет противоопухолевой активности; (2) декстрановый комплекс фолиевой кислоты способен проникать в клетку по маршруту с участием рецептора фолиевой кислоты и рассматриваемый препарат обладает очевидной активностью в плане подавления роста опухолевой ткани, высокой безопасностью, низкой токсичностью и незначительным побочным действием; (3) противоопухолевый эффект рассматриваемого декстранового комплекса фолиевой кислоты отличается от действия традиционных хемотерапевтических препаратов, вследствие чего настоящее изобретение обеспечивает новый способ медикаментозного лечения опухолей.
Исходя из результатов проведенных экспериментов с использованием полисахаридного комплекса фолиевой кислоты, настоящее изобретение предусматривает возможность объединения фармацевтически применимого эксипиента, адгезива, суспендирующего агента, дезинтегрирующего агента, разбавителя, смазочного агента, материалов, покрытых энтеросолюбильной оболочкой, биологических адгезионных материалов, матричных материалов, нерастворимых в воде, и других адьювантов с указанными комплексами фолиевой кислоты и декстрана с получением соответствующих фармацевтических композиций. Различные единичные дозировки фармацевтических композиций настоящего изобретения могут быть получены традиционными в области фармакологии методами.
Предпочтительные фармацевтические композиции включают: раствор полисахаридного комплекса фолиевой кислоты или высушенный вымораживанием продукт, который может смешиваться с водой для инъекций с целью приготовления раствора для внутривенной инъекции или для инъекции вблизи опухоли или в опухоль; сухой сироп полисахаридного комплекса фолиевой кислоты для перорального применения, содержащий бикарбонат натрия или гидроксид алюминия, а также трисиликат магния; а также кишечные капсулы полисахаридного комплекса фолиевой кислоты для перорального применения. Указанные композиции также могут представлять собой пероральные энтеросолюбильные таблетки из полисахаридного комплекса фолиевой кислоты, микрогранулы из полисахаридного комплекса фолиевой кислоты, используемые для эмболии артерий, пероральные гранулы из полисахаридного комплекса фолиевой кислоты, используемые для освобождения толстой кишки, или биологические адгезивные микрогранулы из полисахаридного комплекса фолиевой кислоты, используемые для распыления в носовой полости, полости матки и других полостях или для инъекции в абдоминальную полость.
Описание рисунков
Фигура 1 изображает поглощение F-Dx105 и Dx105 (культивированных при 37°С в течение 4 часов) клетками НеLа229 при различных культурирующих концентрациях.
Фигура 2 изображает поглощение F-Dx105 (культивирование при 37°С, при концентрации 4,5 мг/мл) клетками НеLа229 при различном времени культивирования.
Фигура 3 изображает поглощение F-Dx105 (культивирование при 37°С в течение 4 часов, концентрация 4,5 мг/мл) клетками НеLа229 при различных концентрациях фолиевой кислоты (F-концентрация).
Фигура 4 изображает поглощение F-Dx105 (культивирование в течение 4 часов при 37°С, при концентрации 4,5 мг/мл) клетками НеLа229, предварительно обработанными различными концентрациями фосфатидазы D.
Фигура 5 - фотографии флуоресценции срезов опухолевой ткани (круглые яркие пятна представляют собой флуоресценцию в опухолевых клетках) через 24 часа после инъекции F-Dx105-FITC (слева) или Dx105-FITC (справа) вблизи опухоли голых ch-мышей, иннокулированных клетками НеLа229.
Фигура 6 изображает динамику изменения размера опухоли (V=пab2/6) после инъекции F-Dx105 и Dx105, соответственно (за период с первого по шестой день: 56 мг/кг, на 19-ый день: 526 мг/кг) вблизи опухоли голых ch-мышей, инокулированных клетками НеLа229 (в группах из 6 ch-мышей).
На фигуре 7 представлены сравнительные данные по размеру опухолей in vivo умерщвленных трех групп голых ch-мышей, которых инокулировали клетками НеLа229 и продолжали их введение в течение 33 дней (верхний рисунок: контрольная группа; нижний рисунок слева: Dx105; нижний рисунок справа: F-Dx105).
На фигуре 8 представлены сравнительные данные по размеру опухолей in vitro умерщвленных трех групп голых ch-мышей, которых инокулировали клетками НеLа229 и продолжали их введение в течение 33 дней.
Фигура 9а изображает срез опухолевой ткани контрольной группы голых ch-мышей, которых инокулировали клетками НеLа229 и кормили в течение 33 дней.
Фигура 9b изображает срез опухолевой ткани группы голых ch-мышей, обработанных Dx105, которых инокулировали клетками НеLа229 и введение продолжали в течение 33 дней.
Фигура 9с изображает срез опухолевой ткани группы голых ch-мышей, обработанных F-Dx105, которых инокулировали клетками НеLа229 и введение продолжали в течение 33 дней.
Описание конкретных вариантов осуществления изобретения
Следующие ниже технические решения, не ограничивающие область изобретения, использовались для дополнительного, детального описания настоящего изобретения.
Пример 1. Получение полисахаридного комплекса фолиевой кислоты (F-PS)
1. Приготовление F-PS
(1) Фолиевая кислота-интрадекс (F-Dx)
* Влияние молекулярного веса Dx
0,74 г Диметиламинопиридина растворяли в 12 мл смешанного растворителя из формамида/N,N-диметилформамида/дихлорметана (10:9:1), после чего к смеси добавляли 0,25 г F и 1,16 г дициклогексилкарбодиимида, добавляли 6 мл раствора Dx (молекулярный вес: 10000), растворенного в указанном смешанном растворителе (0,1 г/мл), в течение 20 часов проводили реакцию в темноте, полученный продукт отфильтровывали после завершения реакции, фильтрат переливали в ацетон с образованием светло-желтого осадка, указанный осадок фильтровали и собирали, сушили в вакууме с получением сырого F-Dx продукта, проводили его очистку на колонке с Sephadex G-15 и элюирование дважды дистиллированной водой, после чего отбирали первую хроматографическую фракцию элюирующей жидкости и ее сушили вымораживанием с получением чистого F-Dx продукта.
- проводили реакцию между Dx (молекулярный вес: 70000) и F и обработку в соответствии с описанными выше методами
- проводили реакцию между Dx (молекулярный вес: 105000) и F и обработку в соответствии с описанными выше методами
- проводили реакцию между Dx (молекулярный вес: 500000) и F и обработку в соответствии с описанными выше методами
- проводили реакцию между Dx (молекулярный вес: 2000000) и F и обработку в соответствии с описанными выше методами
* Эффект массового соотношения между F и Dx
- В соответствии с описанным выше, проводили реакцию и обработку при массовом соотношении между Dx (молекулярный вес: 105000) и F 2,4:1 (г/г)
- В соответствии с описанным выше, проводили реакцию и обработку при массовом соотношении между Dx (молекулярный вес: 105000) и F 1,71:1 (г/г)
- В соответствии с описанным выше, проводили реакцию и обработку при массовом соотношении между Dx (молекулярный вес: 105000) и F 1,33:1 (г/г)
- В соответствии с описанным выше, проводили реакцию и обработку при массовом соотношении между Dx (молекулярный вес: 105000) и F 1,20:1 (г/г)
(2) Фолиевая кислота-полисахароза (F-Ficoll)
Вместо 0,6 г Dx (молекулярный вес 10000) использовали 0,6 г Ficoll (молекулярная масса 400000) и при соотношении реагирующих масс Ficoll к F 2,4:1 (г/г) проводили ту же реакцию и обработку, что использовали для приготовления комплекса F-Dx.
(3) Фолиевая кислота-Декстрин (F-декстрин)
0,74 г диметиламинопиридина растворяли в 8 мл диметилсульфоксида, после чего добавляли 0,25 г F и 1,16 г дициклогексилкарбодиимида, добавляли 4 мл декстринового раствора (молекулярный вес: 4500) в диметилсульфоксиде (0,15 г/мл), после чего проводили реакцию и соответствующую очистку с использованием тех же способов, что применялись для получения комплекса F-Dx.
(4) Фолиевая кислота-Гепарин (F-гепарин)
0,37 г диметиламинопиридина, 0,125 г F и 0,58 г дициклогексилкарбодиимида растворяли в 6 мл смешанного растворителя из формамида/N,N-диметилформамида/дихлорметана (10:9:1), после чего добавляли 10 мл раствора натрий-гепарина (молекулярный вес: 2000-6000), растворенного в указанном смешанном растворителе (0,03 г/мл), и затем проводили реакцию по той же методике, что использовалась для приготовления комплекса F-Dx, с использованием описанной методики очистки, за исключением того, что элюирующая жидкость представляла собой смесь 5 мМ раствора бикарбоната натрия и 0,1 М хлористого натрия.
(5) Фолиевая кислота - аравийская камедь (F-аравийская камедь)
Вместо 0,6 г Dx (молекулярный вес 10000) использовали 0,6 г аравийской камеди (молекулярный вес 240000-580000) и затем, при массовом соотношении между аравийской камедью и F 2,4:1 (г/г), по приведенной выше методике проводили реакцию и очистку, описанные для приготовления комплекса F-Dx, за исключением того, что фильтрат переливали в этанол.
(6) Дигидрофолиевая кислота - Декстран (F2-Dx)
0,74 г диметиламинопиридина растворяли в 12 мл смешанного растворителя, состоящего из формамида/N,N-диметилформамида/дихлорметана (10:9:1), затем добавляли 0,25 г F2 и 1,16 г дициклогексилкарбодиимида, добавляли 6 мл раствора Dx (молекулярный вес: 105000) в указанном смешанном растворителе (0,1 г/мл) и затем проводили реакцию и очистку, следуя описанной выше методике для приготовления комплекса F-Dx.
(7) Тетрагидрофолиевая кислота - Декстран (F4-Dx)
0,