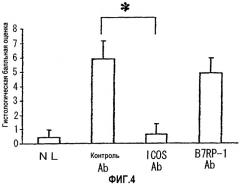
Средства для лечения воспалительных кишечных заболеваний
Иллюстрации
Показать всеИзобретение относится к фармакологии, медицине и конкретно к композициям, включающим вещество, обладающее активностью регулирования, например ингибирования, пролиферации клеток, экспрессирующих AILIM, для подавления начала воспалительных заболеваний кишечника, в частности болезни Крона и колита. Изобретение обеспечивает усиление терапевтического эффекта. 9 з.п. ф-лы, 12 ил.
Реферат
Область техники
Настоящее изобретение относится к фармацевтическим композициям, включающим вещество, обладающее активностью модулирования биологической активности «индуцируемой активацией лимфоцитарной иммуномодуляторной молекулы» (AILIM) (известной также, как «индуцируемый совместный стимулятор» (ICOS)), в частности, трансдукции сигнала, опосредованной AILIM.
Конкретно, настоящее изобретение относится к фармацевтическим композициям, включающим вещество, обладающее активностью регулирования (например, ингибирования) пролиферации клеток, экспрессирующих AILIM, гибели клеток (или апоптоза), или иммунного цитолизиса, или модулирования (например, ингибирования) продукции цитокина (например, интерферона-γ или интерлейкина-4) клетками, экспрессирующими AILIM.
Более конкретно, настоящее изобретение включает вещества, обладающие активностью модулирования трансдукции сигнала посредством AILIM и, особенно предпочтительно, вещества, которые индуцируют гибель клеток, апоптоз или истощение запаса клеток, экспрессирующих AILIM. Настоящее изобретение относится к фармацевтическим композициям для подавления, лечения или профилактики заболеваний, сопровождающих нарушенный иммунитет кишечного тракта (например, воспалительные кишечные заболевания, такие как колит (язвенный колит и подобные заболевания) и болезнь Крона и пищевые аллергии).
Предшествующий уровень техники
Слизистые оболочки желудочно-кишечного тракта постоянно подвержены воздействию не только антигенов, происходящих из пищи и энтеробактериальной флоры, но также различных антигенов, существующих во внешней среде, которые вредны для живого организма, таких как патогенные микроорганизмы. Поэтому слизистые оболочки желудочно-кишечного тракта проявляют цитотоксическую активность для противодействия таким антигенам, вредным для живого организма. Сохраняя способность секретировать антитела для нейтрализации токсинов, указанные слизистые оболочки в то же самое время также имеют уникальный иммунный механизм подавления избыточных иммунных реакций против антигенов, таких как антигены пищевой и энтеробактериальной флор (данный механизм называется иммунитетом слизистых оболочек желудочно-кишечного тракта или кишечным иммунитетом). В частности, нормальный иммунитет слизистых оболочек устанавливается на равновесии между положительными иммунными реакциями против патогенов и отрицательными иммунными реакциями против непатогенных антигенов. Когда указанное равновесие иммунологической гомеостатической поддержки рушится, происходят воспаление, аллергии и инфекции, давая начало кишечным заболеваниям, обычно именуемым воспалительные кишечные заболевания (IBD), и пищевые аллергии.
Наиболее репрезентативными воспалительными кишечными заболеваниями являются болезнь Крона (CD) и колит (в частности, язвенный колит (UC)). Оба указанных заболевания представляют собой заболевания, при которых патоген невозможно определить, и происходят хронические и рецидивирующие приступы боли в животе и диареи, вызывающие значительные и долгосрочные препятствия повседневной жизни больных детей и лиц молодого возраста. Кроме того, поскольку колит (в частности, язвенный колит) может стать причиной рака толстой кишки, имеется неотложная необходимость в выяснении патогенеза колита и разработке эффективных способов лечения.
Хотя различные возможности, такие как генетические факторы и факторы окружающей среды, обсуждались в отношении механизма начала воспалительных кишечных заболеваний, последние исследования указывают на высокую вероятность возможности того, что причиной может быть нарушенный иммунитет кишечного тракта (иммунитет слизистой оболочки желудочно-кишечного тракта). Более конкретно, воспаление или аллергия возникает в слизистых оболочках кишечника вследствие индукции избыточной иммунной реакции, которая происходит по некой причине против антигенов в кишечнике, которые обычно не являются патогенными и имеют низкую иммуногенность, что приводит к началу воспалительного кишечного заболевания.
Кроме того, предполагали, что нарушенный иммунитет против чужеродных патогенов, антигенов, происходящих из пищи, или аутоантигенов глубоко вовлечен в такие воспаления и аллергии кишечника. Кроме того, последние исследования свидетельствовали о возможности того, что нарушенные иммунные реакции в отношении определенных местных бактерий проявляются в виде хронических воспалительных реакций.
Данный механизм начала воспалений и аллергий кишечника вследствие нарушенного иммунитета кишечного тракта подтверждается анализами функции и дифференциации Т-клеток пациентов, а также типа продукции цитокинов в повреждениях или сыворотке. Кроме того, анализ различных недавно разработанных экспериментальных моделей воспалительных кишечных заболеваний на животных также выявляет то, что нарушенный иммунитет слизистых оболочек вызывает хроническое воспаление в кишечнике (Gastroenterology, Vol.109, p.1344-1367, 1995).
Например, ясно, что Т-клетки глубоко вовлечены в начало хронического энтерита, поскольку воспаление кишечника развивается спонтанно у нокаутных мышей с дефицитом α-цепи Т-клеточного рецептора (TCR) (TCRα-/-) (Cell, Vol.75, p.275-282, 1993; J. Exp. Med., Vol.183, p.847-856, 1996). При колите у указанных мышей TCRα-/-продукция интерферона-γ (IFN-γ) в кишечнике возрастает, и на начальной стадии воспаления наблюдается подъем уровней интерлейкинов IL-1α и IL-1β (Laboratory Investigation, Vol.76, p.385-397, 1997). Кроме того, Т-клетки TCRβ (βdim), которые имеют специфический поднабор Vβ и продуцируют IL-4, могут наблюдаться в пищеварительном тракте и лимфоузлах (Gastroenterology, Vol.112, p.1976-1886, 1997). В данной модели, как полагают, дефицит Т-клеток TCRαβ вызывает увеличение фракции патологических Т-клеток, которое затем вызывает патологическую регуляцию продукции цитокинов, становясь медиатором воспаления.
В модели, в которой Т-клетки CD4+/CD45RBhigh вводят мышам с тяжелым комбинированным иммунодефицитом (мышам SCID), индуцируется развитие тяжелого энтерита, сопровождаемого гиперплазией слизистого слоя и инфильтрацией лимфоцитов в кишечнике. Однако данный энтерит не возникает, когда одновременно вводят нефракционированные Т-клетки CD4+ (J. Exp. Med., Vol.178, p.237-244, 1993; Int. Immunol., Vol.5, p.1461-1471, 1993). Т-клетки CD4+ мышей SCID, у которых имеется развившийся энтерит, продуцируют IFN-γ. С другой стороны, поскольку энтерит подавляется введением антител против IFN-γ, считают, что Т-клетки типа Th1 вызывают воспаление (Immunity, Vol.1, p.553-562, 1994).
На основании указанных фактов представляется, что нет сомнений в том, что Т-клетки CD4+ кишечника и их избыточная активация представляют собой важные факторы при воспалительных кишечных заболеваниях.
Кроме того, регрессия энтерита с уменьшением количества Т-клеток CD4+ у пациентов, пораженных и воспалительным заболеванием кишечника, и ВИЧ, также подтверждает глубокое вовлечение патологических Т-клеток CD4+ при воспалительных заболеваниях кишечника (J. Clin. Gastroenterology, Vol.23, p.24-28, 1996). На основании указанных данных предпринимались попытки лечения воспалительных кишечных заболеваний с использованием антитела против CD-4 и сообщалось, что воспалительные поражения подавляются введением антитела против CD-4 (Gut, Vol.40, p.320-327, 1997).
С другой стороны, такая патологическая функциональная регуляция Т-клеток означает, что нарушилось равновесие продукции регуляторных цитокинов.
В действительности, имеются также сообщения о том, что энтерит развивается спонтанно у нокаутных мышей с дефицитом IL-2 и у нокаутных мышей с дефицитом IL-10 (Cell, Vol.75, p.235-261, 1993; Cell, Vol.75, p.263-274, 1993). Кроме того, в указанных моделях наблюдается также избыточная продукция IFN-γ, подтверждая тот факт, что произошла избыточная реакция Т-клеток типа Th1. Избыточная продукция IFN-γ в указанных моделях также согласуется с наблюдением возросшей экспрессии IFN-γ в поражениях, наблюдающаяся при болезни Крона. Энтерит можно лечить у мышей с дефицитом IL-10 введением IL-10. Сообщалось, что энтерит можно подавить указанным способом у мышей SCID, которым вводили Т-клетки CD4+/CD45RBhigh (Immunity, Vol.1, p.553-562, 1994).
Как указано выше, прогресс в анализе механизма начала воспалительных кишечных заболеваний начинался с аспекта патологического иммунитета слизистой оболочки желудочно-кишечного тракта, предполагая возможность лечения воспалительных заболеваний кишечника подавлением возросшей активации Т-клеток CD4+ и избыточно продуцируемых цитокинов. Однако истинный патогенез воспалительных заболеваний кишечника еще не был выявлен, и, кроме того, не был предоставлен эффективный способ лечения.
Активация Т-клеток (приобретение антигенной специфичности) инициируется, когда Т-клетки распознают антигены, представленные антиген-представляющими клетками (APC), такими как макрофаги, В-клетки или дендритные клетки. АРС обрабатывают включенные антигены, и обработанные антигены связываются с главным комплексом гистосовместимости (МНС) и представляются. Т-клетки получают первый сигнал для клеточной активации (приобретения специфичности) в результате распознавания обработанного антигена, представленного АРС посредством комплекса, образованного между рецептором Т-клетки (TCR) на поверхности мембраны Т-клетки и антигеном (комплекс TCR/CD3).
Для достаточной активации Т-клеток в дополнение к первому сигналу необходим второй сигнал, называемый совместным стимулирующим сигналом. Т-клетки активируются специфически в отношении антигена приемом указанного совместного стимулирующего сигнала после приема первого сигнала.
Для трансдукции данного второго сигнала крайне важно взаимодействие (более конкретно, межклеточная адгезия, опосредованная связями, образованными между следующими молекулами) среди CD28 (также известной, как Тр44, Т44 или антиген 9.3), которая представляет собой молекулу клеточной поверхности, экспрессированную, главным образом, на Т-клетках и клетках тимуса, CD80 (также известной, как В7-1, В7, ВВ1 или B7/BB1), которая представляет собой молекулу клеточной поверхности, экспрессированную антиген-представляющими клетками (макрофаги, моноциты, дендритные клетки и т.д.), и CD86 (также известной, как В7-2 или В70), которая также представляет собой молекулу клеточной поверхности на антиген-представляющих клетках.
Кроме того, экспериментально было выявлено взаимодействие (в частности, межклеточная адгезия, опосредованная связями, образуемыми между следующими молекулами) между ассоциированным с цитолитическими Т-лимфоцитами (CTLA-4) антигеном 4, экспрессия которого усиливается в зависимости от второго сигнала, CD80 (B7-1) и CD86 (B7-2) также играет важную роль в регуляции активации Т-клеток указанным вторым сигналом. Более конкретно, было выявлено, что регуляция активации Т-клеток трансдукцией указанного второго сигнала включает, по меньшей мере, взаимодействие между CD28 и CD80/CD86, усиление экспрессии CTLA-4, зависящее, как полагают, от указанного взаимодействия, и взаимодействие между CTLA-4 и CD80/CD86.
Кроме того, недавно, подобно описанным выше CTLA-4 и CD28, была идентифицирована молекула, названная индуцируемой активацией лимфоцитарной иммуномодуляторной молекулой (AILIM; человека, мыши и крысы; Int. Immunol., 12(1), p.51-55, 2000; также называемая индуцируемый совместный стимулятор (ICOS; человека; Nature, 397(6716), p.263-266, 1999); J. Imminol., 166(1), p.1, 2001; J. Immunol., 165(9), p.5035, 2000; Biochem. Biophys. Res. Commun., 276(1), p.335, 2000; Immunity, 13(1), p.95, 2000; J. Exp. Med., 192(1), p.53, 2000; Eur. J. Immunol., 30(4), p.1040, 2000), в качестве третьей, совместно стимулирующей молекулы передачи, которая трансдуцирует второй сигнал (совместно стимулирующий сигнал), необходимый для активации лимфоцитов, таких как Т-клетки, и связана с сигналом, регулирует функцию активированных лимфоцитов, таких как активированные Т-клетки.
Кроме того, была идентифицирована новая молекула, названная B7h, B7RP-1, GL50 или LICOS, которую считают лигандом, взаимодействующим с совместно стимулирующей молекулой передачи AILIM (Nature, Vol.402, №6763, pp.827-832, 1999; Nature Medicine, Vol.5, №12, pp.1365-1369, 1999; J. Immunology, Vol.164, pp.1653-1657, 2000; Curr. Biol., Vol.10, №6, pp.333-336, 2000).
Проводятся трудоемкие исследования биологических функций указанных двух новых молекул, функциональной регуляции молекулами лимфоцитов, таких как Т-клетки, посредством трансдукции третьего совместно стимулирующего сигнала.
С другой стороны, не было даже предположений о взаимосвязи между AILIM (ICOS), которая представляет собой третью совместно стимулирующую молекулу трансдукции, считающуюся существенной для активации Т-клеток, таких как Т-клетки CD4+, и началом указанного выше патологического иммунитета слизистой оболочки кишечника и воспалительных заболеваний кишечника (болезнь Крона и колит (язвенный колит и ему подобный)). Не было также никакого предложения о попытках лечения воспалительных заболеваний кишечника регулированием функции молекулы AILIM.
Описание изобретения
Конкретно, задачей настоящего изобретения является предоставление способов и фармацевтических средств для подавления, лечения или профилактики заболеваний, сопровождающих патологический иммунитет (патологическую активацию Т-клеток, увеличение количества патологических клеток CD4+) кишечного тракта, таких как воспалительные заболевания кишечника (болезнь Крона и колит (язвенный колит и ему подобный)) модулированием посредством лекарственных и фармацевтических способов (например, фармацевтических средств, таких как соединения с низкой молекулярной массой и антибиотики) биологической функции новой молекулы AILIM, которая, как считают, трансдуцирует второй сигнал, существенный для активации лимфоцитов, таких как Т-клетки (совместно стимулирующий сигнал), и регулирует функцию активированных лимфоцитов, таких как активированные Т-клетки.
Еще одной задачей является применение таких фармацевтических средств, которые модулируют биологическую функцию AILIM (например, фармацевтические средства, такие как соединения с низкой молекулярной массой и антибиотики) для предоставления способов усиления терапевтического эффекта существующих фармацевтических средств, широко применяемых для лечения воспалительных заболеваний кишечника (гормонов коры надпочечников, салазосульфапиридина и т.д.).
Обширные исследования способов подавления биологической функции AILIM (ICOS) млекопитающих, пищевых аллергий и воспалительных заболеваний кишечника, при которых может быть глубоко вовлечен патологический иммунитет кишечного тракта (в частности, болезнь Крона и колит (язвенный колит и ему подобный)), привели авторов настоящего изобретения к открытию того, что фармацевтические средства, которые регулируют функцию AILIM, значительно подавляют воспалительные заболевания кишечника (в частности, болезнь Крона и колит (язвенный колит и ему подобный)). Таким образом, было создано настоящее изобретение.
Фармацевтическую композицию настоящего изобретения можно применять в качестве лекарственного средства для модулирования различных реакций in vivo, в которых участвует трансдукция совместно стимулирующего сигнала к клеткам, экспрессирующим AILIM, опосредованная AILIM (например, пролиферации клеток, экспрессирующих AILIM, продукции цитокина (цитокинов) клетками, экспрессирующими AILIM, иммунного цитолизиса или гибели клеток, апоптоза или истощения запаса клеток, экспрессирующих AILIM, и активности индукции зависимой от антител клеточной цитотоксичности против клеток, экспрессирующих AILIM), и/или в качестве лекарственного средства для профилактики начала и/или прогрессирования различных заболеваний, при которых участвует трансдукция сигнала, опосредованная AILIM, и для лечения или профилактики указанных заболеваний.
Конкретно, фармацевтическая композиция изобретения может модулировать (подавлять и усиливать) пролиферацию клеток, экспрессирующих AILIM, гибель, апоптоз или истощение запаса клеток, или иммунный цитолизис, или может модулировать (ингибировать или усиливать) продукцию цитокинов (например, интерферона-γ, или интерлейкина-4) клетками, экспрессирующими AILIM, и может предотвращать различные патологические состояния, запускаемые различными физиологическими феноменами, в которых участвует трансдукция сигнала, опосредованная AILIM, и обеспечивает возможность лечения или профилактики различных заболеваний.
Таким особенно предпочтительным вариантом реализации фармацевтических композиций данного изобретения являются фармацевтические композиции, включающие вещество, которое вызывает гибель клеток, апоптоз или истощение запаса клеток, экспрессирующих AILIM.
Применяя фармацевтические композиции данного изобретения, можно подавить, предотвратить и/или лечить заболевания, которые могут быть вызваны патологическим иммунитетом кишечного тракта, более конкретно, воспалительные заболевания кишечника (в частности, болезнь Крона и колит (язвенный колит и ему подобный)) и пищевые аллергии.
Кроме того, фармацевтические композиции данного изобретения могут усилить терапевтический эффект при воздействии на воспалительные заболевания кишечника при применении в комбинации с существующим фармацевтическим средством, назначаемым для лечения таких воспалительных заболеваний кишечника.
Более конкретно, настоящее изобретение описано в следующих пунктах (1)-(10).
(1) Фармацевтическая композиция для подавления, лечения или профилактики заболевания, которое сопровождает патологический иммунитет кишечного тракта, причем фармацевтическая композиция включает вещество, обладающее активностью модулирования трансдукции сигнала посредством AILIM, и фармацевтически приемлемый носитель.
(2) Фармацевтическая композиция по п.(1), где указанное вещество обладает активностью вызывать гибель клеток, экспрессирующих AILIM.
(3) Фармацевтическая композиция по п.(1) или (2), где указанное заболевание представляет собой воспалительное заболевание кишечника.
(4) Фармацевтическая композиция по п.(3), где указанное воспалительное заболевание кишечника представляет собой колит.
(5) Фармацевтическая композиция по п.(3), где указанное воспалительное заболевание кишечника представляет собой болезнь Крона.
(6) Фармацевтическая композиция по п.(1) или (2), где указанное заболевание представляет собой пищевую аллергию.
(7) Фармацевтическая композиция по любому одному из пп.(1)-(6), где указанное вещество представляет собой белковое вещество.
(8) Фармацевтическая композиция по п.(7), где указанное белковое вещество выбирают из группы, состоящей из:
а) антитела, которое связывается с AILIM, или части указанного антитела;
b) полипептида, включающего всю внеклеточную область AILIM или ее часть;
c) гибридного полипептида, включающего всю или часть внеклеточной области AILIM и всю или часть константной области тяжелой цепи иммуноглобулина, и
d) полипептида, который связывается с AILIM.
(9) Фармацевтическая композиция по любому одному из пп.(1)-(6), где указанное вещество представляет собой небелковое вещество.
(10) Фармацевтическая композиция по п.(9), где указанное небелковое вещество представляет собой ДНК, РНК или химически синтезированное соединение.
Настоящие изобретения подробно описаны здесь ниже определением терминов и способов продукции веществ, применяемых в данном изобретении.
В настоящем описании термин «млекопитающее» означает человека, корову, козу, кролика, мышь, крысу, хомяка и морскую свинку; предпочтительным является человек, корова, крыса, мышь или хомяк, а особенно предпочтительным является человек.
"AILIM" данного изобретения представляет собой аббревиатуру «индуцируемой активацией лимфоцитарной иммуномодуляторной молекулы» и означает молекулу клеточной поверхности млекопитающего, имеющую структуру и функцию, описанные в предыдущих сообщениях (J. Immunol., 166(1), p.1, 2001; J. Immunol., 165(9), p.5035, 2000; Biochem. Biophys. Res. Commun., 276(1), p.335, 2000; Immunity, 13(1), p.95, 2000; J. Exp. Med., 192(1), p.53, 2000; Eur. J. Immunol., 30(4), p.1040, 2000; Int. Immunol., 12(1), p.51, 2000; Nature, 397(6716), p.263, 1999; GenBank Accession Number: BAA82129 (человек); BAA82128 (крыса); BAA82127 (мутантная крыса); BAA82126 (мышь)).
Особенно предпочтительно, термин обозначает AILIM, полученную у человека (например, International Immunology, Vol.12, №1, p.51-55, 2000; GenBank Accession Number: BAA82129).
Данную AILIM также называют ICOS (Nature, Vol.397, №6716, p.263-266, 1999) или антиген JTT-1/антиген JTT-2 (не рассмотренная опубликованная заявка на патент Японии №(JP-A) Hei 11-29599, международная патентная заявка №WO98/38216), и данные молекулы взаимно относятся к одной и той же молекуле.
Кроме того, "AILIM" в данном изобретении включает аминокислотные последовательности AILIM от каждого млекопитающего, описанного в ранее опубликованных литературных источниках, а особенно предпочтительно, полипептид, имеющий по существу ту же аминокислотную последовательность, что и последовательность AILIM человека. Кроме того, мутанты AILIM человека, аналогичные ранее идентифицированному мутанту AILIM, полученному у крысы (GenBank Accession Number: BAA82127), также включены в "AILIM" данного изобретения.
В настоящем описании выражение «имеющая по существу такую же аминокислотную последовательность» означает, что "AILIM" настоящего изобретения включает полипептиды, имеющие аминокислотные последовательности, в которых множественные аминокислоты, предпочтительно, от 1 до 10 аминокислот, особенно предпочтительно, от 1 до 5 аминокислот, были замещены, подвергнуты делеции и/или модифицированы, и полипептиды, имеющие аминокислотные последовательности, в которых множественные аминокислоты, предпочтительно, от 1 до 10 аминокислот, особенно предпочтительно, от 1 до 5 аминокислот, были добавлены, до тех пор, пока полипептиды имеют по существу такие же биологические свойства, как полипептид, включающий аминокислотную последовательность, показанную в предыдущих сообщениях.
Такие замещения, делеции или инсерции аминокислот можно достичь в соответствии с обычным способом (Experimental Medicine: SUPPLEMENT, "Handbook of Genetic Engineering" (1992), и т.д.).
Примерами являются сайт-направленный мутагенез с использованием синтетического олигонуклеотида (дуплексный способ с гэпами), точечный мутагенез, посредством которого точечную мутацию вводят случайным образом обработкой нитритом или сульфитом, способ, посредством которого получают делеционный мутант с помощью фермента Bal31, и т.д., кассетный мутагенез, способ сканирования линкера, способ ошибки включения, способ с использованием затравки с ошибочным спариванием, способ синтеза сегмента ДНК и т.д.
Сайт-направленный мутагенез с использованием синтетического олигонуклеотида (дуплексный способ с гэпами) можно осуществить, например, следующим образом. Область, которую желательно подвергнуть мутагенезу, клонируют в вектор фага М13, имеющий амбер-мутацию, для получения одноцепочечной ДНК фага. После того как ДНК RF I вектора М13, не имеющего амбер-мутации, линеаризируют обработкой рестрикционным ферментом, ДНК смешивают с указанной выше одноцепочечной ДНК фага, денатурируют и подвергают отжигу, образуя посредством этого «дуплексную ДНК с гэпами». Синтетический олигонуклеотид, в который введены мутации, гибридизируют с дуплексной ДНК с гэпами, и замкнутую в кольцо двухцепочечную ДНК получают путем реакции с ДНК-полимеразой и ДНК-лигазой. Клетки mutS E. coli, дефицитные по активности реапарации ошибочного спаривания, трансфицируют данной ДНК. Клетки E. coli, не имеющие супрессорной активности, инфицируют выращенными фагами и проводят скрининг только фагов, не имеющих амбер-мутации.
В способе, посредством которого вводят точечную мутацию нитритом, используют, например, принцип, указанный ниже. Если ДНК обрабатывают нитритом, нуклеотиды деаминируются с изменением аденина в гипоксантин, цитозина в урацил и гуанина в ксантин. Если в клетки вводят деаминированную ДНК, "A:T" и "G:С" соответственно замещаются "G:C" и "A:T", потому что при репликации ДНК основание гипоксантина, урацила и ксантина конъюгируется соответственно с цитозином, аденином и тимином. На самом деле, фрагменты одноцепочечной ДНК, обработанные нитритом, гибридизируют с «дуплексной ДНК с гэпами», а затем мутантные штаммы отделяют манипулированием таким же образом, как при сайт-направленном мутагенезе с использованием синтетических олигонуклеотидов (дуплексный способ с гэпами).
Термин «цитокин», как в выражении «продукция цитокина клетками, экспрессирующими AILIM», в настоящем изобретении означает произвольный цитокин, продуцируемый клетками, экспрессирующими AILIM (в частности, Т-клетками).
Примерами Т-клеток являются Т-клетки типа Th1 или типа Th2, а цитокин настоящего изобретения, в частности, означает цитокин, продуцируемый Т-клетками типа Th1, и/или произвольный цитокин, продуцируемый Т-клетками типа Th2.
Цитокины, продуцируемые Т-клетками типа Th1, включают IFN-γ, IL-2, фактор опухолевого некроза (TNF), IL-3, а цитокины, продуцируемые Т-клетками типа Th2, включают IL-3, IL-4, IL-5, IL-10 и TNF (Cell, Vol.30, №9, pp.343-346, 1998).
Используемое в настоящем изобретении выражения «вещество», «вещество, обладающее активностью модулирования трансдукции сигнала, опосредованной AILIM», «вещество, обладающее активностью ингибирования пролиферации клеток, экспрессирующих AILIM, или ингибирования продукции цитокина клетками, экспрессирующими AILIM» или «вещество, обладающее активностью индукции гибели клеток, экспрессирующих AILIM» означают встречающееся в природе вещество или искусственно полученное произвольное вещество.
Особенно предпочтительным вариантом реализации «вещества» в соответствии с данным изобретением является вещество, обладающее активностью индукции гибели клеток, апоптоза или истощения запаса клеток, экспрессирующих AILIM.
В настоящем описании выражение «трансдукция сигнала, опосредованная AILIM», означает трансдукцию сигнала посредством AILIM, приводящую к описанному выше изменению любого фенотипа клеток, экспрессирующих AILIM, или в последующих примерах (изменение клеточной пролиферации, активация клеток, инактивация клеток, апоптоз и/или способность продуцировать произвольный цитокин из клеток, экспрессирующих AILIM).
«Вещество» можно, главным образом, классифицировать на «белковое вещество» и «небелковое вещество».
Примерами «белковых веществ» являются следующие полипептиды, антитела (поликлональные антитела, моноклональные антитела или части моноклональных антител).
Когда вещество представляет собой антитело, оно предпочтительно является моноклональным антителом. Когда вещество представляет собой моноклональное антитело, оно включает не только моноклональные антитела, происходящие от млекопитающего, кроме человека, но также следующее: рекомбинантные химерные моноклональные антитела, рекомбинантные гуманизированные моноклональные антитела и человеческие моноклональные антитела.
Когда вещество представляет собой полипептид, оно включает следующее: полипептиды, фрагменты полипептидов (олигопептиды), гибридные полипептиды и химически модифицированные полипептиды. Примерами олигопептидов являются пептиды, включающие от 5 до 30 аминокислот, предпочтительно, от 5 до 20 аминокислот. Химическую модификацию можно проектировать в зависимости от различных назначений, например, для увеличения периода полувыведения из крови в случае введения in vivo, или увеличения устойчивости к разложению, или увеличения всасывания в пищеварительном тракте при пероральном введении.
Примерами полипептидов являются следующие:
(1) Полипептид, содержащий всю или часть внеклеточной области AILIM;
(2) Гибридный полипептид, включающий всю или часть внеклеточной области AILIM и всю или часть константной области тяжелой цепи иммуноглобулина; или
(3) Полипептид, который связывается с AILIM.
Примерами «небелковых веществ» являются ДНК, РНК и химически синтезированные соединения.
В данном описании «ДНК» означает «ДНК, включающую частичную нуклеотидную последовательность антисмысловой ДНК, полученной на основании нуклеотидной последовательности ДНК (включая кДНК и геномную ДНК), кодирующей указанную выше AILIM (предпочтительно, человеческую AILIM), или ее химически модифицированную форму», которую можно применять в качестве лекарственного препарата антисмысловой ДНК. В частности, антисмысловая ДНК может ингибировать транскрипцию ДНК, кодирующей AILIM, в мРНК, или трансляцию мРНК в белок путем гибридизации с ДНК или РНК, кодирующей AILIM.
Используемое в настоящем описании выражение «частичная нуклеотидная последовательность» относится к частичной нуклеотидной последовательности, включающей произвольное количество нуклеотидов в произвольной области. Частичная нуклеотидная последовательность включает от 5 до 100 последовательных нуклеотидов, предпочтительно, от 5 до 70 последовательных нуклеотидов, более предпочтительно, от 5 до 50 последовательных нуклеотидов, а еще предпочтительнее, от 5 до 30 последовательных нуклеотидов.
Когда ДНК применяют в качестве лекарственного препарата антисмысловой ДНК, последовательность ДНК можно химически частично модифицировать для удлинения периода полувыведения (устойчивости) из крови, когда ДНК вводят пациентам, для увеличения проницаемости ДНК через цитоплазматическую мембрану, или для увеличения устойчивости к разрушению или всасывания перорально введенной ДНК в пищеварительных органах. Химические модификации включают, например, модификацию фосфатной связи, рибозы, нуклеотида, сахарной части и 3'-конца и/или 5'-конца в структуре ДНК олигонуклеотида.
Модификации фосфатных связей включают, например, превращение одной или более связей в сложный эфир двухосновной фосфорной кислоты (D-олиго), фосфортиоатные связи, фосфордитиоатные связи (S-олиго), метилфосфонатные связи (МР-олиго), фосфорамидатные связи, нефосфатные связи или метилфосфонотиоатные связи, или их комбинации. Модификация рибозы включает, например, превращение в 2'-фторрибозу или 2'-О-метилрибозу. Модификация нуклеотида включает, например, превращение в 5-пропинилурацил или 2-аминоаденин.
В данном описании термин «РНК» означает «РНК, включающую частичную нуклеотидную последовательность антисмысловой РНК, полученной на основании нуклеотидной последовательности РНК, кодирующей указанную выше AILIM (предпочтительно, человеческую AILIM), или ее химически модифицированную форму», которую можно применять в качестве лекарственного препарата антисмысловой РНК. Антисмысловая РНК может ингибировать транскрипцию ДНК, кодирующей AILIM, в мРНК или трансляцию мРНК в белок путем гибридизации с ДНК или РНК, кодирующей AILIM.
Используемое здесь выражение «частичная нуклеотидная последовательность» относится к частичной нуклеотидной последовательности, включающей произвольное количество нуклеотидов в произвольной области. Частичная нуклеотидная последовательность включает от 5 до 100 последовательных нуклеотидов, предпочтительно от 5 до 70 последовательных нуклеотидов, более предпочтительно от 5 до 50 последовательных нуклеотидов, а еще предпочтительнее от 5 до 30 последовательных нуклеотидов.
Последовательность антисмысловой РНК можно химически частично модифицировать для удлинения периода полувыведения (устойчивости) из крови, когда РНК вводят пациентам, для увеличения проницаемости РНК через цитоплазматическую мембрану, или для увеличения устойчивости к разрушению или всасывания перорально введенной РНК в пищеварительных органах. Химические модификации включают такие, как модификации, которые относятся к указанной выше антисмысловой ДНК.
Примерами «химически синтезированного соединения» являются произвольное соединение, исключая указанные выше ДНК, РНК и белковые вещества, имеющее молекулярную массу от около 100 до около 1000 или менее, предпочтительно, вещество, имеющее молекулярную массу от около 100 до около 800, а предпочтительнее, молекулярную массу от около 100 до около 600.
Термин «полипептид», включенный в определение указанного выше «вещества», означает часть (фрагмент) полипептидной цепи, составляющей AILIM (предпочтительно, человеческой AILIM), предпочтительно, всю или часть внеклеточной области полипептида, составляющего AILIM (от 1 до 5 аминокислот можно необязательно добавить в N-конец и/или С-конец области).
AILIM в соответствии с настоящим изобретением представляет собой трансмембранную молекулу, пронизывающую клеточную мембрану, включающую 1 или 2 полипептидных цепи.
В настоящем описании «трансмембранный белок» означает белок, который соединен с клеточной мембраной посредством гидрофобной области пептида, который пронизывает липидный бислой мембраны один или несколько раз, и структура которого в целом составлена из трех основных областей, то есть внеклеточной области, трансмембранной области и цитоплазматической области, как наблюдается во многих рецепторах или молекулах клеточной поверхности. Такой трансмембранный белок составляет каждый рецептор или молекулу клеточной поверхности в виде мономера или в виде гомодимера, гетеродимера или олигомера, связанного с одной или несколькими цепями, имеющими одну и ту же или различную аминокислотную последовательность (последовательности).
В настоящем описании «внеклеточная область» означает всю или часть частичной структуры (частичной области) всей структуры упомянутого выше трансмембранного белка, где частичная структура существует снаружи от мембраны. Другими словами, она означает всю или часть области трансмембранного белка, исключая область, включенную в мембрану (трансмембранная область), и область, существующую в цитоплазме, следом за трансмембранной областью (цитоплазматическая область).
«Гибридный полипептид», включенный в указанное выше «белковое вещество», означает гибридный полипептид, включающий всю или часть внеклеточной области полипептида, составляющего AILIM (предпочтительно, человеческую AILIM), и «всю или часть константной области тяжелой цепи иммуноглобулина (Ig, предпочтительно, человеческого Ig)». Предпочтительно, гибридный полипептид представляет собой гибридный полипептид, имеющий внеклеточную область AILIM и часть константной области тяжелой цепи человеческого IgG, и особенно предпочтительно, гибридный полипептид включает внеклеточную область AILIM и область (Fc) тяжелой цепи человеческого IgG, включающую шарнирную область, домен СН2 и домен СН3. В качестве IgG предпочтителен IgG1, а в качестве AILIM предпочтительна человеческая, мышиная или крысиная AILIM (предпочтительно, человеческая).
Используемое здесь выражение «вся или часть константной области тяжелой цепи иммуноглобулина (Ig)» означает константную область области Fc тяжелой цепи иммуноглобулина (цепи Н), полученного у человека, или ее часть. Иммуноглобулин может представлять собой любой иммуноглобулин, относящийся к любому классу и любому подклассу. В частности, иммуноглобулин включает IgG (IgG1, IgG2, IgG3 и IgG4), IgM, IgA (IgA1 и IgA2), IgD и IgE. Предпочтительно, иммуноглобулин представляет собой IgG (IgG1, IgG2, IgG3 или IgG4) или IgM. Примерами особенно предпочтительных иммуноглобулинов настоящего изобретения являются иммуноглобулины, относящиеся к IgG (IgG1, IgG2, IgG3 или IgG4), полученными у человека.
Иммуноглобулин имеет Y-образную структурную единицу, в которой 4 цепи, составленные из 2 гомологичных легких цепей (L-цепей) и двух гомологичных тяжелых цепей (Н-цепей) соединены посредством дисульфидных связей (S-S связей). Легкая цепь составлена из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). Тяжелая цепь составлена из вариабельной области тяжелой цепи (VН) и константной области тяжелой цепи (CН).
Константная область тяжелой цепи составлена из нескольких доменов, имеющих аминокислотные последовательности, уникальные для каждого класса (IgG, IgM, IgA, IgD и IgE) и каждого подкласса (IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2).
Тяжелая цепь IgG (IgG1, IgG2, IgG3 и IgG4) составлена из VH, домена СН1, шарнирной области, домена СН2 и домена СН3 в указанном порядке от N-конца.
Аналогичным образом, тяжелая цепь IgG1 составлена из VH, домена Сγ11, шарнирной области, домена Сγ12 и домена Сγ13 в указанном порядке от N-конца. Тяжелая цепь IgG2 составлена из VH, домена Сγ21, шарнирной области, домена Сγ22 и домена Сγ23 в указанном порядке от N-конца. Тяжелая цепь IgG3 составлена из VH, домена Сγ31, шарнирной области, домена Сγ32 и домена Сγ33 в указанном порядке от N-конца. Тяжелая цепь IgG4 составлена из VH, домена Сγ41, шарнирно