Полианионные производные норборнана, способ получения и ингибиторы репродукции вируса иммунодефицита человека на их основе
Иллюстрации
Показать всеНастоящее изобретение относится к полианионным производным норборнана (бицикло[2,2,1]гептана) общей формулы:
где
или остаток другого кислородсодержащего мономера, например;
n≥15, предпочтительно n=35-100 (степень полимеризации); М=Н, Na, К, NH4; Х=ОН, ОМ, ONH3-Y-Nb, NH-Y-Nb, причем в ряду указанных модификаций химического фрагмента Х не менее 3% от общего числа Х составляет совокупная доля вариантов ONH3-Y-Nb и NH-Y-Nb (степень модификации норборнаном), в которых "спейсерная" группа -Y-=-(Yi)m - где Yi=СН2, СН(СН3), СН(СН2СН3), m≥0, (предпочтительно m=1-3), а "норборнановый фармакофор" описывается формулой:
где
каркасный бициклический углеродный остов норборнана, включающий семь атомов углерода (С) в положениях 1-7, где в ряду выше обозначенных двенадцати заместителей R1, R2а, R2b, R3a, R3b, R4, R5a, R5b, R6a, R6b, R7a, R7b один (любой) из них представляет собой - (ковалентную связь между Nb и Y), тогда как остальные одиннадцать =Н или алкил, или попарно составляют ковалентную химическую связь в пределах бициклического углеводородного остова, то есть дополнительная (двойная) связь между атомами углерода. Также изобретение относится к способу получения соединений формулы I. Соединения формулы I имеют высокий индекс селективности и эффективны в отношении штаммов ВИЧ-1, устойчивых к действию известного клинического препарата азидотимидина. Эти полианионные производные норборнана могут быть перспективны в качестве активных субстанций в составе лекарственных форм противовирусного назначения. 2 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Настоящее изобретение относится к области органической химии и вирусологии и касается новых биологически активных производных норборнана(бицикло[2,2,1]гептана) - его полианионных модификаций, способа получения и противовирусной активности соединений этого ряда, которые могут найти применение в медицине.
В ряду известных соединений норборнана выраженная противовирусная активность зарегистрирована в случае 2-(1-аминоэтил)норборнана, в частности в форме гидрохлорида(дейтифорина):
Однако дейтифорин не обладает ВИЧ-ингибирующей активностью, а его противовирусное действие (и показания к медицинскому применению) ограничиваются, преимущественно вирусом гриппа А [1а].
По химической структуре, биологической активности и клиническим показаниям дейтифорин является близким аналогом ремантадина (1-(1-аминоэтил) адамантан гидрохлорида)
который также высокоактивен в отношении ряда штаммов вируса гриппа А [1б, 2], но, как и другие низкомолекулярные производные адамантана, не подавляет репродукцию ВИЧ в клеточных культурах. Ранее нами описаны и запатентованы новые соединения адамантана, химически модифицированные полимерными (или олигомерными) полианионами, которые в отличие от известных прототипов адамантанового ряда обладают выраженной ВИЧ-1 ингибирующей активностью, подавляя проникновение вируса в клетку через плазматическую мембрану [3, 4]. Однако соединения адамантанового ряда (каркасные трициклы) имеют более сложное химическое строение, чем норборнановые аналоги (бициклы), что обусловливает значительно более сложный синтез и меньшую доступность адамантановых соединений по сравнению с норборнановыми. Кроме того, адамантановые абиотики в целом более токсичны, чем аналогичные производные норборнана, который составляет основу ряда природных бициклических терпеноидов (камфора, камфен, борнеол, изоборнеол, фенхен, фенхон и др.)[5].
Сущность изобретения заключается в получении новых полианионных производных норборнанового ряда, общей формулы I. Предлагаемые соединения, обладают противовирусным действием, в первую очередь против вируса иммунодефицита человека 1 типа (ВИЧ-1) и химически более доступны, чем адамантановые прототипы. Эти соединения высокоселективно подавляют репродукцию ВИЧ-1 и эффективны против штаммов, устойчивых к действию базового препарата анти-ВИЧ/СПИД терапии - азидотимидина (АЗТ).
В соответствии с настоящим изобретением предлагаются полианионные производные норборнана(бицикло[2,2,1]гептана) общей формулы I
где
или остаток другого кислородсодержащего мономера, например:
n≥15, предпочтительно n=35-100 (степень полимеризации);
М=Н, Na, К, NH4;
-X=-ОН, -ОМ, -ONH3-Y-Nb, -NH-Y-Nb,
причем в ряду указанных модификаций химического фрагмента -X не менее 3% от общего числа -X составляет совокупная доля вариантов -NH3-Y-Nb и -NH-Y-Nb (степень модификации норборнаном), в которых "спейсерная" группа -Y-=-(Yi)m - где Yi=СН2, СН(СН3), CH(CH2CH3), m≥0, (предпочтительно m=1-3), а "норборнановый фармакофор" описывается формулой:
где
каркасный бициклический углеродный остов норборнана, включающий семь атомов углерода (С) в положениях 1-7,
где в ряду выше обозначенных двенадцати заместителей R1, R2а, R2b, R3a, R3b, R4, R5a, R5b, R6a, R6b, R7a, R7b один (любой) из них представляет собой - (ковалентную связь между Nb и Y), тогда как остальные одиннадцать =Н, или алкил, или попарно составляют ковалентную химическую связь в пределах бициклического углеводородного остова, то есть дополнительную (двойную) связь между атомами углерода.
Соединения формулы I являются новыми производными норборнана, модифицированными олиго- или полимерными производными янтарной кислоты. При этом в водной фазе карбоксильные группы (или их солевые модификации): - СООМ и -COX (где Х=ОН, ОМ) способны к диссоциации с образованием карбокси-анионов, несущих отрицательный электрический заряд
При достаточно высоких степенях полимеризации (n≥15) достигается полианионная модификация производных норборнана, которая обеспечивает прекрасную растворимость соединений формулы I в водных (физиологических) средах (в отличие от немодифицированных соединений норборнана) и приводит к существенной модуляции биологической активности норборнановых фармакофоров. В частности, соединения формулы I проявляют специфическую активность против ВИЧ-1, включая штаммы вируса, резистентные к АЗТ.
Предполагаемый механизм ВИЧ-ингибирующего действия соединений формулы I заключается в синергическом сочетании комбинации двух основных функций: 1) электростатического воздействия полианионов на положительно заряженные сайты вирус-специфических белков по аминокислотным остаткам лизина, аргинина или гистидина (предпочтительно на этапе клеточной адсорбции ВИЧ - в районе V3 петли гликопротеина вирусной оболочки gp120) и 2) защиты клеточных мембран за счет мембранотропных норборнановых (Nb) фармакофоров (предпочтительно на этапе фузии оболочки вируса с клеточной мембраной).
Синтез соединений формулы I может быть осуществлен:
Способ А. Присоединением аминопроизводных норборнана формулы NH2-Y-Nb к соответствующим олиго- или полимерным (со степенью полимеризации n не менее 15) аналогам янтарного ангидрида (ПА) с последующим гидролизом непрореагировавших ангидридных звеньев и солевой модификацией образующихся в результате гидролиза карбоксикислотных групп:
Либо аналогичный результат достигается
Способ Б. Присоединением тех же аминореагентов к карбоксильным группам не ангидридной, а кислотной формы соответствующих олиго- или полимерных аналогов янтарной кислоты (ПК), но в присутствии конденсирующих агентов (КА):
Настоящее изобретение проиллюстрировано нижеследующими примерами.
Пример 1. Синтез, выделение и очистка соединения Ia, формулы I,
где
среднемассовое значение n=70±20
M=Na
Х=ОН (≤86%), ONH3-Y-Nb (≤7%, аммониевая форма), NH-Y-Nb (≥7%, амидная форма)
2-замещенный норборнан без разделения стерео- (экзо-, эндо- и оптических изомеров), то есть: один из группы R2a, R2b, R3a, R3b составляет ковалентную связь между Nb и Y, а все остальные заместители, включая также R1, R4, R5a, R5b, R6a, R6b, R7a, R7b представляют собой атомы водорода (Н).
Получение соединения Ia по способу А, вариант А-1.
К раствору полиангидридного сополимера формулы ПА-1
0.80 г (0.0060 г-экв. ангидридных реакционных центров) в 9.0 мл сухого диметилсульфоксида (ДМСО) при температуре 25±3°С и интенсивном перемешивании добавляют 0.12 г (0.00085 моля) 2-(1-аминоэтил)норборнана в 0.9 мл сухого толуола. Реакционный раствор перемешивают 1 час при 40°С и 24 часа при 25±3°С. Полимерный продукт высаживают в избыток гексана (50 мл), фильтруют и удаляют остатки органических растворителей в вакууме при 40°С в течение 10 часов. К полученному порошкообразному продукту добавляют 0.52 г (0.006 молей) бикарбоната натрия в 25 мл бидистиллированной воды и перемешивают при комнатной температуре до образования гомогенного раствора. Температуру раствора поднимают до 40-45°С и перемешивают в течение 2 часов, раствор охлаждают до комнатной температуры и выдерживают 48 часов в атмосфере азота. Низкомолекулярные примеси удаляют ультрафильтрацией на мембранах проницаемостью 1 KD. Удаление высокомолекулярных фракций с одновременной стерилизацией продукта осуществляют ультрафильтрацией на мембранах проницаемостью 100 KD. Конечный очищенный продукт выделяют из водной фазы лиофильной сушкой в виде высокопористого порошка белого цвета. Выход 0.95 г (83%).
ЯМР 1Н (D2O, δ, ppm): 4.49 (Н, >СН-O-CH< в положениях 2,5 фуранового цикла фрагмента -Z-), 3.43 (2Н, СН2 в положении 7 Nb-2-экзо), 3.04 (1Н, CH в положении 1 Nb-2-экзо), 2.90 (2Н, СН2 в положении 7 Nb-2-эндо), 2.9-2.7 (1Н, >СН-CO- в составе остатков янтарной кислоты), 2.40-2.35 (CH2 в положениях 5-эндо и 6-экзо Nb-2-экзо, а также в составе фрагмента -Z-), 2.07 (1Н, СН в положении 1 Nb-2-эндо), 2.01 (1Н, СН в положении 4 Nb-2-эндо), 1.94 (1Н, СН2 в положении 2-экзо Nb-2-эндо), 1.83 (1Н, СН2 в положении 3-экзо Nb-2-эндо), 1.74 (1Н, СН2 в положении 6-экзо Nb-2-экзо), 1.62 (1Н, СН2 в положении 2-эндо Nb-2-экзо), 1.60 (1Н, СН2 в положении 5-экзо Nb-2-эндо), 1.57 (1Н, СН2 в положении 6-экзо Nb-2-эндо), 1.40 (1Н, СН2 в положении 5-эндо Nb-2-эндо), 1.23 и 1.15 (2Н, СН2 в положениях 7а и 7b Nb-2-экзо), 1.04 (1Н, СН2 в положении 6-эндо Nb-2-экзо), 0.97 (1Н, СН2 в положении 6-эндо Nb-2-эндо), 0.78 (1Н, СН2 в положении 3-эндо Nb-2-экзо), 0.53 (1Н, СН2 в положении 3-эндо Nb-эндо)
Получение соединения 1а по способу А, вариант А-2.
К раствору полиангидридного сополимера формулы ПА-1 1.17 г (0.0088 г-экв. ангидридных реакционных центров) в 20.0 мл сухого N-метилпирролидона (N-МП) при температуре 20°С добавляют 0.23 г (0.0013 моля) 2-(1-аминоэтил)норборнан хлоргидрата в 2.0 мл сухого N-МП, перемешивают 10 минут и добавляют 0.13 г (0.0013 моля) триэтиламина. Реакционный раствор перемешивают 3 часа при 40°С и оставляют на 24 часа при 25±3°С. Полимерный продукт высаживают в избыток осаждающего раствора, например: пентан (50 мл) + диэтиловый эфир (30 мл) + уксусная кислота (1 мл), фильтруют, промывают пентаном и удаляют остатки органических растворителей в вакууме при 40°С в течение 10 часов. К полученному порошкообразному продукту добавляют 0.71 г (0.0089 молей) бикарбоната натрия в 45 мл бидистиллированной воды и перемешивают при комнатной температуре до образования гомогенного раствора. Температуру раствора поднимают до 40-45°С и перемешивают в течение 2 часов, раствор охлаждают до комнатной температуры и выдерживают 48 часов в атмосфере азота. Низкомолекулярные примеси удаляют диализом на мембранах проницаемостью 1-3 KD. Удаление высокомолекулярных фракций с одновременной стерилизацией продукта осуществляют ультрафильтрацией на мембранах проницаемостью 100 KD. Конечный очищенный продукт выделяют из водной фазы лиофильной сушкой в виде высокопористого порошка белого цвета. Выход 1.28 г (77%). Спектральные и физико-химические характеристики продукта идентичны таковым для продукта, полученного по способу А, вариант А-1.
Получение соединения Ia по способу Б.
К раствору поликислотного сополимера формулы ПК-1
0.91 г (0.012 г-экв. карбоксикислотных реакционных центров) в 9.0 мл сухого диметилсульфоксида (ДМСО) добавляют в качестве конденсирующего агента N,N'-дициклогексилкарбодиимид 1.24 г (0.006 моля) и перемешивают при 45°С 2 часа. К полученной реакционной смеси при интенсивном перемешивании по каплям добавляют 2-(1-аминоэтил)норборнан 0.12 г (0.00085 моля) в 0.9 мл сухого ДМСО, перемешивают 1 час при 40°С. Полимерный продукт высаживают в избыток осадителя, например, пентан + эфир + уксусная кислота (соответственно: 30 мл + 15 мл + 5 мл), фильтруют, фильтрат промывают пентаном и удаляют остатки органических растворителей в вакууме при 40°С в течение 10 часов. К полученному порошкообразному продукту добавляют 0.32 г (0.003 моля) карбоната натрия в 25 мл бидистиллированной воды и перемешивают при 40-45°С в течение 5 часов. Последующие операции выполняют аналогично вышеописанным по способу А. Выход 0.74 г (65%). Спектральные и физико-химические характеристики продукта идентичны таковым для продукта, полученного по способу А.
Соединение Ia прекрасно растворимо в водных и водно-спиртовых средах, а также в ДМСО.
Пример 2. Синтез, выделение и очистка соединения Ib формулы I,
где параметры -Z-, n, М и -Х такие же, как и в предыдущем примере (соединение Ia), но
5-замещенный норборнан-2,3-ен в экзо-изомерной стереоконфигурации (без разделения оптических изомеров), то есть:
-R2b-R3b-= - (двойная связь в положениях 2, 3), а один из экзо-изомерных R5a или R6a составляет ковалентную связь между Nb и Y, тогда как все остальные заместители, включая также R1, R2a, R3a, R4, R5b, R6b, R7a, R7b представляют собой атомы водорода (Н).
Синтез, выделение и очистка соединения Ic осуществляется аналогично таковым процедурам, описанным в примере 1 для соединения Ia, но в качестве аминореагента используется 5-экзо-аминометилен-2,3-норборнен или его хлоргидрат, например, по способу А, вариант А-2.
К раствору полиангидридного сополимера формулы ПА-1 (см. пример 1) 1.17 г (0.0088 г-экв. ангидридных реакционных центров) в 20.0 мл сухого N-метилпирролидона (N-МП) при температуре 20°С добавляют 0.21 г (0.0013 моля) 5-экзо-аминометиленнорборнан-2,3-ен хлоргидрата в 2.0 мл сухого N-МП, перемешивают 10 минут и добавляют 0.13 г (0.0013 моля) триэтиламина. Реакционный раствор перемешивают 3 часа при 40°С и оставляют на 24 часа при 25±3°С. Полимерный продукт высаживают в избыток осаждающего раствора: пентан (50 мл) + диэтиловый эфир (30 мл) + уксусная кислота (1 мл), фильтруют, промывают пентаном и удаляют остатки органических растворителей в вакууме при 40°С в течение 10 часов. К полученному порошкообразному продукту добавляют 0.71 г (0.0089 молей) бикарбоната натрия в 45 мл бидистиллированной воды и перемешивают при комнатной температуре до образования гомогенного раствора. Температуру раствора поднимают до 40-45°С и перемешивают в течение 2 часов, раствор охлаждают до комнатной температуры и выдерживают 48 часов в атмосфере азота. Низкомолекулярные примеси удаляют ультрафильтрацией на мембранах проницаемостью 1 KD. Удаление высокомолекулярных фракций с одновременной стерилизацией продукта осуществляют ультрафильтрацией на мембранах проницаемостью 100 KD. Конечный очищенный продукт выделяют из водной фазы лиофильной сушкой в виде высокопористого порошка белого цвета. Выход 1.36 г (82%).
ЯМР 1H (D2O, δ, ppm): 6.06 (Н, СН в положениях 2 и 3 Nb, при двойной связи), 4.49 (Н, >СН-O-CH< в положениях 2,5 фуранового цикла фрагмента -Z-), 3.31, 3.18 (1Н, СН2 фрагмента -Y-), 2.82 (1Н, СН в положении 1 Nb), 2.9-2.7 (1Н, >СН-CO- в составе остатков янтарной кислоты), 2.63 (1Н, СН в положении 5-эндо Nb), 2.35 (СН2 в составе фрагмента -Z-), 1.56 (1Н, СН2 в положении 6-экзо Nb), 1.25, 1.34 (2Н, СН2 в положении 7 Nb), 1.14 (1Н, СН; в положении 6-эндо Nb).
Соединение Ib прекрасно растворимо в водных и водно-спиртовых средах, а также в ДМСО.
Пример 3. Синтез, выделение и очистка соединения Ic формулы I,
где параметры -Z-, n, М, -Х и -Y- такие же, как и в предыдущем примере 2 (соединение Ib), но
5-замещенный норборнан-2,3-ен в эндо-изомерной стереоконфигурации* (без разделения оптических изомеров,), то есть: -R2b-R3b-= - (двойная связь в положениях 2, 3), а один из эндо-изомерных R5b или R6b составляет ковалентную связь между Nb и Y, тогда как все остальные заместители, включая также R1, R2a, R3a, R4, R5a, R6b, R7a, R7b представляют собой атомы водорода (Н) *Примечание: по фрагменту Nb соединение 1с является эндо-стереоизомерным аналогом соединения Ib, имеющего экзо-изомерную конфигурацию.
Синтез, выделение и очистка соединения 1с осуществляется аналогично таковым процедурам, описанным в примерах 1-2 для соединений Ia и Ib, но в качестве аминореагента используется 5-эндо-аминометилен-2,3-норборнен или его хлоргидрат. Выход 69-88%.
ЯМР 1Н (D2O, δ, ppm): 6.17, 5.95 (Н, СН в положениях 2 и 3 Nb, при двойной связи), 4.49 (Н, >СН-O-CH< в положениях 2,5 фуранового цикла фрагмента -Z-), 3.55, 3.46 (1Н, СН2 фрагмента -Y-), 2.82 (1Н, СН в положении 4 Nb), 2.9-2.7 (1Н, >СН-CO- в составе остатков янтарной кислоты), 2.51 (1Н, СН в положении 1 Nb), 2.35 (CH2 в составе фрагмента -Z-), 2.05 (1Н, СН в положении 5-экзо Nb), 1.69 (1Н, СН2 в положении 6-экзо Nb), 1.54, 1.34 (2Н, CH2 в положении 7 Nb), 1.24 (1Н, СН2 в положении 6-эндо Nb).
Соединение Ic прекрасно растворимо в водных и вводно-спиртовых средах, а также в ДМСО.
Пример 4. Синтез, выделение и очистка соединения Id, формулы I,
где
среднемассовое значение n=80±20
М=К
Х=ОН (≤90%), ONH3-Y-Nb (≤5%, аммониевая форма), NH-Y-Nb (≥5%, амидная форма)
2-замещенный 7,7-диметилнорборнан без разделения стерео- (экзо-, эндо- и оптических изомеров), то есть: один из группы R2a, R2b, R3a, R3b составляет ковалентную связь между Nb и Y, R7a=R7b=СН3, а все остальные заместители, включая R1, R4, R5a, R5b, R6a, R6b представляют собой атомы водорода (Н).
ЯМР 1Н (D2O, δ, ppm): 6.11 (Н, -CH=СН- в положениях 3,4 фуранового цикла фрагмента -Z-), 5.32 (Н, >СН-0-CH< в положениях 2,5 фуранового цикла фрагмента -Z-), 3.04 (Н, СН в положении 1 Nb-2-экзо), 3.3-2.9 (Н, >СН-CO- в составе остатков янтарной кислоты), 2.40-2.35 (Н, СН2 в положениях 5-эндо и 6-экзо Nb-2-экзо и в составе фрагмента -Z-), 2.07 (Н, СН в положении 1 Nb-2-эндо), 2.01 (Н, СН в положении 4 Nb-2-эндо), 1.94 (Н, СН2 в положении 2-экзо Nb-2-эндо), 1.83 (Н, СН2 в положении 3-экзо Nb-2-эндо), 1.74 (Н, СН2 в положении 6-экзо Nb-2-экзо), 1.62 (Н, СН2 в положении 2-эндо Nb-2-экзо), 1.60 (Н, СН2 в положении 5-экзо Nb-2-эндо), 1.57 (Н, СН2 в положении 6-экзо Nb-2-эндо), 1.40 (Н, CH2 в положении 5-эндо Nb-2-эндо), 1.04 (Н, СН2 в положении 6-эндо Nb-2-экзо), 0.97 (Н, СН2 в положении 6-эндо Nb-2-эндо), 0.93 (Н, СН2 в положении 7 Nb), 0.78 (Н, СН2 в положении 3-эндо Nb-2-экзо), 0.53 (Н, СН2 в положении 3-эндо Nb-эндо).
Соединение Id прекрасно растворимо в водных и водно-спиртовых средах, а также в ДМСО.
Пример 5. Токсические свойства соединений формулы I.
5-1. Методики экспериментального тестирования цитотоксичности
Определение числа живых клеток с помощью трипанового синего.
Для определения доз препаратов, вызывающих деструкцию незараженных клеток на 50% (ЦТД50) и на 90% (ЦТД90) исследуемые препараты растворяли в среде RPMI-1640 и вносили в суспензию клеток. Через 48 часов определяли процент живых и мертвых клеток в контрольных (клетки, необработанные препаратами) и опытных (клетки обработанные препаратами) образцах. Подсчет проводили в камере Горяева после окрашивания 0,4% раствором трипанового синего. Полученные данные статистически обрабатывали по методу Ридда и Менча [6].
Определение числа живых клеток с помощью МТТ-теста
МТТ - тест основан на способности клеток переводить растворимый желтый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолиум (МТТ) бромид в нерастворимые внутриклеточные пурпурно-голубые кристаллы МТТ-производного формазана. Это характеризует общую дегидрогеназную активность, которая прямо пропорциональна количеству жизнеспособных клеток. Концентрированный раствор МТТ (КР МТТ; 11 мг/мл) готовится на основе 10-кратного солевого раствора Хэнкса [7].
5-2. Результаты экспериментальной оценки цитотоксичности соединений формулы I
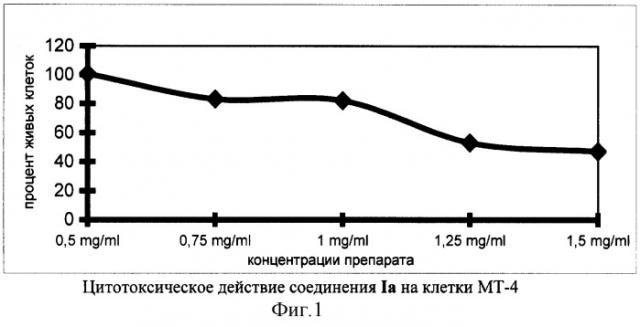
На фиг.1, в качестве примера, представлена зависимость цитотоксического действия производного норборнана (соединение 1а) от его концентрации в культуре клеток МТ-4.
В таблице 1 показано действие производных норборнана формулы I в сравнении с известным референс-препаратом (ремантадин) на жизнеспособность клеток МТ-4
| Таблица 1.Цитотоксичность соединений формулы I в отношении МТ-4 клеток | ||
| Препараты | ЦТД50 (мкг/мл) | ЦТД90 (мкг/мл) |
| Соединение Ia | 1260 | 2750 |
| Соединение Ib | 1100 | 1150 |
| Соединение Ic | >1000 | - |
| Ремантадин | 160 | 340 |
В таблице 2 показано действие производных норборнена на жизнеспособность клеток "MAGI" (HeLa-CD4+-LTR/β-gal). Клетки "MAGI" - модифицированные монослойные клетки HeLa, содержащие встроенный рецептор CD4 и интегрированную копию гена β-галактозидазы под контролем LTR ВИЧ-1 [8].
| Таблица 2.Цитотоксичность соединений формулы I в отношении клеток "MAGI" | ||
| Препараты | ЦТД50 (мкг/мл) | ЦТД90 (мкг/мл) |
| Соединение Ia | 1260 | 3750 |
| Соединение Ib | 1325 | 2225 |
Приведенные данные показывают, что соединения формулы I являются нетоксичными даже в высоких концентрациях и их токсичность в несколько раз меньше токсичности ремантадина, применяемого в клинической практике в качестве противогриппозного препарата.
Пример 6. Противовирусная активность соединений формулы I в качестве ингибиторов репродукции ВИЧ-1
ВИЧ-1 ингибирующую эффективность соединений оценивали на экспериментальной модели вирус - клетка (in vitro) в присутствии соединений, вносимых в клеточную культуру в различных концентрациях и в различное время по отношению к моменту внесения вируса.
Инфицирование лимфобластоидных клеток МТ-4 ВИЧ-1 проводили, добавляя осветленную вируссодержащую жидкость к клеточной суспензии в концентрации 2×106 клеток/мл и множественностью заражения 0,1-0,2 TCID50/кл. Влияние препаратов на репродукцию ВИЧ-1 количественно оценивали по уровню белков ВИЧ-1, определяемых методами электрофореза в ПААГ и иммуноблотинга. На фиг.2 показан пример ингибирующего действия соединения Ia на репликацию ВИЧ-1 (штамм 899).
Влияние соединений формулы I на ранние события в ходе ВИЧ-инфекции, включающие стадии от узнавания вирусом специфических рецепторов и до интеграции вирусного генома в геном клетки-хозяина, исследовались в одноцикловом анализе инфекционности путем заражения монослоя индикаторных клеток "MAGI". Для заражения клеток готовили серию двукратных разведений вируса от 1:2 до 1:64. Количество инфицированных клеток оценивали по уровню активации интегрированной β-галактозидазы в реакции гидролиза X-gal. На фиг.3 представлен пример экспериментальной оценки противовирусной эффективности соединения Ib.
Результаты экспериментальных испытаний показывают, что наиболее полное подавление репликации ВИЧ происходит при внесении соединений формулы I одновременно с вирусом, в то время как при предобработке клеток этими препаратами ингибирование репликации ВИЧ менее значительно. При добавлении препаратов через 1 час после внесения вируса уровень подавления репликации снижается, а при внесении препаратов через 4 часа подавления репликации не отмечалось. Эти данные указывают на то, что основное ингибирующее действие соединений формулы I проявляется в течение первого часа инфекции. Таким образом, препараты подавляют репликацию ВИЧ на ранних стадиях инфекции, т.е. действуют, по-видимому, на адсорбцию вируса на клетке-мишени. Тем не менее, и при внесении препаратов после адсорбции вируса наблюдалось подавление репликации ВИЧ, на основании чего можно предположить, что препараты влияют не только на вирусную адсорбцию, но и на последующие ранние этапы репликации ВИЧ. Это могут быть фузия вирусных и клеточных мембран, раздевание вируса или транспорт вирусной РНК и белков в ядро. С учетом липофильной мембранотропной природы норборнановых фармакофоров [2] наиболее вероятной терапевтической мишенью является фузия оболочки вируса и клеточной мембраны.
Действие производных норборнана на инфекцию, вызванную АЗТ-резистентным штаммом ВИЧ-1.
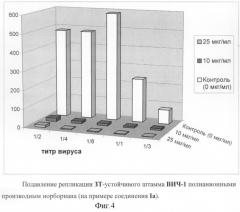
Азидотимидин (АЗТ) является наиболее широко и давно используемым препаратом для терапии ВИЧ-инфекции. К сожалению, его применение ограничивается быстрым возникновением вирусной резистентности. Поэтому особое значение приобретает разработка и применение препаратов с другими механизмами действия, которые могли бы применяться после длительного применения АЗТ, и эффективно подавляли бы вирусные штаммы, устойчивые к АЗТ и другим нуклеозидным ингибиторам обратной транскриптазы. Для того чтобы показать эффективность соединений при подавлении инфекции, вызванной устойчивым к АЗТ вариантом, был использован вирус с высокой степенью устойчивости к АЗТ. Способность соединений подавлять репликацию АЗТ-резистентного штамма ВИЧ-1 была протестирована в одноцикловом анализе инфекционности, например, фиг.4. Как видно из чертежа, соединение Ia в концентрации 10 мкг/мл полностью подавляет репликацию АЗТ-устойчивого штамма ВИЧ-1. Соединения Ib и 1с также эффективно подавляют репликацию АЗТ-устойчивого штамма ВИЧ-1, но в концентрациях 25-50 мкг/мл.
Химиотерапевтическая оценка соединений формулы I
Чтобы оценить перспективность описываемых настоящим изобретением соединений, как возможных химиотерапевтических средств был рассчитан индекс селективности (ИС), который наиболее статистически достоверно характеризует специфическую противовирусную активность препаратов [9]
где ЦТД50 - концентрация соединения, вызывающая снижение жизнеспособности клеток на 50% (см. пример 4),
ИД50 - концентрация соединения, подавляющая репликацию ВИЧ на 50%.
При оптимальном времени внесения препаратов (одновременно с вирусом) индекс селективности соединений формулы I превышает 100.
Таким образом, обнаружено, что соединения формулы I проявляют выраженную ВИЧ-ингибирующую активность на клеточных культурах, причем их противовирусное действие проявляется на самой ранней стадии инфекционного цикла ВИЧ-1 - на начальных этапах проникновения вируса в клетку. Описанные соединения имеют высокий индекс селективности и эффективны в отношении штаммов ВИЧ-1, устойчивых к действию известного клинического препарата азидотимидина. Полученные данные подтверждают перспективность полианионных производных норборнана - соединений формулы I в качестве возможных химиотерапевтических средств или биологически активных субстанций в составе лекарственных форм противовирусного назначения.
Источники информации
1a. Машковский М.Д. Лекарственные средства, "Издательство Новая Волна", 2002, том 2, стр.326.
1б. Машковский М.Д. Лекарственные средства, "Издательство Новая Волна", 2002, том 2, стр.325-326.
2. Киселев О.И., Блинов В.М., Ильенко Ю.И., Платонов В.Г., Чупахин О.Н., Стукова М.А., Каргинов В.А. Молекулярный механизм действия антивирусных препаратов адамантанового ряда.\\Вестн. Рос. Акад. Мед. Наук 1993 (3): 10-15.
3. Boukrinskaia A.G., Serbin A.V., Bogdan O.P., Stotskaya L.L., Alymova I.V., Klimochkin Yu.N. Polymeric Adamantane Analogues. United States Patent US 005880154 A, 1999, Mar.9.
4. Burstein M.E., Serbin A.V., Khakhulina T.V., Alymova I.V., Stotskaya L.L., Bogdan O.P., Manukchina E.E., Jdanov V.V., Sharova N.K., Bukrinskaya A.G. Inhibition of HIV-1 replication by newly developed adamantane-containmg polyanionic agents. Antiviral Research. 1999 Apr; 41 (3): 135-44.
5. Муравьева Д.А., Самылина И.А., Яковлев Г.П. Фармакогнозия. М.: "Медицина", 2002, 654 с.
6. Reed L.T., Muench H.A. A simple method for estimating fifty percent endpoints.//Amer. J. Hyg. 1938 (27): 493.
7. Vistica D.T., Scehan P., Scudiero D. et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. // Cancer Research 1991. 51: 2515-2520.
8. Kimpton J., Emerman M. Detection of replication component and pseudotyped human immunodeficiency virus with a sensitive cell line on the basis of activation of an integrated beta-galactosidase gene.//J. Virol. 1992 (66): 2232-39.
9. Новохатский А.С., Ершов Ф.И. Определение биосинтетического химиотерапевтического индекса противовирусных препаратов в культуре клеток.\\Вопросы вирусологии, 1976 (4): 468-473.
1. Полианионные производные норборнана((бицикло[2,2,1]гептана)общей формулы:
где
или остаток другого кислородсодержащего мономера, например
n≥15, предпочтительно n=35-100 (степень полимеризации);
М=Н, Na, К, NH4;
Х=ОН, ОМ, ONH3-Y-Nb, -NH-Y-Nb,
причем в ряду указанных модификаций химического фрагмента Х не менее 3% от общего числа Х составляет совокупная доля вариантов ONH3-Y-Nb и NH-Y-Nb (степень модификации норборнаном), в которых "спейсерная" группа -Y-=-(Y1)m-, где Yi=СН2, СН(СН2), СН(СН2СН3), m≥0 (предпочтительно m=1-3), а "норборнановый фармакофор" описывается формулой
где
каркасный бициклический углеродный остов норборнана, включающий семь атомов углерода (С) в положениях 1-7, где в ряду выше обозначенных двенадцати заместителей R1, R2а, R2b, R3a, R3b, R4, R5a, R5b, R6a, R6b, R7a, R7b один (любой) из них представляет собой - (ковалентную связь между Nb и Y), тогда как остальные одиннадцать =Н, или алкил, или попарно составляют ковалентную химическую связь в пределах бициклического углеводородного остова, то есть дополнительную (двойную) связь между атомами углерода.
2. Способ получения соединений по п.1, заключающийся в химической модификации соответствующих аминопроизводных норборнана полианионными олигомерами или полимерами, включающими звенья янтарного ангидрида или янтарной кислоты, с последующим переводом полученного соединения в карбоксикислотную, либо карбоксикислотно-солевую форму, выделением и очисткой с применением методов разделения веществ различной молекулярной массы.
3. Полианионные производные по п.1, обладающие избирательной противовирусной активностью в отношении вируса иммунодефицита человека (на самых ранних этапах вирусного инфицирования клеток), включая штаммы ВИЧ, устойчивые к действию традиционных клинических препаратов на основе азидотимидина.