Способ оценки токсичности бактериальных антигенов
Иллюстрации
Показать всеИзобретение относится к области микробиологии и иммунологии и может быть использовано для оценки токсичности бактериальных антигенов. Сущность изобретения состоит в том, что в культуру инфузорий Paramecium caudatum вносят исследуемый антиген в различных разведениях, выдерживают в течение трех минут при комнатной температуре, подсчитывают число сокращений выделительных вакуолей за 1 мин у 6-7 инфузорий, определяют токсическое воздействие бактериального антигена по степени угнетения выделительной функции инфузорий, и за токсическую концентрацию принимают концентрацию антигена, снижающую на 50% число сокращений выделительных вакуолей инфузорий по сравнению с контролем. Техническим результатом является разработка высокочувствительного и быстрого способа оценки токсичности бактериальных антигенов. 2 табл., 5 ил.
Реферат
Изобретение относится к области медицины, в частности к микробиологии и иммунологии, и может найти применение при разработке новых химических вакцин на основе бактериальных антигенов. До настоящего времени практическое здравоохранение не имеет вакцин против некоторых особо опасных инфекций, в том числе против сапа и мелиоидоза. Мелиоидозная инфекция в современных условиях имеет тенденцию к распространению далеко за пределы эндемичных очагов за счет расширения экономических и культурных международных связей и усиления процессов миграции населения. В связи с этим весьма актуальной остается проблема создания химической вакцины против мелиоидозной инфекции.
Одним из важных и необходимых этапов при отборе бактериальных антигенов в качестве возможных компонентов химической вакцины является изучение их токсических свойств.
Токсичность бактериальных антигенов изучается как на лабораторных животных in vivo, так и в условиях in vitro на моделях различных клеток, в частности на культурах макрофагов животных, культурах перевиваемых клеточных линий (1). Способ оценки токсичности на одноклеточных организмах - инфузориях также используется в медицинских и гигиенических исследованиях, отличается достаточной простотой и может применяться в любой санитарно-бактериологической лаборатории. Инфузории, будучи клеткой и организмом одновременно, позволяют оценить разнообразные воздействия как на клеточном, так и на более высоком организменном уровне.
Описан метод определения токсичности на культуре инфузорий Tetrachymena pyriformis по степени задержки роста культуры под воздействием исследуемого вещества (2). Однако данный метод достаточно трудоемок, связан с необходимостью суточного культивирования и многократного измерения плотности культуры при подсчете в камере Горяева, а также с необходимостью обработки инфузорий формалином. При этом остается неясным, за счет каких механизмов уменьшается численность популяции инфузорий: за счет их частичной гибели или за счет торможения процесса размножения или по другим причинам.
Наиболее близким аналогом является работа (3), в которой для оценки токсичности веществ используется критерий гибели инфузорий, однако такой способ недостаточно чувствителен, поскольку не позволяет определять токсические дозы веществ, нарушающие жизнедеятельность клеток без необратимых последствий, неизбежно ведущих к их гибели.
Цель изобретения - повышение чувствительности, упрощение и ускорение метода оценки токсичности бактериальных антигенов.
Поставленная цель достигается за счет регистрации функциональных изменений у инфузорий, наступающих задолго до грубых морфологических нарушений, ведущих к гибели клетки. В качестве критерия оценки токсичности антигенов предлагается использовать уменьшение на 50% числа сокращений выделительных (сократительных) вакуолей инфузорий Paramecium caudatum при добавлении в их культуру испытуемого антигена.
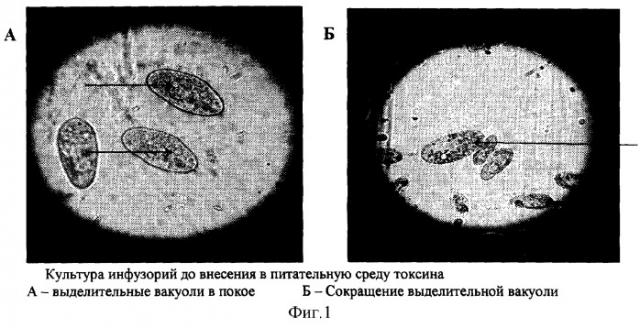
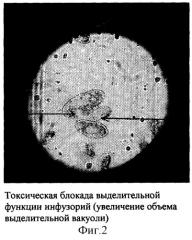
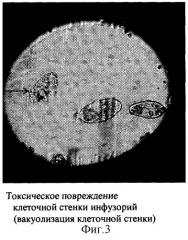
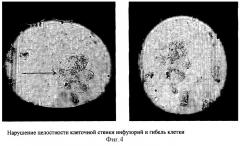
Инфузории Paramecium caudatum имеют две сократительные (выделительные) вакуоли - одна в передней, другая - в задней части тела (фиг.1). Вакуоли попеременно сокращаются по мере наполнения их жидкостью с продуктами обмена веществ и выбрасывают содержимое в окружающую среду через специальное отверстие в клеточной стенке - экскреторную пору. Длительность интервала между двумя сокращениями вакуолей (частота пульсации) зависит от температуры окружающей среды (при температуре 16°С она равна 3-4 в мин) (4). При добавлении в среду токсического вещества оно немедленно поступает внутрь инфузории, т.к. всасывание происходит всей поверхностью ее тела. Токсические вещества, поступившие внутрь клетки, нарушают ее жизнедеятельность, что сказывается и на выделительной системе, число сокращений выделительных вакуолей уменьшается вплоть до полной блокады их функции. При полном прекращении сокращений вакуоли переполняются продуктами обмена, их объем значительно увеличивается (фиг.2).Следующим этапом губительного действия токсина на инфузории при его высокой концентрации в среде являются грубые морфологические изменения в клеточной стенке инфузорий в виде множественных округлых выростов («вакуолизация» клеточной стенки), которые затем разрываются и содержимое клетки (эндоплазма) выходит в окружающую среду (фиг.3, 4).
Предлагается метод оценки токсичности бактериальных антигенов на физиологическом уровне - по урежению числа сокращений выделительных вакуолей на 50%, когда морфологические изменения в клетке еще не наступают.
Методика проведения опыта по определению токсичности бактериальных антигенов
Раствор бактериального антигена (на физиологическом растворе) в исходной концентрации последовательно разводится в лунках полистироловой планшеты. Тестирование токсичности начинают с наименьшей концентрацией антигена. Для этого в отдельную лунку планшеты вносят 100 мкл питательной среды с инфузориями, добавляют 100 мкл раствора антигена и оставляют на 3 мин при комнатной температуре. В контрольную лунку к 100 мкл среды с инфузориями добавляют 100 мкл физ. раствора. Через 3 мин по 25 мкл содержимого опытной и контрольной лунок помещают на предметное стекло, добавляют несколько волокон ваты для ограничения движений инфузорий, сверху накрывают покровным стеклом и микроскопируют препараты в световом микроскопе с использованием синих светофильтров или фазово-контрастного устройства. Подсчитывают число сокращений выделительных вакуолей в минуту у 6-7 особей. При температуре воды 28-30°С без добавления токсического вещества число сокращений обычно составляло 7-8 в мин. В опытных пробах в зависимости от степени токсичности антигена число сокращений уменьшалось вплоть до их полного отсутствия. За токсическую дозу принимали такую концентрацию антигена, которая угнетала на 50% выделительную функцию инфузорий, то есть число сокращений вакуолей составляло 3-4 в мин (ЦТЕ 50). Питательной средой для инфузорий Paramecium caudatum служит настой лугового сена (10 г на 1 литр воды), который кипятят 15 мин, в течение которых все простейшие и их цисты погибают, но сохраняются споры сенной палочки. Через 2-3 дня из спор развиваются бактерии, необходимые для питания парамеций. В готовый питательный раствор вносят культуру инфузорий, которая культивируется далее при комнатной температуре и интенсивном солнечном освещении.
Пример 1.
Для определения токсических свойств были использованы следующие бактериальные антигены:
1 - водно-солевой экстракт (ВСЭ) бактерий возбудителя мелиоидоза - Burkholderia pseudomallei С-141;
2 - ВСЭ бактерий возбудителя сапа - Burkholderia mallei В-120;
3 - ВСЭ непатогенных буркхольдерий -Burkholderia thailandensis;
4 - ультразвуковой (УЗ) дезинтеграт бактерий возбудителя чумы - Yersinia pestis 358/80;
5 - УЗ-дезинтеграт бактерий возбудителя сапа B.mallei Ц-5;
6 - V фракция по Бейкеру, полученная при фракционировании сульфатом аммония водно-солевого экстракта бактерий возбудителя чумы Y.pestis 231;
7 - холерный токсин из возбудителя холеры - Vibrio cholerae (Serva);
8 - актиномицин С (Serva).
Актиномицин С был использован в качестве контрольного препарата, известного своей высокой токсичностью, цитопатогенным и иммуносупрессивным действием. Исследование каждого антигена проводили в 6 повторностях. Статистический анализ результатов осуществляли с определением средних величин и доверительных интервалов для уровня достоверности 95% (5).
Нами показано, что дозы бактериальных антигенов, вызывающие «вакуолизацию» клеточной стенки и разрушение инфузорий (DCL), в 8-26 раз выше доз, угнетающих на 50% их выделительную функцию (ЦТЕ 50) (табл.1, фиг.5).
| Таблица 1Параметры токсического действия бактериальных антигенов на культуру инфузорий по критериям угнетения выделительной функции и гибели клеток | ||||
| №№п/п | Препарат | Токсическое действие, мкг/мл (М±m) | ||
| Угнетение выделител. функции (ЦТЕ 50) | Гибель клеток (DCL) | Соотношение DCl/ЦТЕ50 | ||
| 1 | 2 | 3 | 4 | 5 |
| 1, | ВСЭ В.pseudomallei С-141 | 3,02±0,96 | 33,8±4,1 | 10,5 |
| 2. | ВСЭ B.mallei В-120 | 2,14±0,59 | 27,1±3,32 | 12,6 |
| 3. | ВСЭ В.thailandensis | 3,82±1,1 | 46,5±4,68 | 12,1 |
| 4. | УЗ-дезинтеграт Y.pestis 358/80 | 6,65±1,34 | 58,5±5,09 | 8,7 |
| 5. | УЗ-дезинтеграт B.mallei Ц-5 | 2,91±0,63 | 28,12±3,12 | 9,7 |
| 6. | V фракция по Бейкеру из Y.pestis 231 | 3,82±0,94 | 70,0±5,84 | 18,3 |
| 7. | Холерный токсин | 0,36±0,08 | 7,02±1,63 | 19,5 |
| 8. | Актиномицин С | 0,33±0,06 | 8,58±1,76 | 26,0 |
Мы провели сравнительное изучение токсичности бактериальных антигенов на разных типах клеток: мышиных фибробластах L-929, клетках овариальной опухоли китайского хомячка СНО К-1, перитонеальных макрофагах (ПМ) мышей BALB/C и на инфузориях Paramecium caudatum. Токсичность на клетках L-929, СНО К-1 и ПМ оценивали по обычной методике через 24 часа контакта с антигеном по гибели 50% клеток в лунках полистироловой планшеты (1), токсичность на инфузориях - по угнетению на 50% их выделительной функции.
Сводные результаты нескольких экспериментов представлены в табл.2.
| Таблица 2Сравнительная токсичность бактериальных антигенов для разных типов клеток | |||||
| №№п/п | Препарат | Токсичность, мкг/мл (М±m) | |||
| СНО К-1 | L-929 | ПМ | Р. caudatum | ||
| 1. | ВСЭ B.pseudomallei C-141 | 2,76±0,71 | 3,52±0,86 | 8,36±1,62 | 3,02±0,96 |
| 2. | ВСЭ B.mallei B-120 | 2,83±0,54 | 6,4±1,68 | 18,06±2,44 | 2,14±0,59 |
| 3. | ВСЭ B.thailandensis | 3,83±1,56 | 4,46±1,8 | 9,0±1,9 | 3,82±1,1 |
| 4. | УЗ-дезинтеграт Y.pestis 358/80 | 12,9±1,94 | 9,7±2,3 | 22,7±3,1 | 6,65±1,34 |
| 5. | УЗ-дезинтеграт B.mallei Ц-5 | 3,36±1,13 | 6,49±2,26 | 14,56±2,31 | 2,91±0,63 |
| 6. | V фракция по Бейкеру из Y.pestis 231 | 3,96±1,2 | 6,4±1,82 | 18,06±2,32 | 3,82±0,94 |
| 7. | Холерный токсин | 0,22±0,04 | 0,68±0,11 | 0,32±0,04 | 0,36±0,08 |
| 8. | Актиномицин С | 0,17±0,03 | 0,91±0,13 | 0,40±0,07 | 0,33±0,06 |
Как видно из табл.2, метод определения токсичности по угнетению выделительной функции на инфузориях сравним по чувствительности с тестированием на клетках опухолевых линий L-929 и СНО К-1, однако выгодно отличается быстротой и простотой. Кроме того, работа с перевиваемыми клеточными линиями невозможна без специального оборудования и реактивов (CO2 - инкубатор, ламинарный шкаф, специальные питательные среды и стерильная посуда для культивирования).
Приведенные результаты показывают, что предлагаемый метод оценки токсичности бактериальных антигенов на инфузориях Paramecium caudatum отличается простотой, возможностью получения быстрого ответа и позволяет оценивать токсичность на физиологическом уровне.
СПИСОК ЛИТЕРАТУРЫ
1. Сальникова О.И. Тестирование и изучение токсинов холерного вибриона в культуре монослойных клеток/ Дисс.канд.биол.наук, Ростов-на-Дону, 1994.
2. Этлин С.Н., Лахонина Г.М., Ирлина И.С., Попова Л.А., Малыгин С.А. (Изучение связей между параметрами токсичности химических веществ для инфузорий Tetrahymena pyriformis и животных// Ж.Гигиена и санитария, 1987, №9, С.80-82.
3. Цикуниб А.Д.. Определение эндогенной интоксикации по токсикоурии с использованием Tetrahymena pyriformis// Клин. лаборатор. диагностика, 2001, №6, С.50-52.
4. Зеликман А.Л. /Практикум по зоологии беспозвоночных// М., «Высшая школа», 1969, С.31.
5. Ашмарин И.П., Воробьев А.Н. Статистические методы в микробиологических исследованиях//Л., 1962, С.10-21.
Способ определения токсической концентрации бактериального антигена,. отличающийся тем, что в культуру инфузорий Paramecium caudatum вносят исследуемый антиген в различных разведениях, выдерживают в течение трех минут при комнатной температуре, подсчитывают число сокращений выделительных вакуолей за 1 мин у 6-7 инфузорий, определяют токсическое воздействие бактериального антигена по степени угнетения выделительной функции инфузорий и за токсическую концентрацию принимают концентрацию антигена, снижающую на 50% число сокращений выделительных вакуолей инфузорий по сравнению с контролем.