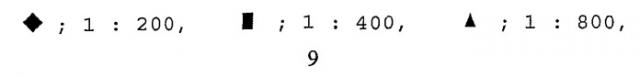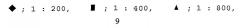Способ и диагностический набор для измерения количества белка бетта ig-h3
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способа диагностики заболеваний, связанных со сверхэкспрессией белка β ig-h3 и диагностического набора для его осуществления. Сущность изобретения заключается в измерении уровня белка β ig-h3 в жидкости организма пациента с использованием антитела, специфического в отношении белка β ig-h3, и диагностике заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний, а также набора для диагностики поражений этих органов. Преимущество изобретения заключается в разработке экспресс-метода для предварительной диагностики заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний. 2 н. и 10 з.п. ф-лы, 5 табл., 19 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу и диагностическому набору для измерения количества белка β ig-h3. В частности, оно относится к способу измерения количества белка β ig-h3 в жидкостях организма с помощью реакции специфического связывания белка β ig-h3 или рекомбинантных белков, содержащих домен fas-1 белка β ig-h3 (включая их фрагменты или производные), с лигандами, а также оно относится к набору для диагностики заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний, содержащему белок β ig-h3 или рекомбинантные белки, соответствующие домену fas-1 белка β ig-h3 (включая их фрагменты или производные), и их лиганды.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
β ig-h3 представляет собой белок внеклеточного матрикса, который индуцируется под действием TGF-β в клетках разных видов, в том числе в клетках меланомы человека, эпителиальных клетках молочной железы, кератиноцитах и легочных фибробластах. TGF-β (трансформирующий фактор роста-β) участвует в процессах роста и дифференцировки во многих видах клеток, причем у млекопитающих обнаружено три вида TGF-β (TGF-β 1, TGF-β 2 и TGF-β 3). Известно, что TGF-β выполняет много сложных функций, таких как регуляция роста, регуляция иммунного ответа, стимуляция костеобразования, в том числе специфических макромолекул хрящевой ткани, стимуляция заживления ран и др. (Bennett, N. T. et al., Am. J. Surg. 1993,165, 728). TGF-β экспрессируется в эпителиальных клетках во время заживления ран, возможно, для стимуляции экспрессии интегрина в кератиноцитах в процессе регенерации эпителиальных клеток. Последние исследования по экспрессии TGF-β показали, что мРНК TGF-β 3 экспрессируется как в эпителии нормальной кожи, так и в эпителии, восстанавливающемся после острых или хронических повреждений, тогда как мРНК TGF-β 1 экспрессируется только в регенерированном эпителии после острых повреждений, а мРНК TGF-β 2 не экспрессируется совсем (Schmid, P. et al., J. Pathol., 1993, 171, 191). Хотя конкретная теория для механизма осуществления вышеописанных процессов еще не установлена, полагают, что TGF-β играет ключевую роль в регенерации эпителия.
β ig-h3, индуцируемый TGF-β ген h3, впервые обнаружен Stonier et al. А именно, β ig-h3 обнаружен в результате анализа данных, полученных при дифференциальном скрининге библиотеки кДНК клеточной линии A549, клеточной линии аденокарциномы легких человека, обработанной TGF-β 1; показано, что через 2 дня после обработки TGF-β 1 уровень β ig-h3 увеличивается в 20 раз (Stonier, J. et al., DNA cell Biol., 1992, 11, 511). Секвенирование ДНК также показало, что β ig-h3 состоит из 683 аминокислот, представленных в SEQ ID NO: 1, имеет аминоконцевую секреторную последовательность и карбоксиконцевой фрагмент Arg-Gly-Asp (RGD), обеспечивающий лигандное распознавание лиганда некоторых интегринов.
β ig-h3 содержит 4 гомогенных внутренних повторяющихся домена наряду с мотивом RGD, который присутствует в мембранных или секреторных белках млекопитающих, насекомых, морских ежей, растений, дрожжей, бактерий и др. как высоко консервативная последовательность. Такие белки, как периостин, фасциклин I, HLC-2 морского ежа, водорослей CAM и MPB70 микобактерии, также содержат вышеуказанную консервативную последовательность (Kawamoto, T. et al.,Biochem. Biophys. Acta., 1998, 1395,288). Гомогенный домен (далее называемый "домен fas-1"), высоко консервативный в данных белках, состоит из 110-140 аминокислот и включает в себя две очень консервативные ветви (H1 и H2), каждая из которых состоит из 10 аминокислот. β ig-h3, периостин и фасциклин I имеют 4 домена fas-1, HCL-2 имеет 2, а MPB70 - только 1 домен fas-1. Известно, что некоторые из указанных белков, в качестве молекул клеточной адгезии, опосредуют присоединение и отсоединение клеток, хотя биологические функции данных белков до конца еще не выяснены. Например, β ig-h3, периостин и фасциклин I опосредуют присоединение фибробластов, остеобластов и нервных клеток, соответственно, а водорослей CAM, как установлено, является молекулой клеточной адгезии, постоянно присутствующей в зародышах вольвокса (LeBaron, R. G. et al., J. Invest. Dermatol., 104, 844, 1995; Horiuchi, K. et al., J. Bone Miner. Res., 1999, 14, 1239; Huber, O. et al., EMBO J., 1994, 13, 4212).
Очищенный белок β ig-h3 стимулирует адгезию и рост фибробластов кожи, но препятствует адгезии клеток A549, HeLa и WI-38 в среде, не содержащей сыворотки. В особенности β ig-h3 препятствует росту, колониеобразованию и появлению опухолевых клеток. Действительно, рост опухолевой клетки у мышей nude, полученной трансфицированием яйцеклеток китайского хомячка экспрессирующим вектором β ig-h3, значительно уменьшается, что четко установлено в патентах США №5714588 и №5599788. Кроме того, в данных патентах также приводится способ стимуляции роста и адгезии фибробластов в районе поврежденной области путем приведения раны в контакт с требующимся количеством β ig-h3. Следовательно, как молекула клеточной адгезии, в значительной степени индуцируемая TGF-β в клетках разных типов, β ig-h3 играет важную роль в процессах клеточного роста, клеточной дифференцировки, заживления ран, морфогенеза и клеточной адгезии.
Хотя β ig-h3 является эффективным полезным веществом, оно обеспечивается не полностью, так как в организме человека образуется только минимальное количество β ig-h3. Для решения данной проблемы был разработан способ получения β ig-h3 путем экспрессии его в системе эукариотической клетки с использованием методов генной инженерии. В данном случае, однако, клетки, продуцирующие β ig-h3, растут гораздо медленнее, чем другие клетки, что затрудняет получение достаточного количества клеток, продуцирующих β ig-h3. Следовательно, авторы настоящего изобретения разработали способ очистки, который позволяет осуществлять высокопродуктивную экспрессию рекомбинантных белков, содержащих целый белок β ig-h3 или какой-либо из его доменов, с использованием E. coli в качестве хозяина, подтвердили, что данные рекомбинантные белки поддерживают клеточную адгезию и клеточный рост, и подали заявку на патент (патентная заявка Кореи №2000-25664).
Активность β ig-h3 как молекулы клеточной адгезии впервые была описана для фибробластов кожи человека и затем раскрыта для хондроцитов, перитонеальных фибробластов, а также для человеческих фибробластов MRC5. Было предположено, что клеточно-адгезивная активность β ig-h3 опосредуется мотивом RGD, находящимся на карбоксильном конце β ig-h3 в первые дни. Однако позднее было опубликовано, что для стимуляции роста хондроцитов мотив RGD не требуется, а зрелый β ig-h3, в котором мотив RGD утрачивается в результате процессинга карбоксильного конца, может препятствовать клеточной адгезии. В результате было подтверждено, что мотив RGD не является необходимым медиатором для обеспечения клеточно-адгезивной активности β ig-h3. Последние исследования дополнительно подтвердили, что β ig-h3 стимулирует клеточную адгезию и рост, особенно рост фибробластов, независимо от интегрина α1β1, хотя присутствие мотива RGD в β ig-h3 не является обязательным для клеточного роста, опосредованного β ig-h3 (Ohno, S., et al., Biochim. Biophys. Acta, 1999, 1451, 196). Кроме того, было доказано, что пептиды H1 и H2, присутствующие в β ig-h3, не влияют на клеточную адгезию, опосредованную β ig-h3, это позволило предположить, что некоторые аминокислоты, необходимые для клеточной адгезии, расположены не в H1 и H2, а в других участках β ig-h3. Для подтверждения вышесказанного с помощью компьютера анализировали гомологию повторяющегося домена fas-1 белка β ig-h3 и доменов fas-1 других белков, в результате было показано, что в β ig-h3 существует много других консервативных аминокислот, кроме H1 и H2, которые участвуют в клеточной адгезии.
Поэтому авторы настоящего изобретения предприняли попытки обнаружить консервативный мотив, участвующий в активности, касающейся клеточной адгезии и отлипания клеток, и получить содержащий его пептид. В результате авторы настоящего изобретения получили пептиды NKDIL, EPDIM, а также их производные, которые, работая вместе с интегрином 3β 1, опосредуют клеточную адгезию и отлипание клеток, для получения пептидов использовали второй и четвертый домены β ig-h3, известного как молекула клеточной адгезии, а также они раскрыли, что две очень консервативные аминокислоты, аспарагиновая кислота (Asp) и изолейцин (Ile), расположенные вблизи участка H2 во втором и четвертом доменах β ig-h3, необходимы для проявления активности, касающейся клеточной адгезии и отлипания клеток, что позволило им подать заявку на патент (патентная заявка Кореи №2000-25665).
На сегодняшний день не существует публикаций, свидетельствующих о том, что β ig-h3 непосредственно связан с заболеваниями, однако, по-видимому, β ig-h3 связан с некоторыми видами рака человека. Взаимосвязь экспрессии β ig-h3 и развития заболеваний почек, печени, ревматоидного артрита и сердечно-сосудистых заболеваний еще не выяснена, возможность использовать белок β ig-h3 для диагноза заболеваний путем измерения количества белка β ig-h3 в жидкостях организма тоже еще не обсуждалась.
Таким образом, авторы настоящего изобретения разработали способ измерения количества β ig-h3 с использованием рекомбинантного белка, полученного путем соединения нескольких β ig-h3 или четвертого домена fas-1 белка β ig-h3, в качестве стандартного белка, а также содержащий его диагностический набор. Авторы настоящего изобретения завершили работу подтверждением того, что способ и набор по настоящему изобретению можно эффективно использовать как чувствительный способ диагностики степени поражения или развития заболеваний почек, печени, ревматоидного артрита и сердечно-сосудистых заболеваний.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение способа измерения количества белка β ig-h3 с использованием белка β ig-h3 или рекомбинантных белков, включающих в себя домены fas-1 белка β ig-h3, а также диагностического набора, содержащего упомянутые белки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
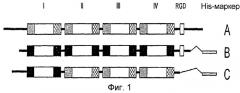
На фиг. 1 приведена диаграмма, изображающая структуру рекомбинантного белка β ig- h3,
I, II, III и IV: каждый домен,
и консервативный участок основной последовательности
A: β ig-h3; B: человеческий β ig-h3; C: мышиный β ig-h3
На фиг. 2 приведена диаграмма, изображающая геометрическую структуру рекомбинантных белков β ig-h3 D-IV, полученных путем повторения доменов IV белка β ig-h3,
A: β ig-h3;B:
β ig-h3 D-IV(1x);
C: β ig-h3 D-IV (2x);
D: β ig-h3 D-IV(3x);
E: β ig-h3 D-IV (4x)
На фиг. 3 приведена фотография электрофореза выделенного рекомбинантного белка β ig-h3,
| 1: человеческий β ig-h3; | 2: мышиный β ig-h3 |
На фиг. 4 приведена фотография электрофореза белков β ig-h3 D-IV (1x, 2x, 3x, 4x),
| 1: β ig-h3 D-IV(1x); | 2: β ig-h3 D-IV (2x); |
| 3: β ig-h3 D-IV(3x); | 4: β ig-h3 D-IV (4x) |
На фиг. 5 приведена фотография, показывающая результат вестерн-блоттинга с использованием первичных антител, с помощью которого идентифицируют человеческий β ig-h3 и мышиный β ig-h3,
| 1: человеческий β ig-h3; | 2: мышиный β ig-h3 |
На фиг. 6 приведена диаграмма, демонстрирующая принцип твердофазного иммуноферментного анализа (ELISA)
На фиг. 7 приведен график, демонстрирующий количественные соотношения первичных антител,
На фиг. 8 приведен график, демонстрирующий количественные соотношения вторичных антител,
A: фиксированные первичные антитела, 1:1600;
В: фиксированные первичные антитела, 1:2000;
: разбавленные вторичные антитела, 1:1000;
: разбавленные вторичные антитела, 1:2000;
: разбавленные вторичные антитела, 1:3000
На фиг. 9 приведен график, демонстрирующий покрывающую концентрацию человеческого белка β ig-h3,
| : 0,5 мкг/мл, | : 1,0 мкг/мл |
На фиг. 10 приведен график, демонстрирующий, что в качестве стандартного белка можно использовать и человеческий, и мышиный белок β ig-h3, что подтверждается перекрестным анализом,
: покрывающая концентрация человеческого белка β ig-h3 0,5 мкг/мл, первичные антитела против человеческого β ig-h3 1:2000, вторичные антитела 1:2000;
: покрывающая концентрация человеческого белка β ig-h3 0,5 мкг/мл, первичные антитела против мышиного β ig-h3 1:2000, вторичные антитела 1:2000;
: покрывающая концентрация мышиного белка β ig-h3 0,5 мкг/мл, первичные антитела против человеческого β ig-h3 1:2000, вторичные антитела 1:2000;
: покрывающая концентрация мышиного белка β ig-h3 0,5 мкг/мл, первичные антитела против мышиного β ig-h3 1:2000, вторичные антитела 1:2000
На фиг. 11 приведен график, демонстрирующий, что в качестве стандартного белка можно использовать рекомбинантный белок β ig-h3 D-IV(1x) и рекомбинантный белок β ig-h3 D-IV(4x), что подтверждается перекрестным анализом,
(А): покрывающая концентрация β ig-h3 D-IV(1x) 0,5 мкг/мл, первичные антитела против человеческого β ig-h3 1:2000, вторичные антитела 1:2000;
(А): покрывающая концентрация β ig-h3 D-IV(4x) 0,5 мкг/мл, первичные антитела против человеческого β ig-h3 1:2000, вторичные антитела 1:2000;
(В): покрывающая концентрация β ig-h3 D-IV(1x) 0,5 мкг/мл, первичные антитела против мышиного β ig-h3 1:2000, вторичные антитела 1:2000;
(В): покрывающая концентрация β ig-h3 D-IV(4x) 0,5 мкг/мл, первичные антитела против мышиного β ig-h3 1:2000, вторичные антитела 1:2000
На фиг. 12 приведена фотография иммуногистохимического окрашивания, демонстрирующая характер экспрессии β ig-h3 в почечной ткани,
(А): характер экспрессии на базальной мембране проксимальной канальцевой клетки S3;
(B); характер экспрессии на базальной мембране боуменовой капсулы клубочка;
→ (B); характер экспрессии на базальной мембране корковой толстой восходящей сегментной клетки
На фиг. 13 приведен график, демонстрирующий уровни β ig-h3 в моче крыс с индуцированным диабетом,
: контрольная группа;
: крысы с диабетом, индуцированным стрептозотоцином
На фиг. 14 приведен график, демонстрирующий индивидуальный уровень β ig-h3 в моче крыс с индуцированным диабетом фиг. 13
На фиг. 15 приведен график, демонстрирующий уровень β ig-h3 в моче, полученной от каждой нормальной крысы, крысы с пониженным количеством нефронов, крысы с хроническим отторжением, крысы с рецидивирующим GN и крысы с токсичностью CyA
На фиг. 16 приведен график, демонстрирующий различные концентрации белка β ig-h3 посуточно, которые измеряют, используя образцы мочи пациентов, которые подвергаются плазмоферезу в то время как очаговый сегментарный гломерулосклероз (FSGS) повторно развивается после трансплантации почки,
На фиг. 17 приведен график, демонстрирующий концентрации белка β ig-h3 в моче, взятой от живого донора, от трупа, от пациента с недостаточностью и отторжением, которые измеряли до и после трансплантации почки
На фиг. 18 приведена фотография иммуногистохимического окрашивания, демонстрирующая характер экспрессии белка β ig-h3 в поврежденных кровеносных сосудах мыши с индуцированным диабетом,
A: нормальные кровеносные сосуды;
B: поврежденные кровеносные сосуды,
L: просвет
На фиг. 19 приведен график, демонстрирующий характер экспрессии белка β ig-h3 в культуре клеток гладкой мускулатуры сосудов,
| *: p<0,05, | **: p<0,01 |
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для достижения вышеуказанной цели настоящее изобретение относится к способу измерения количества белка β ig-h3.
Настоящее изобретение также относится к набору для диагностики заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний, содержащему упомянутый белок.
Другие признаки настоящего изобретения будут описаны ниже.
Способ измерения количества β ig-h3 согласно настоящему изобретению включает в себя следующие стадии:
1) Получение белка β ig-h3 или рекомбинантных белков, содержащих домен fas-1 белка β ig-h3, их фрагментов или производных;
2) Получение специфических лигандов для вышеуказанных рекомбинантных белков, их фрагментов или производных, полученных на описанной выше стадии 1; и
3) Измерение количества белка β ig-h3 в образцах по способу, в котором используется реакция связывания лигандов, полученных на описанной выше стадии 2, с рекомбинантными белками, их фрагментами или производными, полученными на описанной выше стадии 1.
На стадии 1 белком β ig-h3 является либо человеческий β ig-h3, имеющий аминокислотную последовательность, представленную SEQ ID NO: 3, либо мышиный β ig-h3, имеющий аминокислотную последовательность, представленную SEQ ID NO: 5. Структурные элементы человеческого и мышиного белков β ig-h3 приведены на фиг. 1. Заштрихованный участок и заштрихованный накрест участок на фиг. 1 обозначают высоко консервативные последовательности повторяющегося домена fas-1 I, II, III и IV, а пустой участок обозначает мотив RGD.
Белок β ig-h3 имеет 4 домена fas-1. Для домена fas-1 β ig-h3 вышеприведенной стадии 1, предпочтительно выбрать один или более двух из четырех доменов fas-1 белка β ig-h3 и более предпочтительно использовать 4ый домен fas-1. 4ый Домен fas-1 можно использовать либо отдельно, либо в виде рекомбинантного белка, в котором повторяются несколько доменов fas-1, соединенных между собой. Для получения рекомбинантного белка нужно соединить 1-10 доменов fas-1, причем более предпочтительно использовать от 1 до 4 доменов fas-1. В предпочтительных воплощениях настоящего изобретения авторы предлагают примеры использования только 4ого домена fas-1, и, соответственно, рекомбинантные белки, полученные соединением 2, 3 и 4 четвертых доменов fas-1 белка β ig-h3.
Авторы настоящего изобретения получили белки, представленные последовательностями SEQ ID NO:7, NO:8, NO:9 и NO:10, содержащие 4ый домен fas-1, который состоит из 502ой-632ой аминокислот белка β ig-h3 и повторяется соответственно один, два, три или четыре раза, и назвали их "β ig-h3 D-IV(1x)", "β ig-h3 D-IV(2x)", "β ig-h3 D-IV(3x)" и "β ig-h3 D-IV(4x)" (см. фиг. 4).
В качестве фрагментов рекомбинантного белка можно использовать эпитоп белка β ig-h3, в котором происходит реакция специфического связывания с лигандом, а также любую другую часть белка, содержащую пептиды, гидролизующиеся под действием протеазы. Производные рекомбинантного белка могут быть получены в результате образования ковалентной связи, например, путем фосфорилирования и гликозилирования, а также нековалентной связи, в том числе ионной связи, координационной связи, водородной связи или связи ван дер Ваальса. Если фрагменты производных вышеуказанных рекомбинантных белков могут специфически связываться с лигандами, их можно отнести к категории белков по настоящему изобретению.
Для получения стандартного белка по настоящему изобретению конструирование экспрессирующего вектора и трансформацию можно проводить традиционным методом.
На стадии 2 специфичность связывания лигандов с β ig-h3, доменом fas-1 белка β ig-h3, их фрагментами или производными можно подтвердить путем наблюдения реакции связывания лигандов с белком или рекомбинантным белком стадии 1. Существует много видов лигандов, например, антитело, РНК, ДНК, органические соединения, включающие в себя липид, белок или органические соли, или неорганические соединения, включающие в себя ионы металлов или неорганические соли, а предпочтительный лиганд представляет собой первичное антитело против β ig-h3 или домена fas-1 белка β ig-h3 стадии 2, полученное с использованием в качестве антигена белка или рекомбинантного белка (в том числе фрагментов или производных) стадии 1. Первичное антитело может быть получено традиционным методом, причем можно использовать моноклональное антитело или поликлональное антитело.
На стадии 3 количество белка β ig-h3, входящего в состав образца, измеряют с помощью реакции специфического связывания лиганда с белком β ig-h3, его фрагментами или производными. Если происходит реакция связывания с лигандом, можно использовать даже кусочки данных фрагментов или производных. Предпочтительно используют количественный анализ посредством реакции связывания антиген-антитело, в которой в качестве антигена используют белок β ig-h3. Более предпочтительно, выбирают один метод из группы, состоящей из иммуноблотинга (Current Protocols in Molecular Biology, vol 2, chapter 10.8; David et al., Cells (a Laboratory manual), vol 1, chapter 73), иммунопреципитации (Current Protocols in Molecular Biology, vol 2, chapter 10.16; Cells (a Laboratory manual), vol 1, chapter 72), ELISA (Current Protocols in Molecular Biology, vol 2, chapter 11.2; ELISA Theory and Practice, John R. Crowther; The ELISA Guidebook, John R. Crowther), RIA (радиоиммунного анализа) (Nuklearmedizin 1986 Aug; 25 (4): 125-127, Tumor markers as target substances in theradioimmunologic detection of malignancies. von Kleist S; Mariani G. Ann Oncol 1999; 10 Suppl 4: 37-40), метода белковых чипов (Daniel Figeys et. al,Electrophoresis 2001, 22, 208-216; Albala JS. Expert Rev Mol Diagn 2001 Jul; 1 (2): 145-152), экспресс-анализа (Kasahara Y and Ashihara Y, Clinica Chimica Acta 267 (1997), 87-102; патентная заявка Кореи №2000-46639) или микрочипов (Vivian G. cheung et al, Nature genetics 1999, 21, 15-19; Robert J. Lipshutz et al, Nature genetics 1999,21, 20-24; Christine Debouck and Peter N. Goodfellow, Nature genetics 1999, 21, 48-50; DNA Microarrays, M. Schena), причем наиболее предпочтительным методом является ELISA. Массовый анализ образцов также можно проводить, используя биологический микрочип и автоматическую систему микрочипов, наряду с ELISA, на основе которых может быть разработан простой метод самодиагностики с использованием мочи.
В соответствии с предпочтительными воплощениями настоящего изобретения, способ измерения количества белка β ig-h3 путем конкурентного анализа с использованием ELISA включает в себя следующие стадии:
1) Нанесение белка β ig-h3 или рекомбинантного белка, содержащего домен fas-1 β ig-h3, его фрагментов или производных, на основу;
2) Взаимодействие антитела против белка вышеописанной стадии 1, его фрагментов или производных с образцом;
3) Добавление реагента вышеописанной стадии 2 к покрывающему белку стадии 1, проведение реакции и затем промывание; и
4) Добавление вторичного антитела к реагенту вышеописанной стадии 3, проведение следующей реакции и измерение ОП.
В качестве основы на вышеописанной стадии 1 можно использовать все виды традиционно используемых основ, в особенности, нитроцеллюлозную мембрану, поливиниловый планшет (например, 96-луночный планшет), планшет из полистирола и стеклянную пластинку.
Вторичное антитело вышеописанной стадии 4 метят окрашивающими ферментами, флуоресцентными веществами, светящимися веществами, радиоизотопами или хелатами металлов. Все традиционно используемые для мечения вещества пригодны для данного изобретения, а предпочтительными окрашивающими ферментами являются пероксидаза, щелочная фосфатаза, β-D-глактозидаза, малатдегидрогеназа, нуклеаза стафилококка, пероксидаза хрена, каталаза и ацетилхолинэстераза. В качестве флуоресцентных веществ предпочтительно используют флуоресцеинизотиоцианат, фикобилипротеин, родамин, фикоэритрин, фикоцианин, ортофталевый альдегид и др.
Кроме окрашивающих ферментов или флуоресцентных веществ для мечения вторичных антител предпочтительно используют светящиеся вещества, такие как изолюминол, люцигенин, люминол, сложный эфир акридиновой кислоты, имидазол, соль акридиновой кислоты, люциферин, люцифераза и экворин, или радиоизотопы, такие как 125I, 127I, 131I, 14C, 3H, 32P и 35S. Кроме того, антитело может конъюгировать с микромолекулярными гаптенами, такими как биотин, динитрофенил, пиридоксил или флуорескамин.
В случае применения на стадии 4 окрашивающих ферментов, для измерения активности фермента следует использовать окрашивающие субстраты, в качестве которых можно использовать любое вещество, способствующее развитию окраски фермента, связанного со вторичным антителом. В качестве окрашивающих субстратов предпочтительно используют 4-хлор-1-нафтол (4CN), диаминобензидин (DAB), аминоэтилкарбазол (AEC), 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновую кислоту) (ABTS), o-фнилендиамин (OPD) и тетраметилбензидин (TMB).
В качестве образцов вышеописанной стадии 2 можно использовать все виды жидкостей организма пациентов, страдающих от заболеваний, связанных с β ig-h3. В особенности, предпочтительными являются моча, кровь или синовиальная жидкость пациентов, страдающих от заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний.
Для того чтобы подтвердить, является ли способ измерения количества белка β ig-h3 по настоящему изобретению корректным, авторы в качестве стандартного белка использовали рекомбинантный белок, содержащий мышиный β ig-h3 или 4ый домен fas-1 белка β ig-h3, и сравнивали результат с полученным при использовании человеческого β ig-h3 в качестве стандартного белка.
Для способа измерения β ig-h3 по настоящему изобретению определяли оптимальную покрывающую концентрацию человеческого белка β ig-h3 и количественное соотношение антител. Наилучшим количественным соотношением первичных антител против человеческого β ig-h3 являлось 1:1600 и 1:2000 (см. фиг. 7), а наилучшим количественным соотношением вторичных антител являлось 1:2000 (см. фиг. 8). Соответствующая концентрация белка β ig-h3 составляла 1,0 мкг/мл и 0,5 мкг/мл, но более предпочтительной покрывающей концентрацией являлась 0,5 мкг/мл (см. фиг. 9).
Следовательно, авторы настоящего изобретения за оптимальную покрывающую концентрацию человеческого β ig-h3 приняли 0,5 мкг/мл, наилучшей степенью разбавления для первичных антител против человеческого β ig-h3 и для вторичных антител считали 1:2000, соответственно.
Авторы настоящего изобретения также определили концентрацию белка и количественное соотношение первичных и вторичных антител, используя мышиный β ig-h3, рекомбинантный β ig-h3 D-IV(1x), β ig-h3 D-IV(2x), β ig-h3 DIV(3x) и β ig-h3 D-IV(4x). А именно, получили покрывающую концентрацию каждого белка 0,5 мкг/мл, разбавили первичные антитела против человеческого β ig-h3 и вторичные антитела до соотношения 1:2000 соответственно и провели количественный анализ. Первичные антитела против мышиного β ig-h3 и вторичные антитела разбавили до соотношения 1:2000 и также провели количественный анализ.
В результате во всех случаях были получены графики с прямолинейной зависимостью, это говорит о том, что соотношения являются наилучшими, а интервал измерения составлял 11 нг/мл - 900 нг/мл для всех случаев, это означает, что не существует большой разницы в интервалах измерения (см. фиг. 11 и фиг. 12).
Приведенные выше результаты подтверждают, что стандартным белком может быть любой из человеческого β ig-h3, мышиного β ig-h3, рекомбинантного β ig-h3 D-IV(1x), ig-h3 D-IV(2x), ig-h3 D-IV(3x) и ig-h3 D-IV(4x), а в качестве первичных антител можно использовать либо антитела против человеческого β ig-h3, либо антитела против мышиного β ig-h3.
В данном изобретении предпочтительная покрывающая концентрация стандартного белка составляет 0,1-2,0 мкг/мл, более предпочтительно 0,5-1,0 мкг/мл. Предпочтительный индекс разведения первичных и вторичных антител находится в интервале 1:400-1:3200, более предпочтительно он составляет 1:2000.
Настоящее изобретение относится к набору для диагностики заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний, который позволяет диагностировать заболевания путем измерения количества белка β ig- h3 в жидкостях организма пациентов.
Диагностический набор по настоящему изобретению включает в себя белок β ig-h3 или рекомбинантные белки, содержащие домен fas-1 белка β ig-h3 (включая их фрагменты или их производные), и их лиганды. В данное время в качестве предпочтительных специфических лигандов используют антитела против белка β ig-h3 или доменов fas-1 белка β ig-h3. Данный набор может дополнительно включать буферный раствор, вторичное антитело, раствор для промывания или окрашивающий субстрат.
Диагностический набор по настоящему изобретению подходит для диагноза различных заболеваний, таких как заболевания почек, печени, ревматоидный артрит или сердечно-сосудистые заболевания, путем измерения количества белка β ig-h3 в жидкостях организма.
Заболевания почек можно диагностировать путем измерения количества белка β ig-h3 на основе того факта, что экспрессия β ig-h3 индуцируется под действием TGF-β, который играет важную роль в развитии почечных заболеваний. Для подтверждения вышесказанного измеряли количество β ig-h3 в моче больных диабетом. Полученное в результате количество β ig-h3 в моче пациентов с диабетическими почечными заболеваниями, включая микроальбуминурию, было в пять раз выше, чем у нормальных субъектов. У некоторых больных диабетом, не имеющих почечных заболеваний, количество β ig-h3 также выше, чем у нормальных субъектов. Учитывая вышеприведенные результаты, можно сделать вывод, что уровень β ig-h3 в моче отражает степень поражения почек, а высокий уровень β ig-h3 у некоторых больных диабетом, не имеющих заболеваний почек, позволяет предположить, что их почки уже поражены в некоторой степени, хотя клинические симптомы еще отсутствуют. Следовательно, измерение количества β ig-h3 в моче пациентов является высокочувствительным и важным диагностическим методом, который может отражать поражение почек на ранней стадии.
Для того чтобы подтвердить, действительно ли концентрация β ig-h3 в моче больного диабетом может отражать поражение почки на ранней стадии, измеряли концентрацию β ig-h3 у животного, страдающего диабетом. В результате концентрация β ig-h3 увеличилась в 4 раза через 5 дней после индуцирования диабета (см. фиг. 13). Изменение концентрации β ig-h3 наблюдали у каждого субъекта после индуцирования диабета, приводящему к сильному увеличению концентрации β ig-h3 в моче (см. фиг. 14). На 5 день после индуцирования диабета анализы крови, мочи и креатина были нормальными, и ткани почек казались нормальными. Таким образом, сильное увеличение количества β ig-h3 в моче позволяет предположить, что уже существует минимальное поражение почек, которое не определяется традиционными методами.
Кроме того, авторы настоящего изобретения подтвердили взаимосвязь поражения почек и концентрации β ig-h3 путем измерения количества β ig-h3 в моче у пациентов, подвергавшихся трансплантации почки, до и после операции. Высокая концентрация β ig-h3, наблюдающаяся у пациента до операции, постепенно уменьшалась после успешной операции. Но у пациента № 5, у которого функция почки не восстанавливалась даже после операции, концентрация β ig-h3 оставалась высокой (см. фиг. 2). Все вышеприведенные результаты подтверждают, что концентрация β ig-h3 чувствительно отражает степень поражения почек.
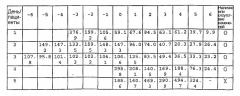
Авторы настоящего изобретения также измерили концентрацию β ig-h3 в моче пациентов с почечной недостаточностью. Концентрация β ig-h3 в моче у всех пациентов с почечной недостаточностью была высокой. Таким образом, опять было подтверждено, что количество β ig-h3 в моче чувствительно отражает поражение почки даже на ранней стадии, следовательно, измерение количества β ig-h3 является очень важным методом диагностики различных заболеваний почек (см. таблицу 3).
Очень важно определить, развивается ли у пациента хронический гепатит в цирроз печени, однако пока не существует метода, который позволяет это сделать. Самым критическим фактором для развития цирроза печени является TGF-β. Следовательно, при развитии цирроза печени уровень β ig-h3, экспрессия которого индуцируется TGF-β, в крови, возможно, будет увеличиваться. В таком случае, количество β ig-h3 также может отражать степень поражения циррозом печени. Фактически доказано, что экспрессия β ig-h3 возрастает при увеличении тяжести цирроза печени, которую устанавливают с помощью иммуногистологического анализа тканей печени пациентов с гепатитом. Авторы настоящего изобретения подразделили состояние пациентов на несколько степеней и стадий на основе результатов биопсии, полученных для пациентов с хроническим гепатитом, и определили концентрацию β ig-h3 в крови для каждой стадии и степени. У пациентов с хроническим гепатитом концентрация β ig-h3 в крови выше, чем у нормальных людей. Доказано, что концентрация β ig-h3 на ранней стадии и низшей степени выше, чем на более поздней стадии и высшей степени (см. таблицу 5). Степень 3 и стадия 3 характеризуются тяжелым состоянием цирроза печени, перешедшего пик в своем развитии. Между тем, степени 1 и 2 и стадии 1 и 2 соответствуют состоянию пациента, при котором очень интенсивно развивается воспалительный процесс. Следовательно, концентрация β ig-h3 отражает интенсивность цирроза печени, так что его развитие можно отслеживать, регулярно измеряя концентрацию β ig-h3 в крови.
Также измеряли концентрацию β ig-h3 в синовиальной жидкости пациентов с ревматоидным артритом и остеоартритом. Концентрация β ig-h3 в синовиальной жидкости пациентов с ревматоидным артритом была в два раза выше, следовательно, измерение концентрации β ig-h3 в синовиальной жидкости может служить эффективным способом диагностики остеоартрита и ревматоидного артрита (см. таблицу 6).
Кроме того, для подтверждения взаимосвязи экспрессии β ig-h3 и сосудистых заболеваний исследовали характер экспрессии β ig-h3 в нормальных и поврежденных кровеносных сосудах диабетических мышей с помощью иммуногистохимических методов. Результаты показали, что белок β ig-h3 в поврежденных кровеносных сосудах диабетических мышей экспрессируется гораздо интенсивнее, чем в нормальных кровеносных сосудах (см. фиг. 18). Поскольку TGF-β, который играет важную роль в развитии сосудистых заболеваний, индуцирует экспрессию β ig-h3, исследовали индуцирование экспрессии β ig-h3 под действием TGF-β 1 в клетках гладкой мускулатуры сосудов, образующих кровеносные сосуды. Полученные результаты подтвердили, что экспрессия β ig-h3 увеличивается по мере увеличения количества TGF-β 1 (см. фиг. 19).
Экспрессия β ig-h3 в крови и тканях отражает их поражение. Следовательно, было доказано, что способ измерения количества белка β ig-h3 настоящего изобретения можно эффективно использовать для диагностики различных сосудистых заболеваний.
Таким образом, диагностический набор для измерения количества белка β ig-h3 по настоящему изобретению может применяться с высокой эффективностью, так как он позволяет установить степень поражения и развития заболеваний почек, печени, ревматоидного артрита или сердечно-сосудистых заболеваний.
ПРИМЕРЫ
Практические и в настоящий момент предпочтительные воплощения данного изобретения являются иллюстративными, как показано в нижеследующих примерах.
Однако следует понимать, что специалисты в данной области, исходя из приведенного описания, могут осуществлять модификации и улучшения в пределах сущности и объема настоящего изобретения.
Пример 1: Получение стандартных белков и первичных антител
<1-1> Выделение человеческого β ig-h3 и мышиного β ig-h3
Авторы настоящего изобретения получили человеческий и мышиный белки β ig-h3. Структурные элементы человеческого и мышиного белков β ig-h3 приведены на фиг. 1. Заштрихованный участок и заштрихованный накрест участок на фиг. 1 обозначают высоко консервативные последовательности повторяющегося домена fas-1 I, II, III и IV, а пустой участок обозначает мотив RGD.
кДНК β ig-h3 (pBS β ig-h3; по