Способ маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и может быть использовано для маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия. В качестве маркера используют углеродный войлок марки Карботекстим М (КМ), разделенный на фрагменты объемом от 0,1 мм до 2 см3 или механически измельченный до размеров частиц не менее 10-5 м и суспендированный с содержанием твердой фазы 10-50 мг/мл. Данное изобретение позволяет получить долговременную маркировку биологических тканей за счет размеров частиц КМ, которые не могут быть поглощены макрофагами, впоследствии они прорастают соединительной тканью, что в свою очередь способствует длительной фиксации КМ в месте имплантации. 2 з.п. ф-лы, 2 ил.
Реферат
Предлагаемое изобретение относится к экспериментальной медицине и предназначено для маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия.
При проведении экспериментального исследования на биологических тканях часто возникает проблема последующей идентификации зоны экспериментального воздействия, особенно на поздних сроках. В связи с этим очень важна маркировка зоны экспериментального воздействия с помощью инертного материала, не вызывающего в окружающих тканях воспалительных реакций, которые могут повлиять на результаты эксперимента, а также способного длительное время находиться в месте его введения и хорошо различимого в биологических тканях.
Кроме того, в ряде исследований требуется оценить топографию различных каналов, полостей, кровеносных и лимфатических сосудов, пассаж различных жидкостей по ним, для чего в соответствующую жидкую среду требуется ввести маркер с целью трассирования пути тока данной жидкости.
Существуют различные способы маркировки биологических тканей в эксперименте. Как правило, используются способы, которые применяются в клинической медицине, например, в тканях оставляется игла с ориентацией конца в интересующей области. Через иглу может быть введен краситель, служащий ориентиром [1]. Однако при данном способе маркировки возможно смещение иглы, а большинство используемых красителей (бриллиантовый зеленый, метиленовый синий) недолговечны в тканях, подвергаются биологической деградации, а также вымываются при обработке спиртом при приготовлении гистологических препаратов, что делает невозможной последующую идентификацию зоны воздействия, особенно при необходимости проведения долгосрочного исследования.
Другими, весьма распространенными способами маркировки интересующей зоны в эксперименте являются различные варианты кожной маркировки: наложение дополнительных кожных швов над интересующей зоной или нанесение красителей (бриллиантовый зеленый, метиленовый синий) на поверхность кожи. Основными недостатками применения кожных швов является их прорезывание и возможность возникновения воспалительного процесса в области их расположения. При использовании красителей, как уже было сказано выше, происходит достаточно быстрое обесцвечивание зоны маркировки.
Известен способ маркировки биологических тканей с использованием мельчайших металлических скобок, выстрелянных пистолетом в зону интереса [2]. Однако при длительном нахождении в биологических тканях скобки могут мигрировать с места своего первоначального расположения, поскольку они надежно не зафиксированы. В связи с этим данный способ не применим при долгосрочных исследованиях.
Для исследования топографии различных каналов, полостей, кровеносных и лимфатических сосудов, а также для оценки пассажа различных жидкостей по ним используют введение в исследуемые жидкости различных маркеров, например анилиновых красителей [4]. Основным недостатком применения данных красителей является их вымывание, в связи чем краситель находится в месте введения очень непродолжительное время, а при препарировании препарата с введенными в каналы, полости, кровеносные или лимфатические сосуды красителями он вытекает и не позволяет точно определить место его введения, что затрудняет проведение требуемого исследования. Другими маркерами, применяемыми для маркировки биологических тканей и для исследования пассажа различных жидкостей по каналам, полостям и сосудам, являются радиоактивные маркеры [6, 7]. К их недостаткам относится воздействие радиоактивного излучения на исследователя, а также необходимость применения дорогостоящего оборудования для регистрации зоны локализации маркера.
Ближайшим аналогом предлагаемого способа является способ маркировки зоны интереса в эксперименте с использованием туши [5, 8], которая представляет собой взвесь мельчайших частиц химически чистого углерода в органическом растворителе. В связи с тем, что частицы углерода черного цвета, они хорошо заметны в тканях, однако вследствие очень малого размера частиц они в значительной степени подвержены фагоцитозу, поэтому с течением времени данная маркировка становится неэффективной. Другим недостатком данного способа является наличие в составе туши органического растворителя, присутствие которого в биологических тканях может вызвать воспалительную реакцию, способную повлиять на ход эксперимента. Кроме того, отсутствуют параметры стерилизации туши.
Задачей предлагаемого изобретения является разработка способа маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия, лишенного недостатков ближайшего аналога.
Техническим результатом предлагаемого изобретения является возможность долговременной маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия.
Технический результат достигается за счет использования в качестве маркера углеродного войлока марки Карботекстим-М, который разрешен к применению и который можно вводить в любые ткани, органы и полости организма.
Углеродный войлок марки Карботекстим-М разработан в НИИ «Графит» по ТУ 9398-004-00200851-00. KM представляет собой аморфный двухмерный химически чистый (99,9%) углерод, в котором имеются незначительные примеси легких металлов, карбидов и окислов [3]. Для этого материала характерна развитая пористая структура (до 80% по массе) и малая плотность (0,12 г/см3).
Углеродные материалы уже длительное время с успехом применяются в стоматологии, травматологии, ортопедии и офтальмологии в качестве различных имплантатов. Преимуществами Карботекстима-М по сравнению с другими материалами являются его инертность по отношению к живым тканям и очень низкая подверженность биодеградации. Пористая структура KM позволяет соединительной ткани быстро врастать в имплантат, в результате чего достигается надежная фиксация материала в тканях в месте имплантации. Исследования, проведенные на базе НИИ глазных болезней им. Гельмгольца [10, 11], показали, что при имплантации КМ в живые ткани он хорошо там фиксируется, практически не вызывает воспалительных изменений, на ранних сроках полностью прорастает соединительной тканью, а соответственно, полностью исключается миграция и резорбция материала. Гистологические исследования показали, что КМ в течение длительного времени (до 1 года и более) остается в тканях. Эти свойства Карботекстима-М, а также результаты собственных исследований в ММА им. И.М. Сеченова натолкнули нас на идею его нового использования, а именно в качестве маркера биологической ткани при проведении экспериментального исследования для последующей идентификации зоны экспериментального воздействия.
Пористая структура и инертность КМ являются его положительными качествами с точки зрения маркировки биологических тканей, поскольку частицы КМ прорастают соединительной тканью и в течение длительного времени остаются в месте имплантации, а черный цвет КМ позволяет легко идентифицировать зону маркировки. Даже при наименьшем размере частиц KM (10-5) макрофаги и другие фагоциты их не поглощают, что также обеспечивает возможность длительного нахождения КМ в тканях, а следовательно, надежную идентификацию зоны экспериментального воздействия.
Способ осуществляют следующим образом.
В одном случае КМ механически измельчают до размеров частиц не менее 10-5 м, после чего полученный порошок смешивают с физиологическим раствором, или аутокровью, или аутоплазмой, или слезной жидкостью, или синовиальной жидкостью, или гидрогелем из расчета 10-50 мг измельченного КМ на 1 мл жидкости. Полученную суспензию тщательно перемешивают для равномерного распределения частиц КМ в дисперсионной среде. Далее, для осуществления маркировки необходимой области содержащую КМ суспензию можно вводить с помощью шприца внутрикожно, подкожно, внутримышечно, в суставную полость, в просвет или стенку полого органа, в толщу паренхиматозного органа, в кровеносные сосуды, в зону оперативного вмешательства.
В другом случае КМ скальпелем или ножницами разрезают на фрагменты объемом от 0,1 мм3 до 2 см3, а затем полученные фрагменты вводят в ткани, либо непосредственно в края или дно операционной раны, либо через отдельный прокол или разрез кожи, слизистой или серозной оболочки, или другой ткани органа, на котором было произведено оперативное вмешательство.
Описанные способы обработки Карботекстима-М перед использованием применяются в зависимости от поставленных экспериментальных задач, топографии исследуемых органов или тканей и уровня исследования (тканевой, органный, системный).
При экспериментальных оперативных вмешательствах на полых или паренхиматозных органах для обозначения места операции КМ может быть введен в стенку полого или толщу паренхиматозного органа. В зависимости от размеров органа, на котором было произведено вмешательство, перед введением КМ разрезают с помощью скальпеля или ножниц на фрагменты объемом от 0,1 мм3 до 2 см3. После этого фрагмент КМ вводят либо в края операционной раны перед ее ушиванием, либо через дополнительный разрез в ткани вблизи от зоны оперативного вмешательства, в зависимости от задач и условий эксперимента. Дополнительный разрез также ушивают. При последующем исследовании органа, на котором производилось оперативное вмешательство, по месту расположения маркера можно обнаружить место оперативного вмешательства.
Для оценки особенностей топографии карманов суставной сумки, а также для оценки сообщения этих карманов с суставной полостью в суставную полость можно ввести суспензию, содержащую в качестве маркера КМ. Для этого KM механически измельчают до размеров частиц не менее 10-5 м и суспендируют, причем в качестве дисперсионной среды используют синовиальную жидкость, предварительно аспирированную из суставной полости. Содержание твердой фазы в суспензии - от 10 до 50 мг в 1 мл синовиальной жидкости. Далее полученную суспензию вводят в суставную полость. При этом частицы КМ адсорбируются на поверхности слизистой оболочки суставной сумки. После введения в полость сустава содержащей КМ суспензии производят препарирование сустава и оценивают нахождение КМ в карманах суставной сумки. Оценка возможна как на макроскопическом уровне (КМ вследствие своего черного цвета хорошо заметен на фоне слизистой оболочки суставной сумки), так и с помощью светового микроскопа, для чего берут участок синовиальной сумки и готовят гистологические препараты. При любой окраске препаратов частицы КМ будут четко видны при световой микроскопии. Микроскопическое исследование препаратов карманов синовиальной сумки позволяет выявить наличие в ней маркера в случае, когда отверстие, с помощью которого карман сообщается с полостью сустава, небольшого размера и в карман попадает небольшое количество частиц КМ.
Подобным образом можно исследовать топографию и сообщение патологических полостных образований в эксперименте (абсцессы, кисты), однако в этом случае измельченный КМ следует суспендировать, используя в качестве дисперсионной среды физиологический раствор или гидрогель, и вводить, предварительно удалив содержимое образования в объеме, равном объему вводимой суспензии.
Для оценки путей тока различных биологических жидкостей по каналам (например, слезной жидкости по слезоотводящим путям) можно ввести в исследуемую зону (слезные канальцы) суспензию, содержащую в качестве дисперсионной среды исследуемую жидкость (слезную) или физиологический раствор, а в качестве дисперсной фазы КМ, измельченный до размеров частиц не менее 10-5 м, с содержанием твердого вещества от 10 до 50 мг на 1 мл жидкости. После введения данной суспензии соответствующую область препарируют и выявляют наличие маркера в макроскопических образованиях (слезный мешок). Также из соответствующей зоны (область внутреннего угла глаза) можно приготовить гистологические препараты и оценить топографию путей оттока жидкости на светооптическом уровне по наличию КМ на поверхности слизистой оболочки канальцев, что, как уже было сказано выше, заметно при любой гистологической окраске.
Для оценки кровоснабжения различных органов или патологических образований (опухоли) в эксперименте в интересующую артерию можно ввести суспензию, состоящую из измельченного КМ до размеров частиц не менее 10-5 м и аутокрови или аутоплазмы в качестве дисперсионной среды, в соотношении от 10 до 50 мг измельченного КМ на 1 мл жидкости. После введения суспензии в артерию из интересующего органа или патологического образования готовят гистологические препараты, окрашивают и исследуют их с помощью светового микроскопа. В капиллярах тканей, кровоснабжающихся из бассейна исследуемой артерии, будут содержаться частицы КМ, хорошо заметные при световой микроскопии вне зависимости от использованной гистологической окраски.
Таким образом, предложенный способ позволяет добиться долговременной маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия.
Пример.
Для исследования особенностей взаимодействия с биологическими тканями двух видов рассасывающегося шовного материала (викрил 6/0, монокрил 6/0) был проведен эксперимент.
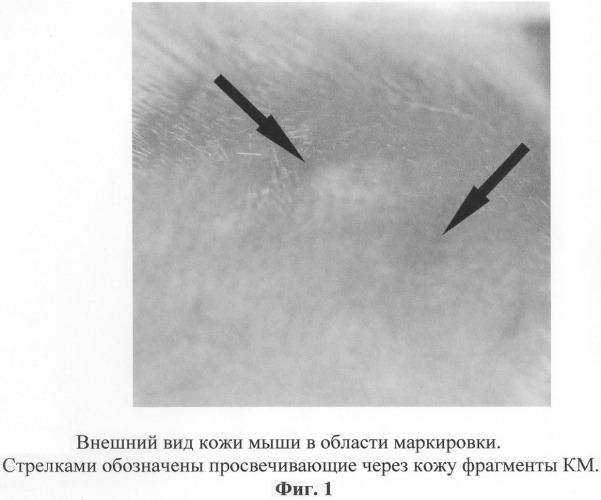
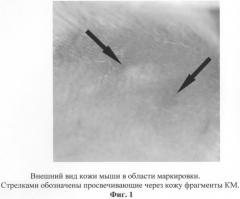
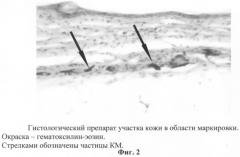
Белой лабораторной мыши под местной инфильтрационной анестезией (Sol. Lidocaini 0,5% - 0,1 ml) в межлопаточной области спины ножом выполняли разрез кожи длиной 5 мм. На подлежащие ткани было наложено шва из биологического рассасывающегося шовного материала: викрил 6/0, монокрил 6/0. После этого для маркировки зоны оперативного вмешательства в края кожного разреза был введен фрагмент КМ объемом 1 мм3, а на края разреза были наложены два узловых шва (Prolene 6/0). Через 1 месяц область оперативного вмешательства была идентифицирована по расположению маркера (фиг.1). Исследуемый участок кожи с подлежащими тканями, на которые были наложены изучаемые шовные материалы, был иссечен для проведения гистологического исследования. Были приготовлены парафиновые гистологические препараты (окраска - гематоксилин-эозин). При световой микроскопии («Фотомикроскоп-III», Opton, Германия) частицы КМ были хорошо заметны на препарате в виде черных включений (фиг.2), обозначая таким образом место, где ранее находились исследуемые шовные материалы.
Таким образом, данная маркировка оказалась эффективной в течение длительного времени (4 месяца). Она позволила идентифицировать зону экспериментального воздействия как на макроскопическом, так и на светооптическом уровнях, что дало возможность целенаправленного исследования области, в которой ранее располагались исследуемые рассасывающиеся шовные материалы.
Источники информации
1. Голов Л.Б. - "Этапы комплексной диагностики непальпируемых раков молочной железы" - Московский маммологический диспансер // Журнал "Лечащий Врач" 1998; 6; Издательство "Открытые системы".
2. Харченко В.П., Рожкова Н.И. - "Инвазивные методы при исследовании молочной железы" // "Рак молочной железы. Актуальные вопросы диагностики и лечения" - материалы международной конференции. Архангельск, 1998.
3. Золкин П.И., Леонова Т.В., Юдина Т.В., Татаринов В.Ф. - «Исследование свойств углеродных материалов, используемых в медицине» // Конверсия в машиностроении. OOO Информконверсия, 2003; 3, 100-104.
4. Шнитко С.Н. «Маркировка новообразований легкого при выполнении видеоторакоскопических операций» // «Новое в хирургии и эндоскопии - сборник научных трудов, посвященный 70-летию Новокузнецкого ГИДУВа» - 1997; С.17.
5. Шаров Д.Г., Дралюк М.Г., Мейнгот Я.Я., Данилова Т.Д., Бурдыко К.В. - «Распределение индикаторной массы (тушь + желатин) по сосудам шейного отдела спинного мозга при введении ее в позвоночные артерии при травме шейного отдела позвоночника и спинного мозга. Экспериментальное исследование» - Красноярск, 1997, 6 с.
6. Праздников Э.Н., Луцевич Э.В., Вельшер Л.З. и др. - «Радионуклидная индикация и визуальное контрастирование сторожевых лимфоузлов при опухолях различных локализаций» - // Третий конгресс Ассоциации хирургов имени Н.И.Пирогова. Материалы конгресса (под ред. академика РАМЫ Ю.Л.Шевченко). - М., 2001.
7. Вельшер Л.З., Габуния З.Р., Праздников Э.Н. и др. - «Сторожевые лимфоузлы: их поиск и значение при раке молочной железы» // «Современная онкология» - 2001; Том 3; №3.
8. Бутин А.А., Максимишин С.В., Семченко В.В., Степанов С.С. - «Изменения сосудистого русла большого мозга белых крыс в зоне ишемического инсульта» // Материалы VIII Всероссийского съезда анестезиологов-реаниматологов; Омская государственная медицинская академия; 2002.
9. Гундорова Р.А., Хорошилова-Маслова И.П., Быков В.П., Катаев М.Г., Илатовская Л.В., Филатова И.А. - «Экспериментальные и морфологические результаты вживления углеродного войлока для пластики опорно-двигательной культи и придаточного аппарата глаза» // Вестник Офтальмологии - 1996; №1, С.27-31.
10. Филатова И.А. «Пластические операции в офтальмохирургии с использованием углеродных имплантатов» Дис... канд. мед. наук. Москва, 1994, 147 с.
11. Филатова И.А. «Особенности имплантации материала Карботекстима-М в пластической офтальмохирургии» // Клиническая офтальмология 2001; 3.
1. Способ маркировки биологических тканей для последующей идентификации зоны экспериментального воздействия, включающий введение в организм маркера, отличающийся тем, что в качестве маркера используют углеродный войлок марки Карботекстим М (КМ), разделенный на фрагменты объемом от 0,1 мм3 до 2 см3 или механически измельченный до размеров частиц не менее 10-5 м и суспендированный с содержанием твердой фазы 10-50 мг/мл.
2. Способ по п.1, отличающийся тем, что для получения суспензии механически измельченного КМ в качестве дисперсионной среды используют физиологический раствор, или аутокровь, или аутоплазму, или слезную жидкость, или синовиальную жидкость, или гидрогель.
3. Способ по п.1, отличающийся тем, что КМ или содержащую КМ суспензию вводят внутрикожно, подкожно, под слизистую оболочку, внуримышечно, в суставную полость, в просвет или стенку полого органа, в толщу паренхиматозного органа, в кровеносные сосуды, в края операционной раны.